cryIAc基因在转基因玉米中的遗传规律及对抗虫性影响
2015-10-25王建军杨慧珍刘佼
王建军杨慧珍刘佼
(1.山西省农业科学院隰县农业试验站,隰县 041300;2.山西省农业科学院作物科学研究所,太原 030031)
cryIAc基因在转基因玉米中的遗传规律及对抗虫性影响
王建军1杨慧珍2刘佼1
(1.山西省农业科学院隰县农业试验站,隰县 041300;2.山西省农业科学院作物科学研究所,太原 030031)
旨在研究目的基因在转基因植株和后代植株(株系)中的遗传规律及其对转化植株抗虫性的影响。以花粉介导法将cryIAc基因导入玉米自交系‘郑58’和‘昌7-2’,对转化植株及其后代株系进行分子检测和田间抗虫鉴定。结果表明:(1)转化‘郑58’和‘昌7-2’,T1代分别获得转基因植株24和41个,转化率高达20%以上;(2)转基因T2代、杂交F2代及回交1代(B1)的分子检测结果证明,外源基因的遗传符合孟德尔的3∶1、3∶1和1∶1的遗传分离规律;(3)连续多带的分子检测结果还表明,外源基因可稳定遗传并有效表达,表达水平在9.8-14.3 ng/g叶片鲜重之间;(4)抗虫鉴定结果显示,在阴性对照全部感虫情形下,转基因纯合株系仍表现出较高抗虫活性;(5)此外,回交试验结果还证明外源基因通过杂交可传递给下一代;(6)最终经筛选得到SZ003、SZ005、SC001、SC004和SC007五个高抗虫转基因株系。结果表明,花粉介导法是一种高效、快捷的转化方法,cryIAc基因导入玉米自交系植株后赋予和提高了转基因植株的抗虫活性。
转基因玉米;cryIAc基因;遗传规律;抗虫性
玉米(Zea mays L.)是我国重要的粮食、饲料作物。目前我国玉米生产的总体形势是供不应求,加之在玉米生产中还存在许多影响玉米产量的因素,特别是虫害对玉米生产的制约,使得玉米市场的供应压力更加沉重。由于资源匮乏,常规育种也已无法满足当前玉米生产对抗性品种的需求,因此应用转基因技术,突破常规育种中物种间基因横向交流的壁垒,扩大其可利用基因资源的范围,是改良玉米自交系、创制玉米新的抗虫品种、提高玉米产量、缓解市场压力的一条新途径。苏云金芽胞杆菌(Bacillus thuringiensis,Bt)所产生的杀虫晶体蛋白(insecticidal crystal protein,ICPs)恰好可引起昆虫细胞膜穿孔,导致细胞肿胀破裂,以致昆虫进食困难并死亡[1,2]。目前Bt 基因是植物基因工程及转基因育种中应用最广泛、最具应用前景的抗虫基因。转基因植株抗虫性方面:国外,早在1990年美国孟山都公司和迪卡公司就用基因枪轰击法获得了能正常结实的抗虫转基因玉米[3,4]。Lauer等[5]研究发现,在玉米螟自然侵染和人工接种4次的条件下,转Bt 毒蛋白基因玉米的产量不受玉米螟的影响,产量比非转Bt 毒蛋白基因玉米增产10%以上,比生产上应用的适应性好的对照品种增产4%-8%。同样研究还发现,在欧洲玉米螟中等偏重发生的情况下,虽转Bt 毒蛋白基因玉米杀虫效果同化学防治相当,但较非转Bt 毒蛋白基因玉米却增产10%[6,7]。国内,丁群星等[8]首次用子房注射法将Bt 毒蛋白基因导入玉米自交系;王国英等[9]用基因枪轰击法将Bt毒蛋白基因转入玉米愈伤组织和幼胚获得再生转基因植株;袁英等[10]采用基因枪法将苏云金芽胞杆菌的杀虫毒蛋白基因(cryIA)导入东北春玉米自交系铁7922 的幼胚中,获得了转基因植株,经筛选最终得到一批抗玉米螟自交系。在目的基因遗传规律研究方面:大量的转基因研究表明,转化的外源基因能够整合到植物细胞基因组,整合后的外源基因遵循该细胞遗传物质的复制和表达规律,T1或T2代呈常见的3∶1遗传分离[3,11-17],也有研究认为转Bt 基因植株的测交后代抗虫和感虫植株的比例接近1∶1,符合孟德尔单显性基因的遗传规律[18,19]。而李余良等[20]则认为转基因T1代植株PCR检测证明Bt基因能够稳定遗传,基因分离符合1∶1的孟德尔遗传规律[19]。此外,还有一些研究认为由于转基因整合的方式和拷贝数不同,或者由于沉默、损伤或丢失导致不规则的遗传[21-24]。上述关于转基因植物抗虫性研究,大多集中在对转基因植物前几代抗虫性研究,而转基因纯合株系的抗虫性表现即对转化株系抗虫性稳定性却少见报道;关于Bt基因在转化株系中的遗传分离方式的研究主要是针对T1、T2代或回交后代的遗传分离,很少有人将两者结合起来进行系统的研究。总之,由于在各自试验中所用材料不尽相同,转化方法也各有区别、缺少连续而系统的试验策略,故所得结论虽类同,但可比性较差。
因此,本研究以p3301UbiAc为供体质粒,采用花粉介导法[25]将cryIAc基因导入玉米自交系‘郑58’和‘昌7-2’,通过多代PCR检测、Southern杂交分析,在获得转基因植株的基础上,加代分析,即对后代植株进行PCR检测、Southern杂交分析、ELISA分析,直到获得转基因纯合株系,并通过杂交和回交,分别对T2代、F1代和B1代材料进行PCR和ELISA分析,验证其外源基因分离比,并在T5代进行田间抗虫鉴定,旨在连续系统地研究目的基因在转化植株及其后代株系中的遗传规律和转化植株纯合系的抗虫活性表现。
1 材料与方法
1.1 材料
1.1.1 植物材料 以目前玉米制种上使用较广泛的自交系‘郑58’和‘昌7-2’为受体材料。材料为本研究室保存备用。
1.1.2 质粒 转化用质粒为p3301UbiAc,含有cryIAc基因,启动子为Ubi,终止子为nos,载体菌为农杆菌LBA4404。图1是质粒p3301UbiAc的图谱。载体由中国农业科学院作物科学研究所王国英教授提供。
1.2 方法
1.2.1 质粒DNA、植物DNA和可溶性蛋白质的提取 质粒DNA的提取方法参见《分子克隆》[26],植物DNA采用CTAB法提取。提取的DNA用于PCR检测和Southern杂交分析。植物可溶性蛋白提取方法参考杨文鹏等[27]的方法,提取的蛋白用于ELISA分析。
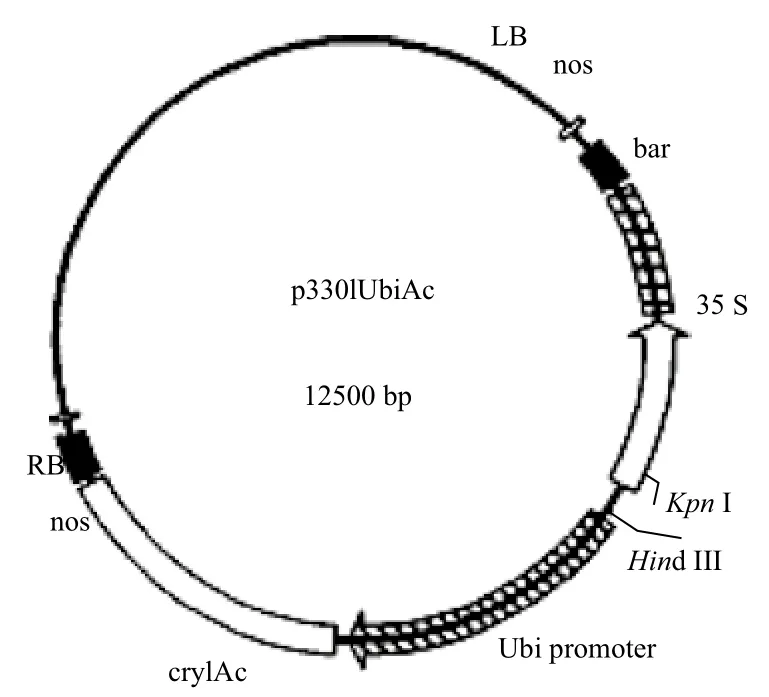
图1 质粒p3301UbiAc图谱
1.2.2 转化方法 转化方法采用花粉介导法[28],略作改良,在加入质粒DNA前做第1次超声波处理,加入质粒DNA后,做第2次超声波处理,处理参数不变。在授粉前,花粉处理液中加入少量的硼酸(50 mg/L)、GA3(40 mg/L)以促进花粉在授粉后的萌发。授粉后套袋,秋季收获T0代种子。
1.2.3 田间试验安排 2009-2013年间完成本项目研究,所有田间试验均在山西东阳基地或三亚南繁基地进行,每年两季。所有分子检测试验均在本中心基因工程研究室进行。
T0代种子全部播种得到T1代植株,全部取样做PCR扩增分析,对PCR检测呈阳性结果的材料做Southern杂交分析和ELISA分析,以获得转基因植株;T1代PCR和Southern检测呈阳性的植株全部套袋自交,收获的种子来年全部播种得到T2代植株,每个株系种5行,每行留苗12株,全部取样进行PCR检测,每个株系随机取样5份进行ELISA分析,每个株系取5份PCR扩增结果阳性的材料进行Southern杂交分析;T3代为随机选取T2代分子检测结果呈阳性株系的植株,每个自交系选20株,每株种5行,每行留苗12株,全部取样做PCR检测,随机选取PCR阳性结果的材料做Southern杂交和ELISA分析;T4代同T3代;以此类推直到获得稳定遗传的纯合转基因株系。本研究在T4代获得了6个‘郑58’转基因纯合株系和7个‘昌7-2’转基因纯合株系。
2011年冬,每个自交系随机选取2份转基因纯合株系的种子赴三亚做杂交试验,每份种1行,另外取4份非转基因的‘郑58’和‘昌7-2’种子(每个自交系2份),每份播种1行,每行10株(对应于1个纯合株系),花期取转基因纯合株系植株花粉授粉于其对应的非转基因植株上,套袋,并作标记,秋季收获F1杂交种子。2012年春东阳基地播种得到F1代植株,每穗种子种6行,每行定苗时留10株(3次重复),F1代植株全部取样,做PCR扩增分析,每系每个重复各随机选取30份样品做ELISA分析,确定杂交F1代的外源基因分离比;同时取适量杂交F1代种子和各自交系非转基因对照种子分别播种,取阴性对照花粉分别授粉于各个自交系的F1代植株,得到B1代种子;2012年冬季赴海南播种B1代种子,5叶期取样做PCR检测和ELISA分析,确定B1代材料的分离比。
1.2.4 遗传规律研究 T1代来自T0种子单粒播种,因此不存在遗传分离问题,仅通过PCR扩增、Southern杂交分析和ELISA分析,观察外源基因在转化植株中的导入、整合和表达等遗传现象;对T2代转化植株做同样的分子检测,结果可用来确定T2代中外源基因的遗传分离现象;获得转基因纯合株系前各代的分子检测结果可用来确定外源基因在转化株系中的世代遗传规律;对F2、B1代的分子检测结果可用于分析外源基因能否通过杂交方式传递给后代植株以及外源基因在F2和B1代的遗传规律。
1.2.5 抗虫性鉴定 2012年将T4代纯合株系种子播种得到的T5代材料作为抗虫鉴定接虫圃。各个自交系分别选取5份纯合系种子播种,每份种子出苗后定苗60株,以非转基因的相应自交系为对照,试验设3次重复。为避免株系间以及环境的干扰,每个株系间都用遮虫网分开,空中也用遮虫网覆盖。当玉米生长到9-10 片叶左右时,将孵化的玉米螟卵接在心叶中,每株接3个中等大小的卵块。在玉米抽雄吐丝期调查玉米螟危害植株的叶片数、虫孔大小及其数目;在成熟期调查茎杆中玉米螟的隧道长度,按照Armstrong等[6]采用的标准,把只有蛀孔没有运动的隧道长度记为<2.5 cm;另外每份材料随机取样10份并混合,提取其可溶性蛋白质,采用Bradford[29]的方法测定蛋白浓度,以阴性对照的光吸收值为0,测定目的基因表达的蛋白量,以探讨转基因植株抗虫活性与其体内杀虫蛋白表达量的相关性。
1.2.6 分子检测 各代植株均在5叶期取新鲜幼嫩叶片作为样品,按1.2.1方法提取植物DNA或可溶性蛋白质,以备进行分子检测和分析。
1.2.6.1 PCR扩增 cryIAc基因引物序列:上游5'-CTGACCGTGACCGTGCTG-3',下游5'-TGGTGCCGTAGGCGAACT-3',引物由上海生工生物工程股份有限公司合成。扩增体系:总体积20 μL,Taq酶购自TRANSGEN 生物技术公司。扩增反应:94℃预变性5 min;94℃变性30 s,60℃退火30s,72℃延伸30 s,30个循环;72℃延伸10 min。扩增产物于1%琼脂糖凝胶上电泳分离,在SYN成像系统上观察电泳结果并照相。试验设质粒DNA阳性对照,阴性对照。
1.2.6.2 Southern杂交分析 以PCR扩增结果呈阳性的植株为材料,用核酸蛋白检测仪测定待酶切DNA浓度,再经适当稀释,使各总DNA 浓度大致相同。取质粒DNA 25 μg和阴性对照DNA 25 μg各1份,转化植株DNA 25 μg若干份,植物DNA用Xba I内切酶37℃ 酶切16 h,质粒DNA用Hind Ⅲ内切酶酶切,酶切产物在0.8%琼脂糖凝胶上电泳分离,然后采用毛细管转移法转移到尼龙膜上[26]。
以cry I Ac 基因的PCR 特异扩增产物为模板,采用随机引物方法制备地高辛标记探针。预杂交、杂交和洗膜,均按Roche 公司的地高辛DNA 标记及检测试剂盒提供的方法进行,最后在含有NBT 和BCIP 的染色液中显色。
1.2.6.3 ELISA检测 各代材料取样数参见表1。ELISA 检测按试剂盒(EnviroLogix,USA)说明书进行。
1.2.6.4 玉米不同生育期目的基因表达分析 T5代植株,每个自交系选取2个株系,每个株系所取样品混合后提取总蛋白,取样时期和取样材料为:5叶期,取样第5叶片;拔节期,取样此时植株部分心叶叶片;抽雄期,取样此时植株第3顶叶叶片叶尖;灌浆期,取样第2顶叶叶片叶尖。分别提取蛋白质做ELISA分析,从而研究外源基因在转化植株不同生育期的表达现象。
1.2.7 对数据的统计分析 用DPS数据软件进行分析。
2 结果
2.1 转化植株的获得
花粉介导法收获T0种子‘郑58’129粒、‘昌7-2’153粒。来年播种‘郑58’出苗118株,‘昌7-2’出苗143株。经PCR检测呈阳性结果:‘郑58’ 51个,‘昌7-2’83个,对PCR阳性结果植株的Southern杂交分析,呈阳性结果:‘郑58’24个,‘昌7-2’41个,转化率分别为20.3%和28.7%。对Southern杂交阳性结果植株的ELISA检测,结果全为阳性。证明cryIAc基因已导入并整合到转化植株的染色体组中,且外源基因得到表达。由此获得转化植株‘郑58’24个,‘昌7-2’41个。以上分子检测中,所有阴性对照的检测结果均为阴性。
T4代部分转化植株的PCR检测结果(图2)显示,除阴性对照外,质粒和转化植株都可看到期望大小的特异条带,表明目的基因存在于T4代转化植株中。同时证明T4代转基因株系已拟视纯合。结合T4代材料的Southern杂交分析结果以及其田间抗虫表现,最终选择得到转基因纯合株系。
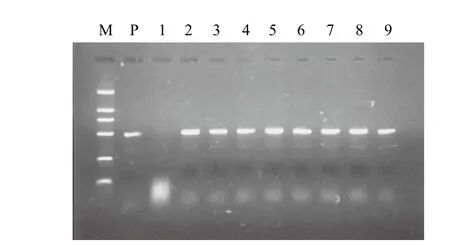
图2 T4代部分转化植株的PCR检测结果
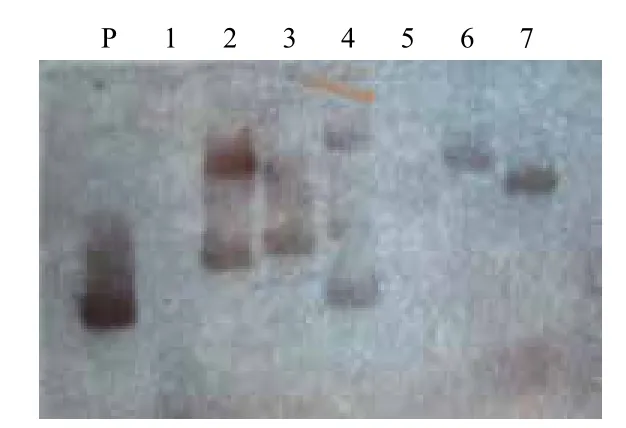
图3 T2代部分转基因植株的Southern杂交分析结果
部分T2代转化植株的Southern杂交结果(图3)显示,阴性对照(泳道1)无杂交条带出现,阳性对照(P)和绝大部分转化植株(泳道2,3,4,6,7)都有杂交条带存在,证明目的基因已整合到转化植株的染色体组中。泳道5没有发现杂交信号,可能与基因分离或丢失有关。图3中还可看到,绝大部分转基因植株均有一条杂交信号条带,证明目的基因皆以单拷贝、单位点方式插入并整合到转基因植株的染色体上。其中,泳道2和4号植株有两条杂交信号带,可能与多拷贝数整合有关(被淘汰)。各代分子检测结果,见表1。
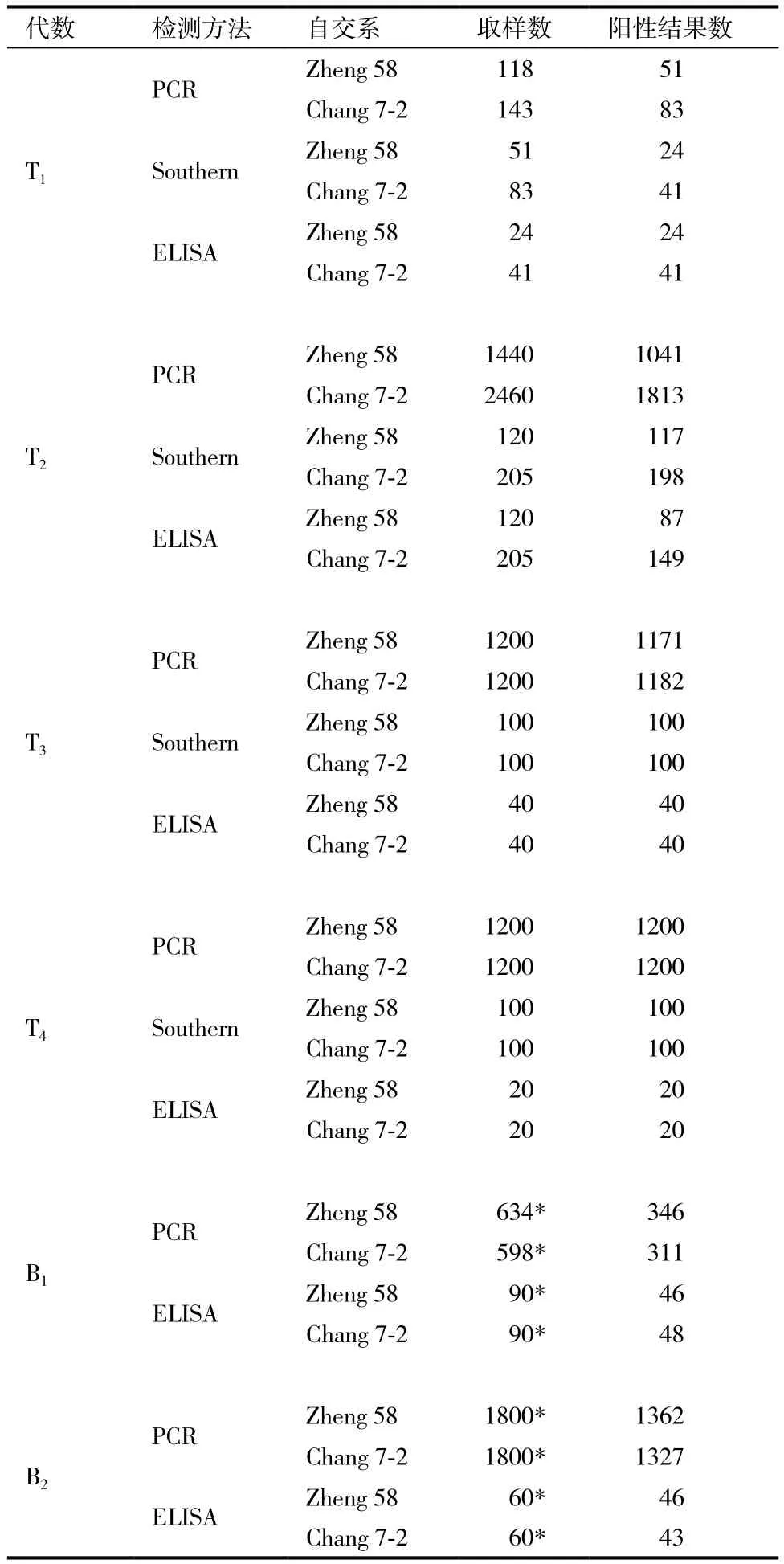
表1 各代转基因植株的分子检测结果
2.2 遗传规律研究结果
T1代样品的PCR检测和Southern杂交分析结果证明,cryIAc基因已导入转基因植株并整合到转基因植株的染色体组中,ELISA检测结果表明外源基因在转基因植株中得到表达。
T2代材料的PCR检测,‘郑58’材料的阳性结果数∶阴性结果数=2.61∶1(χ2=5.633 3),‘昌7-2’材料的阳性结果数∶阴性结果数=2.8∶1(χ2= 2.220 1);ELISA检测结果:‘郑58’材料的阳性结果数∶阴性结果数=2.64∶1(χ2=0.400 0),‘昌7-2’材料的阳性结果数∶阴性结果数=2.66∶1(χ2= 0.588 8)。PCR检测结果与ELISA分析结果接近一致,对分离比例进行χ2测验,结果证明外源基因在T2代的遗传分离符合3∶1 的孟德尔遗传规律。上述χ2检验水平为P>0.01。
T3代转基因材料的分子检测结果显示,PCR检测阳性结果率接近99%,Southern杂交和ELISA分析的阳性结果率均为100%。证明转基因株系已趋于纯合。
T4代的分子检测结果全为阳性,通过4代筛选,最终得到‘郑58’转基因纯合株系9个,‘昌7-2’转基因纯合株系8个。
B1代的PCR扩增结果为:‘郑58’阳性结果数∶阴性结果数=1.05∶1(χ2=2.151 1),‘昌7-2’阳性结果数∶阴性结果数=1.09∶1(χ2=0.257 8),ELISA检测结果为:‘郑58’阳性结果数:阴性结果数=1.05∶1(χ2=0.044 4),‘昌7-2’ 阳性结果数∶阴性结果数=1.14∶1(χ2=0.400 0)。χ2测验,结果证明外源基因在F1代的分配符合1∶1 的孟德尔遗传规律。同时,F2代植株中检测到目的基因,证明转基因可以通过杂交方式传递给期望的玉米自交系。同样,F2代呈现出明显的3∶1分离现象(PCR:χ2=5.305 9和 χ2=0.963 2,ELISA:χ2=0.088 9和χ2=0.355 5,P>0.05)。
总体来讲,转cryIAc基因玉米植株及其后代株系中,目的基因均表现出孟德尔的单显性基因的遗传分离规律。
T5代转基因植株的ELISA分析结果证明,在玉米生长的5叶期、拨节期、抽雄期和灌浆期,cryIAc基因均能正常表达,意味着在转基因的玉米株系的大部分生长发育阶段,均能在一定程度上减少杀虫剂的使用或不用。
本研究从横向、纵向分别对转基因植株(株系)中目的基因的遗传方式和表达现象进行了分析。均未发现cryIAc基因的基因沉默现象。
2.3 转化植株的抗虫鉴定结果
田间抗虫鉴定转基因植株的蛋白质浓度测定结果(表2)显示,T5代转基因植株中目的基因的表达量介于9.8-14.3 ng/g叶片鲜重之间,占植株总可溶蛋白量的0.1%左右。抗虫调查结果(表3)显示,阴性对照株系的玉米螟食叶危害的程度比转基因株系大,即两个自交系的阴性对照材料全部感虫,且单株虫孔叶片数多、虫孔也大,害虫的茎秆隧道长度为5.7-14.6 cm。图4显示转基因株系的受损植株数和单株受损叶片数均比阴性对照低得多,而且受害叶片的受损程度也比对照低。证明目的基因的导入赋予和提高了转化植株的抗虫活性,不同的转基因株系间感虫程度和虫害程度以及各重复间虽有差异,但差异不显著,而且转基因株系的茎秆隧道长度均<2.5 cm,证明在纯合株系T5代时转基因株系的抗虫活性基本稳定。这与张红伟等[30]认为高代转基因株系植株的田间食叶级别均较小的结论基本一致。
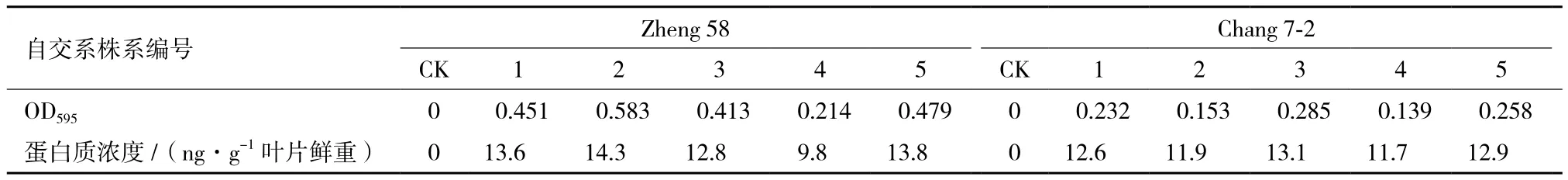
表2 T5代转基因植株中外源基因的表达量测定好结果

表3 转基因株系抗玉米螟鉴定调查和分析结果
在玉米成熟期,茎杆中玉米螟的隧道长度可反映玉米材料对玉米螟抗性的强弱[31,32]。本研究同样证明,转基因株系的玉米螟茎秆隧道长度<2.5 cm,表现出比阴性对照株系高抗虫的特性。以上结果证明,在玉米转基因纯合株系中,抗虫活性基本稳定。
结合转基因纯合株系植株中目的基因表达量与其抗虫活性的相关性分析,转基因植株中目的基因表达量与其自身的抗虫活性呈显著相关(R2=0.821,P<0.01)。最终经认真筛选,本研究最后得到5个高抗虫的转基因出合株系,分别为SZ003、SZ005、SC001、SC004和SC007。
3 讨论
转cryIAc基因玉米自交系中,外源基因的遗传分析表明,外源基因多以单拷贝、单位点形式整合到转基因植株的染色体组中,而且可以有效表达和稳定遗传,T2代和F2代的遗传分离研究结果证明符合孟德尔单因子显性遗传分离规律,与朱常香等[33]的研究结论一致。转基因株系的回交试验结果显示,外源基因的分离比为1∶1,与朱卫红等[18]结果相近。不同生育期材料的ELISA分析结果表明,在玉米生长期间的大部分阶段,外源基因都能以较高的水平表达,这对害虫的防治是非常有益的。本研究分别依据T2代、F1代和B1代植株的检测结果,证明目的基因遵循孟德尔单显性因子的遗传分离规律。
抗虫性鉴定表明,相对于阴性对照,转基因株系的抗虫能力都有很大提升。但是不同转基因植株或株系之间,杀虫活力还是存在一定的差异,除了这些转化体中存在个体差异外,还与外源基因在转化植株中的表达量、整合拷贝数、位点等有关、甚至与基因的沉默或丢失或修饰也有关,表达量越高,抗性也越强[34,35]。关于抗虫转基因作物选育过程,转基因后代材料抗虫能力的稳定性一直受到人们关注。郭东全等[36]在研究大豆的转化植株及其后代抗虫性中,经连续4代筛选,得到抗虫性趋于稳定的转化后代株系。本研究对转基因纯合株系的抗虫性分析表明纯合株系中除个体间略有差异外,株系间、株系内植株的抗虫活性基本一致。这较先前报道中在研究转基因前几代中转基因株系抗虫活性时所得出的株系间差异较大的结论更接近现实,因为遗传不稳定的转基因株系是不可能释放到田间的。

图4 田间抗虫试验照片
玉米优良自交系很多,对这些自交系一一转化不仅需要很多时间,而且还要耗费大量的人力、物力。能否通过杂交方式将外源基因传递到期望的自交系中,从而培育出优良自交系,用于创制优异性状的玉米品种,是人们所期望的。有报道认为,无论用何种转化方法,基因整合一旦发生,外源DNA 都有可能在减数分裂过程中保留下来,从而稳定地遗传给后代[37]。本研究中T5转基因植株与其对应非转化自交系杂交得到含有目的基因的F1代,也证明了转化体中的外源基因可通过杂交方式传递给下一代,这将为玉米新型抗性品种的创制提供技术保障。不过花粉与非转基因自交系杂交结果还证明,花粉可携带导入的外源基因,这与前人研究所得的Bt基因能通过转基因玉米的花粉大量传送而发生转移以及也能通过转基因玉米的花粉飘落等多种形式进入土壤等结论[38-40]一致,再次证明Bt基因可能会飘逸造成基因污染;还有研究结果表明,鳞翅目、鞘翅目和双翅目的多种昆虫对生物制剂和转基因植物均可产生抗性,鳞翅目昆虫更容易产生抗性[41],因此如何避免基因飘逸造成污染及其防止昆虫对转基因植株中杀虫蛋白产生抗性等问题还需要进行深入的研究。此外,根据传统理论,杂交F1代植株中的目的基因需要回交至少5代以上才能稳定,本研究中仅回交了1代,还需继续开展这方面的工作。
许多植物的遗传转化体系都以抗生素或除草剂作为选择标记基因,虽提高了获得转基因植物的效率,但随着选择过程的结束,这些外源选择基因在植物基因组中的存在和表达就变得多余,可能会引发有关转基因植物安全的许多问题[42]。本研究采用的花粉介导法转化体系,无需冗长的组培过程,直接得到转化种子,因此也无需这些标记基因的存在,在一定程度上会减少人们对转基因食品和环境安全的担忧。
本研究根据cryIAc基因的遗传规律、表达水平以及田间抗虫鉴定的研究分析,经筛选,得到5个高抗虫的转基因出合株系,分别为SZ003、SZ005、SC001、SC004和SC007。针对这5个株系材料,我们已申请了农业部的转基因产品中间试验,在进行中间试验的同时,以转基因材料作为亲本,设计多个组合,观察转基因技术对转化材料的配合力、农艺性状等的影响,进而筛选出更适合生产上应用的转基因新品新,为转基因产品早日走向市场做好技术和物质准备。
4 结论
采用花粉介导法将cryIAc基因导入玉米自交系中,T4代获得了转化植株及转基因纯合株系,目的基因在转化植株及其后代植株中能稳定遗传和表达,表达量占总可溶蛋白的0.1%左右,而且目的基因表达量与植株的抗虫活性间显著相关。遗传规律研究表明,转基因材料在T2、杂交F2和回交B1代,外源基因的分离或分配比分别为3∶1、3∶1和1∶1。抗虫鉴定结果证明,转cryIAc基因的玉米植株获得和增强了对玉米螟虫害的抗性。经筛选,得到5个高抗虫的转基因纯合株系,分别为SZ003、SZ005、SC001、SC004和SC007。
[1]林良斌, 官春云.毒蛋白基因与植物抗虫基因工程[J].生物工程进展, 1997, 17(2):51-55.
[2] 袁胜亮, 李明, 周国娜, 等.浅析抗虫基因种类及抗虫原理[J].安徽农业科学, 2007, 35(31):9963-9964.
[3] Fromm ME, Morrish F, Armstrong C, et al. Inheritance and expression of chimaeric genes in the progeny of transgenic maize plants[J]. Biotechnology, 1990, 8(9):833-839.
[4] Gordon-Kamm WJ, Spencer TM, Mangano ML, et al. Transformation of maize cells and regeneration of frtile transgenic plants[J]. Plant Cell, 1990, 2(7):603-618.
[5] Lauer J, Wedberg J. Grain yield of initial Bt corn hybrid introductions to farmers in the northern Corn Belt[J]. Journal of Production Agriculture, 1999, 12(3):373-376.
[6] Armstrong CL, Parker GB, Pershing JC, et al. Field evaluation of European corn borer control in progeny of 173 transgenic corn events expres-sing an insecticidal protein from Bacillus thuringiensis[J]. Crop Science, 1995, 35(2):550-557.
[7] Labatte JM, Meusnier S, Migeon A, et al. Field evaluation of and modeling the impact of three control methods on the larval dynamis of Ostrinia nubilalis(Lepidoptera:Pyralidae)[J]. Journal of Economic Entomology, 1996, 89(4):852-862.
[8]丁群星, 谢友菊, 戴景瑞, 等.用子房注射法将Bt 毒蛋白基因导入玉米的研究[J].中国科学:B辑, 1993, 23(7):707-713.
[9]王国英, 杜天兵, 张宏, 等.用基因枪将Bt 毒蛋白基因转入玉米及转基因植株再生[J].中国科学:B辑, 1995, 25(1):71-77.
[10]袁英, 李晓辉, 孔祥梅, 等. Bt 基因转化玉米培育抗玉米螟自交系[J].分子植物育种, 2007, 5(4):572-576.
[11]Budar F, Thia-Toongl L, Van MM, Hernalseens JP. Agrobacteriummediated gene transfer results mainly in transgenic plants transmitting as a single Mendelian factor[J]. Genetics, 1986,114(1):303-313.
[12]Walters DA, Vetsch CS, Potts DE, Lundquist RC. Transformation and inheritance of a hygramycin phosphoto transferase gene in maize plants[J]. Plant Molecular Biology, 1992, 18(2):189-200.
[13]Spencer TM, James VO, William GS, et al. Segregation of transgenes in maize[J]. Plant Molecular Biology, 1992, 18(2):201-210.
[14] Christon P, Swain WF, Yang NS, Mccabe DE. Inheritance and expression of foreign gene in transgenic soybean plants[J]. Proc Nati Acad Sci USA, 1989, 86(19):7500-7504.
[15]王守才, 王国英, 丁群星, 等.转基因在玉米中的遗传分离与整合特性的研究[J].遗传学报, 1999, 26(3):254-261.
[16]王得元, 殷秋秒, 石尧清, 李乃坚.外源基因在作物基因组的整合特性及遗传分析[J].湖北农学院学报, 1999, 19(2):113-115.
[17]姚方印, 朱常香, 李广贤, 温孚江. Bt 水稻的抗虫性鉴定及转基因的遗传分析[J].中国农业科学, 2002, 35(2):142-145.
[18]朱卫红, 王庆东, 刘宗华, 等.玉米转Bt基因后代的抗虫性鉴定及其遗传分析[J].河南农业大学学报, 2004, 38(2):135-138.
[19]王国英, 张宏, 谢友菊, 等.玉米胚性愈伤组织转化及转Bt基因植株的抗虫性[J].农业生物技术学报, 1995, 3(3):49-53.
[20]李余良, 胡建广, 苏菁, 刘建华.子房注射法将Bt基因导入超甜玉米[J].玉米科学, 2005, 13(1):41-43.
[21]Deroles SC, Gardner RC. Expression and inheritance of kanamycin resistance in a large number of transgenic Petunias generated by Agrobacterium-mediated transformation[J]. Plant Molecular Biology, 1988, 11(3):355-364.
[22]Brandle JE, Mchugh SG, James L, et al. Instability of transgene exptession in field grown obacco carring the csrL-L gene for sulfonylurea herbicide resistance[J]. Biotechnology, 1995, 13(9):994-998.
[23]Matzke MA, Matzke AJM. How and why do plants inactivation homologous(trans)gene?[J]. Plant Physiology, 1995, 107(3):679-685.
[24]Richard AJ. Cosuppression, flower clolor pattern and matastable gene expression states[J]. Science, 1995, 268(5211):686-691.
[25]孙毅, 崔贵梅, 郝曜山, 等.超声波辅助花粉介导植物转基因方法.中国, 201110041484.0[P]. 2011-02-18.
[26]Sanbrook J, Fritsch EF, Maniatis T. Molecular cloning:A Laboratory Manual[M]. 2nded. New York:Cold Spring Harbor Laboratory Press, 1989:19-27, 474-490.
[27]杨文鹏, 王明春, 杨留启, 王伟.玉米总蛋白质提取技术和蛋白质样品浓度测定方法的比较[J].种子, 2010, 29(12):18-23.
[28]杜建中, 孙毅, 王景雪, 等.转水稻NibT基因玉米植株的获得及抗病性研究[J].西北植物学报, 2011, 31(5):893-901.
[29]Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1-2):248-254.
[30]张红伟, 张红梅, 郑祖平, 等. Bt转基因玉米的获得及其对玉米螟的抗性分析[J].西北植物学报, 2004, 24(7):1266-1270.
[31]Michael GK, Gary LB, Cindy B, et al. Field performance of elite transgenic maize plants expressing an insecticidal protein derived from Bacillus thuringiensis[J]. Biotechnology, 1993, 11(2):194-200.
[32]李慧芬, 李旭刚, 刘翔, 等.转苏云金杆菌毒蛋白基因玉米植株的获得及其抗虫性分析[J].植物学报, 2002, 44(6):684-688.
[33]朱常香, 宋云枝, 张杰道, 等.抗虫、抗除草剂转基因玉米的获得及遗传研究[J].山东农业大学学报:自然科学版,2002, 33(2):120-125.
[34]Linn F, Heidmann I, Safdler H, Meyer P. Epigenetic changes in the expression of the maize A1 gene in Petunia hybrid:role of number of integrated gene copies and state of methylation[J]. Molecular Genetics and Genomics, 1990, 222(2-3):329-336.
[35]Sangtong V, Moran L, Chikwamba R, et al. Expression and inheritance of the wheat Glu-1DX5 gene in transgenic maize[J]. Theoretical and Applied Genetics, 2002, 105(6-7):937-945.
[36]郭东全, 杨向东, 包绍君, 等.转CryIA和CpTI双价抗虫基因大豆的获得与稳定表达[J].中国农业科学, 2008, 41(10):2957-2962.
[37]王金凤, 李钊, 杜丽璞, 等.转PvPGIP2基因小麦的获得与纹枯病抗性鉴定[J].植物遗传资源学报, 2013, 14(1):179-183.
[38] Steven RS, Larry RH. Insect bioassay for determining soil degradation of Bacillus thuringiensis subsp. Kurstaki Cry1A(b)protein in corn tissue[J]. Environmental Entomology, 1996, 25(3):659-664.
[39]Saxena D, Stotzky G. Bacillus thuringensis(Bt)toxin released from root exudates and biomass of Bt corn has no apparent effect on earthworms, nematodes, protozoa, bacteria, and fungi in soil[J]. Soil Biology & Biochemistry, 2001, 33(9):1225-1230.
[40]路兴波, 孙红炜, 杨崇良, 等.转基因玉米外源基因通过花粉漂移的频率和距离[J].生态学报, 2005, 25(9):2450-2453.
[41]梁革梅, 谭维嘉, 郭予元.棉铃虫对Bt 的抗性筛选及交互抗性研究[J].中国农业科学, 2000, 33(4):46-53.
[42]高翔, 别晓敏, 佘茂云, 叶兴国.安全型转基因植物培育技术研究进展[J].植物遗传资源学报, 2009, 10(4):607-612.
(责任编辑 马鑫)
Genetic Analysis of cryIAC Gene in Transgenic Maize Plants and Its Effects on Insect-resistance
Wang Jianjun1Yang Huizhen2Liu Jiao1
(1. Xixian Agricultural Experiment Stations,Shanxi Academy of Agricultural Sciences,Xixian 041300;2. Crop Science Institute,Shanxi Academy of Agricultural Sciences,Taiyuan 030031)
In order to analyse the genetic regularity of target gene cryIAc in transgenic and their descendant plants(lines), and to study the effect of target gene on insect-resistant activity of transgenic plants at the same time, this research work was conducted. Firstly, cryIAc gene was transformed into maize inbred ‘Zheng 58’ and ‘Chang7-2’ separately by pollen-mediated transformation method. PCR, Southern,ELISA analysis and bioassay in the field of each generation transgenic plants were then conducted according to experimental requirements. Results showed that ⑴ A total of 24 and 41 transgenic plants were obtained through transformed cryIAc gene into maize inbred ‘Zheng 58’and ‘Chang7-2’, respectively. ⑵ The molecular detection results of transgenic T2, hybridization F2and backcross B1plants suggested that the segregation of target gene in these lines followed 3∶1, 3∶1 and 1∶1 segregation ratio of the Mendel laws of heredity, respectively. ⑶ The molecular detection results of T1to T4transgenic plants(lines)showed that the target gene could stably inherited and expressed effectively, the expression amount of the target gene was from 9.8 to 14.3 ng/g leaf fresh weight. ⑷ Moreover, the results of bioassay in the field indicated that in the case of high insect-susceptibility of negative control line, the transgenic lines still showed highly insect-resistant activity. ⑸ In addition, the target gene integrated into genomics of transgenic plants could inherit to the next generation plants by hybridization. ⑹ At last, 5 high insectresistant transgenic lines, SZ003, SZ005, SC001, SC004 and SC007, was gained by screening. The pollen-mediated transformation method was a effective and shortcut tool used in plant transformation, cryIAc gene could confer and enhance insect-resistant activity of transgenic plants(lines)tansfomated with it.
transgenic maize;cryIAc gene;genetic regularity;insect-resistance
10.13560/j.cnki.biotech.bull.1985.2015.01.019
2014-05-21
山西省科技攻关项目(20140311002-1),山西省农科院院育种高产项目(11yzgc064)
王建军,研究方向:玉米育种和栽培;E-mail:wangjianjun1123@126.com
