烟草远缘杂种合子中父本特异表达基因EB30的克隆与分析
2015-10-25罗岸
罗岸
(长江大学生命科学学院,荆州 434023)
烟草远缘杂种合子中父本特异表达基因EB30的克隆与分析
罗岸
(长江大学生命科学学院,荆州 434023)
已知烟草远缘杂种的合子中EB30基因(EST序列号EB426694)的表达具有父本特异性。参考NCBI的EST序列设计引物,克隆得到该基因的CDS序列,并对其编码的蛋白进行生物信息学分析。使用染色体步移和hiTAIR-PCR技术获取EB30基因的5'侧翼序列(启动子和5' UTR)。构建由该基因5'侧翼序列驱动的EB30-EGFP融合蛋白表达载体并转化烟草。结果表明,EB30蛋白由211个氨基酸组成,蛋白分子量为22.616 2 kD,等电点pI 为5.63。该蛋白具有亲水性,可能定位于线粒体中。烟草EB30蛋白与同属茄科的番茄和马铃薯的蛋白序列相似度最高,约为73%。不同物种的同源蛋白的N端和C端都具有一段较为保守的序列区段。观察转基因植株合子和二胞原胚能检测到较强荧光,证实所获EB30基因的5'侧翼序列在早期胚胎发生时期具有启动子活性。
烟草;远缘杂交;早期胚胎发生;父本特异表达;基因克隆
父本转录本是否参与了植物早期胚胎发生这一问题曾引起过巨大的争议。早前的研究认为,受精前即存储于卵细胞中的母本转录本主导着胚胎的早期发育[1-5]。但对拟南芥和玉米等植物中父本信号的检测暗示父本转录本可能也参与了植物的早期胚胎发生[6-8]。随后父母双方转录本的相对表达水平首次在玉米不同自交系的杂种合子中被量化,试验结果清楚地表明,父母双方的遗传信息对于合子的发育具有同等作用,且父本转录本的高活性也印证了所观察到的杂种优势[9]。利用深度测序技术,最新的工作系统分析了拟南芥早期胚胎中存在的转录本的父母本来源[10,11]。两项研究都证实某些父本的转录本单独存在于胚胎的早期发育时期。因此父本转录本在植物早期胚胎发生中可能扮演重要角色。但至今,对这类转录本的生物学意义仍知之甚少。
杂种优势在自然界中普遍存在,它是指杂种F1代与其亲本相比,在抗逆、抗病虫或产量等方面表现出更优良的性状。杂种优势一般在成熟植株中表现明显,但某些时候在胚胎和幼苗时期就已出现[9,12]。除不同品种和品系的杂交,跨越种属的远缘杂交也是制造杂种优势,创造新品种的重要手段。虽然杂种优势早已被广泛应用于生产,但对其分子调控机制的认识却一直裹足不前。如今研究者发现,在玉米杂种中有些基因的表达呈现出等位基因的差异化[13,14],暗示等位基因的差异表达可能也反映了杂种优势的一种调控途径。因此对在杂种早期胚胎发生中单一亲本来源的转录本的研究十分必要。
通过之前的工作可知EB30基因在烟草远缘杂种的合子中呈父本特异表达[15]。本研究利用NCBI的EST数据库获得该基因的CDS全长序列,并运用生物信息学软件加以分析。通过染色体步移和hiTAIR-PCR技术获得EB30 基因的5'侧翼序列(启动子和5'UTR),分析新获得的序列在早期胚胎发生时期的启动子活性情况,旨在为进一步研究EB30基因的生物学功能奠定良好基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 GFP融合蛋白表达载体在pART27载体上改造而成,由武汉大学彭雄波副教授提供。大肠杆菌DH5α和农杆菌GV3101感受态为武汉大学植物生殖发育教育部重点实验室自制。
1.1.2 植物材料 试验材料为野生型烟草(Nicotiana tabacum var. SR1),阴性对照植株为携带有花粉特异启动子Lat52驱动的EGFP蛋白的转基因SR1植株(武汉大学植物生殖发育教育部重点实验室自制),种植于长江大学生命科学学院所属温室内,室温25℃,光照16 h。
1.1.3 主要试剂 普通DNA片段回收试剂盒,琼脂糖凝胶回收试剂盒,质粒小提试剂盒购自天根生化科技有限公司,DNeasy Plant Mini Kit试剂盒购自QIAGEN公司,Universal Genome Walker Kit试剂盒购自Clontech公司,DNA聚合酶Ex Taq购自Ta-KaRa公司,DNA聚合酶Phusion High-Fidelity DNA Polymerasehe,限制性内切酶购自NEB公司,T4 DNA lignase购自Fermentas公司,pGEM-T Easy vector购自Promega公司。
1.2 方法
1.2.1 烟草基因组的提取及染色体步移文库的构建 取100 mg幼叶,在液氮中碾碎后按照DNeasy Plant Mini Kit 试剂盒的要求进行操作。使用分光光度计将获得的基因组DNA稀释至Universal Genome Walker Kit试剂盒要求的浓度。建库所需的4种平末端内切酶分别选用EcoR V、Dra I、Ssp I 和Xmn I,酶切时间分别为Dra I 和Ssp I 10 min,EcoR V 48 h,Xmn I 12 h。酶切完成后电泳检测,合格后按照试剂盒要求完成后续步骤。
1.2.2 EB30基因CDS区的克隆 根据NCBI提供的EST序列设计CDS引物(表1)。使用该引物在预制备的烟草合子cDNA pool中扩增,以获得烟草品种SR1的EB30基因的CDS序列[15]。PCR扩增程序:98℃预变性1 min;98℃变性10 s,60℃退火20 s,72℃延伸1 min,30个循环。Pushion高保真酶扩增。回收目的条带,送样测序。

表1 CDS扩增所需引物
1.2.3 EB30基因5'侧翼区的克隆 按照Universal Genome Walker Kit试剂盒的要求设计GSP引物。反应体系和反应条件参照试剂盒要求,引物退火温度灵活掌握,得到目的片段后送样测序。获得一定长度的未知序列后,通过染色体步移技术无法继续向5'上游扩增,故使用hiTAIR-PCR技术继续扩增。按照文献[16]的要求设计引物,反应体系和反应条件参照文献要求,退火温度灵活掌握,得到目的片段后送样测序。引物序列见表2。
1.2.4 生物信息学分析 使用Omiga分析EST序列的开放阅读框。利用ExPASy(http:/ /web.expasy.org)的Protparam和ProtScale预测蛋白质的氨基酸组成和理论等电点等基本理化性质,并通过SOPMA预测其二级结构。采用PSORT(http://psort.hgc. jp/form.html)预测蛋白质的亚细胞定位。利用NCBI的blastx搜索EB30蛋白的同源氨基酸序列,利用软件Clustalx 1.83进行同源比对,并用MEGA 4构建系统进化树。
极限求解过程中,若需要运用等价无穷小替换计算极限,首先需要掌握等价替换定理(等价无穷小替换定理:α~α′,β~β′,则 )和熟记几个常用的等价无穷小替换公式(x→0时,sin x~x,tan x~x,arctan x~x,arcsin x~x,ln(1+x)~x,ex-1~x,1-cos在了解和掌握等价无穷小替换后,例1中运用等价无穷小替换计算极限方法如下:

表2 5'侧翼区扩增所需引物
1.2.5 GFP融合蛋白表达载体的构建 依据已知序列,分别设计用于扩增EB30基因的5'侧翼区和CDS的引物,并在5'端添加酶切位点,引物序列见表3。用CDS-F2/CDS-R2在预制备的烟草合子cDNA pool中扩增CDS序列[12],反应条件和程序同1.2.2。用PRO-F/PRO-R在烟草基因组中扩增启动子和5'UTR,反应条件和程序同1.2.2。对目的条带回收后进行双酶切,并依次连入GFP融合蛋白表达载体,送样测序。

表3 载体构建所需引物
1.2.6 烟草叶盘转化 应用电转法将构建好的GFP融合蛋白表达载体转入农杆菌GV3101,采用叶盘法进行转基因。植株成熟后使用荧光观察以筛选阳性苗。
1.2.7 烟草早期胚胎分离与观察 取人工授粉后96 h和108 h左右的子房用于胚胎分离。采用酶解-研磨法分离得到胚囊,将胚囊继续短时间酶解,然后用自制的微型玻璃吸管小心吹打分离出合子和2胞原胚[17,18]。将得到的胚胎置于微滴中观察。
2 结果
2.1 EB30基因CDS区的克隆
NCBI数据库中的EST序列为738 bp。Omiga软件预测其可能包含一个633 bp的CDS编码区(图1,红色条段)。以此CDS序列为模板设计引物,可在预制备的烟草合子cDNA Pool中扩增到相应条带。测序结果表明,所获序列与数据库相比有两个碱基的差异。但分析图1的红色条段可知,其显示的CDS的起始密码子ATG之前还可能存在新的起始密码子。后续试验将结合新扩增序列对EB30的CDS全长进行确定。
2.2 步移文库的构建及EB30基因5'侧翼区的克隆和CDS完整性的验证
染色体步移文库的构建见图2-A。因EST序列较完整,故直接使用染色体步移技术来获取EB30基因的5'侧翼序列。第一次向序列的5'端延伸了637 bp,其中247 bp的序列与原CDS序列完全匹配。之后由于使用染色体步移技术无法再次延伸序列,故选用hiTAIR-PCR技术来继续获取未知序列。第一次获得了1 296 bp,第二次获得了901 bp。之后无论利用染色体步移或hiTAIR-PCR技术均无法再继续获得新序列。将3次延伸获得的序列进行拼接,发现在图1红色条段所示CDS的起始密码子ATG之前共存在2 406 bp序列(图2-B和图3)。同时将拼接序列进行分析,发现图1的红色条带所示的CDS起始密码子之前96 bp处存在一个终止子TAA,说明图1中红色条段所示即为完整CDS。
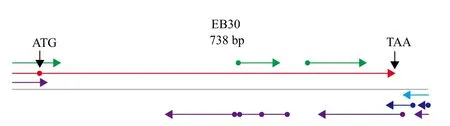
图1 EB30 EST开放阅读框分析
使用在线的Protparam和ProtScale工具对EB30蛋白进行生物信息学分析,结果(表2)表明,该蛋白的分子量为22.616 2 kD,pI5.63,属酸性蛋白。该蛋白由211个氨基酸组成,包含20 种基本氨基酸类型,其中Gly 和Ser含量最为丰富(各占12.3%)。EB30蛋白的正、负电荷残基分别为20和26个,脂肪系数78.44,不稳定性指数64.69,属不稳定蛋白。分析显示EB30蛋白的平均总疏水性为-0.406,属亲水性蛋白。
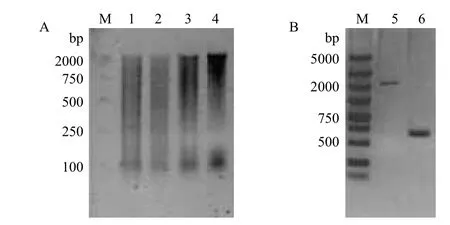
图2 染色体步移文库构建(A)及EB30基因5'侧翼区和CDS的克隆(B)

图3 EB30基因5'侧翼区序列

表 2 EB30基因编码氨基酸一级结构预测分析
2.4 EB30蛋白的亚细胞定位分析
构建由EB30基因5'侧翼序列驱动的EB30-EGFP融合蛋白表达载体并转基因。使用Confocal对融合蛋白植株的花粉粒和花粉管的荧光进行扫描,发现EB30-EGFP蛋白在细胞质中呈现点状聚集,而在阴性对照植株的花粉中EGFP蛋白则弥散分布(图4)。这暗示EB30蛋白可能定位于某种细胞器,从而在胚胎发生过程中发挥作用。软件预测的结果也显示EB30蛋白定位于线粒体中的可能性最大。
2.5 EB30蛋白二级结构的预测
蛋白质的二级结构主要由α-螺旋、β-折叠等组成。二级结构折叠形成正确的三级结构是蛋白质发挥正常的生物学功能的基础。分析显示EB30蛋白的二级结构由4 种形式组成,其中α-螺旋占34.60%,无规则卷曲占49.29%,延伸链和β-转角较少,分别占11.85%和4.27%(表3和图5)。由此可知,无规则卷曲在EB30蛋白二级结构中最多,而α-螺旋和延伸链分散于整个蛋白中。

图4 EB30-EGFP融合蛋白的亚细胞定位

表3 EB30蛋白二级结构的预测

图5 EB30蛋白二级结构预测
2.6 EB30蛋白氨基酸序列同源比对和系统进化分析
利用Blastx搜索烟草EB30蛋白的同源序列,发现在高粱、玉米、粟米、葡萄、番茄和马铃薯等农作物中都存在与之类似的蛋白序列。其中烟草与同属茄科的番茄和马铃薯的序列相似度最高,达到73%(图6)。搜索结果还显示该蛋白无任何功能注释,这表明EB30基因是一种未被研究过的基因,编码一种新型的蛋白。对不同物种中EB30蛋白的氨基酸序列进行比对,发现这些序列的C端和N端附近都各自拥有一段较为保守的区段,这可能与其执行的功能有密切关系。但是在氨基酸序列的其他部分,不同物种间的序列差别较大,说明这些区域进化速度较快。选取不同物种的EB30同源蛋白构建系统进化树(图7),发现同属茄科的番茄、马铃薯和烟草属于同一分支,单子叶植物高粱、玉米和粟米则亲缘关系较近。
2.7 EB30基因的5'侧翼序列在早期胚胎时期的活性
利用2.4中所获得的转基因植株,采用人工授粉的方法取得授粉后96 h和108 h的胚珠。利用二次酶解法获得合子和二胞原胚后利用普通荧光显微镜进行观察,荧光清晰可辨(图8),表明获基因的5'侧翼序列在早期胚胎发生阶段有较强的启动子活性。
3 讨论
现有的科学研究表明,在植物早期胚胎发生中来自父母双方的转录本都参与了胚胎的发育,且有些发育事件或是由父本或母本转录本主导调控[9-11]。如在拟南芥中发现SHORT SUSPENSOR(SSP)基因的父本转录本可以控制胚胎的模式形成[19],以及NIMNA基因(NMA)的父本等位基因的突变会更明显地导致胚胎发育迟滞[20]。但目前对父本转录本在胚胎发生中的生物学功能还只有零星报道,而对单一亲本来源的转录本在远缘杂种早期胚胎中的具体功能的研究则尚未见诸报端。

图6 EB30蛋白氨基酸序列比对分析

图7 烟草与其他物种的EB30蛋白的进化树分析

图8 EB30-EGFP融合蛋白在早期胚胎中的表达
EB30基因是在烟草远缘杂种的合子中父本特异表达的基因。其作为一种未知功能的新型蛋白广泛存在于高粱、玉米、粟米、葡萄、番茄和马铃薯等农作物中。尽管单子叶植物高粱、玉米和粟米中的EB30和同属茄科的烟草、番茄和马铃薯的EB30的氨基酸序列处于不同的进化支,但是不同物种的同源蛋白在靠近C端和N端的位置都有相对保守的序列区段。这暗示了该蛋白的非核心区进化速度较快,而核心区的进化则相对保守。本研究借助已知的EST序列信息,结合染色体步移和hiTAIR-PCR技术成功获得了EB30基因的5'上游侧翼序列。染色体步移是获取未知基因序列较常用的技术。但由于序列特异性等原因,常常遇到序列延伸困难等问题。而Liu等[16]在 TAIR-PCR技术的基础上经重新设计随机引物和改善扩增条件推出了hiTAIR-PCR技术,其只需要简单的基因组模板即可进行试验。本研究通过这两种技术的综合运用获得了EB30基因起始密码子ATG之前2 046 bp的上游序列,包括启动子和5' UTR。一般认为起始密码子上游2 000 bp的序列已足以调控基因的表达,故构建了由EB30基因启动子和5' UTR驱动的EB30-EGFP融合蛋白表达载体并转化烟草。观察转基因植株的合子和2胞原胚发现有明显的荧光信号,说明本研究所获得的EB30基因的5'侧翼序列在早期胚胎发育时期有较强启动子活性。这为以后利用RNA干扰等技术对EB30基因进行功能分析奠定了良好的基础。
4 结论
在烟草远缘杂种的合子中父本特异表达的EB30基因含有633 bp的CDS区,其编码的蛋白质分子量为22.616 2 kD,pI 值5.63,属酸性蛋白。该蛋白不稳定,具有亲水性,且可能定位于线粒体中。其二级结构中无规则卷曲含量最高,其次为α-螺旋。EB30蛋白作为一种未知功能的新型蛋白存在于许多双子叶和单子叶的农作物中,且有较为保守的序列区段。新获得的EB30基因的5'侧翼序列在早期胚胎发生时期有较强启动子活性。
[1]Vielle-Calzada JP, Baskar R, Grossniklaus U. Delayed activation of the paternal genome during seed development[J]. Nature, 2000,404(6773):91-94.
[2]Grimanelli D, Perotti E, Ramirez J, Leblanc O. Timing of the maternalto-zygotic transition during early seed development in maize[J]. Plant Cell, 2005(4):1061-1072.
[3]Golden TA, Schauer SE, Lang JD, et al. Short integuments1/ suspensor1/carpel factory, a dicer homolog, is a maternal effect gene required for embryo development in Arabidopsis[J]. Plant Phys,2002, 130(2):808-822.
[4]Baroux C, Blanvillain R, Gallois P. Paternally inherited transgenes are down-regulated but retain low activity during early embryogenesis in Arabidopsis[J]. FEBS Lett, 2001, 509(1):11-16.
[5]Pillot M, Baroux C, Vazquez MA, et al. Embryo and endosperm inherit distinct chromatin and transcriptional states from the female gametes in Arabidopsis[J]. Plant Cell, 2010, 22:307-320.
[6]Weijers D, Geldner N, Offringa R, Jurgens G. Seed development:Early paternal gene activity in Arabidopsis[J]. Nature, 2001, 414(6865):709-710.
[7]Scholten S, Loerz H, Kranz E. Paternal mRNA and protein synthesis coincides with male chromatin decondensation in maize zygotes[J]. Plant J, 2002, 32:221-231.
[8] Sheldon CC, Hills MJ, Lister C, et al. Resetting of FLOWERING LOCUS C expression after epigenetic repression by vernalization[J]. Proc Natl Acad Sci USA, 2008, 105:2214-2249.
[9] Meyer S, Scholten S. Equivalent parental contribution to early plant zygotic development[J]. Current Biology, 2007, 17(19):1686-1691.
[10] Autran D, Baroux C, Raissig MT, et al. Maternal epigenetic pathways control parental contributions to Arabidopsis early embryogenesis[J]. Cell, 2011, 145(5):707-719.
[11] Nodine MD, Bartel DP. Maternal and paternal genomes contribute equally to the trascriptome of early plant embryos[J]. Natrue,2012, 482(7383):94-97.
[12] Hoecker N, Keller B, Piepho HP, Hochholdinger F. Manifestation of heterosis during early maize(Zea mays L.)root development[J]. Theor Appl Genet, 2006, 112(3):421-429.
[13]Stupar RM, Springer NM. Cis-transcriptional variation in maize inbred lines B73 and Mo17 leads to additive expression patterns in the F1 hybrid[J]. Genetics, 2006, 173(4):2199-2210.
[14]Guo M, Rupe MA, Zinselmeier C, et al. Allelic variation of gene expression in maize hybrids[J]. Plant Cell, 2004, 16(7):1707-1716.
[15]Zhang JE, Luo A, Xin HP, et al. Genes of both parental origins are differentially involved in early embryogenesis of a tobacco interspecies hybrid[J]. PLoS One, 2011, 6(8):e23153.
[16]Liu YG, Chen Y. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J]. Biotechniques, 2007, 43(5):649-650.
[17]Sun MX, Yang HY, Zhou C. A new method for embryo sac isolation and in situ fusion of egg and synergid protoplasts in Nicotiana tubacum[J]. Acta Bot Sin, 1993, 35:893-900.
[18]Fu CM, Sun MX, Zhou C, Yang HY. Isolation of fertilized embryo sacs and zygotes and triggering of zygote division in vitro in Nicotiana tabacum[J]. Acta Bot Sin, 1996, 38:262-267.
[19]Bayer M, Nawy T, Giglione C, et al. Paternal control of embryonic patterning in Arabidopsis thaliana[J]. Science, 2009, 323(5920):1485-1488.
[20] Babu Y, Musielak T, Henschen A, Bayer M. Suspensor len gth determines developmental progression of the embryo in Arabidopsis[J]. Plant Physiol, 2013, 162(3):1448-1458.
(责任编辑 马鑫)
Cloning and Analysis of Paternally Expressed Gene EB30 in Zygote of a Tobacco Interspecies Hybrid
Luo An
(College of Life Science,Yangtze University,Jingzhou 434023)
As known that EB30(EST accession number EB426694)paternally expressed in zygote of a tobacco interspecies hybrid,its CDS sequence was then cloned by using the EST database of NCBI. Also some characters of EB30 protein were analyzed by the methods of bioinformatics. Genome walking and hiTAIR-PCR were used to obtain the 5' flanking region of EB30 including the promoter and 5'UTR. The EB30-EGFP fusion protein expression vector driven by the 5' flanking region of EB30 was constructed and transformed into the tobacco. The results showed that EB30 gene encoded 211 amino-acid residues with a molecular weight 22.616 2 kD and pI5.63. This protein was hydrophilic,and predicted to locate in the mitochondrion. The phylogenetic tree showed that EB30 protein of tobacco was so closed to the tomato and potato,the amino acid homology was about 73%. There were two conserved regions near the N-terminal and C-terminal in homologous proteins from different species. Finally, the 5' flanking region of EB30 was proved to have a promoter activity in the early embryogenesis by fluorescence observation in the zygote and 2-celled proembryo from transgenic plants.
tobacco;interspecies hybrid;early embryogenesis;paternal expression;cloning
10.13560/j.cnki.biotech.bull.1985.2015.01.018
2014-05-04
长江大学博士科研启动基金项目(2014NSFY023)
罗岸,男,博士,讲师,研究方向:植物生殖发育;E-mail:anluo@whu.edu.cn
