乌腺金丝桃愈伤组织中总黄酮及金丝桃素含量测定
2015-10-25刘晓丹张克勤刘连李文昌
刘晓丹张克勤刘连李文昌
(1.吉林农业科技学院生物工程学院,吉林 132101;2.长白山动植物资源利用与保护吉林省高校重点实验室,吉林 132101)
乌腺金丝桃愈伤组织中总黄酮及金丝桃素含量测定
刘晓丹1,2张克勤2刘连1李文昌1
(1.吉林农业科技学院生物工程学院,吉林 132101;2.长白山动植物资源利用与保护吉林省高校重点实验室,吉林 132101)
以乌腺金丝桃新鲜叶片为材料,建立稳定的乌腺金丝桃愈伤组织的培养体系,进一步对愈伤组织总黄酮与金丝桃素的含量进行测定。以MS为基础培养基,考察不同激素组合对愈伤组织诱导的影响。结果表明,乌腺金丝桃诱导愈伤组织的最佳培养基为MS + 2,4-D 4.0 mg/L + 6-BA 0.2 mg/L;采用超声波法提取乌腺金丝桃愈伤组织中的总黄酮和金丝桃素,分别采用紫外分光光度法和HPLC 法测定乌腺金丝桃愈伤组织中总黄酮及金丝桃素的含量,结果表明,干燥乌腺金丝桃愈伤组织中总黄酮含量为27.99 mg/g,金丝桃素的含量为 0.515 mg/g。
乌腺金丝桃;愈伤组织;诱导;总黄酮;金丝桃素
乌腺金丝桃(Hypericum attenuatum Choisy)是藤黄科金丝桃属植物,多分布于我国吉林、黑龙江、辽宁、内蒙古等省,特别是长白山地区具有丰富的乌腺金丝桃资源。该属植物含有十几种黄酮及其苷类化合物,特别是广泛分布于该属的最具有生物活性成分的金丝桃素(Hypericin),具有显著的抗病毒、抗抑郁和光动活性[1-4],近年来成为国内外研究开发的热点。
目前,国内外对金丝桃属植物的研究主要有4个方面:(1)金丝桃属植物天然药用成分的鉴定,提取分离工艺研究及含量测定[5-12];(2)金丝桃属植物天然药用成分的药理作用[13-18];(3)金丝桃属植物组织培养和遗传转化研究[19-24];(4)金丝桃素合成代谢途径关键酶基因的研究[25,26]。而对乌腺金丝桃的研究主要集中其天然活性成分的提取分离的研究[5,10]和天然活性成分的药理作用这两方面[13,14],对其组织培养的研究还未见报道。
随着人们对金丝桃属植物天然药用成分的需求不断增加,利用植物组织培养技术工业化生产具有重要经济价值的植物次生代谢产物,可为中药的可持续发展提供一条新的途径。本研究依托吉林省长白山重点实验室,以乌腺金丝桃叶片为外植体,探索理想的愈伤组织诱导的激素组合,培养生长状态良好的愈伤组织,并分析其愈伤组织中总黄酮和金丝桃素含量,旨在为利用植物组织培养法生产具有重要经济价值的天然植物次生代谢产物提供优质的生物材料,同时为进一步探讨乌腺金丝桃细胞悬浮培养,筛选增殖快、药用有效成分含量高的细胞系奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 材料 乌腺金丝桃栽培苗由吉林农业科技学院长白山动植物资源利用与保护研究中心提供。
1.1.2 试剂 MS培养基(不含蔗糖和琼脂)购自青岛高科技工业园海博生物技术有限公司;植物激素2,4-D和6-BA购自Sigma公司;甲醇、乙醇为分析纯;NaNO2,Al(NO3)3,NaOH等购自北京化工试剂;芦丁标品和金丝桃素标品为吉林农业科技学院长白山动植物资源利用与保护研究中心提供。
1.1.3 仪器 恒温干燥箱(上海岛韩实业有限公司),JY99-IIDN 超声波破碎仪(宁波新芝生物科技股份有限公司),高效液相测定仪LC-20A(日本岛津),KRG-350B智能光照培养箱(上海博珍仪器设备制造厂),751分光光度计。
1.2 方法
1.2.1 乌腺金丝桃愈伤组织的诱导 5月采集乌腺金丝桃幼苗,选取1.0-2.0 cm 的叶片为外植体,经过适当消毒后,切割成0.5 cm2接种于不同激素处理的愈伤组织诱导培养基上,25℃ 暗培养,10 d 后观察愈伤组织生长情况,20 d后统计愈伤组织诱导率。同时将各个处理的愈伤组织放入40℃的干燥箱中至完全干燥,此时称重并记录干重。干重即为生长量。诱导形成的愈伤每15 d 继代一次。
1.2.2 乌腺金丝桃供试品溶液的制备 分别取继代5次的愈伤组织和栽培的乌腺金丝桃幼苗材料5份,40℃完全干燥后,研钵中充分研磨成粉。每份称取0.25 g。加入25 mL 60%乙醇,称重,超声处理60 min,放冷,补重,摇匀。5 000 r/min离心10 min,取上清液,0.45 μm微孔滤膜过滤后作为供试品溶液备用。
1.2.3 乌腺金丝桃愈伤组织中总黄酮含量测定 标准曲线绘制:精确称取2.5 mg芦丁标准品,加90%乙醇定容到25 mL容量瓶中,摇匀即得浓度为0.1 mg/mL芦丁对照品溶液。精确吸取上述对照品溶液0、1.0、2.0、3.0、4.0和5.0 mL分别置于20 mL具塞试管中,各加90%乙醇至5 mL,再依次加5% NaNO20.3 mL 摇匀,放置6 min。10% Al(NO3)30.3 mL 摇匀,放置6 min,4% NaOH 4 mL摇匀,放置15 min。以不加芦丁标品溶液同法操作得到的溶液作为空白对照,在510 nm波长处测定吸光度。以吸光度(A)为纵坐标,溶液浓度(C)为横坐标绘制标准曲线。
供试样品总黄酮含量测定:吸取供试品溶液2.0 mL 按照标准曲线绘制的方法测定吸光度。
1.2.4 乌腺金丝桃愈伤组织中金丝桃素含量测定
1.2.4.1 色谱条件 色谱柱:Symmetry-C18(150 mm × 4.6 mm,5 μm)。流动相:甲醇-0.006 mol/L磷酸氢二纳水溶液(87.5∶12.5),流速为1.0 mL/min 检测波长为 590 nm,柱温30℃;进样量10 μL。
1.2.4.2 标准品溶液制备 精密称取干燥至恒重的金丝桃素标品2.04 mg,置10 mL 容量瓶中,加甲醇超声使溶解并定容,摇匀,即制成204 μg/mL的金丝桃素标品溶液。
1.2.4.3 标准曲线绘制 精密量取上述金丝桃素标品溶液0.1、0.2、0.5、1.0、2.0和5.0 mL 置10 mL容量瓶中,加甲醇定容,摇匀,0.45 μm 微孔滤膜滤过,取续滤液,分别进样10 μL,按上述色谱条件测定峰面积。以峰面积(X)为横坐标,对照品溶液浓度(Y)为纵坐标,绘制标准曲线。
1.2.4.4 供试样品金丝桃素含量测定 分别精密吸取各供试品溶液10 μL,注入液相色谱仪,按色谱条件测定峰面积,以外标法计算金丝桃素含量。
2 结果
2.1 乌腺金丝桃愈伤组织的诱导
取乌腺金丝桃的幼嫩叶片为外植体,经过适当消毒处理后,切割成0.5 cm2接种到不同愈伤组织诱导培养基中:MS 培养基中2,4-D浓度梯度为 1.0、2.0、4.0和6.0 mg/L,6-BA 浓度梯度为0.1、0.2和0.4mg/L,设计12个激素组合。每个平皿中接种2个材料,每个激素组合处理重复30次。暗培养10 d后叶片开始膨胀,培养15-20 d 后诱导出浅黄色,结构疏松的愈伤组织(图1)。
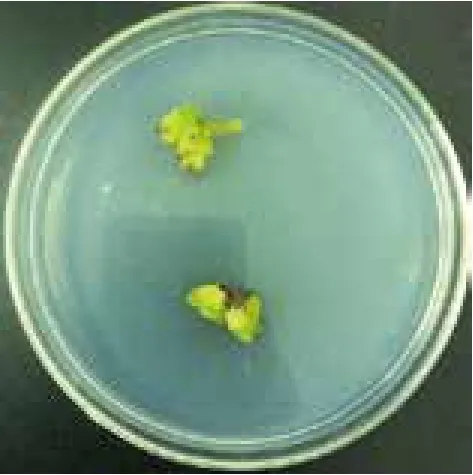
图1 乌腺金丝桃愈伤组织诱导结果
培养20 d 后统计愈伤组织诱导率和生长量。结果(表1)显示,以2,4-D 和 6-BA 为外源激素时,最适合乌腺金丝桃愈伤诱导的激素浓度为2,4-D 4.0 mg/L+6-BA 0.2 mg/L,愈伤组织的诱导率为100%,而且愈伤组织的生物量积累最多。
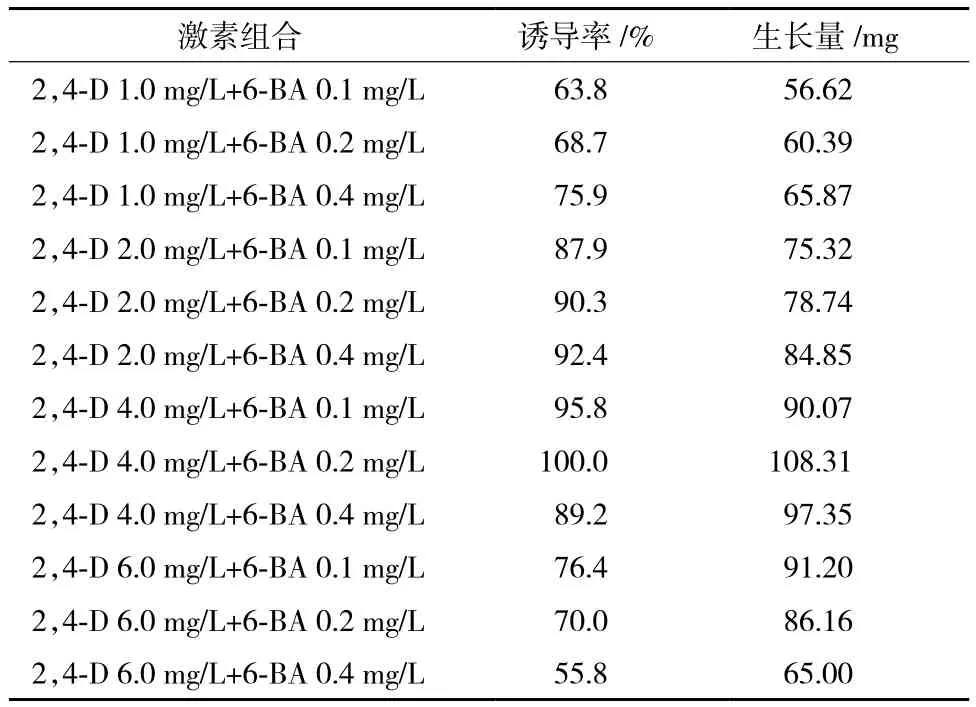
表1 不同激素浓度条件下乌腺金丝桃愈伤组织诱导结果
2.2 乌腺金丝桃愈伤组织中总黄酮含量测定
2.2.1 线性关系 总黄酮标准曲线的回归方程为 A =7.9125C-0.0033,r=0.999 8,表明芦丁在0.010 4-0.052 7 mg/mL范围内线性关系良好。
2.2.2 供试样品总黄酮含量测定 根据总黄酮回归方程,计算各供试样品溶液中总黄酮的含量。结果(表2)显示,栽培一年的乌腺金丝桃中总黄酮含量为28.62 mg/g,愈伤组织中总黄酮含量为27.99 mg/g,两者之间几乎无差异。
2.3 乌腺金丝桃愈伤组织中金丝桃素含量测定
2.3.1 线性关系 金丝桃素标准曲线的回归方程为Y=aX+b,a=1.517268e-003,b=1.017 952,r=0.999 9,表明金丝桃素在10.2-204 μg/mL 范围内线性关系良好。
2.3.2 供试样品金丝桃素含量 金丝桃素标准品、栽培乌腺金丝桃及金丝桃愈伤组织样品HPLC色谱图,见图2。根据金丝桃素回归方程,计算各供试样品溶液中金丝桃素的含量,结果(表2)显示,相比总黄酮的含量,金丝桃素的含量在栽培样品与愈伤组织样品中差异较大,分别为 3.076 mg/g 和0.515 mg/g,前者约为后者的6倍。
3 讨论
目前关于金丝桃属植物组培快繁的报道较多,主要有贯叶金丝桃(H. perforarum)、巴西金丝桃(H. brasiliense)、川慎金丝桃(H. forrestii)、金丝海棠(H. chinensis)、艳果金丝桃(H. androsaemum L.)等。通过快繁能够实现植株的大量繁殖,为金丝桃属植物观赏价值的应用与药用价值的开发奠定基础。金丝桃属植物愈伤诱导中,关键是选择好激素的种类和浓度配比。已经报道的文献资料中,最常用植物激素为2,4-D和6-BA。如 Cardoso等[19]对巴西金丝桃的组织培养研究中发现最适合愈伤诱导的培养基为MS + 2,4-D(1.0-2.0 mg/L);丁如贤等[20]对贯叶连翘的组培与快繁研究中发现含有2,4-D的MS培养基有利于愈伤的诱导;Pretto[21]以叶片为外植体进行愈伤的诱导,2,4-D和6-BA 配合使用时愈伤的诱导率最高;宋馨等[22]以贯叶金丝桃为材料探讨体外培养的植物细胞分化过程与次生代谢物累积之间的关系,研究结果表明MS + 2,4-D(1.0 mg/L)+ 6-BA(0.2 mg/L)中可诱导产生愈伤组织;林华等[23]进行川滇金丝桃组织培养,以叶片、幼嫩的花蕾为外植体进行愈伤的诱导培养基为 MS + 2,4-D 1.0 mg/L+ NAA 0.3 mg/L + TDZ 0.01 mg/L。王海菲[24]对艳果金丝桃叶片愈伤诱导的研究表明,2,4-D和NAA对愈伤的诱导作用较显著,2,4-D在0.5-1.0 mg/L愈伤诱导率达到100.0%,NAA 0.9 mg/L时愈伤诱导率达到96.7%。因此本研究选择2,4-D和6-BA为外源激素,考察不同激素浓度对乌腺金丝桃愈伤形成的影响,最终确定乌腺金丝桃愈伤诱导的最佳培养基配方为MS + 2,4-D 4.0 mg/L + 6-BA 0.2 mg/L,愈伤的诱导率为100%。而且愈伤组织生物量的积累最多。另外愈伤培养中光照的影响也很大,前期的黑暗培养以15-20 d 左右最好,低于15 d 则愈伤生长量少,而且出现褐化现象;而时间过长,虽可产生大量愈伤,但质地变得很致密,不利于继代培养。
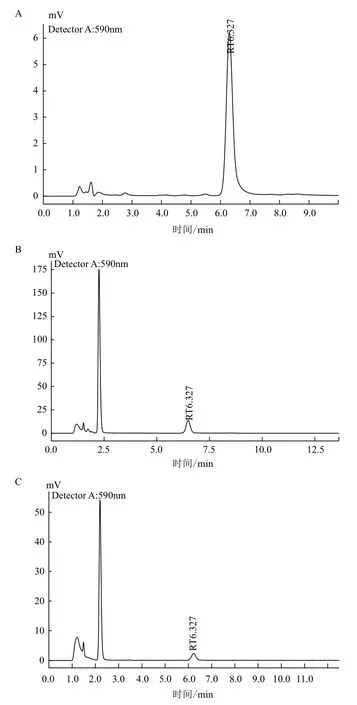
图2 乌腺金丝桃栽培苗及金丝桃愈伤组织样品提取物HPLC 色谱图
目前为止能够采用细胞培养技术进行产业化生产的植物天然活性物质的种类非常有限,制约该项技术产业化应用的核心问题之一是普遍存在的培养细胞中活性物质的低产现象。1990年Kartnig等[27]对贯叶连翘进行了细胞悬浮培养,结果显示培养物中金丝桃素的含量只有自然植株的1%;邵敏敏[28]2008年对贯叶连翘进行组织培养时发现,叶诱导出的愈伤组织中金丝桃素的含量最高,可达0.001 5%,而茎诱导出的愈伤组织中金丝桃素的含量为0.001 1%;于晓坤等[29]2012年对贯叶连翘不定根进行悬浮培养,研究表明pH对金丝桃素的积累有着明显的影响,当pH值为4.8和5.8时,不定根中的金丝桃素含量达到0.35 mg/g和0.49 mg/g。目前的研究主要集中在细胞悬浮培养体系的建立和改变生长环境因子以提高金丝桃素含量等方面,而关于金丝桃素在细胞培养过程中的积累研究则少有报道。国内外的一些研究报道,体外的组织培养中,添加一定浓度的生物或化学促进剂可不同程度地提高次级代谢产物的含量。如Walker和Sirvent等2002年在离体培养贯叶连翘时添加茉莉酸甲酯、水杨酸或植物病原菌苹果炭疽病菌孢子,离体培养物中金丝桃素的含量比对照组(不添加促进剂)提高2-3.3倍[30,31];Bruno等[32]2006年培养贯叶连翘时添加0.01-0.1 mmol/L的铬离子,原伪金丝桃素和假金丝桃素的含量最高分别提高到对照组的4.04倍和3.79倍,而金丝桃素的含量未发生变化;徐茂军等[33]2005年以硝普钠(SNP)为一氧化氮(NO)的供体,研究外源NO 对金丝桃悬浮细胞生长及金丝桃素生物合成的影响,在细胞培养初期(0 d)加入0.5 mmol/L SNP 并在指数生长后期(14 d)加入15.0 mmol/L SNP 的金丝桃悬浮细胞在培养25 d 后,细胞的干重和金丝桃素的含量分别为对照组的1.4和1.8 倍,金丝桃素的产量达15.2 mg/L,比对照高3.2倍,证明外源NO 能激活金丝桃素的合成代谢途径,使金丝桃素的合成加强。但目前这些外源刺激因子的作用机制都尚不明确。
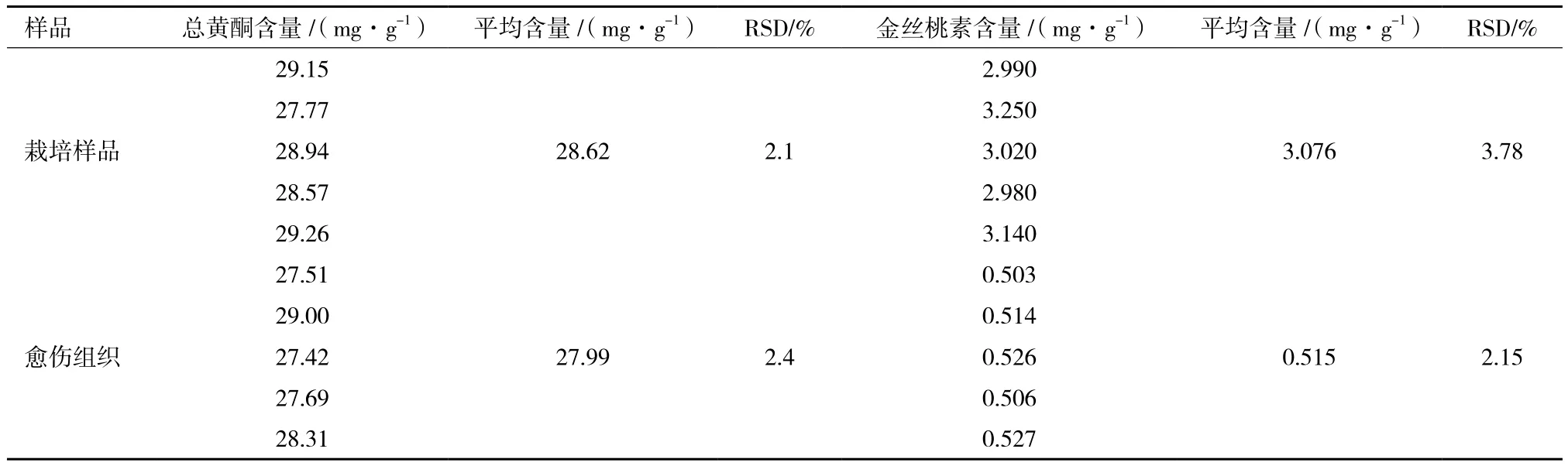
表2 乌腺金丝桃愈伤组织中总黄酮与金丝桃素含量测定结果
为解决乌腺金丝桃愈伤中金丝桃素含量较低的问题,目前本课题组正在开展相关生物促进剂的研究,以期最大限度地提高离体材料中金丝桃素的含量。虽然乌腺金丝桃愈伤中金丝桃素含量低于栽培品种的含量,但愈伤组织诱导只需15-20 d,而且每15 d 就可以继代一次。乌腺金丝桃愈伤组织的培养周期短,可短时间按指数倍大量繁殖,而且不受生长季节的限制。综合考虑,在相同的生长时间内,应用愈伤途径最终获得的乌腺金丝桃生物材料的总量要远远高于依靠栽培获得的生物材料。因此其总的金丝桃素含量的积累也明显高于栽培样品中金丝桃的含量。因此,离体培养获得的愈伤组织也可作为金丝桃素的分离提取的生物材料。
4 结论
本研究以乌腺金丝桃叶片为材料,建立了稳定的愈伤组织的培养体系,最适合乌腺金丝桃愈伤组织培养的培养基为MS + 2,4-D 4.0 mg/L+6-BA 0.2 mg/L;分别采用NaNO2-Al(NO3)3比色法及HPLC法对愈伤组织中总黄酮和金丝桃素进行定性分析,愈伤组织中总黄酮含量为 27.99 mg/g,金丝桃素的含量为 0.515 mg/g。
[1] 陈茂霞, 朱慧. 贯叶金丝桃的化学成分与药理作用研究进展[J].中药研究与信息, 2001, 3(10):24-27.
[2]余爱农, 龚发俊, 马济美. 金丝桃素研究新进展[J]. 湖北民族学院学报:自然科学版, 2003, 21(1):44-47.
[3]Agostinis P, Vantieghem A, Merlevede W, et al. Hypericin in cancer treatment:more light on the way[J]. Int J Biochem Cell Biol,2002, 34(3):221.
[4] Veronika B, Guido J, Adolf N, et al. Flavonoid from Hypericum perforatum show antidepressant activity in the Forced Swimming Test[J]. Planta Med, 2000, 66:3.
[5] 张喜. 乌腺金丝桃中金丝桃素的含量测定及提取纯化金丝桃素的工艺研究[D]. 长春:吉林大学, 2011.
[6]王晓菊, 张立伟. 贯叶连翘中金丝桃素分离工艺的研究[J].山西大学学报:自然科学版, 2005, 28(1):75-77.
[7] 李晓坤, 于雷, 郝鹏飞, 等. 金丝桃素的酶提取工艺优选[J].中国实验方剂学杂志, 2012, 18(8):46-49.
[8] 贺建国, 赵晶, 王金委. HPLC法测定滇西产金丝桃属植物中金丝桃素的含量[J]. 西南国防医药, 2002, 12(1):23-25.
[9] 胡君萍, 杨建华, 马成, 堵年生. HPLC测定新疆贯叶金丝桃中金丝桃素的含量[J]. 华西药学杂志, 2003, 18(5):369-371.
[10]郑炜, 连树林, 孙国辉, 等. HPLC测定乌腺金丝桃中金丝桃素的含量[J]. 吉林中医药, 2010, 30(11):999-1000.
[11]董建勇, 贾忠建. 赶山鞭中黄酮类化学成分研究[J]. 中国药学杂志, 2005, (12):897-899.
[12]张克勤, 薛晓丽, 孔令瑶, 等 . 长柱金丝桃中金丝桃素的含量变化[J]. 中国药学杂志, 2011, 46(3):174-176.
[13] 李冀, 石鑫, 高彦宇. 乌腺金丝桃抗抑郁作用的药理研究[J].中医药信息, 2012(2):16-17.
[14] 李冀, 闫东, 毕珺辉. 乌腺金丝桃正丁醇萃取物对氯化钙诱发大鼠快速性心律失常的影响[J]. 中医药信息, 2012(4):144-145.
[15] Qian J, Wu J, Lu Y. Preparation of a polyclonal antibody against hypericin synthase and localization of the enzyme in red-pigmented Hypericum perforatum L. plantlets[J]. Acta Biochimica Polonica,2012, 59(4):639-645.
[16] Olivo M, Fu CY, Raghavan V, et al. New frontier in hypericin mediated diagnosis of cancer with current optical technologies[J]. Ann Biomed Eng, 2012, 40(2):460-473.
[17] Barathan M, Mariappan V, Shankar EM, et al. Hypericin-photodynamic therapy leads to interleukin-6 secretion by HepG2 cells and their apoptosis via recruitment of BH3 interacting-domain death agonist and caspases[J]. Cell Death Dis, 2013, 4:e697.
[18] 尹兴斌, 曲昌海, 张晓燕, 等. 贯叶金丝桃中金丝桃苷在比格犬体内的药代动力学研究[J]. 中国实验方剂学杂志, 2013,19(2):140-143.
[19] Cardoso MA, Oliveira DE. Tissue culture of Hypericum brasiliense Choisy:Shoot multiplication and callus induction[J]. Plant Cell, Tissue and Organ Culture, 1996, 44(2):91-94.
[20] 丁如贤, 许铁峰, 张汉明. 贯叶连翘的组织培养和快速繁殖[J]. 第二军医大学学报, 2000, 21(10):904-906.
[21] Pretto FR, Santarem ER. Callus formation and plant regeneration from Hypericum perforatum leaves[J]. Plant Cell, Tissue and Organ Culture, 2000, 62(2):107-113.
[22] 宋馨, 祝建, 吕洪飞, 李飞. 贯叶金丝桃愈伤组织分化及二慈酮类物质的积累[J]. 中草药, 2006, 37:305-308.
[23] 林华, 王永清, 林静. 川渝金丝桃的组织培养[J]. 植物生理学通讯, 2007, 43(4):735-735.
[24] 王海菲. 艳果金丝桃再生和遗传转化体系的研究[D]. 武汉:华中农业大学, 2011.
[25] Bais HP, Vepachedu R, Lawrence CB, et al. Molecular and biochemical characterzation of an enyzme responsible for the formation of hypericin in St. John’s Wort(Hypericum perforatum L.)[J]. The Journal of Biological Chemistry, 2003, 278:32413-32422.
[26] 王力. 金丝桃属合成酶的基因克隆、表达及其酶学性质研究[D]. 北京:中国农业大学, 2005.
[27] Kartning TH, Gobel I. Determination of hypericin and paeudohypericin by thin-layer chromatography-densitometry[J]. Journal of Chromatography A, 1992, 609(1-2):423-426.
[28] 邵敏敏. 贯叶连翘和小连翘的组织培养及分泌结构与金丝桃素类物质含量的相关性研究[D]. 金华:浙江师范大学,2008.
[29] 于晓坤, 王玉湾, 代月, 等. 贯叶连翘愈伤组织和不定根培养的研究[J]. 延边大学农学学报, 2012, 34(4):282-288.
[30] Walker TS, Bais HP, Vivanco JM. Jasmonic acid-induced hypericin production in cell suspension cultures of Hyperieum perforatum L.(St. John’s wort)[J]. Phytochemistry, 2002, 60(3):289-293.
[31] Sirvent T, Gibson D. Induction of hypericins and hyperforin in Hypericum perforatum L. in response to biotic and chemical elicitors[J]. Physiological and Molecular Plant Pathology, 2002, 60(6):311-320.
[32] Bruno T, Antonio R, Giorgio P, et al. Induction of hypericins in Hypericum perforatum in response to chromium[J]. Fitoterapia,2006, 77:164-170.
[33]徐茂军, 董菊芳, 张刚. NO对金丝桃悬浮细胞生长及金丝桃素生物合成的促进作用研究[J]. 生物工程学报, 2005, 21(1):66-70.
(责任编辑 马鑫)
Determination the Content of Total Flavonoids and Hypericin in Callus from Hypericum attenuatum Choisy
Liu Xiaodan1,2Zhang Keqin2Liu Lian1Li Wenchang1
(1. School of Biological Engineering,Jilin Agricultural Science and Technology College,Jilin 132101;2. Key Labratory of Changbai Mountain Animal and Plant Rescources’ Utilization and Protection of Universities in Jilin Province,Jilin 132101)
With fresh leaves as test material, this study established a relatively stable system of callus culture for Hypericum attenuatum Choisy, and determined the content of total flavonoids and hypericin in callus. With MS as the basic culture medium, the effects of different hormone combinations were investigated on callus induction. The results showed that the optimum culture media for callus induction was MS + 2,4-D 4.0 mg/L + 6-BA 0.2 mg/L. The total flavonoids and hypericin of callus were extracted using ultrasonic method, respectively, using UV spectrophotometry and HPLC method for determination total flavonoids content and hypericin content in callus. The results showed that total flavonoids was 27.99 mg/g, and hypericin content was 0.515 mg/g in dry callus.
Hypericum attenuatum Choisy;callus;induction;total flavonoids;hypericin
10.13560/j.cnki.biotech.bull.1985.2015.01.015
2014-05-26
刘晓丹,女,讲师,研究方向:植物抗逆基因工程;E-mail:liuxiaodan1981@126.com
张克勤,男,教授,研究方向:天然药物化学;E-mail:kqzhang01@hotmail.com
