甘蔗转基因甘露糖筛选系统的建立
2015-10-25王文治杨本鹏蔡文伟冯翠莲王俊刚熊国如张树珍
王文治 杨本鹏 蔡文伟 冯翠莲 王俊刚 熊国如 张树珍
(中国热带农业科学院甘蔗研究中心 中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 571101)
甘蔗转基因甘露糖筛选系统的建立
王文治 杨本鹏 蔡文伟 冯翠莲 王俊刚 熊国如 张树珍
(中国热带农业科学院甘蔗研究中心 中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 571101)
以甘露糖作为筛选底物,对甘蔗品种新台糖22号进行临界筛选浓度测定,获得愈伤组织的继代、分化、生根的临界筛选浓度。而后应用含有甘露糖筛选标记基因pmi及绿色荧光蛋白报告基因GFP的植物表达载体,通过农杆菌介导法对新台糖22号的愈伤组织进行遗传转化。用所测定的临界筛选浓度先后进行继代、分化、生根筛选培养,获得抗性植株。对获得的抗性植株分别进行pmi基因和GFP基因的PCR检测,以及GFP显微镜荧光检测,结果证实已成功建立了高效的甘蔗转基因甘露糖筛选系统。
甘蔗转基因;甘露糖;pmi基因;GFP基因
以大肠杆菌磷酸甘露糖异构酶(Phosphomannose isomerase,PMI)基因为筛选标记的筛选系统,有别于编码抗生素抗性蛋白的基因(如新霉素磷酸转移酶基因、潮霉素磷酸转移酶基因、氯霉素乙酰转移酶基因)及编码抗除草剂抗性蛋白的基因(如Bar基因)等常用的筛选系统,是一种正向筛选系统,生物安全性好,有很好的应用前景[1]。1967年Malca等[2]就发现了以甘露糖为碳源的培养基上植物细胞不能正常生长,这是由于甘露糖在己糖激酶的催化下转化为6-磷酸甘露糖,6-磷酸甘露糖不仅不能被细胞进一步代谢利用,而且当积累到一定浓度时就会抑制磷酸葡萄糖异构酶的活性,阻碍了糖酵解途径,对细胞的正常生长代谢起到了抑制作用。而在磷酸甘露糖异构酶(PMI)的催化下,6-磷酸甘露糖可以转化为细胞可以代谢的6-磷酸果糖[3]。因此转入含有pmi基因的植物细胞能在以甘露糖为碳源的培养基上正常生长,而非转基因植物细胞由于无法利用甘露糖而被抑制生长。自1998年Joersbo等[4]在甜菜上建立了PMI/甘露糖(PMI/Mannose)转基因筛选系统以来,该系统已经被应用于多种植物的遗传转化筛选。早期研究如Paola等[5]将其应用到水稻转基因上,Negrotto等[6]将其应用到玉米转基因上。目前,我国科研人员利用该筛选体系获得转基因植株的作物也很多,如水稻、棉花、番茄、辣椒、雪柑等,覆盖的作物极其广泛[7-12]。由此可见,作为一种新型的生物安全性较好的转基因筛选标记,越来越受到关注。在甘蔗转基因方面,Jain等[13]通过基因枪轰击法,在甘蔗上应用PMI/Mannose筛选系统,获得的转化效率为7.4%。我国各个甘蔗研究所也开展了对PMI/Mannose筛选系统的研究,转基因方法基本以基因枪为主,转化效率较低,获得的转化株系较少[14]。本研究应用本研究室成熟的农杆菌介导甘蔗转基因技术,建立高效的PMI/Mannose甘蔗转基因筛选系统,旨在为今后对农杆菌介导的甘蔗转基因甘露糖筛选系统的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 品种、质粒和菌株 本研究所用的受体材料为甘蔗主栽品种新台糖22号,含pmi筛选标记基因及GFP荧光蛋白报告基因的植物表达载体为本实验室构建保存,转化所用农杆菌菌株为EHA105。
1.1.2 培养基配方 ①胚性愈伤组织诱导培养基:MS+2,4-D 1 mg/L+蔗糖30 g/L+卡拉胶8 g/L,pH5.8;②胚状体分化培养基:MS+6-BA 1 mg/L+KT 0.5 mg/L +蔗糖30 g/L+卡拉胶8 g/L,pH5.8;③生根诱导培养基:MS(大量元素减半,其它成分不变)+NAA 2 mg/L+蔗糖20 g/L+ 椰水100 mL/L+卡拉胶8 g/L+活性炭0.2 g/L,pH5.8。
MR培养基:1/5MS大量元素+MS其他成分+ 2,4-D 1 mg/L+10 mmol/L果糖+10 mmol/L葡萄糖+30 g/L葡萄糖(固体培养基加入卡拉胶8 g/L),pH5.3。
1.2 方法
1.2.1 甘蔗胚性愈伤组织的诱导 以田间生长良好的甘蔗顶端生长点处的幼叶组织为外植体,经酒精及升汞消毒、无菌水冲洗后,于无菌滤纸上吸干其表面的水分后,切成1 mm左右厚度的薄片接种于诱导培养基上,于避光条件下进行培养至诱导出愈伤组织。
1.2.2 甘蔗愈伤组织继代、分化、生根的临界筛选浓度测定 挑取诱导了20 d左右的甘蔗愈伤组织在0%、40%、45%、50%、55%、60%、65%和 70%的甘露糖浓度梯度的愈伤继代培养基上继代培养20 d后,以相同甘露糖浓度梯度的分化培养基上再分化生长15 d,观察发芽率,测定愈伤继代与分化的临界筛选浓度。以0%、10%、15%、20%、25%、30%、35%和40%的甘露糖浓度的生根培养基对甘蔗小苗进行生根培养30 d,测定甘蔗小苗在生根阶段的最适筛选浓度。
1.2.3 农杆菌侵染菌液的制备 通过冻融法将含有pmi筛选标记基因及GFP荧光蛋白报告基因的植物表达载体导入到农杆菌菌株EHA105中。将经PCR鉴定为阳性的农杆菌在含抗生素的YEP平板上划线,挑取单菌落接种到5 mL YEP的液体培养基中,振荡培养至对数生长期,于150 mL三角瓶中扩大培养,培养至OD为0.6左右,将菌液转移到离心管中,5 000 r/min 离心5 min,弃上清,吸干残液,用MR液体培养基重悬菌体,最后置于28℃,200 r/min激活2 h,诱导细菌Vir基因的表达,作为转化材料的浸染液。
1.2.4 愈伤组织的转化 挑取生长旺盛的愈伤组织于滤纸上吹干使其处于干缩状态,于工程菌液中浸泡30 min后,滤去菌液,用滤纸吸干残液,吹干,转移到MR固体培养基上。共培养3-4 d后,转移到含有甘露糖的继代培养基上继代筛选培养20 d后,转移到含有甘露糖的分化培养基上分化筛选培养15 d。待愈伤长出1 cm左右的小苗后,转移至含有甘露糖的生根培养基上生根筛选培养30 d。
1.2.5 抗性小苗分子检测 当在抗性生根培养基上生长旺盛,浓绿的小苗生长至4-7 cm后,按编号剪取小苗叶片组织约10-20 mg左右,剪碎置于eppendorf管中,用CTAB法提取DNA。分别合成筛选标记基因pmi和报告基因GFP的特异性引物进行PCR扩增检测,扩增时设置正负对照。并对植株扩增产物进行回收测序,检测扩增目的条带的准确性。最后统计筛选标记基因pmi和报告基因GFP的PCR检测阳性率。
1.2.6 遗传转化筛选过程的绿色荧光显微镜检测 愈伤组织经菌液浸泡侵染及共培养,并进行继代筛选培养20 d后,挑取部分生长良好的抗性愈伤颗粒于荧光显微镜中检测绿色荧光蛋白的表达。
当抗性愈伤组织进行分化筛选培养15 d左右后,挑取分化生长迅速,且叶片浓绿的小苗进行绿色荧光显微镜检测。
当抗性小苗于生根培养基上生长到一定高度后,剪取小叶片,进行绿色荧光显微镜检测。分析3个不同筛选阶段绿色荧光蛋白的表达情况。
2 结果
2.1 愈伤诱导与分化生长的甘露糖临界筛选浓度测试
愈伤诱导与分化生长的甘露糖筛选浓度测试结果(图1)显示,甘蔗外植体在甘露糖浓度为0%的对照培养基上诱导30 d后继续分化生长15 d,愈伤生长良好,愈伤分化能力达100%。当甘露糖浓度加大到55%时,愈伤分化能力为20%。当甘露糖浓度为60%时,愈伤分化能力低于10%,基本失去了分化能力。当甘露糖浓度≥65%,愈伤组织100%失去分化能力。因此在进行遗传转化筛选时,甘露糖筛选浓度应为60%。

图1 愈伤继代生长与分化生长的甘露糖筛选浓度测试
2.2 甘蔗小苗生根阶段甘露糖临界筛选浓度测试
如图2所示,甘蔗小苗在甘露糖为0%的对照生根培养基上生长正常,根系发达。在甘露糖浓度为10%和15%的生根培养基上,部分小苗依然能正常生长,但根系已不如对照发达。当甘露糖浓度加大到20%或20%以上时,小苗已经无法正常生长,大部分叶片发黄,部分依然为绿色的叶片也表现出扭曲状,细小而无法伸长生长,根系更是明显受到抑制。因此在遗传转化时,小苗的生根培养甘露糖筛选浓度应为20%。
2.3 遗传转化与筛选
甘蔗外植体经消毒切成薄片置于诱导培养基上培养20-30 d后,逐渐形成生长旺盛,分化能力极强的愈伤组织(图3)。经菌液浸泡过后的愈伤组织,进行20 d的黑暗筛选培养后进行15 d的光照分化筛选培养,甘露糖的筛选浓度为60%。筛选结果(图4)显示,大部分愈伤组织停止生长且无法分化出小芽,而小部分愈伤组织依然能健康生长,且在光照条件下能迅速分化成苗。挑取健康分化的芽丛于生根培养基上生根培养,甘露糖筛选浓度为20%。经过黑暗筛选及分化筛选后能迅速分化出来的小芽在生根筛选培养基上80%左右都能快速生长,且根系发达,而小部分的小芽无法生长,或生长缓慢,叶片偏黄。图5为快速生长的抗性植株,叶片浓绿健康。
2.4 抗性小苗的分子检测
生根培养到适当高度以后,首先进行筛选标记基因pmi的PCR检测。结果(图6)显示,所选的23株抗性植株中除4、5和6号外,其余20株均为阳性,阳性率为87%。同时对这23株抗性植株的荧光标记基因GFP进行PCR检测。结果(图7)显示,23株抗性植株中17株为阳性,阳性率73.9%。与筛选标记基因pmi基因的PCR检测相比,除4、5和6号抗性植株同为阴性外,11、21和22号也表现为阴性。说明在遗传转化的过程中,基因片段出现断裂缺失现象,而因筛选过程是针对pmi基因进行筛选的,所以得到的抗性植株中pmi基因的阳性率高于GFP基因。
2.5 遗传转化筛选过程的绿色荧光显微镜检测
对遗传转化过程中继代、分化、生根3个筛选阶段进行绿色荧光显微镜检测。结果显示,从继代筛选培养中挑取的抗性愈伤组织,为不规则生长的胚性愈伤组织,不受甘露糖筛选的影响生长健康,荧光极强(图8);抗性愈伤组织分化筛选培养后分化出来的小苗展示的绿色荧光(图9);对生根培养后剪取的叶片组织进行绿色荧光的检测(图10),左侧红色叶片为非转基因植株,而显示绿色荧光的叶片为转基因抗性植株。
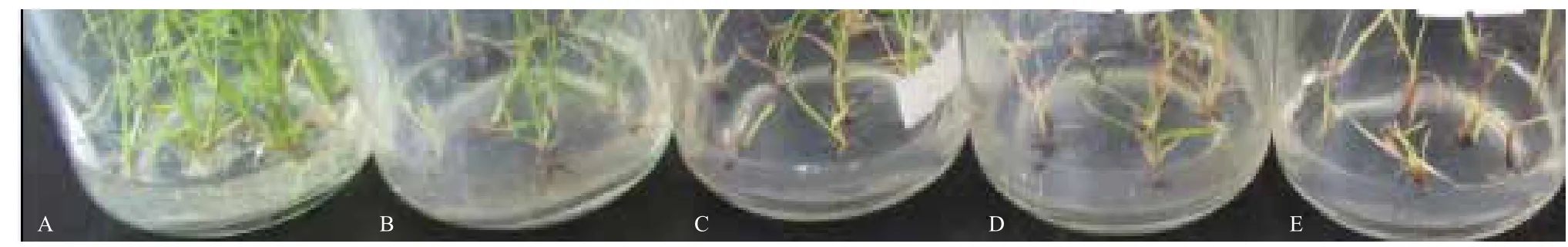
图2 小苗生根生长的甘露糖筛选浓度测试
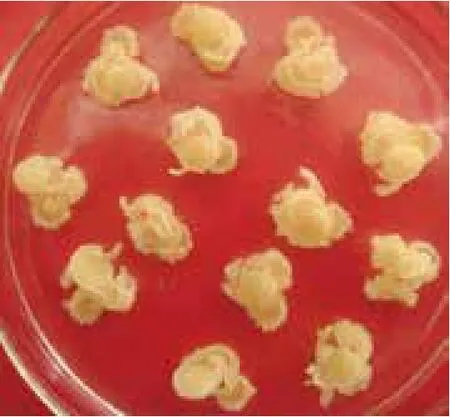
图3 愈伤组织诱导

图4 筛选后的分化培养

图5 筛选后的生根培养
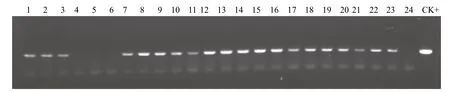
图6 筛选标记基因pmi的PCR检测
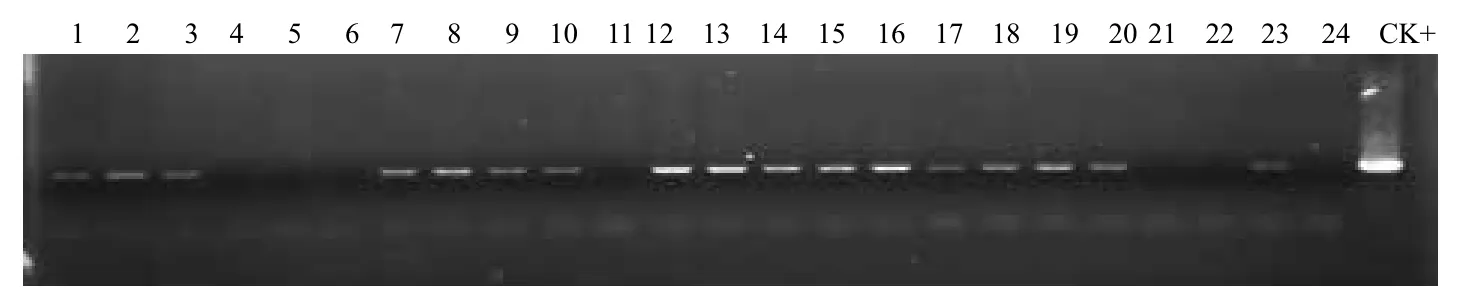
图7 荧光报告基因GFP的PCR检测
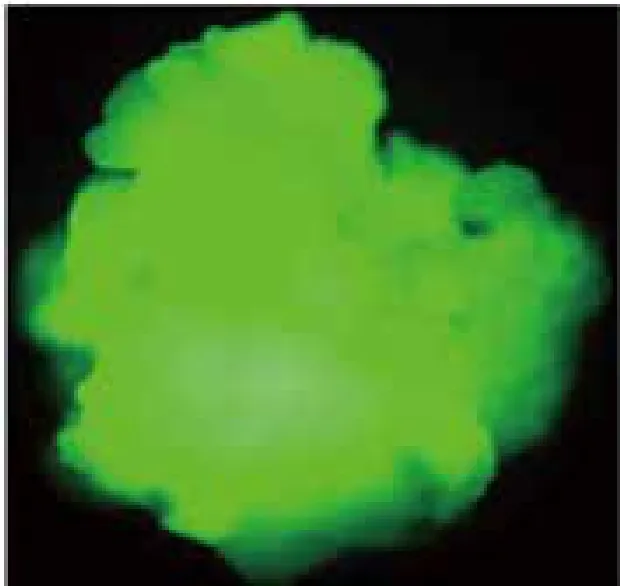
图8 荧光愈伤
3 讨论
本研究在转基因株系的分子检测中出现了报告基因与筛选标记基因PCR检测阳性率不一致的现象,经查阅相关文献,推测为在遗传转化过程中出现DNA片段缺失的现象[15,16]。报告基因GFP和筛选标记基因pmi在同一个T-DNA区内,因在筛选过程中是针对筛选标记基因pmi进行筛选的,因而得到的抗性植株中pmi基因的阳性率高于GFP基因。在筛选的过程中愈伤组织的继代筛选与分化筛选的甘露糖浓度大于生根筛选浓度,主要由于甘蔗根系对甘露糖的敏感性要大于愈伤组织,与其他人的报道基本一致。此外本研究能迅速建立起甘露糖筛选系统,除本实验室已积累的研究经验外,通过强启动子启动报告基因GFP,并在试验过程辅助予荧光显微镜的实时观察,也是本研究取得成功的一大因素。
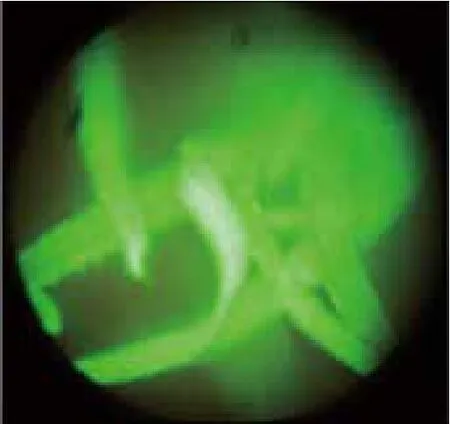
图9 荧光小苗
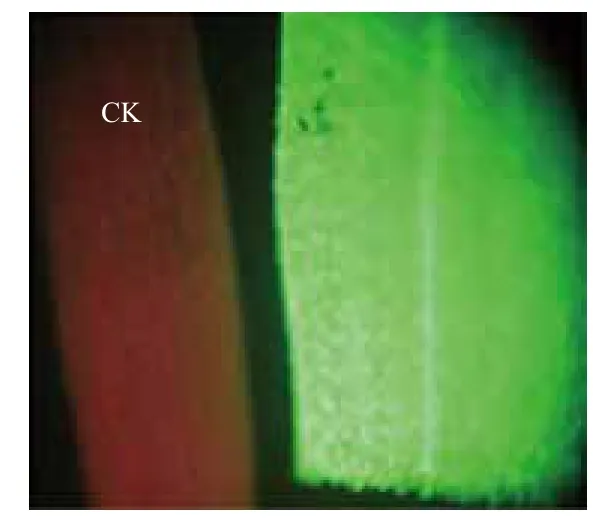
图10 荧光叶片
甘蔗转基因研究上利用甘露糖筛选的报道已经很多。国内报道的基本为基因枪介导的遗传转化方式,效率比起农杆菌介导法来说偏低很多,多次进行遗传转化依然只能获得较少的转基因株系[1]。本研究室通过长期的努力,农杆菌介导的甘蔗转基因技术已经相当成熟,已经成功地应用在bar基因抗除草剂筛选系统上。而本研究将农杆菌介导法与甘露糖筛选进行良好的结合,转化效率较高。单次转化4 g愈伤组织就能获得30个以上的转基因株系。同时因为pmi甘露糖正向筛选系统有较好的生物安全性,因此本研究所建立的农杆菌介导的甘蔗转基因甘露糖筛选系统有很好的应用前景。
4 结论
本研究通过对愈伤继代、分化及生根生长的3个阶段进行甘露糖临界筛选浓度进行测试,最后确定甘蔗愈伤在继代与分化阶段的甘露糖筛选浓度为60%,而生根生长的筛选浓度为20%。而后通过含有pmi筛选标记基因及GFP绿色荧光蛋白基因的植物表达载体对甘蔗品种新台糖22号愈伤组织进行遗传转化,以60%的甘露糖筛选浓度进行继代与分化阶段的筛选,以20%的甘露糖筛选浓度进行生根阶段的筛选,最后获得抗性植株。提取抗性植株的叶片DNA进行pmi筛选标记基因及GFP绿色荧光蛋白基因的PCR检测。同时在筛选的过程中辅助予绿色荧光的显微镜检测。结果均证明本研究可以准确获得转基因植株,同时证明本研究室成功建立起了高效的转基因甘蔗甘露糖筛选系统。
[1]高世武, 阙友雄, 郭晋隆, 等.甘露糖筛选系统的建立及在甘蔗转基因中的应用[J].热带作物学报, 2010, 31(5):789-796.
[2]Malca I, Endo RM, Long MR. Mechanism of glucose counteraction of inhibition of root elongation by galactose, mannose and glucosamine[J]. Phytopathology, 1967, 57:272-278.
[3]Joersbo M, Okkels FT. A novel principle for selection of transgenic plant cells:Positive selection[J]. Plant Cell Reports, 1996, 16:219-221.
[4]Joersbo M, Donaldson I, Kreiberg J, et al. Analysis of mannose selection used for transformation of sugar beet[J]. Molecular Breeding, 1998, 4:111-117.
[5]Paola L, Xu DY, Ingo P. Effective selection and regeneration of transgenic rice plants with mannose as selective agent[J]. Molecular Breeding, 2001, 7:43-49.
[6]Negrotto D, Beer S, Wenck AR, et al. The use of phosphomannoseisomerase as a selectable marker to recover transgenic maize plants[J]. Plant Cell Reports, 2000, 19:789-803.
[7]梁永亚, 李浩, 段永波, 等.以pmi 为筛选标记的水稻转基因研究[J].安徽农业科学, 2011, 39(17):10143-10146.
[8]岳建雄, 孟钊红, 张炼辉, 等.以甘露糖作为筛选剂的棉花遗传转化[J].棉花学报, 2005, 17(1):3-7.
[9]彭世清, 陈守才.甘露糖阳性选择系统的建立及在番茄转化中的应用[J].农业生物技术学报, 2005, 13(2):141-144.
[10]黄皓, 雷建军, 曹必好, 等.利用pmi为筛选基因对辣椒进行Bt基因转化的研究[J].辣椒杂志, 2013, 2:23-28.
[11]曾黎辉, 徐海峰, 王会全, 等. PMI基因最为选择标记的植物表达载体构建及其在雪柑转基因中的应用[J].农业生物技术学报, 2008, 16(5):858-864.
[12]郭倩倩, 孙熙森, 唐益雄, 等.新型筛选标记磷酸甘露糖异构酶基因在转基因植物中的应用[J].中国农业科技导报,2011, 13(6):12-19.
[13]Jain M, Chengalrayan K, Abouzid A, et al. Prospecting the utility of a PMI /mannose selection system for the recovery of transgenic sugarcane(Saccharum spp. hybrid)plants[J]. Plant Cell Rep,2007, 26:581-590.
[14]郭莺, 阮妙鸿, 吴杨, 等.甘蔗转Hc-Pro基因的研究[J].热带作物学报, 2010, 31(6):965-971.
[15]朱丽, 傅亚萍, 刘文真, 等.利用共转化和华药培养技术快速获得无选择标记的三价转基因水稻[J].中国水稻科学,2007, 21(5):475-481.
[16]Cao MX, Huang JQ, Wei ZM, et al. Agrobacterium-mediated multiple gene transformation in rice using a single vector[J]. J Integr Plant Biol, 2005, 47(2):233-242.
(责任编辑 马鑫)
Establishment of Mannose Selection System in Sugarcane Transformation
Wang Wenzhi Yang Benpeng Cai Wenwei Feng Cuilian Wang Jungang Xiong Guoru Zhang Shuzhen
(Sugarcane Research Center of Chinese Academy of Tropical Agricultural Sciences,Institute of Tropical Bioscience and Biotechnology of Chinese Academy of Tropical Agricultural Sciences,Key Laboratory of Biology and Genetic Resources of Tropical Crops Ministry of Agriculture,Haikou 571101)
In this research the killing curve of mannose was tested at the subculture,differentiation and rooting stages of sugarcane cultivar ROC22. Then the expression cassette containing a pmi selection marker gene and a GFP report gene was transformed into sugarcane embryonic callus by Agrobacterium-mediated method. Resistant plants were obtained after selection by Mannose. The PCR detection result and GFP microscope observation result both show that our lab had established a high efficiency PMI/Mannose selection system in sugarcane transformation.
sugarcane transgenic;mannose;pmi gene;GFP gene
10.13560/j.cnki.biotech.bull.1985.2015.01.014
2014-06-12
现代农业产业技术体系建设专项资金项目(CARS-20-2-5),Cry1Ac-2A-gna融合基因遗传转化甘蔗的研究项目(31101197,2012-2014)
王文治,男,硕士研究生,助理研究员,研究方向:甘蔗基因工程;E-mail:wangwenzhi@itbb.org.cn
张树珍,女,博士,研究员,研究方向:甘蔗生物技术;E-mail:zhangshuzhen@itbb.org.cn
