东北地区产油能源微藻的筛选和鉴定
2015-10-25师文静廖莎孙启梅王鹏翔李晓姝
师文静 廖莎 孙启梅 王鹏翔 李晓姝
(中国石油化工股份有限公司 抚顺石油化工研究院,抚顺 113001)
东北地区产油能源微藻的筛选和鉴定
师文静 廖莎 孙启梅 王鹏翔 李晓姝
(中国石油化工股份有限公司抚顺石油化工研究院,抚顺113001)
微藻作为21世纪生物柴油的理想燃料已被人们广泛的关注,但是目前微藻种类很多,如何从诸多的微藻中筛选油脂含量高的微藻已成为人们函待解决的问题。从东北地区水样中分离纯化出93种藻种,采用尼罗红染色法对其中30株藻种进行了筛选获得了8种具有产油潜力的藻种,并利用自制的柱式反应器微藻评价装置对这8株藻株进行了产油能力的评价,获得了一株总脂产率达到133.9 mg/(L·d)的产油能源微藻。在此基础上,对该藻株进行了18S rRNA 的鉴定,确定为Chlorella sp.。
产油微藻;尼罗红;分离纯化;筛选;总脂产率;分子鉴定;18S rRNA
能源是社会发展的重要保证物质,人类所使用的能源中88%来源于化石燃料[1]。然而目前人类所面临化石燃料的日益短缺和燃烧所带来的对全球生态环境的破坏,已经严重威胁人类的生存。因此,积极寻找可再生的、环境友好型能源是当今社会亟待解决的问题[2,3]。生物质能源具有绿色和可再生性,发展生物质能被认为是解决全球能源危机的最理想途径之一[4]。
微藻是生物质能源的一种经济和高效原料[5],高含油微藻藻株的筛选是实现微藻生物质能制备技术的首要和关键环节。近些年来,美国、意大利、日本等国家的许多与微藻研究相关的实验室在能源微藻的筛选方面开展了大量卓有成效的工作[6-9]。美国可再生能源实验室[10](NREL)建立的工程菌大多数属硅藻菌种,在自然条件下微藻的脂质含量为5%-20%时,工程微藻的脂肪含量是实验室条件下增加至60%以上,在户外扩大培养时脂肪含量40%以上。Rodolfi等[11]从30株淡水和海洋微藻中筛选出一株拟微绿球藻(Nannochloropsis sp. F&M-M24),其在营养物质充足的条件下,总脂含量为32%,总脂产率为117 mg/(L·d)。Mandotra等[12]采用改良的CHU-13培养基培养的栅藻(Scenedesmus abundans)藻株获得最高总脂产率为124.71 mg/(L·d),对应的总脂含量为43.91%。国内许多研究机构也正在积极开展含油微藻藻株的选育工作。到目前为止,国内的相关研究报道主要是对实验室现有藻种的总脂含量进行分析与评价,涉及的藻种主要是饵料藻和某些赤潮藻,如球等鞭金藻(Isochrysis galbana)、三角褐指藻(Phaeodactylum tricomutum)、蛋白核小球藻(Chlorella pyrenoidosa)、绿色巴夫藻(Pavlovviridis)、盐生卡盾氏藻(Chattonella subsalsa)、中肋骨条藻(Skeletonema costatum)等[13-20]。这些藻株中球等鞭金藻的总脂含量较高,蒋霞敏[10]的报道为32.96%,张秋会的报道是57%[15]。缪晓玲[21]采用异养转化细胞工程技术获得了脂类含量为55%的小球藻(Chlorella protothecoides)。
微藻在自然界中分布广,种类资源丰富,每年固定的CO2约占全球净光合产量的40%,在能量转化和碳元素循环中起到举足轻重的作用。从环境中筛选生长速度快、生物量和油脂含量高、易培养的优良微藻,是实现微藻规模化培养的前体和保障[22-24]。本研究对从东北地区水体中分离的藻种进行筛选和产油性能的评价,目的是筛选出一株具有高产油性能的优良性状的微藻,并对筛选的微藻进行分子学水平上的鉴定,以期为后续建立高产能微藻的种质库,研究其产油代谢机理奠定基础。
1 材料与方法
1.1 水样的采集和藻株的分离纯化
野外水样采自东北地区,浮游微藻采用1 L采水器采集水样,底栖微藻采用刷子从水体中的石块、船体、枝条等物体上刮取。采集的水样用透明塑料瓶保存,然后带入实验室进行分离纯化。
采集的水样采用平板划线法进行分离纯化,培养采用BG11培养基[25],培养基组成见表1和表2。培养将使用无菌的线环,在无菌条件下将滴在琼脂上的藻液平行划在琼脂表面上。在温度为25℃,光照强度为3 000 Lux下培养4-8 d,挑取平板上的单藻落在装有BG11液体培养基的摇瓶中培养1周后镜检,重复数次,直到获得纯的单克隆藻株为止。

表1 BG11培养基

表2 A5+Co solution组成
1.2 尼罗红染色法筛查藻种
将获得的纯藻种接种到50 mL摇瓶中培养,培养采用BG11培养基静置培养,培养温度为25℃,培养的光照强度为5 000 Lx,培养的光暗周期为24 h,光暗时间比为14∶10,每天定时摇动藻液2次避免藻液粘壁。取培养至对数生长期后期的藻液适量,8 000 r /min离心5 min,去除上清,藻细胞沉淀用PBS 洗两次,采用体积分数为20%的DMSO水溶液重悬藻细胞,使藻液OD540值0.8,40℃ 水浴20 min,按1 mL 藻液加15 μL 尼罗红染料(质量浓度为0.1 mg /mL 丙酮溶液),混匀染色5 min,激发波长480 nm,测定其在575 nm 波长的荧光强度来筛查藻种总脂含量的大小[26]。
1.3 藻种培养评价实验
将尼罗红染色法筛查获得的藻种分别接入微藻评价装置中简易的柱式反应器,每个反应器的装液量为200 mL,在实验室制作的微藻评价装置上进行生长评价,微藻评价装置如图1所示。培养采用BG11培养基,培养温度为28℃,光照强度为5 000 Lux,通入空气量为0.5 L/min,每天通入大约1 min CO2来调节培养液的pH值不超过9,光照周期为24 h,光暗时间比为14∶10,培养时间为15 d处于稳定期后结束收集藻液,冻干后测量干重和总脂含量。
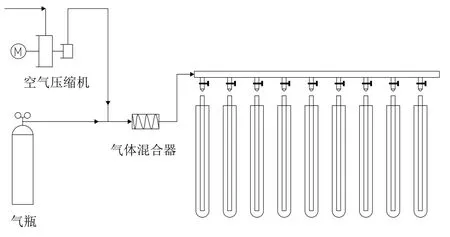
图1 微藻培养装置
1.4 测定方法
1.4.1 生物量的测定 将处于稳定期的藻液通过离心收集后在深冷冰箱中预冻2 h,在真空冷冻干燥机中干燥至恒重,称量后得到藻粉的干重。
1.4.2 总脂含量的测定 参考文献[27]中总脂含量的测定方法。
1.4.3 评价指标计算方法 筛选生长优势的藻种主要用生物量产率来评价,即单位时间单位体积藻液的干重;筛选具有产油潜力的藻种用总脂产率来评价,即单位时间单位体积藻液的总脂产量。计算公式如下表示:
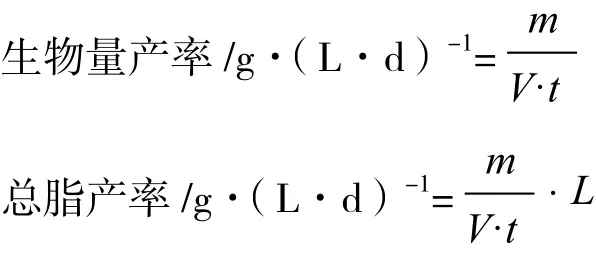
式中:m为收获的藻粉的干重(g),V为藻液的体积(L),t为培养的时间(d),L为收获的藻粉的总脂含量(%dw)。
1.5 藻种分子生物学鉴定方法
1.5.1 藻类基因组的提取和PCR的扩增 藻类基因组DNA 的提取采用改良的CTAB 法。收集对数生长期的藻泥,用蒸馏水清洗3 次,4℃,8 000 r/min 离心收集。加入4 mL CTAB 提取液,充分混匀,65℃水浴1 h。冷却后加入等体积的Tris-饱和酚/氯仿(1∶1),混匀,4℃,12 000 r/min 离心 5 min,取上清液置于另一根离心管中。加入等体积的氯仿,抽提,取上清液置于另一根离心管中。每个离心管中加2倍体积无水乙醇,混匀,-20℃静置4 h。取出,12 000 r/min,4℃离心4 min,弃上清,继续用70%乙醇洗涤2次。沉淀加入20 μL 去离子水即为提取的藻类基因组DNA,-20℃保存。
1.5.2 18S rRNA基因的克隆 18S rRNA的扩增选择真核生物18S rRNA通用引物(上游引物5'-CCAACCTGGTTGATCCTGCCAG-TA-3';下游引物:5'-CCTTGTTAACGAC TTCACCT TCCTCT-3')[28]。PCR 反应条件为:95℃变性5 min;然后94℃ 45 s,55℃ 45 s,72℃ 60 s,30个循环;72℃延伸10 min。PCR 扩增产物于1%的琼脂糖凝胶上电泳,回收目标DNA 片段,并将目标片段连接到pMD18-T 载体上(TaKaRa公司),随即选择3个阳性克隆送至上海生工生物技术有限公司测序。
1.5.3 序列分析 测序得到的分离藻株18S rRNA部分序列通过Blast程序与GenBank中核酸数据进行比对分析,根据同源性高低列出相近序列及所属种或属,以及藻株相关信息,从而判断18S rRNA鉴定结果。
2 结果
2.1 分离藻株的形态特征
通过在东北地区不同地点、时间采集的样品经过分离纯化得到93株藻种,根据培养终期细胞液的颜色和性质观察,除去接团、粘壁、颜色浑浊的藻株,重点考察了30种性质优良的藻株,对这30种藻株进行了细胞形态和培养的特性的观察,参考文献《中国淡水藻类》进行初步分类,结果见表3。表3显示,所分离的藻均为绿藻门藻种,说明绿藻在东北地区自然水体中具有明显的生长优势,同一河流可以分离出不同属的藻,不同河流也能有相同属的藻,这些藻的种类大多集中于小球藻、栅藻、纤维藻和单针藻这几类,纤维藻、单针藻、栅藻多以群生和对生的形态出现,小球藻细胞分散度好,多以单细胞的形态出现。
2.2 尼罗红染色法筛查藻株结果
本实验对分离培养的30株藻采用尼罗红染色法进行了筛选,所得的结果见表4。30种藻种中纤维藻为4种,栅藻为12种,小球藻为6种,单针藻为7种,绿球藻为1种。结果表明,不仅不同属的藻种之间荧光强度有差别,而且同一属的藻种之间的荧光强度差别也差别较大。其中纤维藻的荧光强度普遍较低,介于50.98-79.68之间,这与纤维藻的低油脂含量相关;单针藻的荧光强度偏高,最高的达到123.19,这与单针藻的高油脂含量相对应;栅藻的种类比较多,荧光强度差别也较大,介于40-93之间,不同种的栅藻油脂含量差距较大;小球藻的荧光强度也较高,这与很多文献[29,30]报道的球藻有较高的含油量相对应,是具有潜力的能源微藻,为生物柴油的制备提供了具有潜力的油脂来源。根据微藻类别和荧光强度值比较,筛选出8株SH-S1、SH-S2、SF-S3、HCS-S1、FSH-S1、TMJ-S3、SS-S7和SS-S1荧光强度高的藻种作为油脂含量高的藻种作为进一步的评价对象。

表3 30株微藻细胞形态及培养特征
2.3 藻种产油潜力评价结果
通过尼罗红染色法筛选的藻种的总脂含量都比较高(表5),均超过30%,其中SH-S1的总脂含量高达40%以上,并且荧光强度和总脂含量呈正相关关系,说明尼罗红染色法是一种能够有效的筛选获得高油脂含量藻种的方法。SH-S1的油脂含量最高,为45.61%,但其生物量产率并不高;生物量产率最高的为SS-S7达到381.2 mg/(L·d),但其油脂含量却较低,由此可见,生物量产率与总脂含量并不是正相关关系,仅用生物量产率或总脂含量一个指标作为筛选高产油藻株的指标是比较片面的,因此,引入总脂产率这个指标来筛选高产油藻株。总脂产率为总脂含量与生物量产率的乘积,能够表示单位体积单位时间的藻液的实际产油量,反映了藻细胞的实际油脂积累速率。同一种藻种由于培养条件的不同也会造成生物量产率和总脂含量的差异,一般来说同一藻种在不同培养条件下生物量产率高的总脂含量很可能会降低,因此,为了筛选藻种的基本产油能力,藻种评价均选择了采用了适合大多数绿藻生长的BG11基础培养基,同时以藻种的总脂产率作为评价指标进行藻种筛选,从表中可以看出,SF-S3总脂产率最高,达到133.9 mg/(L·d),为具有产油潜力的藻株。
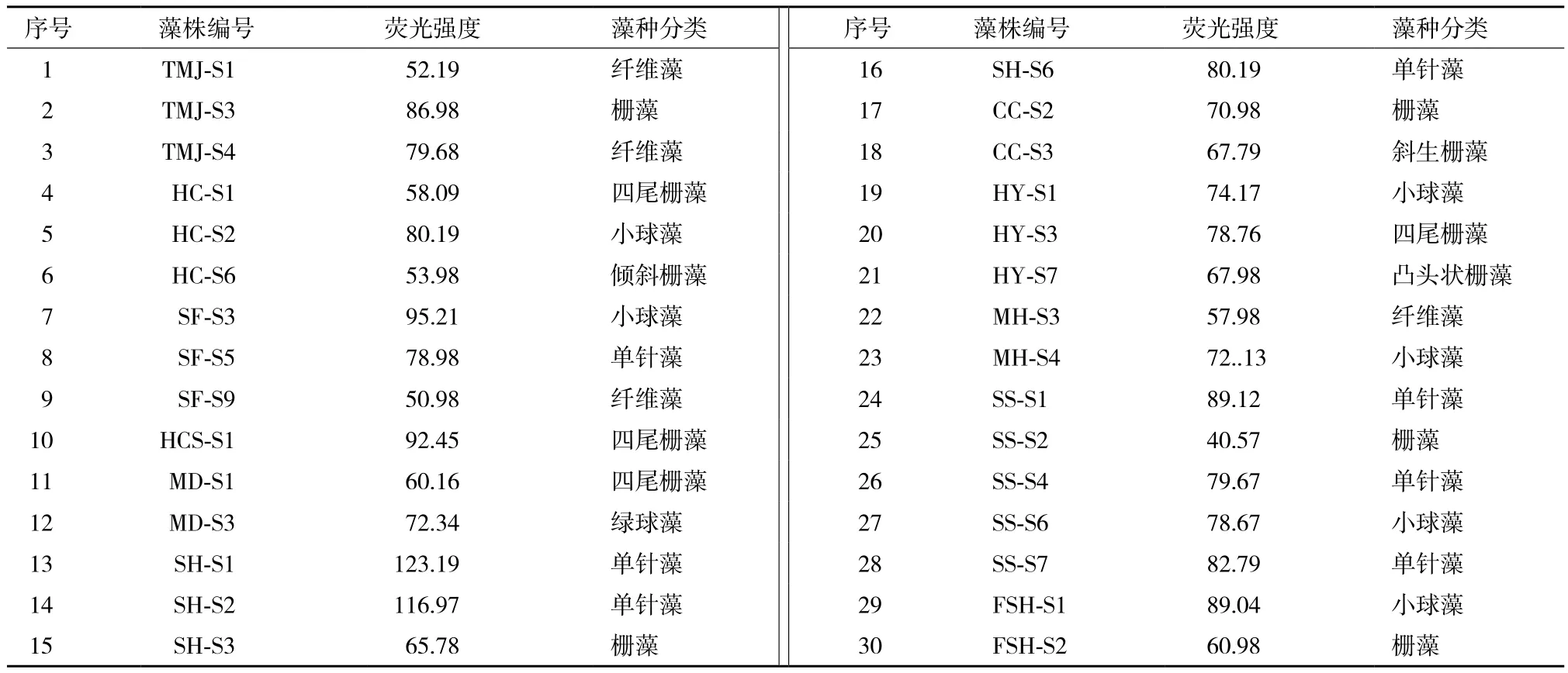
表4 尼罗红染色法筛查藻种结果

表5 不同藻株生物量及油脂含量的比较
2.4 高产油藻株的分子生物学鉴定
用通用引物对SF-S3藻株进行18S rRNA 的PCR扩增,得到预期长度的扩增产物(图2),且产物条带单一。图2 显示,藻株SF-S3 的18S rRNA PCR扩增片段的长度均在1 500 bp附近,测序结果在NCBI GenBank数据库中进行序列同源性比对,18S rDNA序列相似度达到99%,下载相关序列,利用MEGA5.1软件构建进化树。结果(图3)表明,藻株SF-S3与多个Chlorella sp.的亲缘关系最近,初步确定该藻属于Chlorella sp.,即小球藻属。
3 讨论
自然界中存在着大约20万种藻类,不同微藻之间的生物量产率和油脂含量存在着明显的差异,许多藻株是具有开发和利用价值的产油微藻。本实验从东北地区水域种分离出93种微藻,选取其中30种生长状态好的藻种,采用尼罗红染色法对产油微藻进行初步筛选,筛选获得的藻株的油脂含量均大于30%,并且藻株的油脂含量与荧光强度成正相关关系,这与Alonzo 和Mayzaud[31]对浮游动物的脂类进行染色后发现其荧光强度与脂类浓度呈线性关系的结果类似。由于大多数藻种都有细胞壁,限制了尼罗红进入藻细胞与脂类物质结合产生荧光,本实验采用了采用了王海英等[26]的改进的尼罗红染色法,用DMSO渗透剂对藻液进行了预处理,结果表明该种尼罗红染色法是一种很好的初级筛选含油藻的方法。

图2 藻株SF-S3的18S rRNAPCR扩增产物
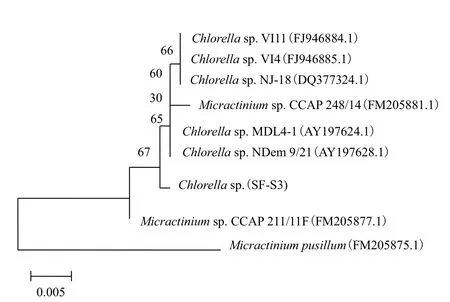
图3 CC-B3的18S rDNA 序列系统发育树
本研究利用实验室自制的通气培养装置对用尼罗红染色法筛选出的8株产油微藻进行了通气培养评价,通过测定生物量和油脂含量两个指标来评价产油微藻,结果表明,生物量和油脂含量不是正相关关系,油脂含量高的生物量不一定高。为了准确地评价藻株的产油能力,引入总脂产率这个指标来筛选高产油藻株。总脂产率为总脂含量与生物量产率的乘积,能够表示单位体积单位时间的藻液的实际产油量,反映了藻细胞的实际油脂积累速率。通过8株藻株的油脂产率的比较,筛选获得了油脂产率最高SF-S3藻株,油脂产率高达133.39 mg/(L·d)。 江丽丽等[32]筛选获得的产油藻株凯氏拟小球藻C. kessleri HY-6培养结束时生物质干重达到1.02 g/L,总脂含量为39.7%,总脂产率为50.8 mg/(L·d),SF-S3油脂产率为其的2.6倍。孙漫等[33]通过采用尼罗红和油脂提取相结合的方法筛选获得的产油量较高的琴式菱形藻在经过Fe3+优化后生物量最大(0.65 g/L),油脂产量为318.96 mg/L,本文所筛选的SF-S3的生物量是其的8.4倍,油脂产量是其的6.3倍。周文俊等[34]对富油微藻金藻Isochrysis sp. CCMM5001优化培养条件并采用两阶段培养法后总脂含量和油脂产率分别高达63.3%和22 mg/(L·d),本研究所筛选的SF-S3的油脂产率是其的6.1倍。可见,藻株SF-S3具有较好的产油潜力,可作为进一步研究的能源微藻。
4 结论
从东北地区水样中分离纯化出93种藻种,获得了8种具有产油潜力的藻种,并利用自制的柱式反应器微藻评价装置对这8株藻株进行了产油能力的评价,获得了一株油脂产率达到133.9 mg/(L·d)的产油能源微藻。对该藻株进行了18S rRNA 的鉴定,确定为Chlorella sp.。
[1]Breena L, Owende P. Biofuels from microalagae-A review of technologies for production, processing, and extrctions of biofuels and co-products[J]. Renew Sustain Energy Rev, 2010, 14:557-577.
[2]Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstorks for biofuel p roduction::perspectives and advances[J]. Plant J, 2008, 54:621-639.
[3]Ma F, Hanna MA. Biodiesel production:a review[J]. Bioresource Technol, 1999, 70:1-15.
[4]Turner JA. A realizable renewable energy future[J]. Science,1999, 285(5427):687-689.
[5] 郑洪立, 张齐, 马小琛, 等. 产生物柴油微藻培养研究进展[J].中国生物工程杂志, 2009, 29(3):110-116.
[6]梅洪, 张成武, 李夜光, 等. 利用微藻生产可再生能源研究概况[J]. 武汉植物学研究, 2008, 26(6):650-660.
[7]Sheehan J, Dunahay T, Benemann J, et al. A look back at the US department of energy’s aquatic species program:biodiesel from algae[M]. US. :National Renewable Energy Laboratory, 1998:1-64.
[8]张齐, 郑洪立, 唐小红, 等. 基于模糊综合评价的产生物柴油微藻藻种筛选[J]. 中国生物工程杂志, 2010, 30(5):69-75.
[9]Pedroni P, Davison J, Beckert H, et al. A proposal to establish an international network on biofixation of CO2and greenhouse gas abatement with microalgae[R]. Canada:IEA Greenhouse Gas R and D Program Executive Committee, 2002.
[10]Huang GH, Chen F, Wei D, et al. Biodiesel production by microalgal biotechnology[J]. Applied Energy, 2010, 87:38-46.
[11]Rodolfi L, Chini Zittelli G, Bassi N, et al. Microalgae for oil:strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor[J]. Biotechnol Biotechnol Bioeng,2009, 102(1):100-112.
[12]Mandotra SK, Kumar P, Suseela MR, et al. Fresh water green microalga Scenedesmus abundans:A potential feedstock for high quality biodiesel production[J]. Bioresource Technology, 2014,156:42-47.
[13]蒋霞敏, 郑亦周. 14种微藻总脂含量和脂肪酸组成研究[J].水生生物学报, 2003, 27(3);243-247.
[14]王金娜, 严小军, 周成旭, 等. 产油微藻的筛选及中性脂动态积累过程的检测[J]. 生物物理学报, 2010, 26(6):472-480.
[15]王立柱, 温皓程, 等. 产油微藻的分离、筛选及自养培养氮源、碳源的优化[J]. 微生物学通报, 2010, 37(3):336-341.
[16]张秋会, 马莺. 工业化生产EPA和DHA藻株的选育[J]. 中国油脂, 2004, 29(6):30-32.
[17]张秋会, 马莺. 气相色谱法测定海洋微藻中二十碳五烯酸和二十二碳六烯酸[J]. 色谱, 2004, 22(6):662.
[18]易翠平, 杨明毅. 三种绿藻总脂肪和脂肪酸的测定[J]. 食品与机械, 2001(2):36.
[19]俞建江, 李荷芳, 周汉秋. 10种海洋微藻总脂、中性脂和极性脂的脂肪酸组成[J]. 水生生物学报, 1999, 23(5):481-488.
[20]卢丽娜, 孙利芹, 王长海, 等. 32株海洋微藻总脂含量及其脂肪酸组成的研究[J]. 中国油脂, 2009, 34(11):68-73.
[21]缪晓玲, 吴庆余. 藻类异养转化制备生物油燃料技术[J]. 可再生能源, 2004(4):41-44.
[22]Miyamoto K. Renewable biological systems for alternative sustainable energy production[R]. US:FAO Agricultural Services Bulletin, 1997:135.
[23]Rodolfi L, Zittelliv CG, et al. Microalgae for oil:strain selection,induction of lipid synthesis and outdoor mass cultivation in a lowcost photobioreactor[J]. Biotechnol Bioeng, 2009, 102(1):100-112.
[24]李涛, 李爱芬, 桑敏, 等. 富油能源微藻的筛选及产油性能的评价[J]. 中国生物工程杂志, 2011, 31(4):98-105.
[25]Richmond A. Handbook of microalgal culture:Biotechnology and applied phycology[M]. UK:Blackwell, 2004.
[26]王海英, 符茹, 黄宝祥. 基于尼罗红荧光染色的小球藻脂质快速检测方法研究[J]. 中国油脂, 2012, 37(3):78-81.
[27]张桂艳, 温小斌, 梁芳, 等. 重要理化因子对小球藻(Chlorella)生长和油脂产量的影响[J]. 生态学报, 2011, 31(8):2076-2085
[28]黄建忠, 江贤章. DHA 高产菌Schizochytrium sp. FJU-512 的分离及其18S rRNA 基因序列比较分析[J]. 应用与环境生物学报, 2005, 11(2):202-207.
[29]王金娜, 严小军, 周成旭, 等. 产油微藻的筛选及中性脂动态积累过程的检测[J]. 生物物理学报, 2010, 26(6):472-480.
[30]万文文, 岳燕燕, 梁科鹏. 两株地下海水微藻的分子鉴定及其油脂分析[J]. 海洋环境科学, 2013, 32(3):440-443.
[31]Alonzo F, Mayzaud P. Spectrofluorometric quantification of neutral and polar lipids in zooplankton using Nile red[J]. Marine Chemistry, 1999, 67(3-4):289-301.
[32]江丽丽, 温小斌, 耿亚红, 等. 一株产油微藻的筛选和分子鉴定[J]. 水生生物学报, 2013, 37(4):606-612.
[33]孙漫, 聂娟, 袁维道, 等. 产油脂海洋微藻的筛选、鉴定及Fe3+对其生长和油脂积累的影响[J]. 微生物油脂, 2012, 37(12):70-73.
[34]周文俊, 郑立, 韩笑天, 等. 基于尼罗红染色分析金藻总脂动态积累[J]. 水生生物学报, 2014, 38(2):312-319.
(责任编辑 李楠)
Selection and Identification of Oil-producing Energy M icroalgae in Northeast Region
Shi Wenjing Liao Sha Sun Qimei Wang Pengxiang Li Xiaoshu
(Fushun Research Institute of Petroleum and Petrochemicals,SINOPEC,Fushun113001)
In the 21st century, the ideal microalgae biodiesel fuel has been widespread concern, but how to filter high in fat content from a lot of microalgae species has become a problem to be addressed. In this study, 93 strains of microalgae were isolated and purified from the water samples of the Northeast region, and 30 strains were screened to obtain eight oil-producing algae by Nile red fluorescence. Oil production capacity of these eight microalgae were evaluated with bubble column photobioreactor. This experiment obtained a higher oil yield algal and its total oil yield reached 133. 9 mg /(L· d). On this basis an oil-producing energy microalgae was identificated by 18S rRNA. This oil-producing energy microalgae was identificated as Chlorella sp.
oil-producing microalgae;nile red;separation and purification ;screening;lipid productivity;molecular identification;18S rRNA
10.13560/j.cnki.biotech.bull.1985.2015.08.035
2015-04-09
中国石化集团微藻生物柴油成套技术开发项目(210080)
师文静,女,硕士研究生,研究方向:微藻生物能源;E-mail:shiwenjing.fshy@sinopec.com
廖莎,女,硕士研究生,研究方向:微藻生物能源;E-mail:liaosha.fshy@sinopec.com
