蛋白核小球藻Fesod基因的克隆及表达分析
2015-10-24沈佳江灵芝孙雪
沈佳 江灵芝 孙雪
(宁波大学海洋学院 浙江省海洋生物工程重点实验室,宁波 315211)
蛋白核小球藻Fesod基因的克隆及表达分析
沈佳 江灵芝 孙雪
(宁波大学海洋学院浙江省海洋生物工程重点实验室,宁波315211)
利用RACE技术克隆了蛋白核小球藻Fesod全基因序列,得到1 215 bp序列,其5'非翻译区长52 bp,3'非翻译区长452 bp,共编码236个氨基酸。生物信息学分析结果表明,该Fesod基因编码蛋白的分子量为26.42 kD,等电点为6.98;位于线粒体中的概率是73.9%;该蛋白没有信号肽序列;蛋白质二级结构预测结果表明FeSOD中α-螺旋和无规卷曲分别占53.39%和39.41%。再利用实时荧光定量PCR技术检测了不同盐度和水杨酸浓度对蛋白核小球藻Fesod基因表达的影响,结果表明Fesod表达量随着盐度升高而增加,45‰盐度表达量为15‰盐度的3.61倍;而植物激素水杨酸的添加一定程度抑制了45‰盐度培养藻Fesod基因的表达,并且随其浓度增加呈现先升后降的趋势。表明蛋白核小球藻Fesod受盐度诱导,而水杨酸对其影响不明显。
蛋白核小球藻;铁超氧化物歧化酶;转录表达;盐度;水杨酸
超氧化物歧化酶(SOD)是一种普遍存在于植物界中的含金属原子的抗氧化酶,常被作为研究植物抗逆性的指标[1]。据SOD所结合金属原子的不同,植物SOD可分为3种类型:MnSOD、Cu/ZnSOD和FeSOD,在低等植物中以FeSOD和MnSOD为主[2]。SOD作为生物体内第一个参与活性氧清除反应的重要保护酶[3],可将超氧阴离子(O2·-)转化为H2O2,H2O2再在过氧化物酶(POD)和过氧化氢酶(CAT)等作用进一步还原为H2O和O2,从而清除植物体内过多的自由基,以减少自由基对植物的毒害[4]。因此植物可以通过提高SOD等抗氧化酶活性来增强其抗逆性,使植物体在一定程度上能耐受或抵抗高温、干旱、高盐等逆境胁迫带来的危害[1,5]。但逆境胁迫对SOD的影响并不完全一致,如杜氏藻D. tertiolecta在3 mol/L NaCl胁迫下的SOD和CAT等抗氧化酶活性则没有明显变化[6]。
此外,植物激素如水杨酸(SA)和脱落酸(ABA)等也能诱导sod基因的表达[7]。水杨酸是一种植物内源信号物质和新型植物激素,大量试验证明水杨酸具有提高植物抗病害等生物胁迫和盐度、高低温等非生物胁迫的作用[8]。其中减轻逆境胁迫引起的抗氧化损伤是水杨酸提高植物抗逆性的重要方式[9]。SA可以提高盐胁迫下的SOD、POD和CAT等抗氧化酶的活性,从而逆转盐度压力对抗氧化酶的扰乱[10-12]。
小球藻(Chlorella)是一类广泛应用于食品、医疗、化工等方面的重要经济微藻,同时小球藻具有较广泛的耐受性,因此经常用于重金属、污染物及其它逆境胁迫的研究[13-15]。目前,在低等藻类中关于FeSOD的研究不多,本研究以蛋白核小球藻(C. pyrenoidosa)为材料,克隆该藻的铁超氧化物歧化酶全基因序列,研究不同盐度以及水杨酸浓度对Fesod表达变化的影响,旨在丰富低等藻类植物中Fesod基因序列信息,并为FeSOD酶在转录水平上响应逆境胁迫研究提供参考。
1 材料与方法
1.1 材料
本实验所用藻种为蛋白核小球藻820,来自宁波大学海洋生物工程重点实验室藻种室。
1.2 方法
1.2.1 材料培养与处理 蛋白核小球藻820培养温度为25℃,光照强度约为40 μmol/(m2·s),光暗周期为12 L/12 D。培养基为添加f/2的人工海水培养基,通过控制NaCl的量来调节培养基盐度分别为15‰、30‰和45‰;在盐度为45‰时,添加水杨酸母液至水杨酸终浓度分别为0、0.1、0.5、1.0和2.0 mmol/L。
1.2.2 Fesod部分序列的克隆 根据GenBank数据库中的蛋白核小球藻(DQ183067)、菜菌衣藻(Chlamydomonas reinhardtii,GQ413964、XM_001690539)和盐生杜氏藻(Dunaliella salina,AY847684)的Fesod序列,运用MEGA5.1软件中的ClustalW程序进行同源性比对,设计简并引物sodF和sodR(表1)。将离心收集的对数生长中期的藻细胞加液氮研磨后,按照Trizol试剂(Invitrogen)说明进行RNA的提取。RNA经过电泳检测与紫外微量分光光度计(Nanodrop 1000)测定总RNA浓度和纯度,再按照PrimeScript RT reagent kit with gDNA eraser反转录试剂盒(TaKaRa,大连)的说明转录成cDNA,并以该cDNA作为模板进行PCR扩增。扩增反应条件为:94℃预变性5 min;94℃ 50 s,55℃ 1 min,72℃ 1 min,共35个循环;72℃延伸8 min。将电泳检测扩增大小正确的产物进行回收,用pMD18-T 载体(TaKaRa,大连)进行连接与转化,最后将经过挑菌检测为阳性的重组克隆送去测序。所有引物序列的合成和序列测定均由Invitrogen(上海)公司完成。1.2.3 Fesod全基因序列扩增 测序得到的Fesod基因部分序列,利用Primer Premier 5.0设计RACE扩增引物(表1)。用上述相同方法进行RNA提取,以其反转录的cDNA为模板,进行5'-RACE和3'-RACE(RACE试剂盒来自TaKaRa,大连)扩增。将扩增产物进行克隆后送去测序。最后将获得的Fesod部分序列、5'-RACE和3'-RACE序列一起拼接后获得Fesod全基因序列,并将序列递交到NCBI数据库。

表1 Fesod基因的扩增引物
1.2.4 Fesod基因的系统进化分析 在NCBI网站(http://www.ncbi.nlm.nih.gov)中的protein数据库中查找几种绿藻的Fesod基因,将它们与本实验得到的蛋白核小球藻一起用MEGA5.1软件中的ClustalW程序进行比对,再用邻接法进行系统进化树的构建,Bootstrap值为1 000。
1.2.5 Fesod的生物信息学分析 在NCBI网站,通过 ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf. html),查找其可能的开放阅读框。蛋白质分子量和等电点预测使用http://www.expasy.org,亚细胞定位用http://psort.hgc.jp,信号肽预测用http://www. cbs.dtu.dk/services/SignalP,蛋白质跨膜区预测用http://www.cbs.dtu.dk/services/TMHMM,蛋白质二级结构预测用http://npsa-pbil.ibcp.fr/ cgi-bin/npsa_ automat.pl?page=/NPSA/npsa_seccons.html。
1.2.6 Fesod的表达分析 利用Primer Premier5.0软件设计Fesod荧光定量PCR引物(表1),用18S rDNA作为内标[16]。按照SYBR Premix Ex Taq 说明书进行荧光定量PCR反应,反应体系中SYBR Premix Ex Taq 10 μL,上下游引物各0.4 μL,cDNA 2 μL,加水补足总体积到20 μL。荧光定量PCR(Rotor-Gene 6000 PCR仪)反应条件为:94℃预变性3 min;94℃ 10 s,55℃ 15 s,72℃ 20 s,共40次循环。荧光定量PCR数据采用2-△△Ct法进行分析[17]。
1.2.7 数据处理 数据均采用Excel软件作图,用SPSS19.0软件进行数据分析,用SPSS的独立样本T检验进行差异显著性分析,用P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 蛋白核小球藻Fesod基因的克隆
以蛋白核小球藻cDNA为模板,经过PCR扩增得到约250 bp大小的cDNA片段,测序后其长度为269 bp(图1-A)。利用GenBank中的BLASTn工具进行搜索发现,该序列与莱茵衣藻Fesod(GenBank登录号为U22416)和盐生杜氏藻(AY847684)的Fesod相似性均为75%,与蛋白核小球藻211-8bFesod(DQ183067)的相似性为73%。该比较结果表明获得片段是蛋白核小球藻的Fesod基因。
根据获得的269 bp的Fesod部分序列,设计RACE引物进行上下游未知序列的扩增。5'-RACE扩增后,电泳检测(图1-B)显示大约在600 bp的位置有一条PCR条带,3'-RACE扩增反应后,电泳检测(图1-C)显示在700 bp附近有一条PCR条带。克隆测序后得到5'-RACE和3'-RACE的扩增产物分别为604 bp和639 bp。拼接后得到长为1 215 bp的全Fesod基因序列。
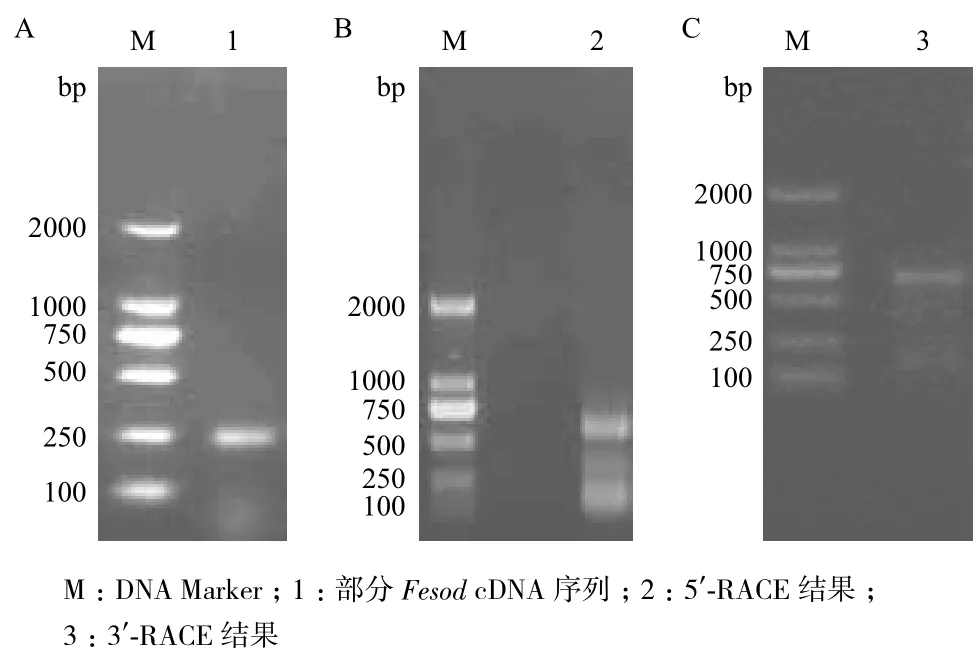
图1 蛋白核小球藻Fesod基因扩增结果
2.2 几株绿藻Fesod基因编码蛋白的进化分析
在NCBI中利用该蛋白核小球藻Fesod(GenBank登录号为KF736945,蛋白序列号为AHD25899)进行BLASTx搜索,发现该蛋白核小球藻Fesod编码氨基酸序列与小球藻C. variabilis(XP_005851580)相似性最高(为68%),与莱茵衣藻Fesod(XP_0016-90591)相似性为64%,而与蛋白核小球藻Fesod(ABA71697)相似性为65%。
我们又从NCBI数据库中下载了11条绿藻和1条小麦的FeSOD氨基酸序列,与本研究得到的蛋白核小球藻FeSOD共13条序列一起构建系统发育树。结果(图2)表明,12条绿藻依次聚在一起,高等植物小麦(与其它绿藻的遗传距离在0.529-0.548)在最外群。其中6株绿藻——两株莱茵衣藻(绿藻门、绿藻纲、衣藻目和衣藻科)(XP_001690591和AAB04944),团藻目的雨生红球藻(Haematococcus pluvialis)(AFC35159)、团藻Volvox carteri f. nagariensis(XP_002946030)和盐生杜氏藻(AAX92665),以及衣藻科的Polytomella parva(ABH11031)最先聚类;外面依次是石莼纲的裂片石莼(Ulva fasciata)(ABR23159)、Trebouxiophyceae纲的蛋白核小球藻(ABA71697)、Coccomyxa subellipsoidea(XP_00564-7238)、本研究的蛋白核小球藻(AHD25899)和另外两条小球藻C. variabilis(XP_005851580和XP_005850533)。可见,根据FeSOD氨基酸序列可以把绿藻门的不同纲分开,但是可能不太适合更低分类水平的区分。如蛋白核小球藻(ABA71697)并没有与同属的小球藻聚在一起,但该小球藻与裂片石莼的遗传距离为0.310,与同属其他3株小球藻的距离为0.329-0.394,差别较小。
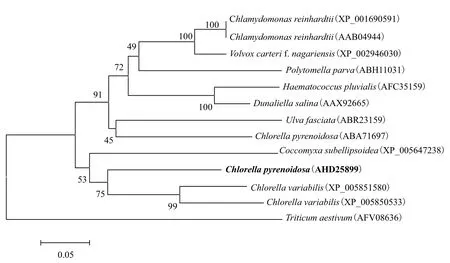
图2 根据FeSOD序列构建的系统进化树
2.3 蛋白核小球藻Fesod的生物信息学分析
获得的Fesod基因全长1 215 bp,其中5'-非翻译区长52 bp,3'-非翻译区长452 bp,开放阅读框长711 bp,共编码236个氨基酸。生物信息学分析结果表明,该Fesod编码蛋白的理论分子量为26.42 kD,等电点为6.98。亚细胞定位结果表明,该Fesod基因定位于线粒体中的概率是73.9%,位于细胞核中的概率是13.0%,位于细胞质、胞外和细胞骨架的概率均是4.3%。
信号肽预测结果表明该FeSOD蛋白没有信号肽。跨膜结构预测结果表明编码的236个氨基酸全部位于胞外。蛋白质二级结构预测结果表明α-螺旋占53.39%,β-折叠占5.93%,无规卷曲所占比例为39.41%,不明确的氨基酸占1.27%(图3)。
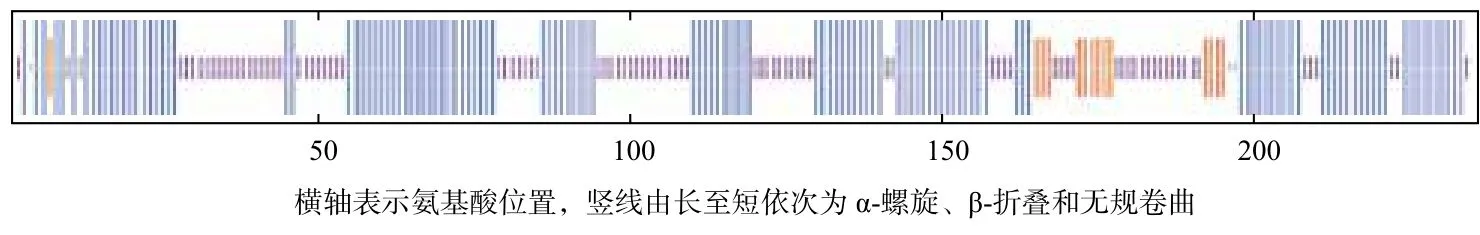
图3 蛋白核小球藻FeSOD二级结构预测图
2.4 蛋白核小球藻Fesod基因的转录表达分析
图4显示,蛋白核小球藻Fesod表达量随着盐度升高而增加。以15‰盐度培养藻的Fesod表达量为1,30‰和45‰盐度培养藻的Fesod表达量分别是15‰盐度培养藻的Fesod表达量的1.89倍(P<0.05)和3.65倍(P<0.01)。结果表明,高盐胁迫一定程度地促进了蛋白核小球藻Fesod的表达,推测高盐胁迫时,藻细胞通过增加Fesod基因表达从而增加FeSOD酶的含量来对抗高盐逆境伤害。
植物激素水杨酸的添加对45‰盐度培养蛋白核小球藻Fesod表达的影响,见图5(30‰盐度结果与45‰类似,文中未显示)。从0.1-2.0 mmol/L SA浓度变化,Fesod表达呈现先下降后上升再下降的趋势。以未添加SA的Fesod基因表达量作为1,0.1 mmol/L SA组Fesod表达量为对照组的0.54倍(P<0.05),0.5和2.0 mmol/L SA组Fesod表达量分别为对照组的0.84倍和0.80倍,而1.0 mmol/L SA组Fesod表达量为对照的1.17倍。表明水杨酸诱导Fesod表达的作用不明显,低浓度(0.1和0.5 mmol/L)和高浓度(2.0 mmol/L)水杨酸处理Fesod基因表达均低于对照组,只有1.0 mmol/L SA添加后Fesod表达水平比对照略高,但差异不显著(P>0.05)。
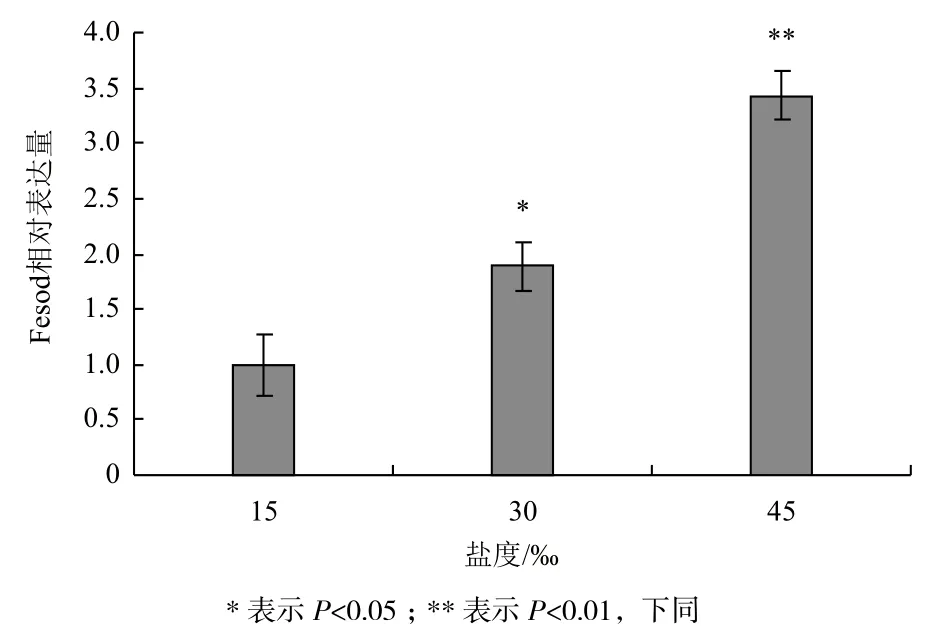
图4 盐度对蛋白核小球藻Fesod转录表达的影响
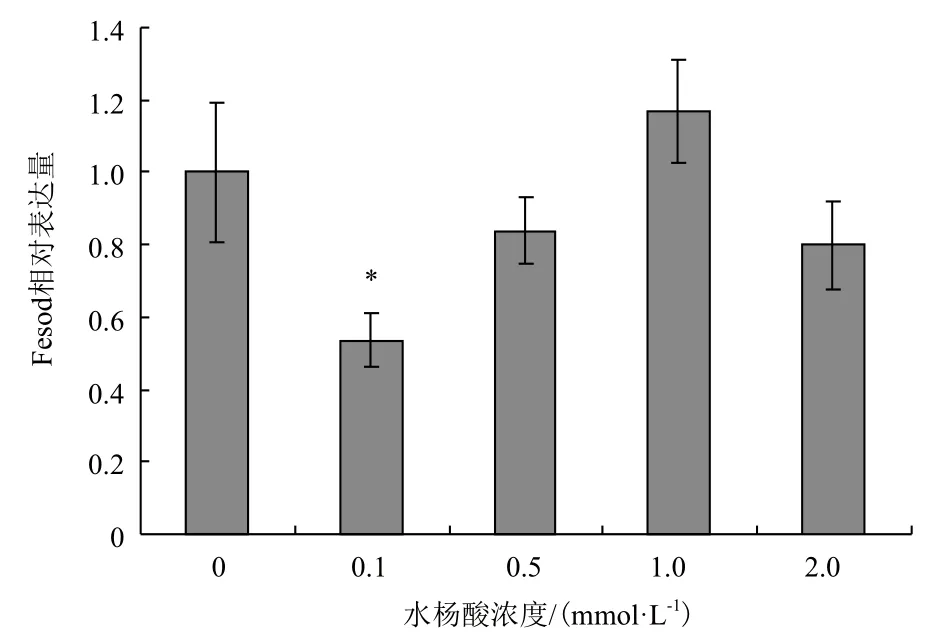
图5 水杨酸对蛋白核小球藻Fesod转录表达的影响
3 讨论
SOD是植物抗氧化系统的重要酶,相对于高等植物中Cu/ZnSOD和MnSOD的研究,低等藻类植物中关于SOD的研究并不多,如大型红藻坛紫菜(Pyropia haitanensis)和龙须菜(Gracilaria lemaneiformis)中Mnsod基因的克隆与热胁迫下的表达[18,19];微藻中的钝顶螺旋藻(Spirulina platensis)、雨生红球藻和莱茵衣藻的Fesod的克隆等[20-22]。FeSOD一般位于植物叶绿体中[23],也有FeSOD位于细胞质中的报道,如苔藓植物Pogonatum inflexum和大豆[24,25]。但本研究生物信息学分析结果表明该FeSOD蛋白位于线粒体中(其概率是73.9%)。已进行基因组测序的小球藻C. variabilis中有两条Fesod基因,分别编码236个和204个氨基酸。该小球藻C. variabilis中编码236个氨基酸的Fesod(XP_005851580)与本研究小球藻Fesod编码的氨基酸个数相同,对其序列进行亚细胞定位分析结果表明其FeSOD蛋白位于线粒体和细胞质中的概率分别是34.8%和30.4%。蛋白质二级结构预测结果表明该蛋白核小球藻中α-螺旋占53.39%,β-折叠占5.93%;钝顶螺旋藻FeSOD的二级结构中α-螺旋所占比例很大,而β-折叠只有一个[20];而雨生红球藻FeSOD中则含有3个β-折叠片和11个α-螺旋[21],这些结果都符合植物中FeSOD的α-螺旋所占比例远远大于β-折叠的序列结构特征[23]。并且,该蛋白核小球藻FeSOD序列也有高等单子叶植物FeSOD蛋白的WEHAYY保守序列[23]。
盐胁迫是影响植物生命活动的重要环境因素。盐胁迫会对植物体内活性氧的代谢系统平衡造成破坏,具体表现在活性氧(ROS)含量增加,SOD活性增加。而作为SOD家族的一员,Fesod表达量也受盐度诱导。如杜氏盐藻中3.0 mol/L NaCl培养的Fesod表达量明显比1.5 mol/L NaCl增加[26];100 mmol/L NaCl 处理后银杏叶中Fesod基因表达量提高为对照组的4.3倍[27]。这些结果与本研究一致。
此外,据报道其他植物激素对高等植物Fesod基因表达的影响不同,如ABA可以诱导银杏Fesod基因的表达[27],但IAA则无此作用[27];而ABA和IAA不能诱导烟草Fesod的表达,并且ABA作用下烟草Fesod mRNA反而有所降低[28]。本研究结果显示水杨酸对蛋白核小球藻Fesod表达作用不明显。
4 结论
本研究从蛋白核小球藻中克隆到1 215 bp的Fesod序列,共编码236个氨基酸,该蛋白很可能位于线粒体中,无信号肽序列,α-螺旋含量远高于β-折叠。该Fesod基因表达受盐度诱导,而植物激素水杨酸对其表达影响较小。
[1] 覃鹏, 刘飞虎, 梁雪妮. 超氧化物歧化酶与植物抗逆性[J].黑龙江农业科学, 2002, 24(1):31-34.
[2] 赵咏梅. 植物SOD在抵抗干旱胁迫中的作用[J]. 生物学教学,2011, 36(3):4-5.
[3] McCord JM, Fridovich I. Superoxide dismutase:An enzymic function for erythrocuprein(hemocuprein)[J]. J Biol Chem, 1969,224(22):6049-6055.
[4] Matés JM. Effects of antioxidant enzymes in the molecular control of reactive oxygen species toxicology[J]. Toxicology, 2000, 153(1-3):83-104.
[5]焉婷婷, 周亚维, 李朋富, 等. 广盐性硅藻披针舟形藻在高盐和低盐胁迫下的抗氧化响应[J]. 盐业与化工, 2010, 39(5):15-19.
[6]Jahnke LS, White AL. Long-term hyposaline and hypersaline stresses produce distinct antioxidant responses in the marine alga Dunaliella tertiolecta[J]. Plant Physiol, 2003, 160(10):1193-1202.
[7] 马旭俊, 朱大海. 植物超氧化物歧化酶(SOD)的研究进展[J].遗传, 2003, 25(2):225-231.
[8]Hayat Q, Hayat S, Irfan M, et al. Effect of exogenous salicylic acid under changing environment:A review[J]. Environmental and Experimental Botany, 2010, 68(1):14-25.
[9]Parashar A, Yusuf M, Fariduddin Q, et al. Salicylic acid enhances antioxidant system in Brassica juncea grown under different levels of manganese[J]. Int J Biol Macromol, 2014, 70:551-558.
[10]Li T, Hu Y, Du X, et al. Salicylic acid alleviates the adverse effects of salt stress in Torreya grandis cv. Merrillii seedlings by activating photosynthesis and enhancing antioxidant systems[J]. PLoS One, 2014, 9(10):e109492.
[11]Mutlu S, Atici O. Alleviation of high salt toxicity-induced oxidative damage by salicylic acid pretreatment in two wheat cultivars[J]. Toxicol Ind Health, 2013, 29(1):89-96.
[12]Al-Whaibi MH, Siddiqui MH, Basalah MO. Salicylic acid and calcium-induced protection of wheat against salinity[J]. Protoplasma, 2012, 249(3):769-778.
[13]李建宏, 浩云涛, 翁永萍. Cd2+胁迫条件下椭圆小球藻的生理应答[J]. 水生生物学报, 2004, 28(6):659-663.
[14]王淑智, 李利, 张道勇, 等. NaCl与Cd对小球藻光系统Ⅱ(PSⅡ)活性的影响[J]. 应用与环境生物学报, 2011, 17(6):839-846.
[15]许超, 李梅梅, 曾伟, 等. 高效氯氰菊酯对蛋白核小球藻的毒性影响[J]. 环境科学与技术, 2013, 36(12M):6-10, 41.
[16]邓意龙, 孙雪, 徐年军, 等. 蛋白核小球藻(Chlorella pyrenoidosa)Rubisco活化酶基因的克隆与表达分析[J]. 海洋与湖沼, 2012, 43(1):41-46.
[17]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Method, 2001, 25(4):402-408.
[18]Yang R, Liu W, Zhang XL, et al. Sequences of Mn-sod gene from Pyropia haitanensis (Bangiales, Rhodophyta)and its expression under heat shock[J]. Botanica Marina, 2013, 56(3):249-259.
[19]Lu N, Zang X, Zhang X, et al. Gene cloning, expression and activity analysis of manganese superoxide dismutase from two strains of Gracilaria lemaneiformis(Gracilariaceae, Rhodophyta)under heat stress[J]. Molecules, 2012, 17(4):4522-4532.
[20]郭建军, 龚兴国, 鲁宇文, 等. 钝顶螺旋藻Fe-SOD基因的克隆及序列分析[J]. 浙江大学学报:理学版, 2004, 31(6):674-678.
[21]樊寅卯, 张蕾, 秦松, 等. 雨生红球藻铁型超氧化物酶基因的克隆与序列分析[J]. 海洋科学, 2012, 36(4):857-865.
[22] McKim SM, Durnford DG. Translational regulation of light-harvesting complex expression during photoacclimation to high-light in Chlamydomonas reinhardtii[J]. Plant Physiol Biochem, 2006,44(11-12):857-865.
[23]李娟, 杨立新, 郑文寅, 等. 小麦FeSOD基因的克隆与序列分析[J]. 核农学报, 2013, 27(8):1111-1117.
[24] Kanematsu S, Okayasu M, Ueno S. Atypical cytosol-localized Fesuperoxide dismutase in the moss Pogonatum inflexum[J]. Bull Minamikyushu Univ, 2013, 43 A:23-31.
[25] Salin ML. Toxic oxygen species and protective systems of the chloroplast[J]. Physiologia Plantarum, 1988, 72(3):681-689.
[26] 卢雪景, 刘红涛, 柴玉荣, 等. 外源一氧化氮缓解盐胁迫下杜氏盐藻氧化损伤的初步研究[J]. 河南农业科学, 2009, 37(5):47-52.
[27] 李琳玲, 程华, 许锋, 等. 银杏铁型超氧化物歧化酶基因(GbFeSOD)的克隆与表达[J]. 果树学报, 2009, 26(6):840-846.
[28] Kurepa J, Herouart D, Van MM. Differential expression of CuZnand Fe-superoxide dismutase genes of tobacco during development,oxidative stress, and hormonal treatments[J]. Plant Cell Physiol,1997, 38(4):463-470.
(责任编辑 马鑫)
Gene Cloning and Expression Analysis of Fesod Gene from Chlorella pyrenoidosa
Shen Jia Jiang Lingzhi Sun Xue
(Key Laboratory of Marine Biotechnology of Zhejiang Province,School of Marine Sciences,Ningbo University,Ningbo315211)
The Fesod gene of Chlorella pyrenoidosa was cloned by RACE method. Total 1 215 bp Fesod sequence was obtained, containing 52 bp 5' untranslated region, 452 bp 3' untranslated region, and an open reading frame of 711 bp. The bioinformatics analysis showed that the molecular weight of FeSOD was 26.42 kD and isoelectric point was 6.98; the FeSOD protein located in the mitochondria with a probability of 73.9%; the FeSOD protein had no signal peptide; and the secondary structure prediction results showed that a-helix and random coil in FeSOD accounted for 53.39% and 39.41%, respectively. Then, the transcriptional expression of Fesod at different concentrations of salinity and salicylic acid was detected by real-time fluorescent quantitative PCR. The results showed that Fesod expression increased with the salinity varying from 15‰ to 45‰, and the expression quantity was 3.61 times under 45‰ salinity culture than that under 15‰ salinity. Moreover, salicylic acid could inhibit the mRNA accumulation of Fesod to a certain extent under 45‰ salinity, and its accumulation firstly increased and then decreased with the salicylic acid concentration from 0.1 to 2.0 mmol/L. In conclusion, the expression of Fesod was induced by salinity, while salicylic acid showed no significant effect on its expression.
Chlorella pyrenoidosa;Fe-superoxide dismutase;transcriptional expression;salinity;salicylic acid
10.13560/j.cnki.biotech.bull.1985.2015.05.027
2014-09-05
浙江省自然科学基金项目(LY13D060007),浙江省科技创新团队(2010R50025-25)
沈佳,女,硕士研究生,研究方向:藻类生化与分子生物学;E-mail:sj677501@163.com
孙雪,女,博士,副研究员,研究方向:藻类生化与分子生物学;E-mail:sunxue@nbu.edu.cn
