农杆菌介导的蓖麻转化体系优化
2015-10-24李伟翟羽佳李鹏程王昌禄
李伟 翟羽佳 李鹏程 王昌禄
(天津科技大学 食品营养与安全教育部重点实验室,天津 300457)
农杆菌介导的蓖麻转化体系优化
李伟 翟羽佳 李鹏程 王昌禄
(天津科技大学 食品营养与安全教育部重点实验室,天津300457)
针对影响农杆菌侵染效率的主要因素进行条件优化,确立了以OD600为0.8的菌液侵染、预培养5 d后的外植体为最佳侵染条件;侵染外植体经过5 d的共培养并除菌后,转到含有250 mg/L Kan的培养基中进行再生诱导,获得了多株具有Kan抗性的再生植株;通过在共培培养基中添加20 mg/L AS,124 mg/L Na2S2O3和152.4 mg/L DTT,有效地抑制了侵染后外植体的褐化现象,提高了筛选阶段抗性芽的成活率;对具有Kan抗性的再生植株进行PCR和Southern blot验证,共获得18株包含外源基因的阳性转化株。
蓖麻;农杆菌侵染;转化体系
蓖麻是世界十大油料作物之一,具有极高的经济价值和广泛的工业用途,是一种十分重要的工业油料作物。人们对蓖麻产业的重视直接导致蓖麻油需求量剧增,使得蓖麻原料供求关系极不平衡,而传统的育种方法又无法有效解决这一矛盾,于是越来越多的人开始将分子育种技术应用到蓖麻育种工作中[1]。
早期对蓖麻分子育种的研究主要包括蓖麻再生体系的构建,自1998年Sujatha Reddy[2]首次报道了更为稳定的再生体系后,以印度和美国为主的几家科研机构先后报道了以不同外植体配以不同的诱导条件构建的再生体系,我国也有很多针对国内蓖麻品种进行的体外再生研究,这些都为蓖麻实施分子育种奠定了良好的基础。但对蓖麻的转化体系研究还处于初级阶段,相关报道较少。2000年,Mckeon等[3]曾申请过蓖麻转化的相关专利,这是世界上首次成功实施蓖麻转化的报道,转化率0.42%;2005年,Sujatha等[4]在以胚轴为外植体,成功构建了以农杆菌介导的蓖麻转化体系,但转化率极低;2008年,Sailaja等[5]构建了以萌发后的胚为外植体的基因枪转化体系,转化效率可达1.4%,这也为蓖麻转化提供了新的思路;随后Sujatha等[6]分别利用农杆菌介导和基因枪的转化方法,均成功地将Cry1基因转入了蓖麻组织中,获得了带有目的基因的转化株,这也是第一例成功实施蓖麻分子育种的报道;我国的刘鹏等[7]也通过对蓖麻子叶节外植体实施农杆菌侵染,并成功获得了转化株。
尽管蓖麻分子育种研究取得了一定进展,但依然存在稳定性差、难以重复等问题。本研究拟在自主构建的胚尖外植体再生体系基础上,进行农杆菌介导的蓖麻转化研究,通过对侵染菌种、侵染时机、侵染强度等影响转化效率的关键因素进行优化,构建更为稳定的蓖麻转化体系,旨在为高效率进行蓖麻分子育种奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 实验用蓖麻品种稼祥2号,购于山东稼祥蓖麻有限公司。侵染农杆菌采用EHA105和GV3101两株植物转化常用根癌农杆菌,并以pBI121作为侵染质粒,实施农杆菌转化,制备工程菌种。农杆菌及质粒均由中国农业科学作物科学研究所抗逆室惠赠。
1.1.2 试剂 实验所用MS培养基购于Phytotech公司,6-苄基嘌呤(BA)、吲哚丁酸(IBA)、乙酰丁香酮(AS)、硫代硫酸钠、二硫基苏糖醇(DTT)、卡那霉素(Kan)、头孢霉素(Cef)等植物激素及其他生化制剂均购于天津蓝碧橙生物科技有限公司。
1.1.3 引物合成 试验根据pBI121中的nptII基因序列设计了检测引物,委托天津鼎国公司进行合成。引物序列:KanF:5'-TCGTCACCCTTTCTCGGTC-3';KanR:5'-CTGGCGGAGAATCATACGCA-3'。
1.2 方法
实验所用基本培养基为Murashige & Skoog(MS)培养基,配以30 g/L蔗糖和6.4 g/L琼脂粉,pH(5.8±0.1)。萌发培养基:MS +0.3 mg/L BA;预培养培养基:MS+0.2 mg/L BA;共培培养基:MS+0.35 mg/L BA+20 mg/L AS+ 124 mg/L Na2S2O3+152.4 mg/L DTT;恢复培养基:MS+ 0.35 mg/L BA+350 mg/L Cef,;筛选芽诱导培养基:MS+0.35 mg/L BA+0.25 mg/L IBA+350 mg/L Cef+250 mg/L Kan,pH(5.8±0.1);筛选根诱导培养基:1/2MS+0.5 mg/L IBA+350 mg/L Cef+250 mg/L Kan,pH(5.8±0.1)。以上培养基灭菌条件为:121℃,20 min.
植物组培培养条件为光照强度2 000 Lx,光照周期16/8,28℃培养。
1.2.1 外植体的获取 取完整饱满的蓖麻种子去壳;用0.1%的KMnO4浸泡10 min消毒;用无菌水反复冲洗3-4次;将灭菌的种子胚乳拨开,用镊子小心取出蓖麻胚,接种于萌发培养基中,28℃,暗培养5 d。
去除萌发胚顶端芽结构,取形态学上端3-5 mm的胚尖部位为外植体,接种于预培养培养基中,28℃,光照培养3-7 d。
1.2.2 侵染菌种的活化 挑取转入pBI121质粒的农杆菌EHA105和GV3101单菌落,分别接种于含有50 mg/L Kan和50 mg/L Rif的LB液体培养基中,28℃,200 r/min,黑暗培养过夜;取培养后的农杆菌液1-2 mL,重新接种于有50 mg/L Kan和50 mg/L Rif的LB液体培养基中,28℃,200 r/min,培养4-6 h,进行二次活化;将活化好的农杆菌菌液进行5 000 r/min离心,收集菌体,用无菌水稀释成特定浓度,备用。
1.2.3 侵染农杆菌的筛选及侵染强度的优化 将活化好的农杆菌用无菌水稀释成OD600值为0.6、0.8和1.0三个浓度的侵染液;将准备好的外植体用手术刀轻轻在形态学上端制造数到划痕,置于稀释好的侵染液中,黑暗条件下,28℃侵染15 min;将侵染后的外植体取出,转移到铺有灭菌滤纸的培养皿中,吸去多余的菌液,接种于铺有一张滤纸的共培培养基上,黑暗条件下,28℃进行共培培养3、5和7 d;共培后的外植体经多次冲洗除菌后,接种于筛选芽诱导培养基中培养21 d;通过统计筛选过程中诱导出的抗性外植体数目,确定最佳的侵染浓度及共培时间。根据侵染菌种、侵染浓度以及共培时间的不同设计实验批次,每组实验100个外植体,重复进行3次。
1.2.4 侵染时机的选择 分别选取在含有0.2 mg/L BA的预培养培养基中培养3、5和7 d后的外植体,以OD600值为0.6、0.8和1.0三个浓度EHA105菌液实施侵染,经共培5 d后,转入筛选培养基观察外植体生长情况。每组实验100个外植体,重复进行3次。
1.2.5 共培条件的优化 选取侵染后的外植体,分别接种于含有0、20、30和40 mg/L AS的共培培养基中培养,通过统计筛选过程中外植体的抗性芽数目,确认最佳AS浓度,同时对比添加124 mg/L Na2S2O3或152.4 mg/L DTT等还原剂对后期外植体生长状况的影响,确立最佳的共培阶段培养基配方。
1.2.6 植株再生 共培后的外植体,经除菌步骤后,转接到不含筛选剂的恢复培养基中,28℃,光照培养5 d;选取正常生长的外植体,转入到筛选芽诱导培养基中,进行芽诱导培养;待抗性芽伸长至3-5 cm时由基部切下,转入生根培养基中诱导生根;将正常生根的再生植株经炼苗后移入土壤中进行培养。
1.2.7 抗性再生植株的PCR验证 取抗性再生植株的新鲜叶片200 mg进行DNA提取。采用康维试剂生产的PlantGen DNA试剂盒。以抗性植株DNA为待测模板,以KanF、KanR为引物,进行PCR扩增,反应条件为:95℃预变性5 min;95℃变性30 s,56℃退火30 s,72℃延伸60 s,循环30次;72℃延伸10 min。PCR检测以pBI121质粒为阳性对照模板,以野生型蓖麻DNA为阴性对照模板。
1.2.8 Southern blot检测 为进一步验证抗性再生植株转化成功与否,对PCR检测呈阳性的转化植株进行了Southern blot检测。采用Roche公司生产的地高辛标记和检测试剂盒II。检测样品为待测植物DNA的BamH I和Hind III酶切产物;以pBI121中nptII基因片段合成探针标记;具体杂交步骤参照该试剂盒说明书进行。
2 结果
2.1 菌种的选择与侵染强度
使用两种农杆菌配制不同浓度的侵染菌液进行了侵染,结果如表1所示。从筛选培养21 d外植体的成活数目来看,两种根癌农杆菌的侵染效果相差不大,以EHA105效果较好。侵染菌液浓度对侵染效果有一定影响,以OD600为0.8侵染获得的抗性外植体数较多。相比之下,共培时间对筛选过程中转化效率影响较大,共培时间过长还会引起较为严重的外植体褐变现象,这说明共培时期是农杆菌进行侵染的主要阶段。实验数据显示,共培培养5 d时,抗性外植体的成活率最高。

表1 侵染步骤的优化实验
2.2 侵染时机的选择
实施转化过程中,首先需要将外源基因整合到植物细胞中表达,此外,还需要将带有外源基因的细胞培育成完整的植株。但由于转化针对的外植体是一个多细胞组织,其中真正具有发育成完整植株潜力的细胞毕竟只是少数,因此,需要对侵染时间进行研究,尽量选择胚性细胞开始或已经形成的阶段实施侵染,以此来提高侵染具有胚性细胞的可能性。试验选择预培养3-7 d后的外植体作为实验材料进行侵染试验,通过统计不同侵染时间对抗性芽生成数目的影响,确定最佳侵染时机。结果(表2)显示,经过一定时间的预培养后,外植体的成活率有所提高,外植体的褐化现象也得到一定的抑制,而侵染菌液浓度影响不大。抗性芽数目统计结果显示,预培养5 d后的外植体,在侵染后抗性芽的生成数目最多。原因可能是由于这个时间胚细胞的活跃程度与农杆菌的侵染效力最为匹配,使得通过侵染转入外源基因并且具有再生潜力细胞数目更多。预培养7 d后的外植体生成的抗性芽数目明显减少,这可能是由于错过了最佳侵染时机所致。最终实验选择预培养5 d后的外植体作为侵染外植体。

表2 预培养对转化效果的影响
2.3 共培培养基的优化
本实验在共培培养基中添加具有强还原作用的物质,以期缓解和抑制侵染后的褐化现象。通过统计共培后恢复培养过程中的褐化率和抗性外植体生长情况(表3),发现适量的AS确实能提高抗性芽的生成数目,同时添加Na2S2O3、DTT也能明显降低外植体褐化的几率。最后,选择在共培培养基中添加20 mg/L AS,124 mg/L Na2S2O3和152.4 mg/L DTT作为最佳共培条件。
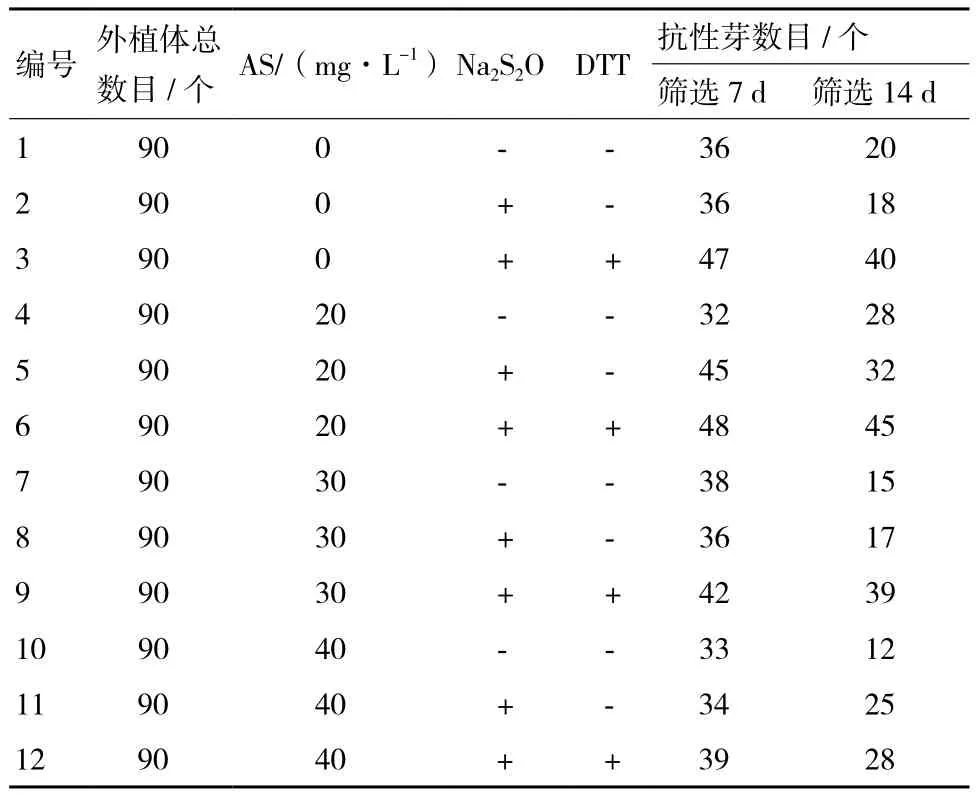
表3 共培培养基的优化结果
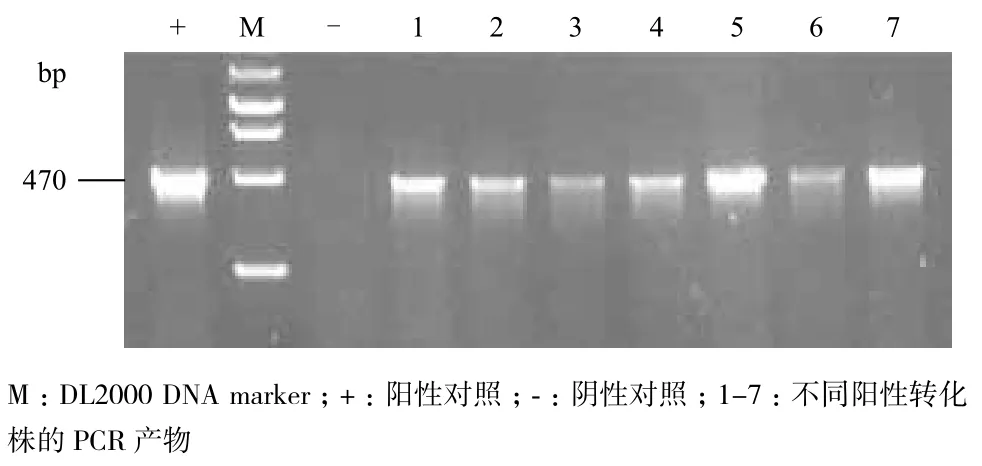
图1 抗性植株PCR检测电泳
2.4 抗性苗的PCR结果
通过Kan抗性筛选及再生诱导,实验最终获得了29株再生植株。对转化质粒中的nptII基因进行PCR检测,在18株再生植株中检测到了外源基因,确定成功整合转化质粒,为转化阳性株。部分转化株PCR检测电泳结果如图1所示。阳性对照及阴性对照显示正常,证明检测结果可靠。
2.5 Southern blot检测结果
将PCR检测呈阳性的转化株,提取其基因组DNA,进行Southern blot检测。分别提取待测植株叶片组织DNA经Hind III和BamH I消化酶切后,进行Southern blot检测实验,杂交结果如图2所示。不同的转化株,其外源基因插入的位点及拷贝数有一定的差异,但基本都具有外源基因的结合信号,证明转化载体pBI121已经成功的整合到了蓖麻基因组中,但各转化株中外源基因的拷贝数和插入位点可能有较大差异。
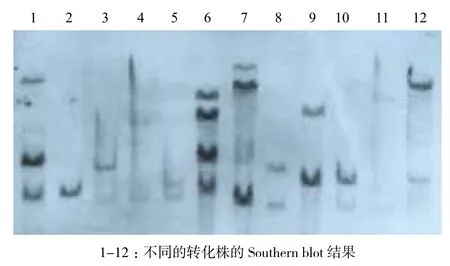
图2 Southern blot检测结果
2.6 农杆菌转化全过程
本实验转化主要步骤如图3所示,转化周期约为3-5个月,平均转化率为0.85%。

图3 胚尖外植体转化过程
3 讨论
农杆菌的侵染是指农杆菌通过感染植物创伤部位的细胞而改变其表达基因的过程,是对植物细胞造成损害的过程。侵染强度主要由侵染时间和侵染菌液浓度两个因素决定。侵染强度过大则可能会使本就造成创伤的细胞受到更大的损害,导致组织坏死;而侵染强度过小则可能会影响侵染效率。本研究在实验过程中发现,共培后的外植体即使发芽后也很容易出现组织褐变坏死的现象,严重影响转化植株的获得,这可能与侵染强度过大有关。因此,选择适宜的侵染强度对于防止组织在后续组培过程中坏死有重要意义,同时也是提高抗性芽诱导效率的重要因素。
除侵染强度之外,植物细胞的生长状态也是影响其被侵染后成活效率的因素之一。截取外植体的过程是对植物细胞进行物理伤害的过程,这些细胞在被侵染后相当于受到双重伤害,使其更容易产生严重的褐化反应[10]。将外植体先进行一段时间的预培养后再实施侵染,可缓解这些植物细胞因物理伤害对其正常生长的影响,不至于因连续受到损伤坏死。刚截取的外植体也需要一定时间的诱导才能开始形成具有胚性的细胞,这也可以最大限度的保证侵染后的细胞能够发育成完整的植株。最终实验选择预培养5 d后的外植体作为侵染对象,同时优化了共培培养基成分,提高了获得转化植株的效率。
目前,大多数农作物的转化体系都是由农杆菌介导,对于蓖麻的转化研究,目前成功获得转化植株的几篇报道也多是通过农杆菌侵染实现。农杆菌介导的植物转化法,效果稳定,应用广泛,但也存在一系列问题。由于基因转入步骤完全依靠农杆菌本身的侵染能力,很多因素无法控制,如插入位点的不确定性、转入基因的拷贝数不确定性等[11],本实验结果也出现了类似的情况。这说明在农杆菌侵染的过程中,还有很多值得继续探索的内容,如具体整合作用基因、插入位点影响因素等,这些工作虽然基础,但对于其更好的生产应用意义重大,值得科研工作者们进行深入探讨。
4 结论
本研究通过对影响农杆菌侵染效率的关键因素进行试验,进一步优化了农杆菌介导的蓖麻转化体系,确定了以最佳侵染条件为以OD600为0.8的菌液侵染经预培养5 d后的外植体;最佳共培时间为5 d;共培培养基中添加20 mg/L AS,124 mg/L Na2S2O3,和152.4 mg/L DTT可有效地提高转化效率并缓解外植体的褐化现象;经分子验证确认获得了18株阳性转化株,平均转化率为0.85%。
[1] 朱保葛, 李文彬. 蓖麻生物工程研究进展[J]. 中国生物工程杂志, 2007, 27(10):98-102.
[2] Sujatha M, Reddy TP. Differential cytokine in effects on the stimulation of in vitro shoot proliferation from meristematic explants of castor(Ricinus communis L. )[J]. Plant Cell Reports, 1998, 17(7):561-566.
[3]Mckeon TA, Chen GC. Tranformation of Ricinus communis, the castor plant:USA, 6620986[P]. 2003.
[4] Sujatha M, Sailaja M. Stable genetic transformation of casto(rRicinus communis L.)via Agrobacterium tumefaciens-mediated gene transfer using embryo axes from mature seeds[J]. Plant Cell Reports,2005, 23(12):803-810.
[5]Sailaja M, Tarakeswari M, Sujatha M. Stable genetic transformation of castor(Ricinus communis L. )via particle gun-mediated gene transfer using embryo axes from mature seeds[J]. Plant Cell Reports, 2008, 27(9):1509-1519.
[6] Sujatha M, Lakshminarayana M, Tarakeswari PK, et al. Expression of the cry1EC gene in castor(Ricinus communis L.)confers field resistance to tobacco caterpillar(Spodoptera litura Fabr.)and castor semilooper(Achoea janata L.)[J]. Plant Cell Reports,2009, 28(6):935-946.
[7] 刘鹏, 张立军, 张春兰, 等. 蓖麻子叶节遗传转化研究[J]. 华北农学报, 2012, 27(4):112-117.
[8] 邓艺, 曾炳山, 赵思东, 等. 乙酰丁香酮在农杆菌介导的遗传转化中的作用机制及应用[J]. 安徽农业科学, 2010, 38(5):2229 -2232.
[9]Bro R, Heimdal H. Enzymatic browning of vegetables. Calibration and analysis of variance by multiway methods[J]. Chemometrics Intelligent Laboratory Systems, 1996, 34(1):85-102.
[10] 张宏平, 姬爱国, 和林涛. 植物组培快繁褐化现象研究进展[J]. 农业工程, 2013, 3(5):128-132.
[11] Zhao Z, Gu W, Ceil T, et al. High throughput genetic transformation mediated by Agrobacterium tumefaciens in maize[J]. Molecular Breeding, 2002, 8(4):323-333.
(责任编辑 李楠)
Optimization of Agrobacterium-mediated Transformation in Castor(Ricinus communis L.)
Li Wei Zhai Yujia Li Pengcheng Wang Changlu
(Key Laboratory of Food Nutrition and Safety,Tianjin University of Science and Technology,Tianjin300457)
The main factors affecting the efficiency of Agrobacterium infection were optimized, and the optimal infection conditions were 5-day-old pre-cultured explants cultured in bacteria solution with OD6000. 8. Infected explants after 5 d of co-culture were transferred to medium with 250 mg/L Kan for bud induction and many strains with Kan resistance ability were obtained. By adding 20 mg/L AS, 124mg/L Na2S2O3and 152. 4 mg/L DTT in the common culture medium, browning phenomenon was effectively inhibited and survival rate of resistant shoots was enhanced. Regenerated plants with resistance to Kan were verified by PCR and Southern blot test. Total 18 positive transformants were obtained.
Castor(Ricinus comunis L.);Agrobacterium infection;transformation system
10.13560/j.cnki.biotech.bull.1985.2015.05.022
2014-09-23
李伟,男,博士,研究方向:植物分子育种;E-mail:skyinmyhear@126.com
王昌禄,男,教授,博士生导师,研究方向:食品生物技术;E-mail:clw123@tust.edu.cn
