烟草胞质6-磷酸葡萄糖酸脱氢酶基因的克隆及表达分析
2015-10-24林世锋付强余婧赵杰宏任学良王仁刚
林世锋 付强 余婧 赵杰宏 任学良 王仁刚
(贵州省烟草科学研究院 烟草行业分子遗传重点实验室,贵阳 550081)
烟草胞质6-磷酸葡萄糖酸脱氢酶基因的克隆及表达分析
林世锋 付强 余婧 赵杰宏 任学良 王仁刚
(贵州省烟草科学研究院烟草行业分子遗传重点实验室,贵阳550081)
采用电子克隆的方法,结合RT-PCR和SMART RACE技术,首次从烟草(Nicotiana tabacum)中克隆到1个胞质6-磷酸葡萄糖酸脱氢酶(6PGDH)基因的cDNA序列,命名为Nt6PGDH(GenBank登录号:KM211534)。该基因cDNA全长1 932 bp,开放阅读框1 455 bp,编码484个氨基酸,与番茄(Solanum lycopersicum)和马铃薯(Solanum tuberosum)的6PGDH氨基酸序列一致性最高,为95%。生物信息学分析表明,Nt6PGDH氨基酸序列不存在信号肽和转运肽,无跨膜结构域,定位于细胞质。对烟草不同发育时期Nt6PGDH基因的表达情况分析发现,Nt6PGDH基因在烟草旺长期根、茎、叶中的表达量均高于苗期,并且在同一发育时期,烟草根中表达量最强,茎次之,叶片最弱。
烟草;胞质6-磷酸葡萄糖酸脱氢酶;基因克隆;表达分析
戊糖磷酸途径(Pentose phosphate pathway,PPP)是植物体中糖代谢的重要途径,其主要生理功能是产生供还原性生物合成需要的NADPH以及可供核酸代谢的磷酸戊糖[1-4],一些中间产物则可参与氨基酸和脂肪酸合成等[5,6]。已有研究表明,磷酸戊糖途径与植物的生长发育、各类环境胁迫密切相关[6-12]。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH)和6-磷酸葡萄糖脱氢酶(6-phosphaogluconate dehydrogenase,6PGDH)是磷酸戊糖途径的两个关键酶,广泛分布于高等植物的胞质和质体中[6]。由于G6PDH和6PGDH是PPP的限速酶而受到人们更多的研究,人们也常常通过对这两个酶的研究来研究磷酸戊糖途径。据报道烟草叶片受到马铃薯Y病毒侵染时,植物体内G6PDH与6PGDH的活性显著增强,而且质体中的G6PDH与6PGDH酶活性的增幅远大于胞质中两个酶活性的增强,研究者认为G6PDH活性的增强可能受到某种粗调节机制的调节[13]。目前,研究者已从烟草中克隆到G6PDH基因的全长cDNA序列[14],并进行了相应的功能研究[15],但对烟草中6PGDH cDNA序列的克隆与分析还未见报道。为此,本研究利用生物信息学方法,结合RT-PCR和SMART RACE技术,对编码烟草6PGDH的cDNA全序列进行克隆;并运用实时荧光定量PCR技术,对其在烟草组织中的表达情况进行研究,以期为烟草6PGDH基因功能的深入研究奠定基础。
1 材料与方法
1.1 材料
分别采集烟草栽培品种K326(Nicotiana tabacum L. K326)生根期幼苗的根、茎、叶和芽组织,液氮迅速冷冻,于-80℃保存备用。
1.2 方法
1.2.1 RNA的提取与cDNA第一链的合成 所有植物材料RNA采用Trizol Reagent(Invitrogen公司)法提取总RNA,并参照TaKaRa公司反转录试剂盒说明书合成cDNA第一链。
1.2.2 Nt6PGDH全长cDNA的克隆 以黄瓜6PGDH全长cDNA序列(登录号:FJ610345)为信息探针,在NCBI烟草EST数据库中进行BLAST检索,将检索到的来自烟草品种K326的全部EST序列利用DNAMAN6.0软件进行拼接,获得1个重叠群(Contig)。根据获得的重叠群设计合成1对PCR 引物P-iF和P-iR,见表1。以烟草品种K326 cDNA为模板,进行PCR扩增,验证拼接结果。

表1 引物序列及预期片段大小
根据验证得到的基因片段设计基因3'RACE嵌套引物和5'RACE嵌套引物,使用SMARTTMRACE cDNA Amplification Kit(TaKaRa公司),按照说明书进行操作,RACE扩增后分别获得基因的3'端序列和5'端序列。利用DNAMAN软件组装以上序列,获得全长cDNA序列信息,设计合成1对基因全长引物P-F和P-R,以合成的烟草品种K326 cDNA第一链为模板,进行PCR扩增,获得烟草6PGDH的全长cDNA序列。
1.2.3 Nt6PGDH基因的生物信息学分析 应用ORF Finder(http://www. ncb.i nlm. nih.gov/gorf/gor.f html)程序确定正确的开放阅读框(ORF);通过NCBI 上的 BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行序列相似性检索;利用 ExPASy(http://web. expasy.org/compute_pi/)预测蛋白的分子质量计算值和理论等电点;利用Smart(http://smart.emblheidelberg.de/)分析蛋白质结构域;信号肽、转运肽和跨膜结构域分析分别由SignalP 4.1、TargetP 1.1和TMHMM Server v.2.0在线程序(http://www.cbs. dtu.dk/services/)进行预测;亚细胞定位采用PSORT II Prediction(http://psort.hgc.jp/form.html)进行分析;用ClustalX 2.0和MEGA4.0软件-邻位相连法(Neighbor-Joining)构建系统进化树。
1.2.4 Nt6PGDH的DNA序列克隆 采用CTAB法从新鲜幼嫩的烟草叶片中提取基因组DNA。利用基因全长引物进行扩增、克隆和测序。
1.2.5 实时荧光定量PCR 根据Nt6PGDH的cDNA序列设计特异引物P-rF和P-rR。选用烟草Actin基因(NTU60495)为内参基因,并设计引物Actin-rF和Actin-rR。利用Taqman探针试剂盒(TaKaRa公司)在ABI Stepone Plus实时荧光定量PCR仪上进行RT-qPCR实验,分析Nt6PGDH在烟草不同组织中的相对表达情况。
2 结果
2.1 Nt6PGDH基因的克隆
以烟草品种K326 cDNA为模板,用P-iF和P-iR为引物,进行烟草6PGDH基因中间片段的PCR扩增和克隆测序(图1)。由此设计合成RACE引物进行扩增,获得该基因的3'端和5'端。通过测序拼接,获得该基因的全长序列信息。经ORF搜索以及其他植物来源6PGDH基因比对分析,确定该基因具有完整的ORF。根据全长基因拼接序列设计引物,用RT-PCR方法,获得全长cDNA序列,将其命名为Nt6PGDH,GenBank登录号为KM211534(图2);同时以烟草基因组DNA为模板扩增获得与RT-PCR扩增相同大小的序列,说明该基因内部无内含子。
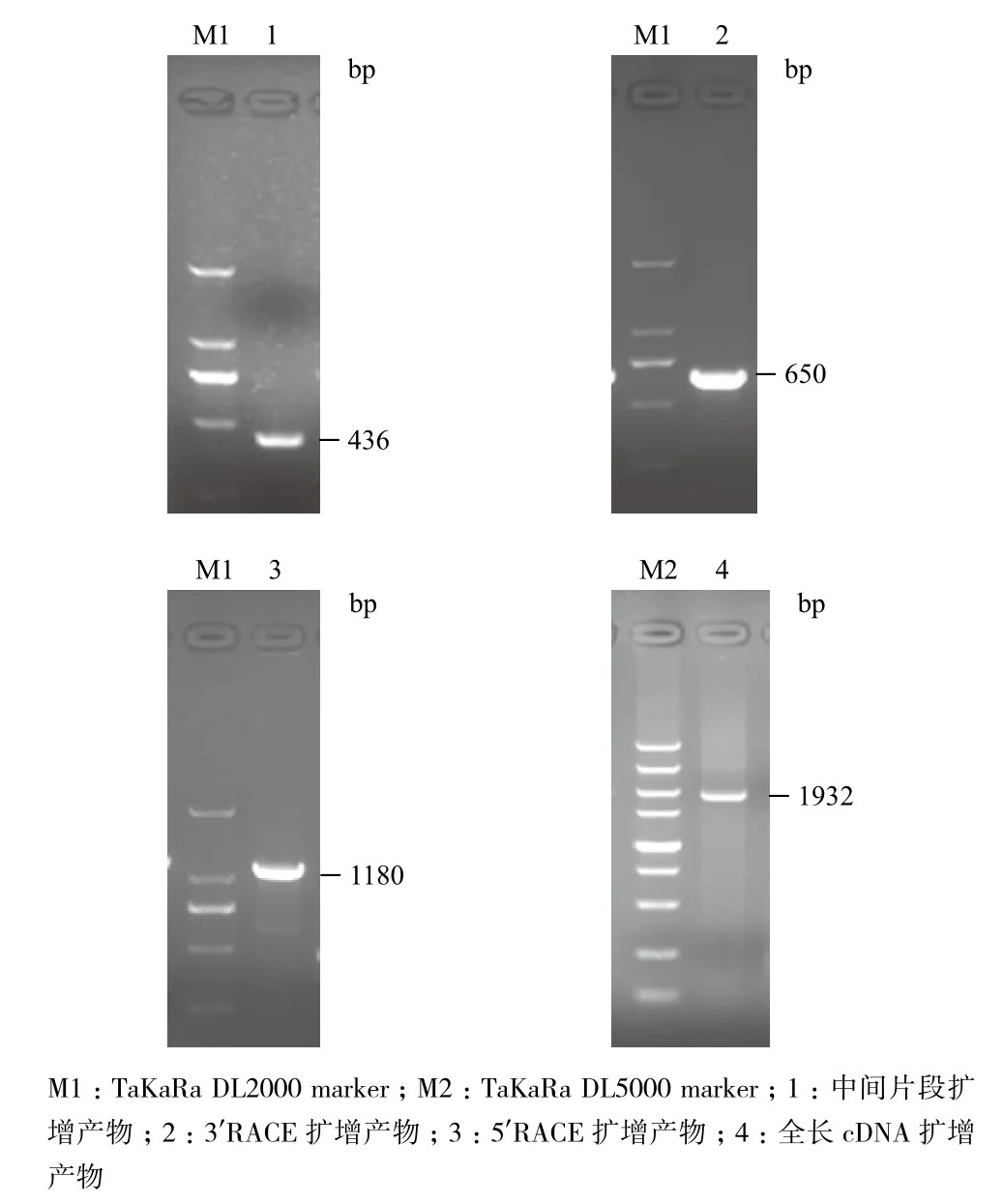
图1 烟草Nt6PGDH基因的PCR扩增结果
2.2 Nt6PGDH基因的序列分析
Nt6PGDH基因cDNA全长1 932 bp(不包括polyA尾上31个连续的碱基A),由174 bp的5'端非翻译区(5'-UTR)、1 455 bp编码区和303 bp的3'端非翻译区(3'-UTR)组成(图2)。该序列可编码484个氨基酸的蛋白质,预测蛋白分子质量约为53.30 kD,等电点为5.70。SMART分析表明,该蛋白质4-178氨基酸位形成6PGDH的NADP结合结 构 域(NAD binding domain of 6-phosphogluconate dehydrogenase),其中氨基酸序列GMGVSGGEEG符合高度保守的NADP结合位点序列GXGXXGXXXG(图2);182-476氨基酸位为6PGDH的C-末端结构 域(6-phosphogluconate dehydrogenase,C-terminal domain),其中氨基酸序列VLDKTGMKGTGKW与已知的细菌、哺乳动物的6PGDH高度保守的底物结合位点序列V/I/L/M-X-D-X-X-G/A-N/Q/S-K-G-T-G-X-W相符,只是第263位氨基酸M替代了N,这一变化在植物界普遍发生。
2.3 信号肽、跨膜区及亚细胞定位预测分析
利用SignalP 4.1 Server预测Nt6PGDH蛋白不具有信号肽。利用TargetP 1.1 Server预测,结果显示叶绿体转运肽(chloroplast transit peptide,cTP)为 0.023、线粒体信号肽(mitochondrial targeting peptide,mTP)为0.189、分泌通路信号肽(secretory pathway signal peptide,SP)为0.449、其他为0.286。利用TMHMM Server v.2.0预测跨膜区,结果(图3)显示Nt6PGDH蛋白没有跨膜区域。在线工具PSORT II Prediction预测该蛋白的亚细胞定位情况,结果显示Nt6PGDH蛋白定位于细胞质中的概率达52.2%,k值达到23。因此,Nt6PGDH蛋白最可能定位于细胞质中。

图2 烟草Nt6PGDH基因的核苷酸序列及其编码的氨基酸

图3 预测的Nt6PGDH蛋白的跨膜区
2.4 烟草与其他植物的6PGDH蛋白的同源性比较经氨基酸序列同源检索,发现Nt6PGDH与已知其他高等植物胞质6PGDH氨基酸序列一致性为76%-95%,其中与番茄(XP_004237068)和马铃薯(XP_006363551)基因一致性最高为95%。进一步利用ClustalX 2.0软件进行多重序列比对,并采用MEGA 4.1软件构建系统进化树。结果(图4)显示,6PGDH蛋白是一个比较古老的蛋白,在单子叶植物和双子叶植物分化之前已经出现,并在单子叶植物与双子叶植物形成过程中发生了分化。此外,6PGDH蛋白在番茄、马铃薯、黄瓜等植物中均以多种形式存在,其中菠菜质体6PGDH(AF295670)在进化树中并未形成一个独立的分支,而与黄瓜、番茄、马铃薯等胞质6PGDH聚在一起,这支持胞质和质体6PGDH并非独立起源的观点。

图4 植物胞质6PGDH的系统进化树
2.5 Nt6PGDH基因的时空表达模式分析
采用荧光定量RT-PCR法,对Nt6PGDH基因在烟草不同发育时期的根、茎、叶中的表达进行相对定量分析。图5显示,Nt6PGDH在苗期和旺长期的各组织中均有表达,以根的表达量为最高,旺长期各组织的表达量均比苗期相同组织的表达量高。

图5 Nt6PGDH基因的时空表达特性
3 讨论
本研究首次报道了烟草Nt6PGDH基因的克隆。通过氨基酸序列同源检索,结果显示烟草Nt6PGDH与已知其他高等植物6PGDH一致性都在76%以上;系统进化树分析结果表明,烟草Nt6PGDH最先与番茄、马铃薯等茄科植物6PGDH聚类,其次与大豆、黄瓜等物种6PGDH聚类合并;用SMART软件分析Nt6PGDH具有典型的6PGDH特征:含有一个NADP结合结构域和一个C-末端结构域。上述分析结果都表明Nt6PGDH为烟草6PGDH基因。植物中6PGDH存在两种形式,一种为存在于胞质中的胞质6PGDH(cytosolic 6PGDH);另一种为存在于质体基质中的质体6PGDH(plastidic 6PGDH),其中后者氨基酸的N端显著长于前者,编码一个转运肽(transit peptide)序列[6,7]。本研究克隆的Nt6PGDH编码的氨基酸序列与菠菜胞质6PGDH(AAK51690)、菠菜质体6PGDH(AF295670)的氨基酸一致性分别为90%和77%(资料未列出),而且与其他物种的胞质6PGDH相类似氨基酸N端都缺少一段长度约为40 aa的转运肽[16,17],因此推测本研究克隆的Nt6PGDH编码的6PGDH为胞质6PGDH。
戊糖磷酸途径是植物中重要的代谢途径,在植物的生长发育中起着非常重要的作用,不仅为生物合成提供还原力NADPH,为核酸的合成提供五碳糖,还涉及到多种环境胁迫引起的植物应答反应,其中6PGDH的活性或基因表达水平与各种逆境胁迫以及淀粉的生物合成等过程有关[7-12]。Fahrendorf等[18]在苜蓿中比较了胞质6PGDH基因在各个组织中的表达,结果发现根中的表达量要高于叶,而且胞质6PGDH在叶中的表达几乎无法检测。在大豆根瘤中,存在高活性的6PGDH可能与嘧啶的合成、酰脲的产生和氮的固定有关[19,20]。因此,胞质6PGDH在根中的大量转录表达可能与氮的吸收利用有关。经表达谱分析发现,本实验克隆的Nt6PGDH在旺长期根、茎、叶的表达量均比苗期相同组织的表达量高,其中在旺长期的根中表达量最高,这可能是因为旺长期牵涉到大量的细胞分裂与生物合成,而戊糖磷酸途径正为生物合成提供必要的还原力NADPH和供DNA/RNA合成所必须的五碳糖;而根中的表达高于叶,也进一步验证本研究克隆的Nt6PGDH编码胞质6PGDH。
4 结论
从烟草中克隆到一个胞质6-磷酸葡萄糖酸脱氢酶基因,命名为Nt6PGDH,基因登录号为KM211534。基因全长1 932 bp,开放阅读框为1 455 bp,编码484个氨基酸。Nt6PGDH氨基酸序列不存在信号肽和转运肽,无跨膜结构域,定位于细胞质。Nt6PGDH基因在烟草苗期和旺长期的根、茎、叶中均有表达,其中在旺长期各组织中的表达量均高于苗期,并且在同一发育时期,烟草根中表达量最强,茎次之,叶片最弱。
[1] Wood T. Distribution of the pentose phosphate pathway in living organisms[J]. Cell Biochemistry and Function, 1986, 4(4):235-240.
[2] Esposito S, Massaro G, Vona V, et al. Glutamate synthesis in barley roots:the role of the plastidial glucose-6-phosphate dehydrogenase[J]. Planta, 2003, 216(4):639-647.
[3] Hutchings D, Rawsthorne S, Emes MJ. Fatty acid synthesis and the oxidative pentose phosphate pathway in developing embryos of oilseed rape(Brassica napus L. )[J]. Journal of Experimental Botany, 2005, 56(412):577-585.
[4] Baillet A1,Xu R,Grichine A, et al. Coupling of 6-phosphogluconate dehydrogenase with NADPH oxidase in neutrophils:Nox2 activity regulation by NADPH availability[J]. The FASEB Journal, 2011,25(7):2333-2343.
[5] Neuhaus HE, Emes MJ. Nonphotosynthetic metabolism in plastids[J].Annual Review of Plant Physiology and Plant Molecular Biology, 2000,51:111-140.
[6] 黄冀, 王建飞, 张红生. 植物戊糖磷酸途径及其两个关键酶的研究进展[J]. 植物学通报, 2004, 21(2):139-145.
[7] Spielbauer G, Li L, Römisch-Margl L, et al. Chloroplast-localized 6-phosphogluconate dehydrogenase is critical for maize endosperm starch accumulation[J]. Journal of Experimental Botany, 2013, 64(8):2231-2242.
[8] van Assche F, Cardinaels C, Clijsters H. Induction of enzyme capacity in plants as a results of heave metal toxicity:doseresponse relation in Phaseolus vulgaris L. treated with zinc and cadmium[J]. Environ Pollut, 1988, 52(2):103-115.
[9] Slaski JJ, Zhang G, Basu U, et al. Aluminum resistance in wheat(Triticum aestivum)is associated with rapid, Al-induced changes in activities of glucose-6-phosphate dehydrogenase and 6-phosphogluconate dehydrogenase in root apices[J]. Physiologia Plantarum, 1996, 98(3):477-484.
[10] Huang J,Zhang H,Wang J, et al. Molecular cloning and characterization of rice 6-phosphogluconate dehydrogenase gene that is up-regulated by salt stress[J]. Molecular Biology Reports,2003, 30(4):223-227.
[11] Hou F, Huang J, Yu S,et al. The 6-phosphogluconate dehydrogenase genes are responsive to abiotic stresses in rice[J]. Journal of Integrative Plant Biology,2007,49(5):655-663.
[12] 魏跃, 陈啸寅, 李振陆, 等. 黄瓜6-磷酸葡萄糖酸脱氢酶基因cDNA片段的克隆及表达分析[J]. 南京农业大学学报,2010, 33(1):37-42.
[13] Sindelar L, Sindelarova M, Burketova L. Changes in activity of glucose-6-phosphate and 6-phosphogluconate dehydrogenase isozymes upon potato virus Y infection in tobacco leaf tissues and protoplasts[J]. Plant Physiology and Biochemistry, 1999, 37(3) :195-201.
[14] Knight JS, Emes MJ, Debnam PM. Isolation and characterisationof a full-length genomic clone encoding a plastidic glucose-6-phosphate dehydrogenase from Nicotiana tabacum[J]. Planta,2001, 212(4):499-507.
[15] Debnam PM, Fernie AR, Leisse A, et al. Altered activity of the P2 isoform of plastidic glucose 6-phosphate dehydrogenase in tobacco(Nicotiana tabacum cv. samsun)causes changes in carbohydrate metabolism and response to oxidative stress in leaves[J]. The Plant Journal, 2004, 38(1):49-59.
[16] 黄骥, 王建飞, 张红生, 等. 水稻葡萄糖-6-磷酸脱氢酶cDNA的电子克隆[J]. 遗传学报, 2002, 29(11):1012-1016.
[17] 魏跃, 王永平, 李为观, 等. 黄瓜胞质6-磷酸葡萄糖酸脱氢酶基因克隆及序列分析[J]. 西北植物学报, 2009, 29(10):1954-1961.
[18] Fahrendorf T, Ni W, Shorrosh BS, et al. Stress responses in alfalfa(Medicago sativa L. )XIX. Transcriptional activation of oxidative pentose phosphate pathway genes at the onset of the isoflavonoid phytoalexin response[J]. Plant Molecular Biology, 1995, 28(5):885-900.
[19] Hong ZQ, Copeland L. Isoenzymes of 6-phosphogluconate dehydrogenase from the host fraction of soybean nodules[J]. Journal of Plant Physiology, 1992, 139:313-319.
[20] Kohl DH, Lin JJ, Shearer G, et al. Activities of the pentose phosphate pathway and enzymes of proline metabolism in legume root nodules[J]. Plant Physiology, 1990, 94(3):1258-1264.
(责任编辑 李楠)
Cloning and Expression Analysis of Cytosolic 6-phosphogluconate Dehydrogenase Gene in Tobacco(Nicotiana tabacum)
Lin Shifeng Fu Qiang Yu Jing Zhao Jiehong Ren Xueliang Wang Rengang
(Key Laboratory of Molecular Genetics,CNTC,Guizhou Academy of Tobacco Science,Guiyang550081)
A cDNA sequence of cytosolic 6-phosphogluconate dehydrogenase(6PGDH)gene was cloned from Nicotiana tabacum by in silico cloning combined with RT-PCR and SMART RACE technologies, and designated as Nt6PGDH(Accession number KM211534). The full length of its cDNA sequence is 1 932 bp, with a 1 455 bp open reading frame, and the gene encoded a protein of 484 amino acids with the sequence of highest identity, 95% as 6PGDH from Solanum lycopersicum and Solanum tuberosum. Bioinformatics analysis indicated that Nt6PGDH had no signal peptide, no transit peptide and notrans-membrane domain, and it was located in cytoplasm. Gene expression analysis showed that the expression levels of Nt6PGDH in roots, stems and leaves were higher at fast-growirg stage than at seedling stage. Moreover, at the same developmental stage, the highest level of Nt6PGDH expression were in the roots, then in the stems, the lowest in the leaves.
Nicotiana tabacum;cytosolic glucose-6-phosphate dehydrogenase;gene cloning;expression analysis
10.13560/j.cnki.biotech.bull.1985.2015.05.018
2014-09-12
中国烟草总公司重点项目(110201302004),贵州省优秀青年科技人才培养对象专项资金(黔科合人字[2013]02 号),贵州省科学技术基金项目(黔科合J字[2012]2256号)
林世锋,男,博士,副研究员,研究方向:烟草遗传育种与分子生物学;E-mail:linshifeng1978@163.com
王仁刚,男,硕士,副研究员,研究方向:烟草遗传育种与分子生物学;E-mail:rengangwang@126.com
