沙冬青脯氨酸转运体基因的克隆及表达分析
2015-10-24岳光振金曼李俊林杨顺瑛郭满园苏彦华
岳光振 金曼 李俊林 杨顺瑛 郭满园 苏彦华
(中国科学院南京土壤研究所 土壤与农业可持续发展国家重点实验室,南京 210008)
沙冬青脯氨酸转运体基因的克隆及表达分析
岳光振 金曼 李俊林 杨顺瑛 郭满园 苏彦华
(中国科学院南京土壤研究所 土壤与农业可持续发展国家重点实验室,南京210008)
通过RACE技术从沙冬青中克隆获得了脯氨酸转运体基因AmProT(GenBank登录号为KJ873133)。序列分析表明,AmProT基因开放阅读框为1 329 bp,编码442个氨基酸,预测蛋白质分子量为48.07 kD,等电点为9.32,含有11个跨膜区域,具有典型的脯氨酸转运蛋白的特征。进化分析显示,AmProT与大豆ProT的相似性达到86%。荧光定量PCR分析表明,AmProT在地上部的表达量要显著高于地下部,在受到干旱、高盐、脱落酸胁迫后表达量呈上调趋势,推测AmProT可能在沙冬青响应干旱、盐等非生物胁迫过程中发挥作用。
沙冬青;脯氨酸转运体基因;基因克隆;表达分析
常绿阔叶灌木蒙古沙冬青(Ammopiptanthus mongolicus),作为古老的第三季残遗物种[1],主要分布在我国的内蒙古、宁夏、甘肃等省区[2,3],其适应性很强,不仅抗寒而且耐旱,在年降水量低于240 mm、蒸发量2 000-3 000 mm、极端低温-24.8℃、极端高温37.7℃的恶劣环境下,仍能正常生长[4]。鉴于在这种极端胁迫条件下的生存能力,使得沙冬青成为一种研究荒漠植物抗逆性的理想材料。
在植物生长受到的诸多环境胁迫中,渗透胁迫是其中最为严重的制约因素之一[5,6]。植物适应渗透胁迫是一种复杂的生理现象。植物通过体内积累可溶性渗透物质,保证正常的细胞结构,以应对渗透胁迫[7]。在这些可溶性物质中,脯氨酸是分布最广的渗透剂[8]。在受到渗透胁迫时,脯氨酸作为一个渗透调节剂持续在植物体内积累[9],使细胞保持适当的渗透势,稳定并保护生物大分子结构以及功能[10]。
脯氨酸在植物体内不是均一存在的,在一些不含叶绿体的组织中,脯氨酸的积累主要靠外源脯氨酸的转运[11]。自从1996年Rentsch等[12]利用酵母SHR缺陷突变体与拟南芥cDNA文库克隆出第一个编码脯氨酸转运蛋白的基因(ProT2)以来,已经有水稻(Oryza sativa)[13]、拟南芥(Arabidopsis thaliana)、榆钱菠菜(Atriplex hortensis)[14]、大麦(Hordeum vulgare)[15]等的ProT基因被成功克隆。研究发现,脯氨酸转运体基因的表达具有物种差异性。Udea等[16]发现,大麦HvProt基因主要在根部表达,在受到盐胁迫的情况下表达更为强烈;Igarashi[13]和Silke等[17]发现水稻的OsProT基因和拟南芥AtProT3基因主要在植株地上部表达。
目前,关于沙冬青基因克隆与遗传表达方面的研究,Wei等[18]发现AmNHX2基因在转基因拟南芥受到干旱和盐胁迫时表达量增加;Liu等[19]克隆获得AmLEA,异位表达发现该基因提高了大肠杆菌对冷和热的适应能力;Song等[20]发现AmGS提高了转基因石楠树的御寒能力。另外,Zhou[21]、Pang[22]和Wu[23]等分别对沙冬青进行了转录组测序,分析研究了沙冬青在干旱和冷胁迫下部分基因的表达状况。
脯氨酸在沙冬青适应胁迫过程中发挥着重要作用[24,25],目前还没有关于沙冬青脯氨酸转运体基因克隆与表达方面的报道。本研究通过RACE技术,克隆了沙冬青脯氨酸转运基因,命名为AmProT(登录号KJ873133),利用生物信息学方法对其核苷酸序列以及编码的氨基酸序列进行分析,并通过实时荧光定量PCR技术对该基因的组织表达模式以及胁迫调控表达模式进行分析,旨为进一步研究其在抗逆过程中的生物学功能提供理论依据。
1 材料与方法
1.1 材料
蒙古沙冬青(Ammopiptanthus mongolicus)种子由甘肃民勤沙生植物园提供。
1.1.1 沙冬青育苗 挑取大小一致、籽粒饱满的沙冬青种子,洗净后用70%的乙醇浸泡30 s,用无菌水清洗4-5次,清水浸泡24 h,种子吸胀。然后转移到铺有双层吸水纸的灭菌培养皿中,向培养皿中加适量蒸馏水,置于25℃的暗光培养箱中进行催芽。3 d之后,将长势一致的发芽沙冬青转移到有孔的,内径为17.5 cm×9 cm×3.5 cm的长方体塑料盒中,每盒定植72棵沙冬青,用改良的pH5.8的1/2Hoagland[大量元素Ca(NO3)2·4H2O,945 mg/L;NaNO3,425 mg/L;NH4NO3,80 mg/L;NaH2PO4,121 mg/L;MgSO4·7H2O,493 mg/L;微量元素H3BO3,2.86 mg/L;MnSO4·4H2O,1.61 mg/L;CuSO4·7H2O,0.07 mg/L;ZnSO4·7H2O,0.22 mg/L;Na2MnO4·2H2O,0.12 mg/L;铁盐FeSO4·7H2O,5.57 g/L;Na2EDTA·2H2O,7.45 g/L]营养液培养,每2 d更换一次新营养液。
1.1.2 处理及取样 培养3周之后,选取生长一致的四叶一心期沙冬青幼苗进行3种胁迫处理:18%(W/V)的PEG-6000(-0.4 MPa),100 mmol/L的Na-Cl,100 μmol/L的脱落酸(ABA)。样品在处理1、3、6、12、24、48 h时,分别从地上部和地下部取样,对照为处理0 h的样品。上述样品均用液氮速冻,存于-80℃冰箱保存备用。
1.2 方法
1.2.1 总RNA的提取及cDNA第一链的合成 称取0.1 g沙冬青样品,用RNAiso Plus植物RNA提取试剂盒(Invitrogen公司)提取总RNA。取RNA 2 μg,根据Primescript 1st Strand cDNA Synthesis Kit(Invirtrogen)试剂盒的说明,以Oligo-dT为引物通过RT-PCR逆转录制备cDNA第一链。用于cDNA全长的克隆和定量分析。
1.2.2 全长cDNA序列克隆 用DNAMAN软件比对NCBI上登录的豇豆(Vigna unguiculata)(AB3775-28)、拟南芥(Arabidopsis thaliana)(NM_129215)、番茄(Solanum lycopersicum)(NM_001247065)和苜蓿(Medicago truncatula)(XM_003616498)等植物的ProT基因序列。设计保守区引物P1(5'-YAVYGCGATTCATGGTTTC-A-3')/P2(5'-AATYAYAMRTCHGCAAAAACA-3');根据保守区片段测序结果设计引物P3(5'-CCATTTTTCCTGATTATCTTT-3')/P4(5'-TGGCACTGGTTC-AACATTGGTTT-3')用于3'-RACE克隆,P5(5'-ATGATGTAGCCAGTATTTATC-3')/P6(5'-TGTTGACT-CCGGTAGTGAGG-3')用于5'-RACE克隆,根据保守区,3'-RACE和5'-RACE三段cDNA序列的拼接结果,设计引物P5/P6于用基因全长扩增。3'-RACE和5'-RACE反 应 按SMARTTMRACE cDNA Amplification Kit User Manual(Clontech)试剂盒说明书进行。各轮PCR产物均用胶回收试剂盒纯化后与pMD19-T克隆载体连接,转化JM109感受态细胞,挑取阳性菌落,PCR鉴定后由华大公司测序。
1.2.3 生物信息学分析 通过DNAMAN6.0将沙冬青ProT基因cDNA全长序列翻译成氨基酸序列;利用ProtParam分析其编码蛋白质的基本理化性质;通过NCBI中的Conserved Domains分析其功能结构域;用SignalP4.1软件预测信号肽;用TMpred软件预测可能存在的跨膜区;利用Psort预测亚细胞定位;利用Sopma进行蛋白质二级结构分析。
利用NCBI的Blast程序进行AmProT基因编码氨基酸序列的一致性对比,采用Mega5.0软件构建其系统发育进化树。
1.2.4 实时荧光定量PCR分析 以培养3周之后的沙冬青为材料,18%(W/V)的PEG-6000,100 mmol/L NaCl,100 μmol/L脱落酸(ABA),处理0、1、6、12、24、48 h后,称取0.1 g样品,参照植物RNA提取试剂盒说明书提取样品总RNA。
根据获得的cDNA序列,设计引物AmProTBD-S1(5'-ACGATTAGGCAGCCAGTTGT-3')和Am-ProT-BD-F1(5'-GAAGGAGAGCCGCCA-CAAAT-3'),选定看家基因β-actin为内参基因[Ac-tin F(5'-CTGACATGCGCCGTAGGAACG),Actin R(5'-CCCTGCTTATGCCAGTCTTTT)]。根据SYBR®Select Master Mix(Applied Biosystems by Life Technologies 公司)试剂盒说明书,于Bio-Rad CFX-96仪器上进行qRTPCR。反应体系为SYBR®Select Master Mix 10 μL、正反引物各0.4 μL、cDNA 2.5 μL、ddH2O 6.7 μL。反应条件为:95℃预变性30 s;95℃变性10 s,60℃退火10 s,72℃延伸15 s,44个循环。每个取样点设3次技术重复,试验共设3次生物学重复。
2 结果
2.1 AmProT基因的克隆与序列分析
利用简并引物P1/P2扩增获得片段长度为1 236 bp。3'-RACE和5'-RACE分别获得的片段长度为311 bp和206 bp(图1)。将保守区,3'-RACE和5'-RACE三段cDNA序列进行拼接,根据拼接序列进行PCR扩增,测序结果与拼接结果完全一致。AmProT基因全长1 587 bp(GenBank登录号KJ873133),其中5'端非翻译区(5'UTR)长61 bp,3'端非翻译区(3'UTR)长197 bp,ORF长1 329 bp,编码442个氨基酸(图2)。

图1 AmProT基因的PCR扩增电泳
2.2 AmProT基因的生物信息学分析
通过ProtParam预测该基因编码的蛋白分子式为C2253H3459N543O592S14,分子量为48.07 kD,等电点为9.32,属于碱性蛋白质。负电荷氨基酸(Asp+Glu)20个;正电荷氨基酸(Arg+Lys)30个,不稳定系数为26.38,属于稳定型蛋白(<40蛋白稳定),脂肪系数为110.77,平均亲水性(GRAVY)0.617,预测该蛋白质为疏水性蛋白。利用NCBI的Conserved Domains分析发现,AmProT蛋白与已知蛋白质结构功能数据库中其他物种ProT具有相似的结构功能域。运用SignalP4.1程序对ProT编码的蛋白序列进行N端信号肽预测,结果发现无信号肽结构。通过TMHMM2.0预测可知,AmProT编码的蛋白含有11个跨膜区域(图3)。PSORT Prediction软件预测该蛋白质定位于细胞质膜的可信度为0.6,定位于高尔基体的可信度为0.4,定位于叶绿体类囊体膜的可信度为0.394,定位于内质网的可信度为0.3,因此认为该蛋白最可能定位于细胞质膜。

图2 AmProT基因编码的核苷酸及氨基酸序列

图3 AmProT蛋白的跨膜结构与分析
利用在线Sopma预测AmProT蛋白的二级结构,结果(图4)表明,该蛋白由α-螺旋、延伸直链、无规则卷曲3种形式组成,其中α-螺旋包含218个氨基酸,占49.32%;延伸直链包含86个氨基酸,占19.46%;无规则卷曲包含138个氨基酸,占31.22%。
2.3 AmProT基因编码蛋白系统的进化分析
利用NCBI的Blast进行AmProT基因编码氨基酸序列的一致性比对,分析结果表明,其编码的氨基酸序列与已克隆的其他植物基因编码的氨基酸序列均有不同程度的相似性,与大豆基因相似性最高,为86%;与菜豆、豇豆、蒺藜苜蓿、桃、葡萄、拟南芥和番茄的相似性分别为83%、83%、83%、77%、75%、73%和72%。利用MEGA5.0构建沙冬青ProT系统进化树。由图5可见,沙冬青ProT蛋白与大豆(Glycine max)、菜豆(Phaseolus vulgaris)、豇豆(Vigna unguiculata)在同一个小分支上,同源性最高。
2.4 AmProT基因在不同胁迫下的表达分析
2.4.1 AmProT基因的组织特异性表达分析 分别提取沙冬青地上部和地下部的总RNA,采用荧光定量PCR方法检测ProT基因在这两部分中的表达丰度,以看家基因β-actin为内参基因。图6显示,AmProT基因在地上部和地下部中都有表达,在地上部的表达量要显著高于地下部。
2.4.2 AmProT基因的胁迫诱导表达分析 分别用干旱、盐、脱落酸处理沙冬青幼苗,利用荧光定量PCR分析AmProT基因的表达模式。分析结果(图7)表明,干旱[18%(W/V)的PEG-6000]处理可以诱导该基因的表达,在处理之后1 h时表达量迅速升高,到6 h时略有下降,但仍高于本底表达,之后表达量随时间的延长而上升,48 h时表达量达到最大值。盐(100 mmol/L的NaCl)处理后,表达量在1 h时迅速上升,6 h时达到最大值,之后逐渐下降,但仍高于本底值。脱落酸(100 μmol/L)处理后,该基因的表达量在1 h显著提高,3 h略有下降,6 h时再次升高,并达到最高,之后,表达量随时间的延长逐渐下降,但较本底表达仍然保持较高水平。
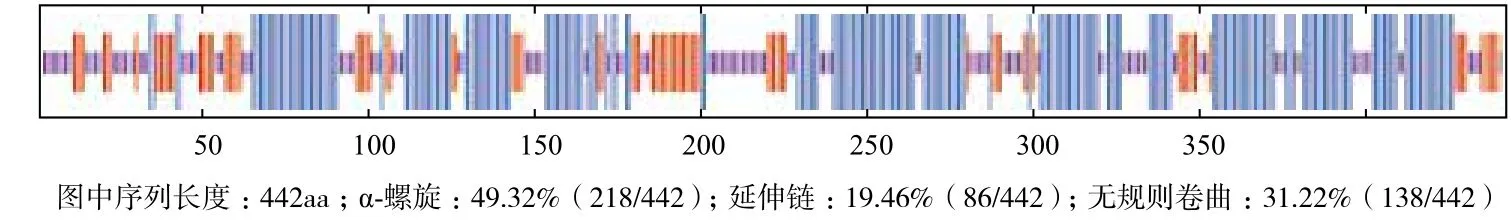
图4 AmProT蛋白的二级结构预测
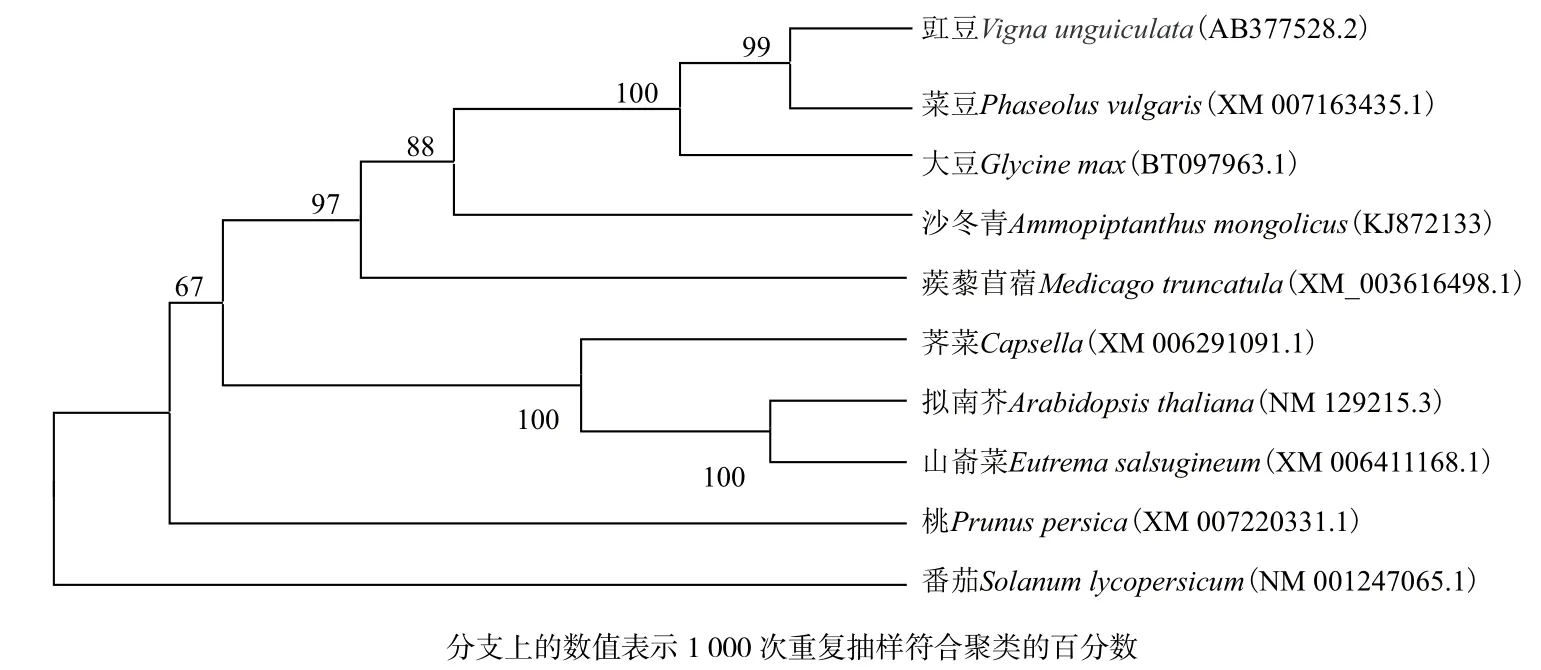
图5 AmProT基因编码氨基酸序列的系统进化树分析

图6 AmProT基因的组织表达模式
3 讨论
脯氨酸作为植物体内主要的渗透调节物质,在应对渗透胁迫时发挥重要作用,研究表明,脯氨酸转运体基因是植物体内脯氨酸转运、调配的功能基因[12-15]。本研究利用ProT基因家族高度保守的结构域,首次克隆了沙冬青脯氨酸转运体基因AmProT,从其编码蛋白的二级结构含有11个跨膜区域的特征来看,其编码的蛋白是典型的ProT转运蛋白[26]。AmProT编码的氨基酸序列与其他已克隆的植物基因编码的氨基酸序列均有不同程度的相似性,其中与同属豆科植物的大豆、菜豆、豇豆、蒺藜苜蓿的相似性较高,分别为86%、83%、83%、83%,说明了与同属豆科的植物亲缘关系较近,基因结构在进化过程中保持较高的保守性。
脯氨酸的生物合成部位主要是在细胞质基质和叶绿体中[27],在渗透胁迫下,植物叶部合成的脯氨酸含量较高,根部合成的脯氨酸不足以满足其对渗透胁迫的需求[28-31]。本研究的qPCR结果显示,AmProT基因在沙冬青的地上部表达量显著高于地下部,说明AmProT基因是一个在地上部中优势表达的基因。推测与叶片中大量合成的脯氨酸,需要大量的转运体有关。这与前人研究结果,即水稻的OsProT基因[13]和拟南芥AtProT3基因[17]主要在植株地上部中表达相一致。通过对AmProT的胁迫表达模式研究发现,该基因的表达量在干旱胁迫后呈现“升—降—升”的趋势,产生这一现象可能是因为AmProT基因的转录受到反馈机制调节,在受到干旱胁迫时,蛋白维持在较高水平。在盐胁迫和ABA处理下,AmProT基因在沙冬青体内的表达表现出相似的趋势,表达量先升高后降低,可能是受到这两种胁迫时,该基因上游的正调控因子与该基因的启动因子结合激活了基因的表达,使其在胁迫后上调,之后略有下降,趋于平稳。这也印证了ProT基因普遍存在于植物组织中,而表达水平受渗透胁迫诱导的观点[12]。在本试验中,AmProT对干旱、盐胁迫及脱落酸均有响应,显示其在植物胁迫响应的过程中可能发挥重要作用,而其在抗逆过程中的生物学功能需要进一步的研究。

图7 AmProT基因的胁迫诱导表达模式
4 结论
从沙冬青克隆获得一个新的基因AmProT,该基因全长1 587 bp,编码442个氨基酸,其编码蛋白的二级结构含有11个跨膜区域,是ProT转运蛋白的一个显著特征。AmProT在地上部中优势表达,对干旱、盐胁迫及脱落酸都能产生响应。
[1]张党权, 宋志丹, 田晔林, 等. 抗逆模式灌木沙冬青的研究进展[J]. 中南林业科技大学学报, 2012(2):16-22.
[2]冯金朝, 周宜君, 周海燕, 等. 沙冬青对土壤水分变化的生理响应[J]. 中国沙漠, 2001(3):9-12.
[3]周宜君, 刘春兰, 冯金朝, 等. 沙冬青抗旱、抗寒机理的研究进展[J]. 中国沙漠, 2001(3):98-102.
[4]李文瑞, 冯金朝, 江天然, 等. 沙冬青几种光合特性的季节性变化的研究[J]. 植物学报, 1999(2):190-193.
[5]Boyer JS. Plant productivity and environment[J]. Science, 1982,218(4571):443-448.
[6]Kanneganti V, Gupta AK. Overexpression of OsiSAP8, a member of stress associated protein(SAP)gene family of rice confers tolerance to salt, drought and cold stress in transgenic tobacco and rice[J]. Plant Mol Biol, 2008, 66(5):445-462.
[7] Delauney AJ, Hu CA, Kishor PB, Verma DP. Cloning of ornithine delta-aminotransferase cDNA from Vigna aconitifolia by transcomplementation in Escherichia coli and regulation of proline biosynthesis[J]. J Biol Chem, 1993, 268(25):18673-18678.
[8] 李玲, 余光辉, 曾富华. 水分胁迫下植物脯氨酸累积德分子机理[J]. 华南师范大学学报:自然科学版, 2003(1):126-134.
[9]朱金方, 陆兆华, 夏江宝, 等. 盐旱交叉胁迫对怪柳幼苗渗透调节物质含量的影响[J]. 西北植物学报, 2013(2):357-363.
[10] 吴雪霞, 朱月林, 朱为民, 等. 外源—氧化氮对NaCl胁迫下番茄幼苗生长和光合作用的影响[J]. 西北植物学报, 2006(6):1206-1211.
[11] Schwacke R, Grallath S, Breitkreuz KE, et al. LeProTl, a transporter for Proline, glycine betaine, and(gamma)-amino butyric acid in tomato pollen[J]. Plant Cell, 1999, 11(3):377-392.
[12] Rentsch D, Hirner B, Schmelzer E, Frommer WB. Salt stressinduced praline transporters and saltstress-repressed broadspecificity amino acid permeases identified by suppression of a yeast aminoacid permease-targeting mutant[J]. Plant Cell, 1996,8:1437-1446.
[13] Igarashi Y, Yoshiba Y, Takeshita T, et al. Molecular cloning and characterization of a cDNA encoding praline transporter in rice[J]. Plant and Cell Physiology, 2000, 41:750-756.
[14] Shen YG, Zhang WK, Yan DQ, et al. Overexpression of prolinetransporter gene isolated from halophyte confers salt tolerance in Arabidopsis[J]. Acta Botanica Sinica, 2002, 44(8):956-962.
[15]Ueda A, Shiwm M, Sanmiya K, et al. Functional analysis of saltinducibleproline transporter of barley roots[J]. Plant and Cell Physiology, 2001, 42:1282-1289.
[16] Udea A, Yamane YY, Takabe T. Salt stress enhances proline utilization in the apical region ofbarley roots[J]. Biochemical and Biophysical Research Communication, 2007(37):61-66.
[17] Silke G, Thilo W, Andreas M, et al. The AtProT family. Compatible solute transporters with similar substrate specificity but differential expression patterns[J]. Plant Physiology, 2005, 137:117-126.
[18] Wei Q, Guo YJ, Cao HM, Kuai BK. Cloning and characterization of an AtNHX2-like Na+/H+antiporter gene from Ammopiptanthus mon golicus (Leguminosae)and its ectopic expression enhanced drought and salt tolerance in Arabidopsis thaliana[J]. Plant Cell Tissue and Organ Culture, 2011, 105(3):309-316.
[19] Liu RL, Liu MQ, Liu J, et al. Heterologous expression of a Ammo piptanthus mongolicus late embryogenesis abundant protein gene(AmLEA)enhances Escherichia coli viability under cold and heat stress[J]. Plant Growth Regulation, 2010, 60(2):163-168.
[20] Song J, Liu J, Weng ML, et al. Cloning of galactinol synthase gene from Ammopiptanthus mongolicus and its expression in transgenic Photinia serrulata plants[J]. Gene, 2013, 513(1):118-127.
[21] Zhou YJ, Gao F, Liu R, et al. De novo sequencing and analysis of root transcriptome using 454 pyro sequencing to discover putative genes associated with drought tolerance in Ammopiptanthus mongolicus[J]. BMC Genomics, 2012, 13:133.
[22] Pang T, Ye CY, Xia XL, Yin WL. De novo sequencing and transcriptome analysis of the desert shrub,Ammopiptanthus mongolicus, during cold acclimation using Illumina/Solexa[J]. BMC Genomics, 2013, 14:488.
[23] Wu YQ, Wei W, Pang XY, et al. Comparative transcriptome profiling of a desert evergreen shrub,Ammopiptanthus mongolicus,in response to drought and cold stresses[J]. BMC Genomics,2013, 15:671.
[24] 夏晗, 黄金生. 低温、干旱和盐胁迫下沙冬青幼苗脯氨酸含量的变化[J]. 吉林林业科技, 2007, 36(4):1-2, 20.
[25] Rouhi V, Samson R, Lemeur R, et al. Stomatal resistance under drought stress conditions induced by PEG 6000 on wild Almond[J]. Commun Agric Appl Biol Sci, 2006, 71(1):269-273.
[26] Rungaroon W, Takashi H, Yoshito T, et al. Functional characterization of betaine/proline transportersin betaineaccumulating Mangrove[J]. The Journal of Biological Chemistery, 2002, 277:18373-18382.
[27] Szabados L, Savoure A. Proline:a multifunctional amino acid[J]. Trends in Plant Science, 2010, 15:89-97.
[28] Girousse C, Boumoville R, Bonnemain JL. Water deficit induces changes in concentrations inpraline and some other amino acids in the phloem sap of alfalfa[J]. Plant Physilolgy, 1996, 111:109-113.
[29] Rentsch D, Hirner B, Schmelzer E, Frommer WB. Salt stressinduced praline transporters and saltstress-repressed broad specificity amino acid permeases identified by suppression of a yeast aminoacid permease-targeting mutant[J]. Plant Cell, 1996,8:1437-1446.
[30] Ueda A, Shiwm M, Sanmiya K, et al. Functional analysis of saltinducibleproline transporter of barley roots[J]. Plant and Cell Physiology, 2001, 42:1282-1289.
[31] Sandeep S, Joji GV, Paul EV. Essential role of tissue-specific proline synthesis and catabolism in growth and redox balance at low water potential[J]. Plant Physiology, 2011, 157:292-304.
(责任编辑 李楠)
Cloning and Expression Analysis of Proline Transporter Gene in Ammopiptanthus mongolicus
Yue Guangzhen Jin Man Li Junlin Yang Shunying Guo Manyuan Su Yanhua
(State Key Laboratory of Soil and Sustainable Agriculture/Institute of Soil Science,Chinese Academy of Sciences,Nanjing210008)
The cDNA of proline transporter gene in Ammopiptanthus mongolicus(GenBank accession No. KJ873133)was amplified by RACE technology. Bioinformatics analysis showed that the length of AmProT ORF was 1 329 bp, the gene encoded a putative polypeptide of 442 amino acids with a calculated molecular mass of 48.0733 kD and a theoretical pI of 9.32. It had 11 transmembrance domains, which is the typical characteristics of proline translocator. Phylogenic analysis indicated that AmProT was 86% similar to proline transporter gene of Glycine max. Real-time PCR analysis revealed that AmProT expressed in all tissues examined with more higher level in the above-ground part than the underground part; expression profiles under different stress treatments such as drought, salt and ABA were compared, and the results revealed that transcriptional level of AmProT was up-regulated. It is speculated that AmProT plays an important role in response to abiotic stresses such as drought and salt.
Ammopiptanthus mongolicus;proline transporter gene;gene cloning;expression analysis
10.13560/j.cnki.biotech.bull.1985.2015.05.017
2014-09-11
国家自然科学基金重大研究计划项目(91125028)
岳光振,男,硕士研究生,研究方向:植物逆境生理生化特征;E-mail:biboqingyan@163.com
苏彦华,男,博士,研究员,研究方向:分子植物营养学;E-mail:yhsu@issas.ac.cn
