叶黄素分析检测方法的研究进展
2015-10-24梁敏慧崔亚娟
梁敏慧,崔亚娟,何 梅,李 东,闫 红
(1.北京工业大学,北京100124;2.北京市营养源研究所,北京100069)
叶黄素分析检测方法的研究进展
梁敏慧1,崔亚娟2,*,何 梅2,李 东2,闫 红1
(1.北京工业大学,北京100124;2.北京市营养源研究所,北京100069)
叶黄素是一种无维生素A原活性的类胡萝卜素,属纯天然色素,是天然的食品色素和食品强化剂。本文对近年来国内外食品中叶黄素的定性定量检测方法进行了综述,介绍了不同分析方法各自的原理、特点及应用,并分析了目前叶黄素分析方法存在的问题及发展趋势,为今后的分析工作提供参考。
叶黄素,分析检测,研究进展
叶黄素(Lutein)属于天然类胡萝卜素,又名“植物黄体素”,在自然界中与玉米黄素共同存在[1],万寿菊是提取叶黄素的良好来源。Heinrich W ihelm Ferdinand Wackenroder从胡萝卜根中首次提取得到了叶黄素。Handelman研究发现,人类视网膜中叶黄素浓度与视觉敏感度成正相关,研究人员确定了叶黄素是黄斑色素的化学组成成分之一。1995年美国食品与药物管理局批准叶黄素作为食品补充剂,2007年我国卫生部将叶黄素列入营养强化剂。叶黄素系统命名为3'3-二羟基-α-胡萝卜素,分子式为C40H56O2,分子量为568.85,结构如下:
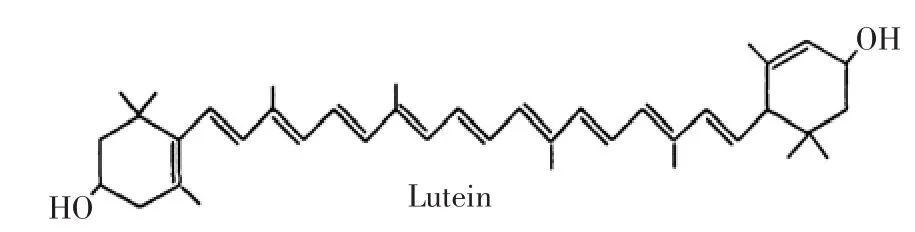
图1 叶黄素结构Fig.1 Structure of lutein
叶黄素具有多种生理功能。可以减少蓝光对视网膜的伤害,保护视力[2];预防年龄性黄斑病变[3];通过降低细胞内的活性氧类活性,对多种癌症有预防和抑制作用,例如:乳腺癌[4]、胃癌[5]、结肠癌[6]等;叶黄素还具有抗动脉硬化[7]、抗氧化[8]等功效,经常被作为营养强化剂添加到食品中,因此其定量分析对于控制产品质量有非常重要的意义。近几年,叶黄素的分析检测技术已经取得了重大的发展,特别是现代分析仪器与计算机技术的高度结合。根据现有的标准、文献、报道,叶黄素的分析检测方法主要有:紫外-可见分光光度法、高效液相色谱法、液相色谱质谱联用法、红外光谱法、超临界流体色谱法及核磁共振法等。在我国现行的国家标准中,叶黄素的分析方法为液相色谱法[9-10],方法比较单一。本文介绍了各种分析方法的原理、适用范围以及各自特点,并分析了目前叶黄素分析方法存在的问题及发展趋势,为叶黄素分析发展提供参考。
1 传统的叶黄素分析检测方法
紫外-可见分光光度法(Ultraviolet-visible spectrophotometry,UV-vis)根据被测物质浓度与吸光度成正比来进行准确分析,是一种简单快速,低成本的检测方法。叶黄素分子结构中含有多个共轭双键体系,受激发能产生可见紫外吸收光谱,因此,可利用紫外-可见分光光度法对叶黄素进行定性定量分析。国际上通行的方法有AOAC法和FAO/WHO法,两种方法如下[11-13]:
为了提高分光光度法的灵敏性及准确性,许多研究人员对其进行了改良。研究人员在改进AOAC法时普遍采用的方法是用冷皂化代替热皂化,并在皂化的过程中通入氮气,通过加入抗氧化剂降低叶黄素的分解,以氧化镁和硅藻土代替硅胶作为层析吸附剂,调整洗脱剂正己烷∶乙腈∶甲醇的比例来提高叶黄素的分离效果。李高峰[14]在上述改进方法基础上,将洗脱剂正己烷∶乙腈∶甲醇的比例调整为70∶25∶5(体积比),最终使叶黄素的测定结果提高了33%。然而,无法分析叶黄素的不同异构体、灵敏度差、易受干扰仍是紫外-可见分光光度法的突出缺点,严重制约它的应用和发展。
2 现代分析法
2.1 高效液相色谱法
高效液相色谱法(High performance liquid chromatography,HPLC)主要利用物质在两相中吸附或分配系数细微的差异,从而达到分离、分析及测定的目的。HPLC法具有分离效果好、选择灵敏性强、分离速度快、可与多种技术联用等优点,是目前使用的最广泛的对叶黄素进行定量分析的检测方法。
HPLC法用于叶黄素及其酯的定量分析,样品处理过程是影响结果准确与否的关键步骤,目前叶黄素常用的提取方法包括:有机溶剂抽提法、微波提取法、超临界CO2萃取法,其中有机溶剂抽提法是最常用的预处理方法。在分析过程中,多采用反相C18或反相C30色谱柱,此外正相硅胶柱也可用于类胡萝卜素的分析检测。仪器一般配备光二极管阵列检测器(DAD或PAD)或紫外检测器作为检测系统,叶黄素检测波长为(446±2)nm。Gill等[15]用HPLC建立了测定婴儿奶粉中叶黄素的方法,以甲醇∶二氯甲烷(70∶30)作为流动相,反相C30柱洗脱,玉米黄质作为内标物,得到叶黄素回收率为101%~108%,相对标准偏差(RSD)为2.2%,最低检出限为1.4μg/100g。表明HPLC法是快速、准确、可靠的定量婴儿配方奶粉中叶黄素的方法。部分HPLC法定量测定叶黄素条件见表2。

表1 AOAC法和FAO/WHO法比较Table 1 The comparison of AOAC and FAO/WHO
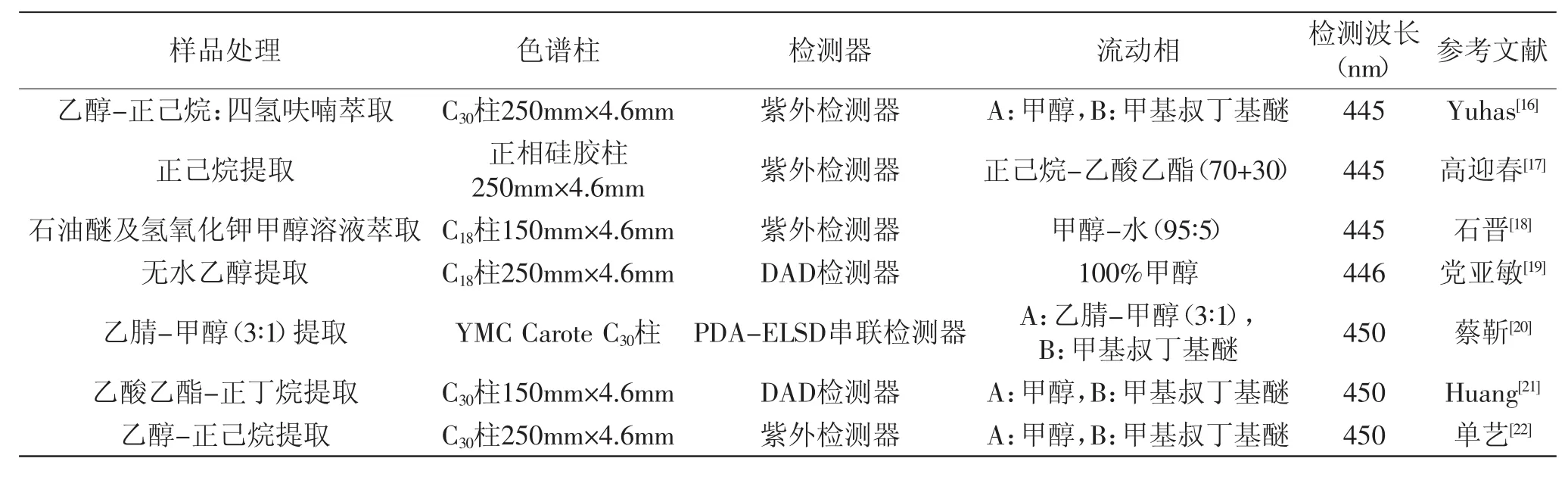
表2 部分HPLC法定量测定叶黄素条件Table 2 Some HPLCmethods for quantification of lutein
HPLC法用于叶黄素的定性分析主要是分析其不同的异构体形式。叶黄素具有多种同分异构体,不同的构象会造成生理学功能显著的差异,因此对于样品萃取物中异构体形式的研究是十分重要的。分析类胡萝卜素异构体时,一般步骤为使用合适色谱柱将不同异构分离,利用MS、NMR等方法确定异构体类型,因此选择合适的色谱柱,是将叶黄素单体和酯及其异构体分离的关键,用于类胡萝卜素分离的色谱柱主要有C18和C30柱两种。惠伯棣等[23-24]认为在分离过程中,C30柱能分离类胡萝卜素同分异构体及顺反异构体,而C18柱则无法达到相同的分离效果,因此C30柱在分析测定类胡萝卜素同分及顺反异构体时有着明显的优势。李大婧等[25]通过实验验证了C18和C30色谱柱对叶黄素顺反异构体的分离效果,证实了在相同的洗脱条件下,C30柱比C18柱更适合用于分离叶黄素异构体,并在此基础上建立了高效液相色谱法测定叶黄素顺、反异构体含量的方法,采用高大气压化学电离质谱对HPLC图中的除反式叶黄素峰的其他主要峰进行定性分析后,确定了顺式结构的种类,分别是:9-顺式、9'-顺式、13-顺式、13'-顺式叶黄素并且利用反式叶黄素标准曲线对顺、反异构体进行了定量分析,结果证明在40~200ng范围内峰面积和进样量线性良好,最低检出限为0.8μg/L。Melendez等[26]对餐后人类血浆及白鼬肺组织中类胡萝卜素同分异构体进行了研究,在62m in内利用C30柱分离得到了48种人体内主要类胡萝卜素的同分异构体,这是目前为止利用HPLC法分离得到最多种的类胡萝卜素同分异构体。
2.2 液相色谱-质谱联用法
液相色谱-质谱联用法(Liquid chromatographymass spectrometry,LC-MS)将HPLC对样品的高分离能力和MS的高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来,是食品分析和环境分析领域最受关注的方法之一。MS是对物质进行定性鉴定的有效方法,具有灵敏度高、进样量少、分析速度快等优点,目前大气压电离(APCI-MS)、电喷雾电离(ESI-MS)、基质辅助激光解吸电离(MALDIMS)等质谱方法都被用于叶黄素的分析检测,其中APCI源应用最广泛。
LC-APCI-MS只产生单电荷峰,适用于非极性或低、中等极性且对热稳定的化合物。叶黄素作为一种非极性的类胡萝卜素,因此APCI源相比于ESI源更适合作为叶黄素分析测试的离子源[27]。Tsao等[28]通过HPLC-APCI-MS联用的方法,利用叶黄素顺式异构体在330nm附近的特征光谱吸收,成功从万寿菊中分离鉴定了6种顺式叶黄素二酯:顺式叶黄素二豆蔻酸酯、顺式豆蔻酸-棕榈酸酯、顺式二棕榈酸酯、顺式棕榈酸-硬脂酸酯、顺式月桂酸-棕榈酸酯及顺式肉豆蔻酸-硬脂酸酯。Mellado-Orteg等[29]则首次从谷物中分离鉴定出了4种3-O-和3'-O-位置的叶黄素二酯的异构体。
LC-ESI-MS是一种灵敏度高、适用范围广的检测方法,近几年来也逐渐被用于对叶黄素进行分析。程红艳等[30]建立浒苔中叶黄素的高效液相色谱-电喷雾电离质谱定性定量方法,在选定的最佳仪器条件下,叶黄素检出限为0.03mg/L,峰面积的RSD为1.13%,保留时间RSD为0.38%;并确定了电喷雾质谱分析叶黄素特征离子为m/z为589及306,在此基础上推断了叶黄素电喷雾质谱可能的裂解方式,见图2。

图2 叶黄素电喷雾质谱裂解规律图Fig.2 Pyrolysis of lutein
液-质联用方法的建立,提高了叶黄素及其异构体的鉴定能力,同时降低了物质的检测限,十分适合天然来源叶黄素的分析,是未来叶黄素测定的发展趋势。但是,该法基质效应较大,对样品预处理及操作过程有较高的要求。
2.3 红外光谱法
红外光谱法(Infrared spectroscopy,IR)是根据物质对红外光区的电磁辐射的不同选择性吸收来进行结构分析及定性定量检测的分析方法。通过对光谱进行分析,可对物质进行定性鉴定,对特征吸收谱带强度测量可对物质进行定量分析。红外光谱一般分为近红外区(13330~4000cm-1)、中红外区(4000~400cm-1)和远红外区(400~10cm-1),其中中红外区是应用和研究最广泛的区域,近红外区以及近红外光谱与其他分析技术联用是最近研究人员的研究热点[31]。
时有明等[32]通过傅里叶变换红外光谱技术比较了万寿菊花瓣和花渣的叶黄素红外光谱,确定了羰基吸收峰对叶黄素酯单一的来源性,得出可以通过比较两者光谱中羰基吸收峰的相对强度来定性反映花瓣中叶黄素酯的提取程度。利用此方法,可以为工业生产中监控叶黄素酯生产过程提供一种更简单灵敏的方法。
有机物的近红外光谱吸收主要是由于X-H基团的运动所引起,叶黄素分子结构中含有-OH键,能产生特定的吸收光谱,借助化学计量学中的分析统计模型,可对其进行定性定量分析。Chen等[33]首次使用近红外光谱法(NIRS)定量测定了羽衣甘蓝中的叶黄素和β-胡萝卜素的含量,通过采集151个样本的近红外光谱图像数据并与高效液相色谱法精确测得的叶黄素和β-胡萝卜素的含量进行比对,建立了偏最小二乘法近红外光谱多元预测模型,其校准方程的相关系数分别为0.983和0.982,标准误差为0.065和0.131mg/g干重,结果说明通过近红外光谱法对羽衣甘蓝中类胡萝卜素物质的定量分析是可行的。邹小波[34]利用近红外高光谱图像和HPLC法分析了黄瓜叶片中的色素含量,其中叶黄素的光谱与色素含量的预测模型的预测集相关系数为0.8262,得出结论:近红外高光谱图像技术可以快速分析黄瓜叶中的叶黄素含量。该方法不受样品状态的限制,特征性强,样品处理过程简单,十分适合大量相同样品的质控分析与监测,但此法定量灵敏度较低,用于定量分析误差较大,不适用于微量叶黄素的定量测定,而且由于食品成分的复杂性,建立一种或几种预测模型并不能适用于所有的样品测定,其实际应用性有待提高。
2.4 超临界流体色谱法
超 临 界 流 体 色 谱 法(Supercritical fluid chromatography,SFC)是依靠超临界流体的溶剂化能力对样品进行分离分析。在达到相同分离效率的条件下,SFC速度比LC快,可用于分离一些LC和GC难以分离和分析的物质,尤其对于一些热敏性、低挥发性的化合物具有良好的分离分析效果。Abrahamsson等[35]采用超临界流体色谱法同时分离测定栅藻中包括叶黄素在内的8种类胡萝卜素,得到了叶黄素的检出限和定量限分别为0.05mg/L和0.14mg/L。该方法分析迅速,所需试剂简单,仅用到CO2和甲醇,安全性优于需要多种用于分离的有机溶剂的HPLC法。
SFC法可与多种检测器联合使用,如:MS、FID、UV-vis、电子捕获等检测器,其中SFC与MS联用将物质分离测定结合在一起,成为分析测定类胡萝卜素类物质的非常有效的分析手段[36]。Matsubara等[37]首次利用SFC-MS法分析测定了叶黄素、番茄红素、玉米黄质、β-胡萝卜素、花黄质、新黄质、紫黄质这7种类胡萝卜素,以CO2和含0.1%甲酸铵的甲醇为流动相,超临界条件为:进出口压力分别为18MPa和10MPa,温度35℃,利用聚合ODS柱成功将7种类胡萝卜素分离,其中叶黄素的检出限可达到55pg,该法选择性强灵敏度高,适合生物类的样品分析,为SFC-MS技术广泛用于叶黄素的分离检测奠定了基础。
从目前SFC对叶黄素异构体研究和应用来看,其仍处于起步阶段,尚不能取代HPLC用于叶黄素分离测定,暂时只能作为一种色谱领域的补充手段。不过,随着实验室规模的SFC的商品化,SFC法必将得到广泛重视和应用。
2.5 核磁共振法
核磁共振法(Nuclear Magnetic Resonance,NMR)是通过测量电磁波与外磁场中原子核之间相互作用来研究物质结构特性,主要用于研究化合物的分子结构信息,如今应用最广泛的是1H-NMR和13C-NMR。NMR用于探索叶黄素同分异构体十分有效,能直接反映其分子的结构,图谱十分直观,并且无需被测物标准对照品、样品预处理步骤简单、不破坏样品,具有其他一些分析方法不可比拟的优势。德国学者Dachtler[38]就采用LC-NMR对菠菜及视网膜中叶黄素和玉米黄素同分异构体进行了分析。表3列出近10年来利用NMR分离鉴定叶黄素类物质的文献报道。

表3 部分NMR法分析测定叶黄素文献Table 3 Some NMRmethods for lutein analysis
利用NMR图谱中的化学位移或耦合常数对叶黄素的不同异构体进行鉴定,利用共振峰面积或峰高可以对异构体的含量进行测定。对于食品中叶黄素同分异构体的测定,NMR法无法单独使用,必须连接LC以保证达到良好的色谱分离效果,且NMR仪器价格较高,费用昂贵,长期以来只是作为结构测定的主要工具,其对叶黄素及其异构体进行定量分析的方法尚未有详细的报道。
3 方法比较
前文综述的方法优缺点和适用性不尽相同,在进行分析检验时,实验人员可以根据自己的工作需求来选择合适的分析方法。表4对不同方法的优缺点进行了比较。

表4 不同方法优缺点比较Table 4 The advantages and disadvantages of differentmethods
4 结语
随着新技术新仪器的开发与应用,作为国内外的研究热点的叶黄素,在提取分离、分析开发方面已经取得了巨大的进展。由于食品组成复杂及叶黄素多种异构体的存在,上述技术并不能完全达到定性定量所需的要求,对于叶黄素的分析,主要集中在提高同分异构体的分离效能以及定量检测的灵敏度。因此:a.高选择性、微量样品前处理技术;b.多维色谱分离技术与质谱、核磁共振等联用技术;c.建立应用范围更广的检测方法仍是叶黄素测定研究热点。HPLC-MS联用法作为最近几年新兴的分析方法,通过对特定碎片离子的检测对分析物进行定性定量,是一种分析检测的理想工具,目前尚未成为一种常规的检测方法,但由于其较低的定量检出限以及良好的普及性,将为功能叶黄素的分析检测开拓一条新的途径。
[1]高迎春,尹伶灵,陈玲,等.高效液相色谱法测定乳制品中的叶黄素[J].中国乳品工业,2012,40(4):48-50.
[2]朱海霞,郑建仙.叶黄素(Lutein)的结构,分布,物化性质及生理功能[J].中国食品添加剂,2005,5:48-55.
[3]魏璐,黄文礼,樊莹.叶黄素,玉米黄素与年龄相关性黄斑病变[J].国际眼科纵览,2007,31(4):229-231.
[4]Eliassen A H,Hendrickson SJ,Brinton LA,et al.Circulating carotenoids and risk of breast cancer:pooled analysis of eight prospective studies[J].Journal of the National Cancer Institute,2012,104(24):1905-1916.
[5]冀波.Lutein对胃癌SGC-7901细胞的作用及分子机制研究[D].郑州:郑州大学,2012.
[6]Reynoso-Camacho R,Gonzalez-Jasso E,Ferriz-Martinez R,et al.Dietary supplementation of lutein reduces colon carcinogenesis in DMH-treated rats by modulating K-ras,PKB,andβ-catenin proteins[J].Nutrition and Cancer,2011,63(1):39-45.
[7]Xu X,Zou Z,Xiao X,et al.Effects of lutein supplement on serum inflammatory cytokines,ApoE and lipid profiles in early atherosclerosis population[J].Journal of Atherosclerosis and Thrombosis,2013,20(2):170-177.
[8]Aimjongjun S,Sutheerawattananonda M,Limpeanchob N. Silklutein extract and its combination with vitamin E reduce UVBmediatedoxidative damage to retinal pigment epithelial cells[J].Journal of Photochemistry and Photobiology B:Biology,2013,124:34-41.
[9]GB/T 23187-2008-2008饲料中叶黄素的测定高效液相色谱法[S].
[10]GB/T 23209-2008-2008奶粉中叶黄素的测定液相色谱-紫外检测法[S].
[11]王琦,许洪高,高彦祥.叶黄素分析方法研究进展[J].中国食品添加剂,2007(6):100-105.
[12]FAO/WHO press compendium of food additive specifications[C].Food&Agriculture Org,1990,52(9):105-106.
[13]AOAC.Official methods of analysis[Z].1990:1048-1049.
[14]李高峰.万寿菊花中叶黄素的提取技术及分析方法研究[D].太原:中国日用化学工业研究院,2009.
[15]Gill B D,Indyk H E.Liquid chromatographic method for the determination of lutein in milk and pediatric formulas[J]. International Dairy Journal,2008,18(9):894-898.
[16]Yuhas R,Mccormick M,Yachetti S,et al.A Method for the measurement of lutein in infant formula[J].Food and Nutrition,2011,2(2):145-149.
[17]高迎春,尹伶灵,陈玲,等.高效液相色谱法测定乳制品中的叶黄素[J].中国乳品工业,2012(4):48-50.
[18]石晋,栾雨时,王静云,等.HPLC法测定甘薯叶片中的叶黄素[J].植物研究,2008,(6):767-769.
[19]党亚敏,李建平,张明月,等.高效液相色谱法测定保健食品中的叶黄素[J].中国卫生检验杂志,2011,21(7):1650-1651.
[20]蔡靳,惠伯棣.蒸发光散射检测器在叶黄素HPLC定量分析中的应用[J].食品科学,2008,29(10):508-511.
[21]Huang X,Liu Y,Di D,et al.An improved LC-DAD method for simultaneous determination of lutein,β-carotene and lycopene in tomato and its products[J].Chromatographia,2010,71(3-4):331-334.
[22]单艺,姜毓君,陈一,等.婴幼儿配方食品中叶黄素的提取及测定[J].食品科学,2012,33(4):189-192.
[23]惠伯棣,张西,文镜.反相C30柱在HPLC分析类胡萝卜素中的应用[J].食品科学,2005,26(1):264-270.
[24]张艳,惠伯棣,裴凌鹏,等.C30柱分离万寿菊花中的叶黄素类化合物初探[J].食品科学,2007,27(11):424-428.
[25]李大婧,王闯,徐爱琴,等.高效液相色谱法测定叶黄素顺,反异构体[J].食品科学,2012,33(22):186-190.
[26]Melendez-Martinez A J,Stinco C M,Liu C,et al.A simple HPLC method for the comprehensive analysis of cis/trans(Z/E) geometrical isomers of carotenoids for nutritional studies[J].Food Chemistry,2013,138(2-3):1341-1350.
[27]齐小花,张孝芳,范晓丽,等.LC-MS/Q-TOF检测叶黄素以及叶黄素在不同离子源下电离机理的研究:第三届中国第三方检测实验室发展论坛[Z].承德:2011:1-8.
[28]Tsao R,Yang R,Young JC,etal.Separation of geometric isomers of native lutein diesters in marigold(Tagetes erecta L.)by high-performance liquid chromatography-mass spectrometry[J].Journal of Chromatography A,2004,1045(1):65-70.
[29]Mellado-Ortega E,Hornero-M E Ndez D A M. Isolation andidentification of lutein esters,including their regioisomers,intritordeum(×Tritordeum Ascherson et Graebner)grains:Evidencefor a preferential xanthophyll acyltransferase activity[J]. FoodChemistry,2012,135(3):1344-1352.
[30]程红艳,陈军辉,赵恒强,等.反相高效液相色谱-电喷雾质谱法测定浒苔中的叶黄素[J].食品科学,2010,31(18):206-211.
[31]罗聪佩,何涛,淳泽.红外光谱法在石斛鉴别中的应用研究进展[J].应用与环境生物学报,2013,19(3):537-541.
[32]时有明,孙艳琳,魏生贤,等.万寿菊花渣中残余叶黄素酯的红外光谱分析[J].光谱实验室,2010(4):1286-1289.
[33]Chen X,Wu J,Zhou S,et al.Application of near-infrared reflectance spectroscopy to evaluate the lutein andβ-carotene in Chinese kale[J].Journal of Food Composition and Analysis,2009,22(2):148-153.
[34]邹小波,陈正伟,石吉勇,等.基于近红外高光谱图像的黄瓜叶片色素含量快速检测[J].农业机械学报,2012,43(5):152-156.
[35]Abrahamsson V,Rodriguez-Meizoso I,Turner C. Determinationof carotenoids in microalgae using supercritical fluid extractionand chromatography[J]. Journal of Chromatography A,2012,1250:63-68.
[36]陈青,刘志敏.超临界流体色谱的研究进展[J].分析化学,2004,32(8):1104-1109.
[37]Matsubara A,Bamba T,Ishida H,et al.Highly sensitive and accurate profiling of carotenoids by supercritical fluid chromatography coupled with mass spectrometry[J].Journal of Separation Science,2009,32(9):1459-1464.
[38]Dachtler M,Glaser T,Kohler K,et al.Combined HPLC-MS and HPLC-NMR on-line coupling for the separation and determination of lutein and zeaxanthin stereoisomers in spinach and in retina[J].Analytical Chemistry,2001,73(3):667-674.
[39]Aman R,Biehl J,Carle R,et al.Application of HPLC coupled with DAD,APCI-MS and NMR to the analysis of lutein and zeaxanthin stereoisomers in thermally processed vegetables[J].Food Chemistry,2005,92(4):753-763.
[40]Putzbach K,Krucker M,Albert K,et al.Structure determination ofpartially deuterated carotenoids from intrinsically labeled vegetables by HPLC-MS and1H NMR[J].Journal of Agricultural and Food Chemistry,2005,53(3):671-677.
[41]Sivathanu B,Palaniswamy S.Purification and characterization of carotenoids from green algae Chlorococcum humicola by HPLC-NMR and LC-MS-APCI[J].Biomedicine&Preventive Nutrition,2012,2(4):276-282.
Research progress on analytical method of lutein
LIANG Min-hui1,CUIYa-juan2,*,HE Mei2,LIDong2,YAN Hong1
(1.Beijing University of Technology,Beijing 100124,China;2.Beijing Nutrition Resources Institute,Beijing 100069,China)
Lutein was one of carotenoids without vitamin A activity. It was a pure natural pigment. Lutein was anatural food pigment and nutrition agent. This paper provided an overview of analytical methods about lutein,which introduced the principles,traits and applicability of these methods. The problems at present and theemphasis of analysis of lutein were put forward to give a light of the further work.
lutein;detection;progress
TS207.3
A
1002-0306(2015)08-0390-05
10.13386/j.issn1002-0306.2015.08.073
2014-03-13
梁敏慧(1992-),女,硕士研究生,研究方向:食品营养分析。
*通讯作者:崔亚娟(1979-),女,硕士研究生,副研究员,研究方向:食品营养分析。
北京市科委科技新星计划项目(2011059)。
