魔芋低聚糖生产制备工艺优化研究
2015-10-24刘水英张志健卫永华
党 娅,刘水英,张志健,卫永华
(1.陕西理工学院生物科学与工程学院,陕西汉中723000;2.陕西理工学院秦巴蓝莓研究所,陕西汉中723000;3.陕西省资源生物重点实验室,陕西汉中723000;4.陕西省黑色有机食品工程技术研究中心,陕西汉中723000)
魔芋低聚糖生产制备工艺优化研究
党 娅1,2,3,4,刘水英1,张志健1,卫永华1
(1.陕西理工学院生物科学与工程学院,陕西汉中723000;2.陕西理工学院秦巴蓝莓研究所,陕西汉中723000;3.陕西省资源生物重点实验室,陕西汉中723000;4.陕西省黑色有机食品工程技术研究中心,陕西汉中723000)
以魔芋精粉为原料,通过正交实验优化超声波法、柠檬酸法和纤维素酶解法降解魔芋葡甘聚糖的工艺参数,并比较这三种方法降解魔芋葡甘聚糖的效率。研究表明纤维素酶解法降解效果最好,纤维素酶法降解魔芋葡甘聚糖的最佳工艺参数为:料液比1.0g/L,酶用量0.25g/L,温度50℃,降解时间100min。
魔芋精粉,魔芋葡甘聚糖,魔芋低聚糖,超声波降解,酸降解,酶降解
魔芋是天南星科(Araceae)魔芋属(AmorphophallusB1.ex Decne.)多年生单子叶宿茎草本植物[1-2],我国的魔芋资源丰富[3-4]。魔芋具有减肥、抗糖尿病、抑制大肠癌变的药用价值[5-6]和高的食用价值[7-8],其主要活性成分是魔芋葡甘聚糖(Konjac glucomannan,KGM),含量高达70%~80%[9-11]。但由于葡甘聚糖相对分子量高(其分子量为2×105~2×106),粘度大,溶解度小,性质不稳定,其应用范围受到了很大限制。
魔芋低聚糖(mannoligosaccharides,MOS)是以魔芋胶,即魔芋葡甘聚糖为原料,在β-甘露聚糖酶的作用下水解得到的产物[12-13]。研究表明魔芋低聚糖除了具有魔芋葡甘聚糖的预防和治疗高血压、降血脂等生理功能外,还具有特殊的生理功能。如抗氧化、增强免疫力、促进双歧杆菌增殖、清理肠道等作用[14-16],并且其分子量小,理化性质较好,可更好地发挥其独特的保健功能作用,能够广泛应用于医药、食品工业、生物制品、农药等方面[17]。据文献报道,多糖的降解方法主要有化学法[18]、物理法[19-20]和酶法[21]。目前,国内外制备魔芋葡甘低聚糖的方法主要有酶解法[22-24]、微波-氧化法、酸解法[25]、超声波法[11,19-20,26,33]、辐射降解法[27]、膜分离法[28]等。酸解法可以有效地降低魔芋精粉的黏度,其副反应少,成本较低。但水解后的低聚糖容易受到酸的影响而分解,操作难控制,得到的产品质量差,副产物多[29]。酶法降解具有高效、专一、条件温和、产物较纯以及不造成环境污染等优点,但酶易受酸度、温度、重金属等的影响而使其活性降低或失去[30]。超声波作为一种新技术在化学领域中发挥着越来越大的作用,利用超声波对葡甘聚糖进行降解,是一种高效、环保的降解方法,但主要存在选择性差、降解产物纯度低等问题[31]。本研究以魔芋精粉为原料,分别在单因素的基础上通过正交实验对超声波法、柠檬酸法和纤维素酶法降解魔芋葡甘聚糖以制备相对分子量低的魔芋葡甘低聚糖的工艺参数进行了优化,并对比了优化后三种方法降解魔芋葡甘聚糖制备魔芋低聚糖的效果。
1 材料与方法
1.1 材料与仪器
魔芋精粉 陕西勉县锦泰实业有限公司提供;纤维素酶 西安化学试剂厂;柠檬酸、盐酸、氢氧化钠等 均为分析纯。
乌氏粘度计 上海申谊玻璃制品有限公司;KQ-100DA型数控超声波清洗器 昆山市超声仪器有限公司;HH-S4型电热恒温水浴锅 北京科伟永兴仪器有限公司;FA2004NDAI型电子天平 梅特勒-托利多仪器(上海)有限公司;101-1型电热恒温鼓风干燥箱 北京科伟永兴仪器有限公司;SHB-3型循环水真空泵 郑州杜甫仪器工厂;PHS-3C型精密酸度计 上海大普仪器有限公司。
1.2 实验方法
1.2.1 魔芋精粉的纯化 魔芋精粉中除含有40%~70%的葡甘聚糖外,还含有少量的蛋白质、食物纤维、淀粉、游离还原糖、氨基酸及少量的无机盐等,因此要得到较纯的魔芋葡甘聚糖,就需除去其中的杂质。根据葡甘聚糖不溶于乙醇,而其他杂质能溶解于乙醇的性质,采用乙醇脱洗的方法对魔芋葡甘聚糖进行纯化。
称取一定量的魔芋精粉,平均分成四份,分别用20%、30%、40%、50%的乙醇溶液反复快速搅拌洗涤,直至魔芋精粉颜色变白,将样品放在60℃恒温干燥箱中烘干,即可得到纯化后的魔芋精粉。以纯化魔芋精粉中葡甘聚糖的纯度及含量作为判断纯化效果的标准,选出最佳的乙醇浓度,并以该浓度的乙醇对余下的魔芋精粉进行纯化处理、备用。
1.2.2 魔芋葡甘聚糖降解的单因素实验
1.2.2.1 超声波法降解 以降解产物的特性粘度为评价指标,分别以超声功率(40、60、80、90、100W)、时间(10、30、50、70、90、110min)、料液比(0.50、0.75、1.00、1.25、1.50g/L)、pH(0.5、1.0、2.0、3.0、5.0)为单因素变量,用乌氏粘度计测定超声波法降解魔芋葡甘聚糖时降解产物的黏度,确定超声波法降解魔芋葡甘聚糖的各单因素降解效果的影响及适用范围[33]。
1.2.2.2 柠檬酸法降解 以降解产物的特性粘度为评价指标,用乌氏粘度计测定柠檬酸法降解时分别以酸解时间(20、40、60、80、100m in)、温度(30、40、50、60、70℃)、底物质量浓度(0.50、0.75、1.00、1.25、1.50g/L)、pH(1.0、2.0、3.0、4.0、5.0)为单因素变量,研究魔芋葡甘聚糖降解产物的黏度变化情况[34-36]。考察柠檬酸法降解魔芋葡甘聚糖的各单因素降解效果的影响及适用范围。
1.2.2.3 纤维素酶法降解 目前用于生产中常用的酶主要有纤维素酶、β-甘露聚糖酶和β-葡聚糖酶[37],本实验选择最为常见易得的纤维素酶。以降解产物的特性粘度为评价指标,用乌氏粘度计分别测定纤维素酶法降解时以加酶量(0.05、0.15、0.25、0.35、0.50g)、酶解时间(20、40、60、80、100m in)、底物质量浓度(0.50、0.75、1.00、1.25、1.5g/L)、酶解温度(30、40、50、60℃)为单因素变量,研究魔芋葡甘聚糖降解产物的黏度变化情况。确定纤维素酶法降解魔芋葡甘聚糖的各单因素降解效果的影响及适用范围。
1.2.3 降解魔芋葡甘聚糖的正交实验
1.2.3.1 超声波降解的正交实验 在单因素实验结果的基础上,分别以超声功率、时间、料液比、pH四个因素为自变量,以降解产物的特性粘度为评价依据,设计四因素三水平的正交实验,选出超声波降解的最佳条件。因素水平见表1。

表1 超声波因素水平表Table 1 Levels and factors table for ultrasonic experiment
1.2.3.2 柠檬酸法降解的正交实验 根据单因素实验结果,分别以酸解时间、水浴温度、pH、料液比四个因素为自变量,以降解产物的特性粘度为评价依据,设计四因素三水平的正交实验,选出柠檬酸法降解的最佳条件。因素水平见表2。
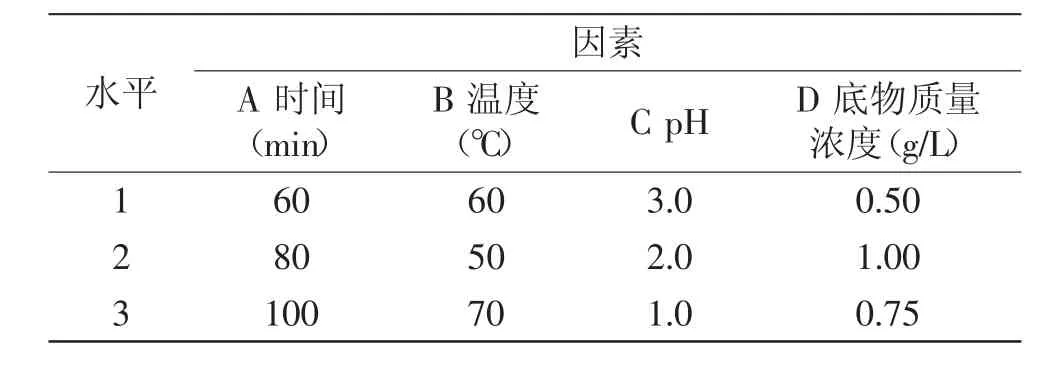
表2 酸解因素水平表Table 2 Levels and factors for citric acid hydrolysis experiment
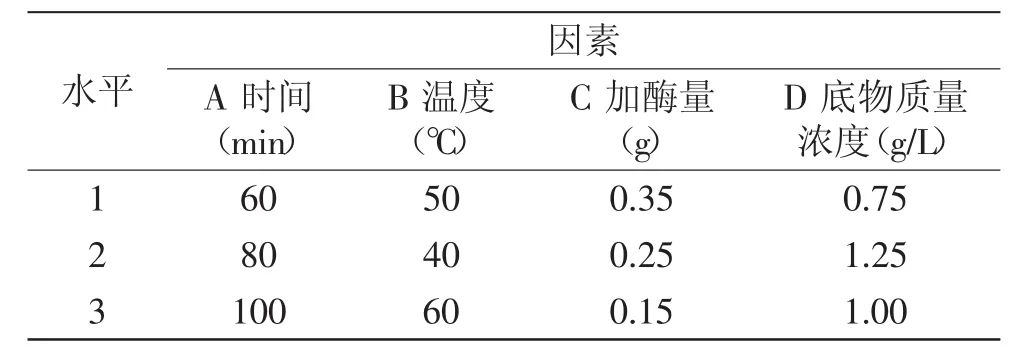
表3 酶解因素水平表Table 3 Levels and factors for cellulose enzymatic hydrolysis experiment
1.2.3.3 纤维素酶法降解的正交实验 以单因素实验结果为依据,分别以加酶量、水浴温度、水浴时间、料液比四个因素为自变量,以降解产物的特性粘度为评价依据,设计四因素三水平的正交实验,选出酶法降解的最佳条件。因素水平见表3。
1.3 测定方法
1.3.1 特性粘度的测定 魔芋精粉采用粘度法测定分子量,将用不同方法处理得到的降解产物用乌氏粘度计(直径0.6~0.7mm)在25℃条件下以外推法测定特性粘度。李斌[32]根据光散射及粘度法测得KGM及不同相对分子质量的Mw和特性粘度[η],以log[η]对logMw作图,依据直线的斜率和截距得到特性粘度与平均分子量之间存在如下关系:[η]=KMwα。式中:η:特性粘度;Mw:重均分子量;K=0.0596,α=0.73。其中α=0.73表明KGM分子在水溶液中的形态为半柔顺性高分子链[38]。从而建立KGM的Mark-Hoodwink方程[11]为[η]=0.0596×Mw0.73。由Mark-Hoodwink方程可知,特性粘度[η]与重均分子量Mw的0.73次方成正比。测得降解产物的特性粘度[η]后代入上式,即得均重分子量Mw。由此可知降解产物的特性粘度越小,对应的重均分子量也越小,降解效果越好。即可以用特性粘度间接反映降解效果。本实验采用乌氏粘度计测量其降解产物的特性粘度,进而反映降解的效果好坏。
1.3.2 还原糖、总糖的测定 还原糖和总糖含量的测定参照GB/T 18104-2000《魔芋精粉》的标准方法进行测定[32]。
1.3.3 特性粘度降解效率的测定 降解效率(ω,%)=[(η0-η1)/η0]×100,其中,η0和η1分别为降解前、后的特性粘度,m L/g。
2 结果与分析
2.1 超声波法降解单因素实验结果与分析
2.1.1 超声时间对降解的影响 由图1可看到,降解开始阶段,特性粘度随降解时间的延长而急剧减小,而当达到90m in以后,特性粘度的变化趋于缓慢。这是因为降解开始时,体系中魔芋葡甘聚糖平均分子量较大,可降解的糖苷键较多,即可降解的糖苷键“浓度”较大,因而降解作用较明显,当降解到一定程度后,魔芋葡甘聚糖分子链变短,体系中可降解的糖苷键“浓度”变小,因而降解效果趋于缓慢。另一方面,超声作用对聚合物的降解过程存在“极限聚合度”,即高分子链降解到一定程度后就不再进行降解了[34]。因而在降解的后阶段,超声降解的作用可能已经很小,因而后期特性粘度曲线趋于平缓。从生产周期和生产成本考虑,最适的降解时间90m in。
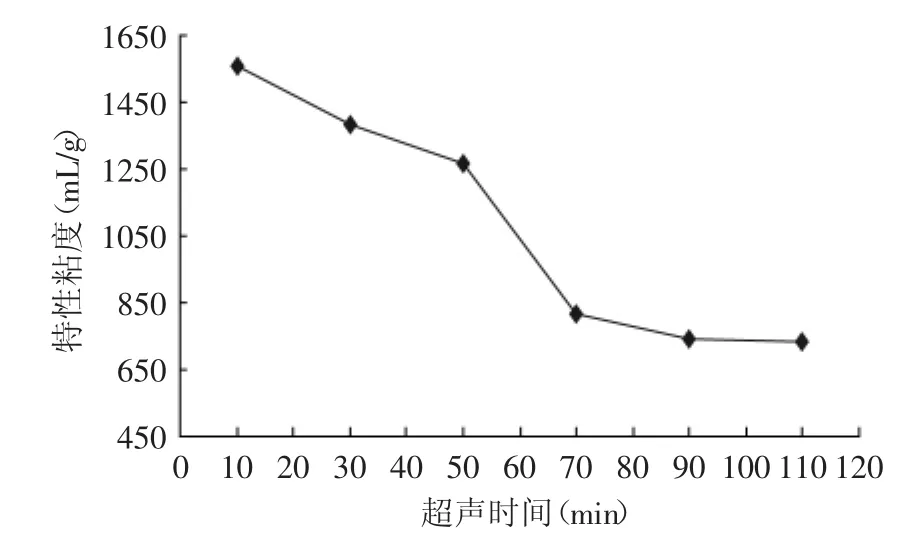
图1 超声时间对特性粘度的影响Fig.1 Influence of ultrasonic time on intrinsic viscosity
2.1.2 超声功率对降解的影响 由图2可见,特性粘度随超声功率的变化总体呈阶梯状下降趋势,但各阶梯的斜率变化基本相同。随着超声功率的增大,特性粘度逐渐减小,魔芋葡甘聚糖的降解程度越来越充分,魔芋低聚糖的含量逐渐升高,表明增大超声功率有利于魔芋葡甘聚糖的降解,但考虑实际生产和需要,选择超声降解的功率90W为最佳。
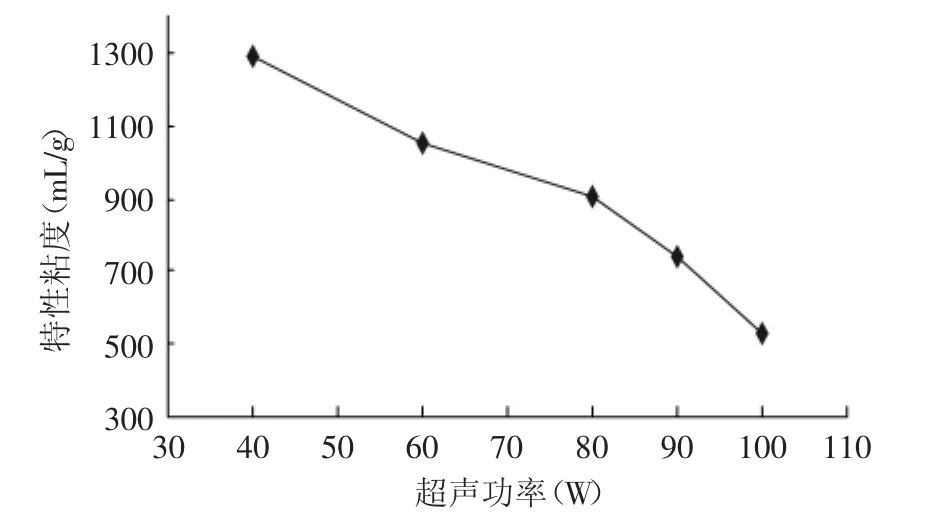
图2 超声功率对特性粘度的影响Fig.2 Influence of ultrasonic power on intrinsic viscosity
2.1.3 超声的料液比对降解的影响 由图3可见,浓度也是影响降解效果的一个重要因素。“空穴效应”造成多糖分子之间的碰撞对降解有一定的贡献[11]。溶液浓度过低,分子距离较远,产生碰撞少;溶液浓度过高,分子排列过于紧密,也使得剪切碰撞力度不够,分子断裂的机会小,使得降解效果不好。综合考虑之后,超声的料液比选择1.00g/L为最适。

图3 料液对特性粘度的影响Fig.3 Influence of solid-liquid ratio on intrinsic viscosity
2.1.4 pH对超声降解的影响 由图4可见,降解产物的特性粘度随pH的增大呈上升的趋势。当pH小于1.0时,降解产物的特性粘度随pH的变化不大。在pH 1.0~3.0之间,降解产物的特性粘度随pH的增大而增大的趋势明显。说明pH在1.0~3.0之间时,酸性越强,降解效果越好。pH大于3.0以后,降解效果基本不明显。由实验结果看出最适pH应为0.5,可能的原因是由于在较高的H+浓度下,魔芋葡甘聚糖中的糖苷键中的O与H+通过氢键形成分子偶极、诱导偶极和瞬间偶极而消弱了原来的糖苷键,使的降解更为容易[39-41]。但是这么高的pH对实际生产中的设备和安全生产要求太高,成本高可行性较低。
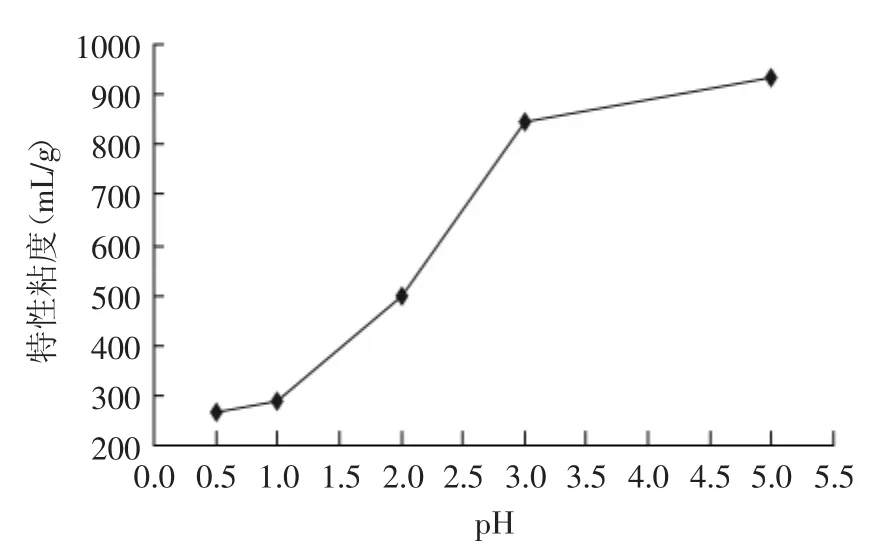
图4 pH对特性粘度的影响Fig.4 Influence of pH on intrinsic viscosity
2.2 酸解单因素实验结果与分析
2.2.1 酸解时间对降解的影响 由图5可知,降解开始阶段,特性粘度随酸解时间的延长急剧减小,而当达到80m in以后,特性粘度已基本上达到稳定,魔芋葡甘聚糖的降解达到平衡,低聚糖的含量基本不再随降解时间的增长而变化。因而,酸解时间选择80m in为最适。
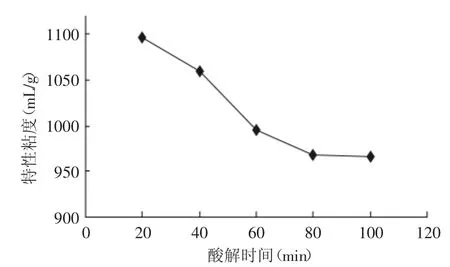
图5 酸解时间对特性粘度的影响Fig.5 Influence of acidolysis time on intrinsic viscosity
2.2.2 酸解温度对降解效果的影响 由图6可知,随着酸解温度的升高特性粘度开始减小,这可能是由于温度升高,分子热运动加剧,体系中H+催化魔芋葡甘聚糖的糖苷键水解加快[42]。而当达到70℃以后,特性粘度已基本上达到稳定,这可能是由于酸解温度过高,导致糖被破坏,使特性粘度增大或不变。
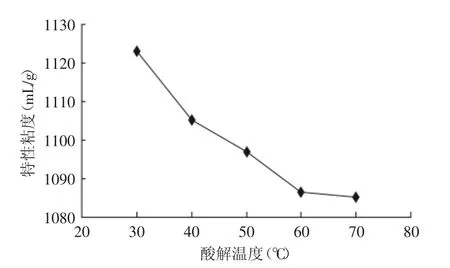
图6 酸解温度对特性粘度的影响Fig.6 Influence of acidolysis temperature on intrinsic viscosity
2.2.3 底物质量浓度对降解效果的影响 由图7可以看出,底物质量浓度在小于1g/L时,特性黏度是随质量浓度的增大而减小,大于1g/L时随底物质量浓度增大而增大。魔芋精粉溶在水中呈胶体状,稀酸溶液对其有一定的水解作用,可以使其分子量减小,降低其粘度。底物质量浓度的增大会增大低聚糖的产量,但底物质量浓度过大,会使胶体粘度过大,影响酸与底物的接触,从而影响酸解效果。
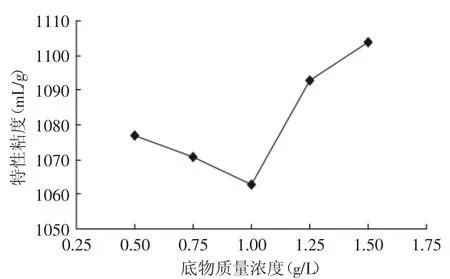
图7 酸解底物浓度对特性粘度的影响Fig.7 Influence of acidolysis substrate concentration on intrinsic viscosity
2.2.4 pH对降解效果的影响 由图8可见,当pH在1~3之间时,降解产物的特性粘度呈上升的趋势,且特性粘度在pH为2~3之间的上升趋势明显大于pH为1~2之间特性粘度的上升趋势。但是之后继续随着pH的增加,特性粘度几乎维持在一个水平,不再变化。说明酸性越强,越有利于魔芋葡甘聚糖的降解。可能的原因是,pH越小,溶液中H+的含量越高,大量的H+可与形成的魔芋低聚糖基团中糖苷键中的氧结合而使基团带正电荷,各带同种电荷的低聚糖基团间因同种电荷间相互排斥,而相互保持一定的距离稳定存在于溶液中。
图8 酸解pH对特性粘度的影响Fig.8 Influence of acidolysis pH on intrinsic viscosity
2.3 酶解单因素实验结果与分析
2.3.1 加酶量对降解效果的影响 结果如图9,由图9可知当加酶量在0.05~0.25g之间时,特性粘度随着加酶量的增加而降低,当加酶量增加到0.25g以后,特性粘度几乎不再减小,基本保持一个固定的水平。因此最佳加酶量为0.25g。
2.3.2 酶解时间对降解效果的影响 结果如图10所示,由图10可知随着酶解时间的延长特性粘度随之降低,当时间达到80m in时,特性粘度的变化趋于缓慢,表明时间太短或太长都不利于酶的降解,时间太短酶解不完全,太长则酶解达到动态平衡后魔芋低聚糖的含量不再随时间的延长而增加[43],说明魔芋葡甘聚糖的降解得到动态平衡,酶解产物的均重分子量区域稳定。因此酶解最佳时间为80m in,同时可以通过控制酶解时间来控制魔芋葡甘聚糖的降解程度及降解产物的均重分子量范围。
图9 加酶量对特性粘度的影响Fig.9 Influence of enzyme amounton intrinsic viscosity
图10 酶解时间对特性粘度的影响Fig.10 Influence of enzymatic hydrolysis time on intrinsic viscosity
2.3.3 底物质量浓度对降解效果的影响 由图11可知当底物质量浓度在0.5~1.0g/L之间时。特性粘度随料液比的增加而降低,粘度在0.75~1.0g/L之间降低的趋势较0.5~0.75g/L明显,在1.0g/L时降为最低,此时的降解效果也最好。当大于1.0g/L时,特性粘度开始增大,这可能是因为底物质量浓度过大,会使胶体粘度过大,影响酶与底物的接触,从而影响酶解效果。
图11 酶解底物浓度对特性粘度的影响Fig.11 Influence of enzymatic hydrolysis substrate concentration on intrinsic viscosity
2.3.4 酶解温度对降解效果的影响 由图12可看出,温度为50℃时降解效果最好,过高或过低都不利于酶解的进行,温度过低,酶的活性受到抑制。温度过高酶的活性降低甚至可能失活,故选择酶解最适温度为50℃。
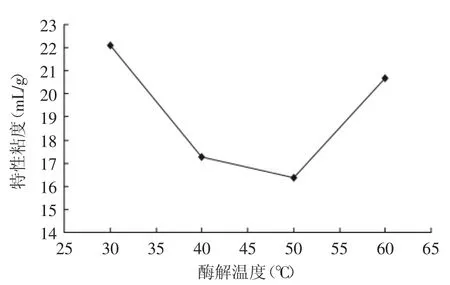
图12 酶解温度对特性粘度的影响Fig.12 Influence of enzymatic hydrolysis temperature on intrinsic viscosity
2.4 正交实验结果与分析
2.4.1 超声波正交实验结果与分析 由表4可以看出,影响超声波降解因素大小的顺序是C>D>A>B,其中因素C和因素D的影响较大,故在生产中应特别控制好pH和料液比;而因素A和因素B的影响强度较小,因此,可从生产的经济性角度考虑,尽可能缩短超声时间和在较低的功率下降解浸提。因此,认为最佳的因素水平搭配是A3B3C3D3。即超声时间110m in,超声功率100W,pH 0.5,料液比为1.0g/L。验证结果计算出特性粘度64.10m L/g。
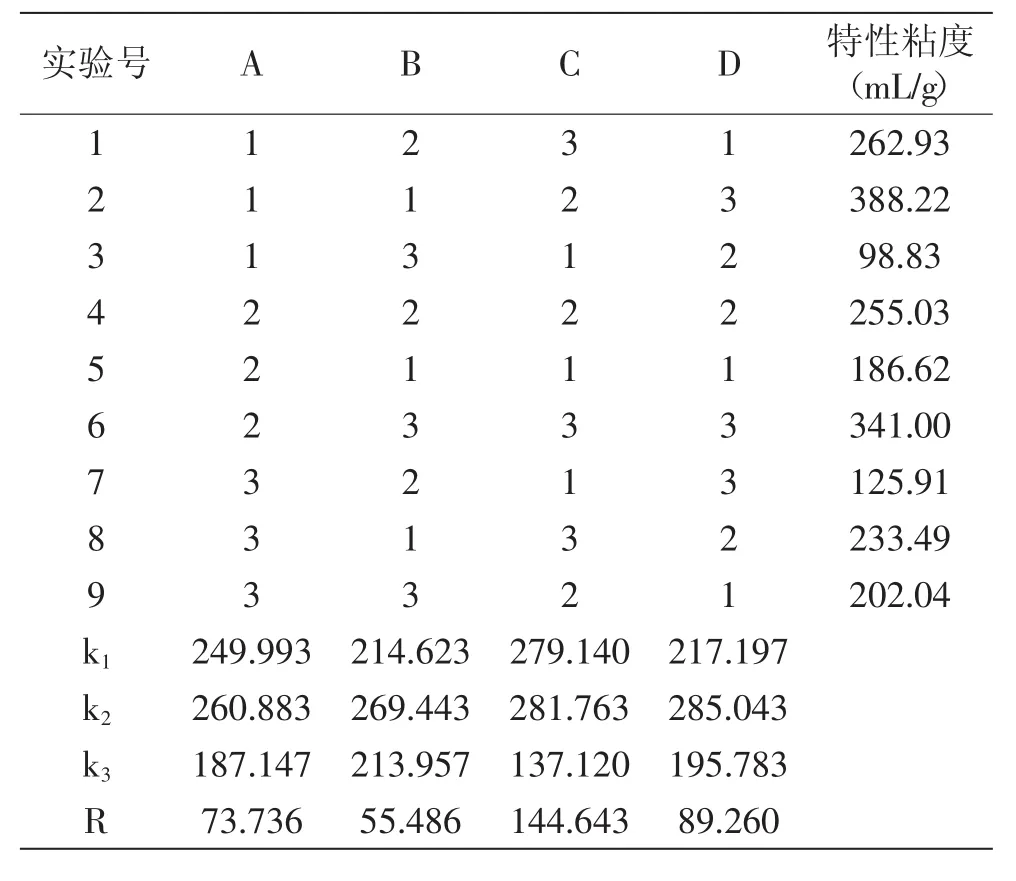
表4 超声波正交实验方案与结果Table 4 The scheme and result of L9(34)ultrasonic orthogonal experiment
2.4.2 酸解正交实验结果与分析 由表5可以看出,影响柠檬酸降解因素大小的顺序是A>C>D>B,其中因素A、因素C和因素D的影响差别相近,故在生产中应特别控制好酸解时间、pH和料液比;而因素B影响强度较小,因此,认为最佳的因素水平搭配是A3B3C3D3。即酸解时间100m in,酸解温度70℃,pH 1,底物质量浓度为0.75g/L。验证结果计算出特性粘度为222m L/g。
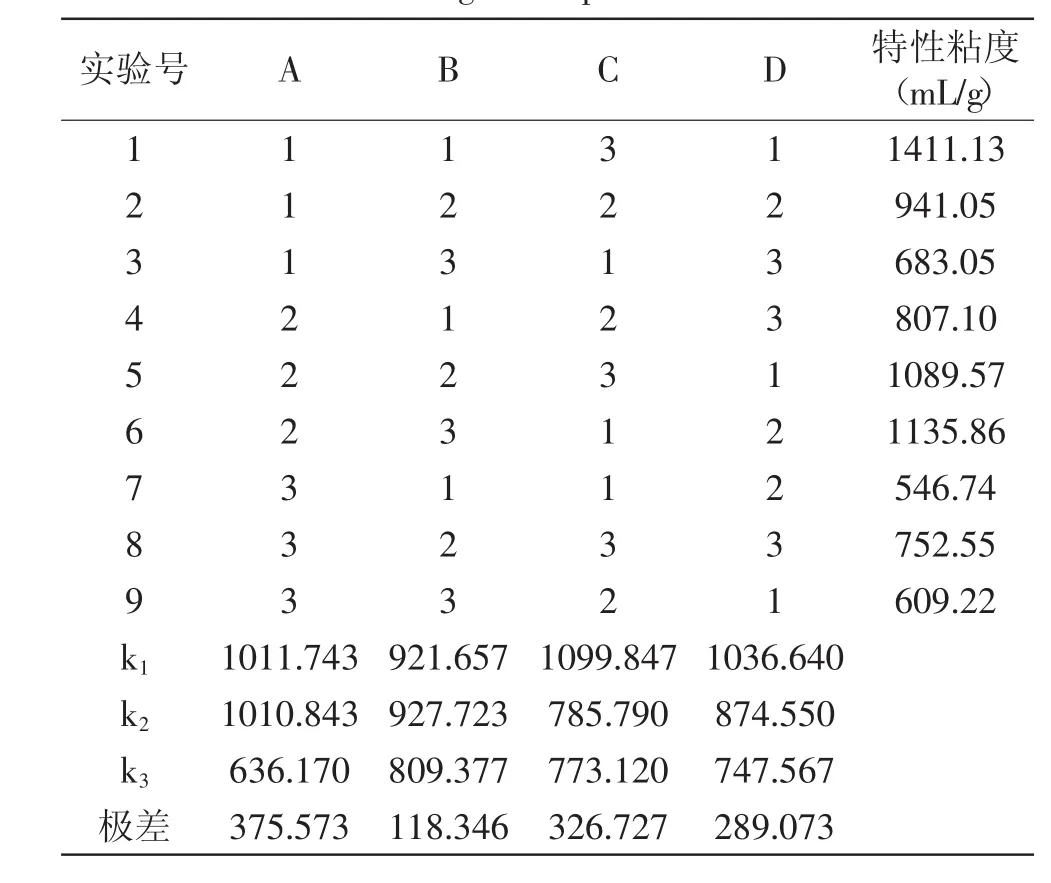
表5 酸解正交实验方案与结果Table 5 The scheme and results of L9(34)acidolysis orthogonal experiment
2.4.3 纤维素酶解正交实验结果与分析 由表6可以看出,影响纤维素酶降解因素大小的顺序是D>C>B>A,其中因素D较其他因素影响较大,故在酶解实验中应控制好料液比;根据正交实验结果,得出最佳的因素水平搭配是A3B1C2D3。即酶解时间100m in,酶解温度50℃,加酶量0.25g,底物质量浓度1.0g/L,验证结果计算出特性粘度为12.50m L/g。

表6 酶解正交实验方案与结果Table 6 The scheme and results of L9(34)enzymatic hydrolysis orthogonal experiment
2.4 三种降解方法得到的还原糖及总糖含量
为了对比三种降解方法对降解产物中还原糖、总糖含量的影响,参照GB/T18104—2000《魔芋精粉》的标准方法对三种不同降解方法得到的魔芋低聚糖溶液所含还原糖和总糖的含量进行测定,每种溶液平行做三组实验。实验所得到的不同降解溶液中还原糖、总糖含量、水解率(水解率=还原糖含量/总糖含量)及特性粘度降解效率见表7。
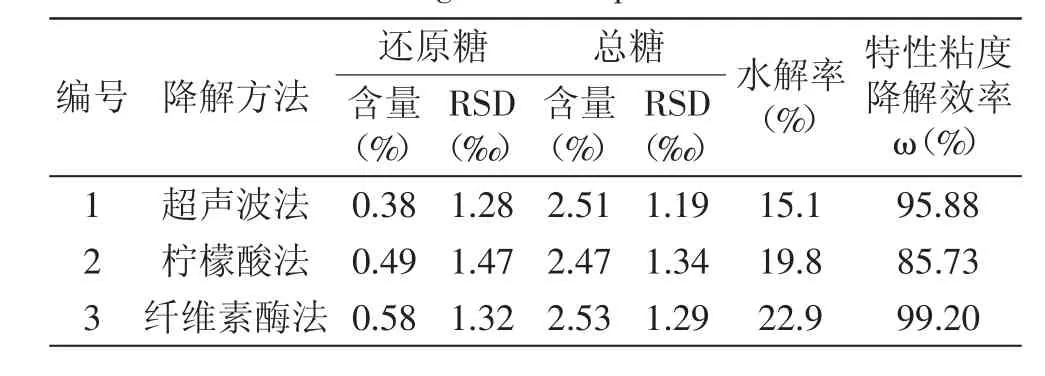
表7 还原糖及总糖含量Table 7 Contentof reducing sugar and total sugar in degradation liquid
由表7可知,超声波法、柠檬酸法、纤维素法在降解魔芋葡甘聚糖时呈现一定的变化趋势。比较三种降解方法得到的还原糖、总糖含量、水解率、特性粘度降解效率和可以得出,纤维素酶法均高于其他两种方法。柠檬酸法得到还原糖含量和水解率高于超声波法,而其降解得到总糖含量和特性粘度降解效率低于超声波法。说明,在三种方法中,纤维素酶法较其他两种降解方法,降解效率更彻底,降解效果更好。
3 结论与讨论
主要采取以上三种方法对魔芋葡苷聚糖进行降解,通过正交实验对三种方法进行了比较。降解前所得魔芋精粉的特性粘度为:1555.74m L/g,超声波降解法最佳条件是超声时间110m in,超声功率100W,pH0.5,料液比为1.0g/L,特性粘度64.10m L/g,粘度降解效率为95.88%;酸解法最佳条件是酸解时间100min,酸解温度70℃,pH1.0,底物质量浓度为0.75g/L,特性粘度为222m L/g,粘度降解效率为85.73%;酶解法的最佳组合为酶解时间100m in,纤维素酶解温度50℃,加酶量0.25g,底物质量浓度1.0g/L,特性粘度为12.50m L/g,粘度降解效率为99.20%。根据特性粘度越小,降解程度越好将此三种方法进行比较,可判断纤维素酶降解所对应的特性粘度最小,降解效果在三种方法中最佳。同时由三种降解方法得到的魔芋低聚糖溶液中还原糖、总糖含量、水解率及粘度降解效率得出,纤维素酶解法降解魔芋葡甘聚糖较超声波法和柠檬酸法降解更为彻底。
由于超声波法和酸解法在降解魔芋葡甘聚糖时用到的酸度过高,反应条件剧烈对生产设备腐蚀极大,降解产物分子大小不易控制,还可能造成水解过度生成单糖或双糖而降低或失去其特殊生理功能。此外酸解时产物的稳定性和复现性较低,并且存在严重的环境污染等问题。综上所述,在三种方法中纤维素酶解法最适合魔芋葡甘聚糖的降解,不仅反应条件相对温和、对环境污染少而且降解效果好。对于魔芋葡甘聚糖降解产物的具体分子量测定及实现魔芋葡甘聚糖的分级降解仍需进一步深入研究。
[1]阚健全,陈宗道.益生元营养及应用研究进展[J].粮食与油脂,2002(2):46-47.
[2]许时婴,杨莉.魔芋葡甘露聚糖的性质与魔芋精粉品质研究[J].无锡轻工业学院学报,1990,3(9):26-32.
[3]陈运忠,侯建成.魔芋胶(魔芋葡甘聚糖KGM)在食品添加剂工业中的应用机理和实践[J].食品工业科技,2006(1):155-157.
[4]冲增哲.魔芋科学[M].重庆食品研究所译,1987.
[5]华西医科大学.魔芋食品对高脂者脂质代谢影响的研究报告[C].全国首届魔芋学术交流会议论文汇编,1988.
[6]王文果.魔芋低聚糖营养及应用的研究进展[J].食品与药品,2006,8(8):12-14.
[7]向进乐,陈文品,刘勤晋.魔芋低聚糖的研究进展[J].中国食品添加剂,2004(1):20-23,26.
[8]SHIMAHARA H,SUZUKIH,SUGIYAMA N,et al.Partial purification of β-mannanase from the tubers and their substrate specificity in relation to the structure of konjac glucomannan[J]. Agricultural and Biological Chemistry,1975,39(2):301-312.
[9]中华医学会消化病学分会胃肠动力组.我国慢性便秘的诊治指南[C].中华消化杂志,2002,22(11):684-687.
[10]莫湘涛,张梅芬,李敏艳.生物法提取魔芋中葡甘露聚糖[J].湖南师范大学自然科学学报,1998,21(1):85-88.
[11]陈峰,钱和.超声波降解魔芋葡甘露聚糖工艺的响应面优化[J].食品工业科技,2008,21(1):146-148,152.
[12]陈黎,杨艳燕,等.魔芋低聚糖降脂作用的初步研究[J].中国生化药物杂志,2002,23(4):181-182.
[13]段蕾,孟艳芬,高润池.魔芋低聚糖的制备及应用[J].广西轻工业,2007,109(12):7-8.
[14]高金,罗丹,刘凯.纤维素酶降解魔芋葡甘聚糖的条件[J].内江师范学报,2010,25(8):48-50.
[15]庞杰,林琼,张甫生,等.魔芋葡甘聚糖功能材料研究应用进展[J].结构学,2003,22(6):633-642.
[16]Vipul Dave,Stephen P McCarthy.Review of Konjac Glucomannan[J].Journal of Environmental Polymer Degradation,1997,5(4):237-241.
[17]许东颖,盛家荣,廖正福,等.魔芋葡甘聚糖的改性与应用研究进展[J].广西师范学院学报,2008,25(3):118-123.
[18]严淑兰,陆大年.壳聚糖H2O2法降解[J].化工新型材料,2001,29(12):21-23.
[19]董岸杰,张晓丽,李军,等.超声波在壳聚糖降解反应中的作用[J].高分子材料科学与工程,2002,18(6):187-189.
[20]张峰,殷佳敏,丁丽娟.超声波辅助降解壳聚糖的研究[J].高分子材料科学与工程,2004,20(1):221-223.
[21]祁黎,李光吉,宗敏华.酶催化魔芋葡甘聚糖的可控降解[J].高分子学报,2003,28(5):650-654.
[22]张迎庆,干信,谢笔钧.纤维素酶制备魔芋葡甘低聚糖[J].吉首大学学报,2003,23(2):42-44.
[23]徐春梅,邬敏辰,李剑芳,等.魔芋葡甘露聚糖的酶水解工艺条件[J].食品与生物技术学报,2008,7(3):120-124.
[24]吴长菲,董岩岩,李俊俊,等.魔芋葡甘露低聚糖的酶法制备工艺的初步研究[J].生物技术通报,2010,15(1):118-122.
[25]罗清楠,谭玉荣,刘宏,等.响应曲面法优化酸解魔芋葡甘露聚糖水解工艺[J].食品科学,2012,19(6):119-122.
[26]张文清.分离分析化学[M].上海:华东理工大学出版社,2007:92.
[27]徐振林,孙远明,丁金龙,等.魔芋葡甘聚糖的辐照降解研究[J].农产品加工,2006,25(10):27-29,46.
[28]徐振林,孙远明,丁金龙.魔芋葡甘聚糖的辐照降解研究[J].农产品加工,2006(10):27-29.
[29]丁金龙,孙远明,杨幼慧.魔芋葡甘聚糖机械力化学降解研究[J].现代食品科技,2008,24(7):621-626.
[30]娄广庆,林向阳,彭树美,等.臭氧降解魔芋葡苷聚糖的效果研究[J].食品科学,2009,30(20):203-206.
[31]徐振林,杨幼慧,孙远明.辐照魔芋葡甘露聚糖的应用研究[J].中国食品学报,2008,8(1):78-82.
[32]李斌,谢笔钧.魔芋葡甘糖分子链形态的研究[J].中国农业科学,2004,37(2):280-284.
[33]黄永春,谢青若,马月飞,等.超声波降解魔芋葡苷聚糖的研究[J].食品科技,2006(9):103-105.
[34]陶兴无,杨海娇,余勇,等.β-葡聚糖酶分级降解魔芋葡甘聚糖工艺研究[J].食品工业科技,2006,27(10):139-141.
[35]侯占伟.魔芋葡甘聚糖的化学改性及其性质研究[D].武汉:武汉理工大学,2008.
[36]许牡丹,汤木红.酸酶结合法制备葡甘露低聚糖的工艺研究[J].现状食品科技,2008,24(1):32-34.
[37]姚雪,韩本超.不同分子量魔芋葡甘露低聚糖的研究进展[J].食品工业科技,2012,33(8):416-419.
[38]朱善农.高聚物链结构.北京:科学出版社,1996:123-130.
[39]李涛,马美湖,邬应龙.氧化-酸解法制备魔芋葡甘低聚糖的初步研究[J].食品与发酵科技,2009,45(1):35-39.
[40]姚雪,韩本超.不同分子量魔芋葡甘露低聚糖的研究进展[J].食品工业科技,2012,33(8):416-419.
[41]何志敏,苏荣欣,齐崴.魔芋葡甘聚糖的pH触发酶解[J].生物加工过程,2004,25(4):36-40.
[42]许牡丹,汤木红.酸酶结合法制备葡甘低聚糖的的工艺研究[J].现代食品科技,2008,24(1):32-24.
[43]张迎庆,干信,谢笔均.纤维素酶制备魔芋葡甘低聚糖[J].吉首大学学报,2003,24(3):42-44.
Research of preparation and production optimization of mannoligosaccharides
DANG Ya1,2,3,4,LIU Shui-ying1,ZHANG Zhi-jian1,WEIYong-hua1
(1.College of Biological Science and Engineering,Shaanxi University of Technology,Hanzhong 723000,China;2.Qin Balan Blueberry Institute of Shaanxi University of Technology,Hanzhong 723000,China;3.Shaanxi Key Laboratory of Bio-Resource,Hanzhong 723000,China;4.Black Organic Food Engineering Technology Research Center in Shaanxi Province,Hanzhong 723000,China)
With konjac purified powder as experimental material,using ultrasonic method,citric acid method andcellulose enzymatic hydrolysis method,the degradation process parameters of konjac glucomannan wereoptimized by the orthogonal test,and these three methods degradation efficiency of konjac glucomannan werecompared in this paper. The results showed that cellulose enzymatic hydrolysis degradation was the best,andthe optimum conditions were as follows:material-liquid ratio was 1.0g/L,dosage of enzyme was 0.25g/L,temperature was 50℃,and enzymatic hydrolysis time was 100min.
konjac purified powder;konjac glucomannan;mannoligosaccharides;ultrasonic degradation;acidic degradation;enzyme deg radation
TS201.2+5
B
1002-0306(2015)08-0250-07
10.13386/j.issn1002-0306.2015.08.044
2014-06-17
党娅(1976-),女,硕士研究生,讲师,研究方向:生物资源开发应用。
陕西省教育厅项目(2013JC01)。
