聚酰胺纯化八角残渣黄酮的工艺研究
2015-10-24司建志周小雷冯家勋缪剑华
司建志,王 硕,周小雷,韦 范,冯家勋,缪剑华,,*
(1.广西大学生命科学与技术学院,广西南宁530005;2.西南濒危药材资源开发国家工程实验室,广西南宁530023)
聚酰胺纯化八角残渣黄酮的工艺研究
司建志1,王 硕2,周小雷2,韦 范2,冯家勋1,缪剑华1,2,*
(1.广西大学生命科学与技术学院,广西南宁530005;2.西南濒危药材资源开发国家工程实验室,广西南宁530023)
目的:研究聚酰胺树脂纯化八角残渣黄酮的工艺。方法:以聚酰胺树脂对八角残渣黄酮的吸附量及解析率为指标,通过静态解吸附实验,确定适于纯化八角残渣黄酮的聚酰胺树脂目数;采用单因素与正交实验优化吸附条件,动态解析实验优化解析条件。结果:聚酰胺纯化八角残渣黄酮最优工艺为上样液浓度为0.05g/mL(生药量),pH为5,聚酰胺柱床高度与内径比为12∶1,流速为1~2BV/h,饱和吸附体积为7.5~8BV,待吸附饱和后,用蒸馏水冲洗聚酰胺树脂柱至Molish反应呈阴性,用4BV体积的90%乙醇洗脱,解析率为70.77%,收集流份液,在60℃下减压回收乙醇至无醇味,干物质中黄酮纯度为87.5%。结论:聚酰胺树脂能有效的纯化八角渣黄酮,最终所得黄酮纯度高,适于工业化生产。
聚酰胺,八角,黄酮,纯化
八角为八角茴香(Illicium verum Hook.f.)的干燥成熟果实,是我国特产香辛料和中药材,主要分布于广西、广东、云南等地,其味辛,性温,有温阳散寒,理气止痛功效,用于寒疝腹痛、肾虚腰痛等症[1]。目前八角中得到开发应用的主要功效成分包括以反式茴香脑为主的挥发油和莽草酸,其中八角挥发油广泛用于香水、香皂、饮料、食品、烟草、制药、牙膏、洗涤及化妆品等行业,莽草酸则是合成抗禽流感药物“达菲”的原料。近年来的研究表明,八角提取物还具有良好的抑菌、镇痛及抗氧化[2-4]等作用,这与八角中黄酮类成分的药理作用有着密切关系,而富含黄酮的八角残渣在原料八角提取八角挥发油和莽草酸之后常被丢弃或作为有机肥料,未能得到有效的开发利用。
作为天然植物成分中的研究重点,黄酮类化合物具有清除自由基抗氧化、抗衰老、保护心血管作用、抗癌抗肿瘤、抑菌抗病毒[5-9]等广泛的药理作用。近年来植物黄酮的精制纯化一般采用树脂柱层析法,此方法不仅简单、成本低、效率高、稳定性好,而且树脂容易再生,没有重金属和有毒有机试剂残留等问题,适于工业化制备。目前应用于植物黄酮分离纯化的树脂主要为大孔树脂与聚酰胺树脂,相对于大孔树脂,聚酰胺树脂利用了黄酮类化合物富含酚羟基的特点,通过黄酮分子中的酚羟基与聚酰胺分子中的酰胺基形成氢键缔合产生吸附[10-11],将黄酮类物质与多糖、蛋白质等极性大的物质分离,从而达到纯化黄酮效果,而且其具有可重复利用、选择性高、分离效果好、操作简便等特点,常用于天然植物黄酮类化合物的分离纯化[12-14]。八角中黄酮类成分多为黄酮苷类[15],聚酰胺树脂非常适合八角中黄酮类物质与其他物质的分离纯化,本实验探究了聚酰胺树脂对八角残渣黄酮吸附与解析过程,为制备八角残渣黄酮提供了理论研究。
1 材料与方法
1.1 材料与仪器
八角果实 产自广西;八角残渣 八角果实经水蒸馏提取挥发油与莽草酸后的剩余残渣,烘干后备用;芦丁标准品、聚酰胺树脂 国药集团化学试剂有限公司;氢氧化钠、亚硝酸钠、硝酸铝、95%乙醇 均为分析纯。
CP224S型电子分析天平 德国Sartorius公司;JJ500型电子天平 常熟市双杰测试仪器厂;UVm ini-1240型紫外可见分光光度计 日本岛津公司;EYEL4 N-1100型旋转蒸发仪 艾拓思实验设备有限公司;EYEL4 A-1000S型真空泵 艾拓思实验设备有限公司;QYC 200型恒温摇床 上海福玛实验设备有限公司;HL-2型恒流泵 上海精科实业有限公司;GRX6型电热恒温鼓风干燥箱 上海天恒医疗器械有限公司。
1.2 实验方法
1.2.1 八角残渣黄酮提取液的制备 称取干燥的八角残渣20g[16],置于圆底烧瓶中,加入50%乙醇500m L,回流提取两次,每次提取时间为4.5h,合并提取液用旋转蒸发仪在60℃下减压回收乙醇至无醇味,用蒸馏水定容至体积200m L,即得0.1g/m L(生药量)的八角残渣黄酮提取液,冷冻保存,备用。
1.2.2 八角渣黄酮测定方法 精密称取芦丁5mg,用60%乙醇溶解,并定容于25m L的容量瓶中,芦丁浓度为0.2mg/m L。依次量取0、0.4、0.8、1.2、1.6、2.0、2.4m L芦丁标准液于10m L量管中,加60%乙醇补足至5m L。依次再加入0.4m L 5%NaNO2溶液,摇匀、静置6m in;然后向各量管中加入0.4m L 5%A l(NO3)3溶液,摇匀,静置6m in;再加入4m L 4%NaOH溶液,然后用60%乙醇补充至10m L,静置15m in。取芦丁标准品溶液和八角残渣黄酮提取液经Na2NO2-A l(NO3)3-NaOH体系显色后在紫外分光光度仪上进行200~700nm全波长扫描。芦丁标准品溶液和八角总黄酮提取液在500nm处均有最大吸收峰,因此选择500nm为检测波长,测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线[17]。
1.2.3 聚酰胺树脂的预处理 将聚酰胺树脂用95%乙醇浸泡24h,使之充分溶胀,倾去乙醇漂浮物后湿法装柱,用蒸馏水洗至无醇味,再用2~3倍BV的5% NaOH溶液冲洗,接着再用蒸馏水冲洗至中性,然后用2~3倍BV的10%稀醋酸冲洗,最后用蒸馏水洗至pH为中性[18],40℃烘干备用。
1.2.4 静态解吸附实验 精确称取四种处理过的目数分别为30~60、60~80、80~100、100~200目的聚酰胺树脂各1.00g置于4个250m L磨口三角瓶中,每个三角瓶中均加入50m L 0.10g/m L(生药量)八角渣黄酮提取液(提取液黄酮浓度C0),置25℃转速180r/m in的恒温摇床中,每0.5h从三角瓶中取上清液1m L,按1.2.2中八角渣黄酮测定方法测定其吸光度,按标准曲线换算出黄酮浓度C1。待吸附平衡后,将三角瓶中上清液倒去,加入50m L 60%的乙醇溶液,置25℃转速180r/min的恒温摇床中,每0.5h从三角瓶中取上清液1m L,按1.2.2中八角渣黄酮测定方法测定其吸光度,按标准曲线换算出黄酮浓度C2,计算吸附量Q(mg/g)和解析率J(%)。Q=(C0-C1)V/M;J(%)=C2/(C0-C1)×100,其中V为提取液体积,M为树脂质量。
1.2.5 动态吸附实验
1.2.5.1 上柱液浓度的选择 精确称取处理过30~60目的聚酰胺树脂3.00g,95%乙醇湿法上柱,用蒸馏水冲洗至无醇味,将八角渣黄酮浸膏依次配制成0.01g/m L×15BV、0.02g/m L×7.5BV、0.03g/m L×5BV、0.04g/m L×3.75BV、0.05g/m L×3BV、0.06g/m L×2.5BV(生药量浓度×体积)一系列的上样液,上样液pH为5,柱床高度与内径比为6∶1,流速为2BV/h,收集流份液,蒸馏水定容到适当体积,测定其中黄酮浓度,计算吸附量Q(mg/g),Q=(C0×V0-C1×V1)/M,其中C0为提取液中黄酮浓度,C1为流份液中黄酮浓度,V0为提取液体积,V1为流份液定容体积,M为树脂质量。
1.2.5.2 上柱液pH的选择 精确称取处理过30~60目的聚酰胺树脂3.00g,95%乙醇湿法上柱,用蒸馏水冲洗至无醇味,取0.03g/m L×5BV(生药量浓度)的上样液,用5%的NaOH或HCl将pH依次调配为3、4、5、6、7、8,柱床高度与内径比为6∶1,流速为2BV/h,收集流份液,蒸馏水定容到适当体积,测定其中黄酮浓度,按1.2.5.1中的计算方法计算吸附量Q(mg/g)。
1.2.5.3 柱床高度与内径比的选择 依次精确称取处理过30~60目的聚酰胺树脂1.50、3.00、4.50、6.00、7.50g,95%乙醇湿法上柱,用蒸馏水冲洗至无醇味,取0.03g/m L×5BV(生药量浓度)的上样液,上样液pH为5,柱床高度与内径比依次为3∶1、6∶1、9∶1、12∶1、15∶1,流速为2BV/h,收集流份液,蒸馏水定容到适当体积,测定其中黄酮浓度,按1.2.5.1中的计算方法计算吸附量Q(mg/g)。
1.2.5.4 流速的选择 精确称取处理过30~60目的聚酰胺树脂4.50g,95%乙醇湿法上柱,用蒸馏水冲洗至无醇味,取0.03g/m L×5BV(生药量浓度)的上样液,上样液pH为5,柱床高度与内径比为9∶1,流速依次为1、2、3、4BV/h,收集流份液,蒸馏水定容到适当体积,测定其中黄酮浓度,按1.2.5.1中的计算方法计算吸附量Q(mg/g)。
1.2.5.5 正交实验 根据动态吸附单因素实验结果,选取合适实验因素水平设计L9(34)正交实验筛选最优吸附工艺条件,见表1。

表1 正交试验因素水平表Table 1 The factors and levels of orthogonal test
1.2.5.6 动态吸附曲线 按最佳吸附工艺上样,收集过柱液,每0.5BV为1流份,测定各流份中总黄酮浓度,以流份液体积为横坐标,流份液中总黄酮浓度为纵坐标绘制动态吸附曲线。收集流份液,蒸馏水定容到适当体积,测定其中黄酮浓度,按1.2.5.1中的计算方法计算饱和吸附量Q(mg/g)。
1.2.6 动态解析实验 取1.2.5.6中已经吸附饱和的聚酰胺树脂柱,先用蒸馏水冲洗至流份Molish反应呈阴性,分别用30%、50%、70%、90%的乙醇冲洗,洗脱流速与吸附流速相一致,收集过柱液,每0.5BV为一流份,各流份取1m L按1.2.2中八角渣黄酮测定方法测定测定其中的黄酮浓度C,以洗脱乙醇体积为横坐标,流份中黄酮浓度为横坐标绘制动态解析曲线,收集流份液,测其中黄酮的浓度,计算解析率J,J(%)= Q×M÷(V×C)×100,其中Q为1.2.5.6中饱和吸附量,M为聚酰胺质量,V为流份液体积,C为流份液黄酮浓度。
2 结果与分析
2.1 标准曲线的绘制
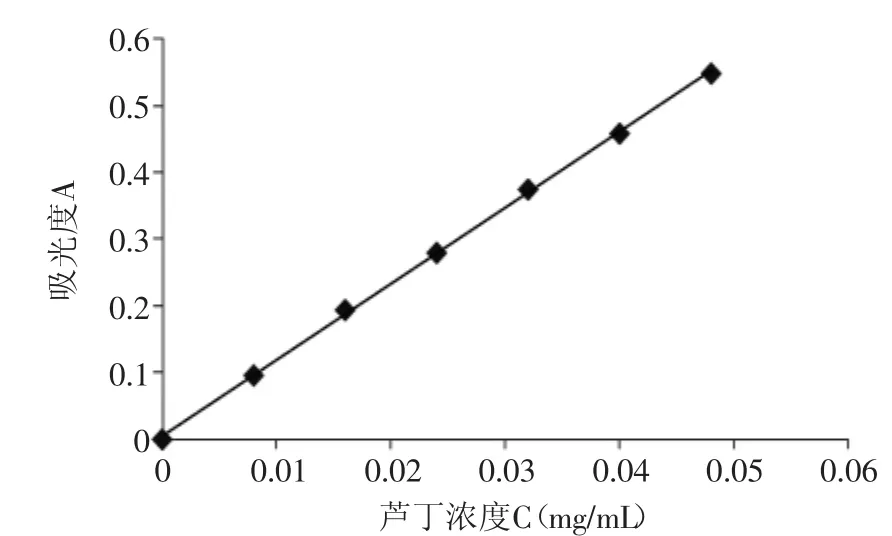
图1 芦丁标准曲线Fig.1 Standard curve of rutin
用最小二乘法进行线性回归,得芦丁质量浓度与吸光度之间的回归方程:A=11.402C+0.0054(R2= 0.9995),线性范围:0.008~0.048mg/m L,式中A为吸光度,C为总黄酮浓度(mg/m L)。
2.2 静态吸附实验结果
2.2.1 静态解吸附曲线 不同目数的聚酰胺树脂的静态吸附、解析特性随时间变化的结果如图2、图3所示。
如图2、图3可知,聚酰胺树脂对八角残渣黄酮吸附与解析均为快速平衡型,在2h内基本达到平衡,故聚酰胺树脂对八角残渣黄酮具有良好的静态吸附动力学特性,节约时间,合适工业化生产。
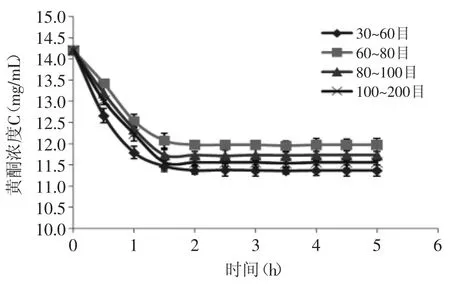
图2 静态吸附曲线Fig.2 Static adsorption curve
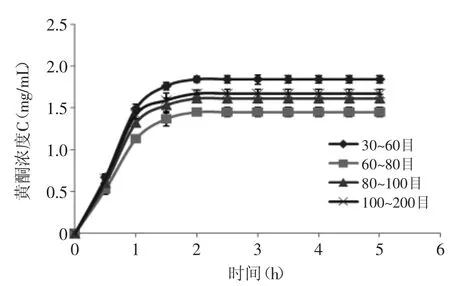
图3 静态解析曲线Fig.3 Static desorption curve
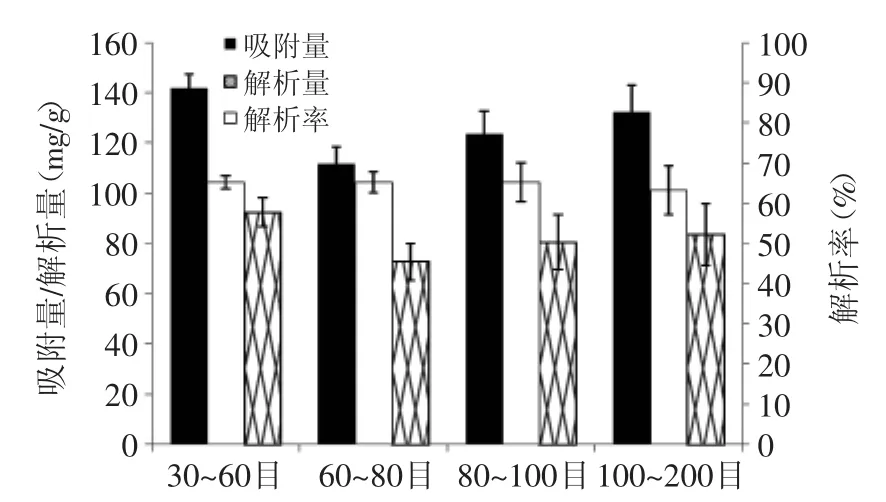
图4 不同目数的聚酰胺树脂的静态吸附参数Fig.4 Static adsorption parameters of differentmesh of polyamide resin
2.2.2 聚酰胺树脂目数的选择 由图4可知,不同目数树脂的吸附量差异较大,其中的树脂吸附量最高的为30~60目(141.65mg/g),其次为100~200目(132.07mg/g),实验结果不符合常规结果[19-20],与聚酰胺树脂纯化甘草黄酮[21]的实验结果相类似,这或许是因为在静态吸附过程中高目数的聚酰胺树脂较容易粘附在三角瓶底,与高浓度的提取液接触不充分,造成部分死吸附;由静态实验结果可知,不同目数树脂的解析率相差不大,而目数越高,聚酰胺树脂吸附黄酮的能力也越强,但颗粒过细造成的死吸附会明显降低树脂的利用率,综合考虑选用30~60目的树脂进行动态吸附实验。
2.3 动态吸附实验结果
2.3.1 上柱液浓度对吸附性能的影响 上柱液浓度对聚酰胺树脂吸附性能的影响如图5所示。

图5 上柱液浓度对吸附量的影响Fig.5 The influence of concentration on the adsorption capacity
由图5可知,在0.01~0.05g/m L(生药量)浓度范围内,树脂吸附量是随着上柱液浓度的上升而增加,但当浓度超过0.05g/m L之后,树脂吸附量不升反降,这可能是因为上柱液浓度增大后,黏度增加不利于树脂吸附。
2.3.2 上柱液pH对吸附性能的影响 由图6可知,随着pH的提高,树脂吸附量呈先上升后下降的趋势,在pH为5时,吸附量达到最大,强酸环境下,黄酮易被水解,在碱性条件下,黄酮以盐的形式存在,这两种形式均不利于树脂吸附。
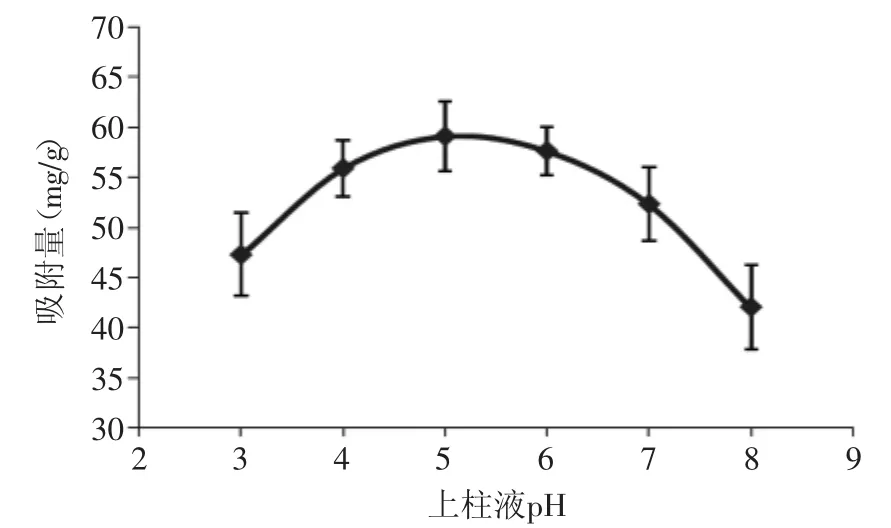
图6 上柱液pH对吸附量的影响Fig.6 The influence of pH on the adsorption capacity
2.3.3 层析柱高度与内径的比值对吸附性能的影响层析柱高度与内径的比值(高径比)对树脂吸附性能的影响如图7所示。
如图7所示,在一定范围内,聚酰胺树脂对八角残渣黄酮的吸附量与高径比呈正相关,但随着柱高继续增加,吸附量增加速度变缓,这与聚酰胺层析柱内死吸附随着层析柱高度的上升而增加,进而影响提取液中黄酮与聚酰胺树脂传质过程。
2.3.4 流速对吸附性能的影响 流速对树脂吸附性能的影响如图8所示。
如图8所示,随着流速增加,聚酰胺树脂对八角残渣黄酮的吸附量呈下降趋势,这表明低流速有利于树脂对于黄酮的吸附,而高流速则容易导致黄酮来不及与树脂缔合形成氢键,被冲洗下来,提早造成泄漏。
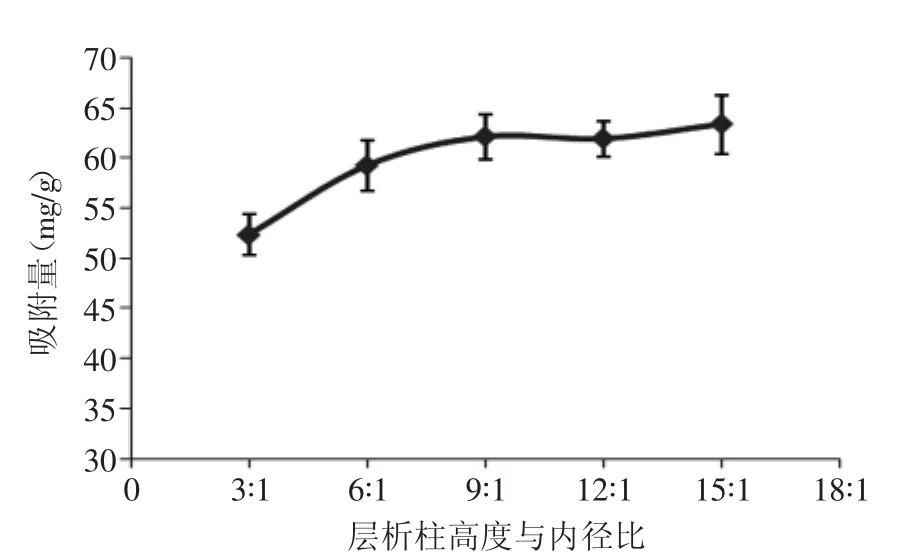
图7 层析柱高度与内径之比对吸附量的影响Fig.7 The influence of diameter-height ratio of column on the adsorption capacity
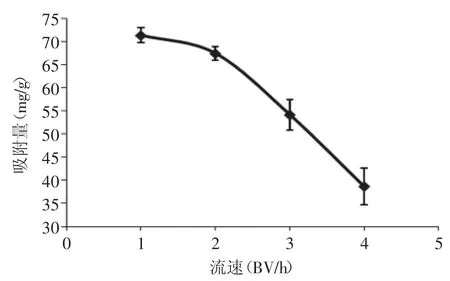
图8 流速对吸附性能的影响Fig.8 The influence of flow rate on the adsorption capacity
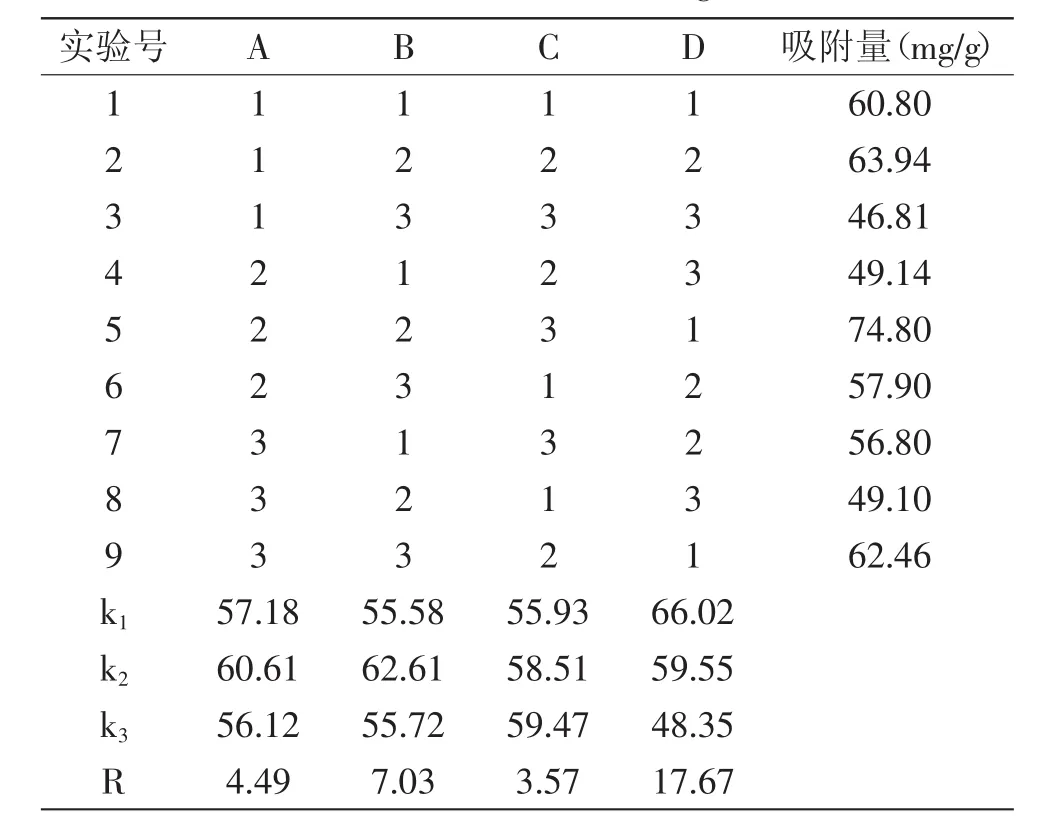
表2 L9(34)正交实验设计及结果Table 2 Results of L9(34)orthogonal test
2.3.5 正交实验设计与分析 由正交实验结果表明,从极差R值可以看出D>B>A>C,即各因素对聚酰胺树脂吸附能力影响顺序为流速>pH>浓度>高径比。方差分析结果表明,流速对聚酰胺树脂吸附能力显著,其他因素对吸附能力不显著。综合考虑得出,聚酰胺树脂对八角渣黄酮的最佳吸附条件为A2B2C3D1,即上样液浓度为0.05g/m L(生药量),上样液pH为5,高径比为12∶1,流速为1BV/h,效果最佳,吸附量达74.80mg/g,这与正交结果相一致。考虑到实际生产中,1BV/h流速耗时较多,流速可采用1~2BV/h。
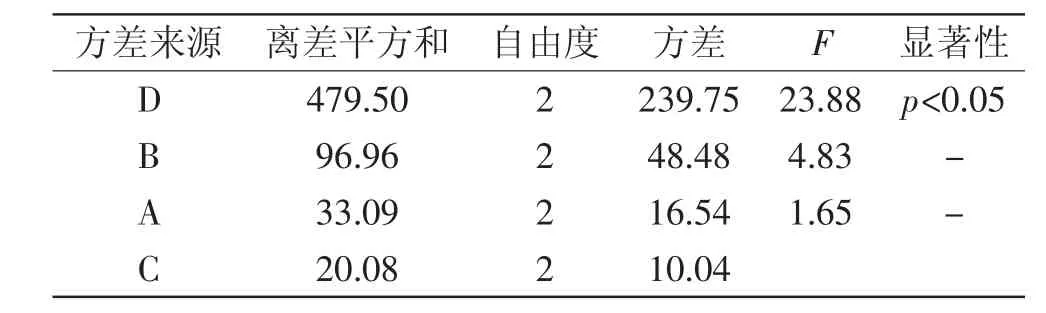
表3 正交试验方差分析Table 3 Analysis of variance of orthogonal test
2.3.6 饱和吸附曲线 由吸附曲线得知,在最佳吸附条件下聚酰胺层析柱的泄露体积为1.5~2BV,饱和体积为8~8.5BV,收集流份液,测定黄酮浓度,饱和吸附量为150.06mg/g。
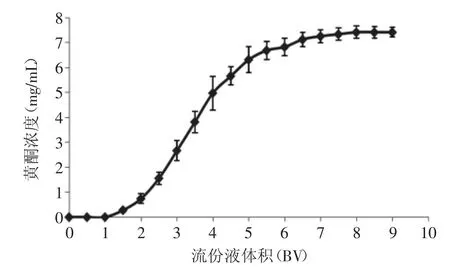
图9 聚酰胺树脂动态吸附饱和曲线Fig.9 Polyamide resin dynamic adsorption saturation curve
2.4 动态解析实验结果
不同浓度乙醇对于八角残渣黄酮动态解析特性如图10所示。

图10 不同浓度乙醇的解析曲线Fig.10 Desorption curves of different concentration of ethanol
由图10可知,随着乙醇浓度的增加,洗脱液对八角残渣黄酮的解析效果越好。优化后的解析条件为洗脱流速1BV/h,90%乙醇对聚酰胺树脂柱进行冲洗,洗头体积为4BV,黄酮解析率为70.77%,收集流份液,在60℃下减压回收乙醇至无醇味,干物质中黄酮纯度为87.5%。
3 结论
采用单因素实验结合正交实验考察了聚酰胺树脂纯化工艺中常见的因素,在本实验范围内,30~60目聚酰胺树脂适宜八角残渣黄酮的纯化,流速对于聚酰胺树脂的吸附影响最大,其次为上柱液pH,上柱液浓度,层析柱高度与内径比,得出聚酰胺树脂吸附八角残渣黄酮的最佳工艺为:上柱液浓度为0.05g/m L(生药量),上柱液pH为5,层析柱高度与内径的比值为12∶1,上柱液流速为1~2BV/h,饱和吸附量为150.06mg/g。树脂饱和吸附后,用蒸馏水冲洗树脂柱至Molish反应呈阴性,4BV体积的90%乙醇冲洗树脂柱,解析率为70.77%,提取液经聚酰胺树脂纯化后,60℃下减压回收乙醇至无醇味,干物质中黄酮纯度达87.5%。该工艺纯化效果好,操作简单,为开发利用八角残渣中黄酮提供参考依据。
[1]国家药典委员会.中华人民共和国药典[M].2011年版(一部).北京:化学工业出版社,2010:4.附录53,62.
[2]陆宁海,吴利民,石明旺,等.不同溶剂提取八角茴香抑菌活性物质的初步研究[J].广东农业科学,2011,38(22):75-77.
[3]曾万玲,李淑贞.红花八角醇提液对小鼠免疫功能的影响[J].贵阳中医学院学报,1992,14(2):60-62.
[4]缪晓平,何泳欣,邓开野.八角茴香提取物抗氧化的研究[J].中国调味品,2010,35(8):56-58.
[5]Ammar BR,BhouriW,Sghaier BM,etal.Antioxidant and free radical scavenging properties of three flavonoids isolated from the leaves of Rhamnus alaternus L.(Rhamnaceae):A structure activity relationship study[J].Food Chemistry,2009,116(1):258-264.
[6]宗灿华,马山,于国萍.荷叶黄酮抗衰老作用研究[J].中国食物与营养,2008(10):52-53.
[7]Naruszewicz M,Laniewska I,Millo B,et al.Combination therapy of statin with flavonoids rich extract from chokeberry fruits enhanced reduction in cardiovascular risk markers in patients after myocardial infraction(MI)[J].Atherosclerosis,2007,194(2):e179-84.
[8]Haddad AQ,Venkateswaran V,Viswanathan L,etal.Novel antiproliferative flavonoids induce cell cycle arrest in human prostate cancer cell lines[J].Prostate Cancer Prostatic Dis,2006,9(1):68-76.
[9]李叶,唐浩国,刘建学.黄酮类化合物抑菌作用的研究进展[J].农产品加工·学刊,2009(12):53-55.
[10]方小燕.聚酰胺树脂在分离纯化黄酮中的应用研究[J].海峡药学,2013,25(5):41-42.
[11]薛扬,吴唯.聚酰胺树脂的层析分离应用[J].化工新型材料,2005,33(4):50-53.
[12]苗建武,陈绍民,王超,等.聚酰胺树脂分离纯化丹参总酚酸的研究[J].中国实验方剂学杂志,2011,17(3):28-30.
[13]吴新荣,刘志刚,颜仁梁,等.聚酰胺颗粒分离纯化土茯苓总黄酮研究[J].中药材,2009,32(10):1606-1609.
[14]蔡凌云,黎云祥,石凤湘,等.白簕叶总黄酮的聚酰胺树脂纯化工艺[J].时珍国医国药,2011,22(4):926-929.
[15]袁经权,周小雷,王硕,等.八角茴香化学成分的研究[J].中成药,2010,32(12):2123-2126.
[16]舒鑫,刘雄民,王巧,等.八角和八角残渣总黄酮提取工艺优化[J].食品科学,2011,31(6):65-68.
[17]李耀华,劳深,袁经权,等.不同产地八角茴香中总黄酮的含量测定[J].广西中医学院学报,2009,12(3):56-57.
[18]乔蓉,钟世安,邓潇君,等.聚酰胺树脂纯化荷叶碱的工艺研究[J].化学与生物工程,2008,25(5):35-38.
[19]白云娥,漆小梅,赵华,等.聚酰胺分离金莲花总黄酮[J].中国医院药学杂,2006,26(5):512-514.
[20]张玉,吴慧明,余建伟,等.聚酰胺分离纯化柑桔皮中总黄酮的工艺研究[J].食品工业科技,2011,28(11):147-148.
[21]刘佳,季芳,孙陶利,等.甘草黄酮分离纯化工艺[J].中国实验方剂学杂志,2012,18(10):50-52.
Study on purification technology for flavonoids from star aniseed residue with polyamide resin
SI Jian-zhi1,WANG Shuo2,ZHOU Xiao-lei2,WEIFan2,FENG Jia-xun2,MIAO Jian-hua1,2,*
(1.College of Life Science&Technology,Guangxi University,Nanning 530005,China;2.Southwest Endangered Medicinal Resources Development,Nanning 530023,China)
Objective:The aim of this research was to study polyamide purification technology of flavonoids fromstar aniseed residue. Methods: With the absorption and desorption capacity as indexes,the optimal mesh ofpolyamide purification for flavonoids was determined from star aniseed residue through static absorption anddesorption experiment,the adsorption conditions were optimized from single factor and orthogonal designexperiment,the desorption conditions were optimized from dynamic desorption experiments. Results:The optimalpurification technology conditions:sample concentration was 0.05g/mL(Crude drug concentration),pH5.0,height-diameter ratio of column 12∶1,flow rate 1~2BV/h,saturated adsorption volume 7.5~8BV,after beingsaturated adsorption,the polyamide resin column was washed with distilled water until Molish were negative,with 4BV 90% ethanol elution volume,at desorption rate of 70.77% ,collect flow of fluid,recycling ethanol at60℃,the purity of flavonoids from dry matter medium was 87.5%. Conclusion:Purified effect of flavonoids fromstar aniseed residue by polyamide resin was effectively and the finally purity of the flavonoids obtained washigh,it was suitable for industrial production.
polyamide;star aniseed;flavonoids;purification
TS201.2
B
1002-0306(2015)08-0245-06
10.13386/j.issn1002-0306.2015.08.043
2014-08-06
司建志(1988-),男,硕士研究生,研究方向:中药有效成分分离提取。
*通讯作者:缪剑华(1962-),男,博士,研究员,研究方向:药用植物资源学。
国家科技支撑计划(2011BAI01B04)。
