高产阿魏酸酯酶菌株的筛选及其产酶条件优化
2015-10-24胡茂丰吴章华刘素纯
陈 锦,胡茂丰,吴章华,刘素纯,4,*
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.湖南农业大学生物科学技术学院,湖南长沙410128;3.长沙市调料食品工程技术研究中心,湖南长沙410000;4.食品科学与生物技术湖南省重点实验室,湖南长沙410128)
高产阿魏酸酯酶菌株的筛选及其产酶条件优化
陈 锦1,胡茂丰2,吴章华3,刘素纯1,4,*
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.湖南农业大学生物科学技术学院,湖南长沙410128;3.长沙市调料食品工程技术研究中心,湖南长沙410000;4.食品科学与生物技术湖南省重点实验室,湖南长沙410128)
通过初筛、复筛从茯砖茶中筛选到了1株产阿魏酸酯酶活力较高的菌株,经个体形态和菌落特征初步鉴定其为冠突散囊菌;以阿魏酸酯酶酶活为衡量指标,选取黑毛茶含水量、接种量、培养温度、培养时间为因子,研究确定筛选出来的冠突散囊菌进行固态发酵黑毛茶的产酶条件。结果表明:黑毛茶固态发酵实验中,黑毛茶含水量26%,接种量1‰,温度30℃条件下培养4d,其酶活力最高可以达到142mU/g。
阿魏酸酯酶,酶活,发酵型茶,冠突散囊菌,筛选
茯砖茶是具有浓郁地方特色的中国传统茶类之一,属于“后发酵茶”,有其独特的品质风味,深受人们喜爱。微生物在其渥堆过程中起到关键作用,Green walt[1]研究表明经微生物发酵后的茶比绿茶具有更高的生物活性,这种活性主要来源于酚酸类物质。阿魏酸是桂皮酸的衍生物,是普遍存在的一种酚酸,具有抗氧化[2]、抗血栓[3]、降血脂[4]、抗菌消炎[5]以及抗突变防癌[6]等功能。阿魏酸酯酶(FAE)是酸羧酸酯水解的一个亚类,属胞外酶,能水解阿魏酸甲酯、低聚糖阿魏酸酯酸和多糖中的酯键,将阿魏酸游离出来,真菌、细菌和酵母都能分泌阿魏酸酯酶[7]。各种微生物分泌的阿魏酸酯酶,在氨基酸序列、肽键的结构、物化性质和催化特性上都有所不同。但目前,由真菌分泌的阿魏酸酯酶受到研究者的关注较多。国内外大多集中在黑曲霉(Aspergillusniger)、米曲霉(Aspergillus oryzae)、嗜松青霉(Penicillium pinophilum)等的研究上[8],而发酵原料也主要以甘蔗渣、麦麸为主,国内目前还未见茯砖茶中微生物产阿魏酸酯酶的报道。笔者从茯砖茶中筛选出一株高产阿魏酸酯酶菌株,通过菌落形态和个体形态初步鉴定为冠突散囊菌,并通过实验对该菌株的固态发酵产阿魏酸的培养条件进行了研究,希望能为生产实践提供理论基础。
1 材料与方法
1.1 材料与仪器
菌种筛选茶叶样本 湖南黑茶市场所购得湘益茯砖茶,湖南益阳茶厂有限公司,中药粉碎机粉碎过100目筛后于阴凉处避光保存;产酶条件优化实验所用原料 湖南黑茶市场所购黑毛茶原料,中药粉碎机粉碎过100目筛后,备用。
FW 135中药粉碎机 天津市泰斯特仪器有限公司;SW-CJ-2G双人单面净化工作台 江苏通净净化设备有限公司;DNP恒温培养箱 上海精宏仪器设备有限公司;BCD-206BD电冰箱 青岛海尔有限公司;TE214S分析天平 长沙康源科技开发有限公司;LDZX-50KBS高压灭菌锅 上海申安医疗器械厂;UV-1601紫外可见分光光度计 北京瑞利分析仪器有限公司;CF-RXⅡ离心机 日本日立公司;CG-3015A光学显微镜 上海普光光学仪器厂。
1.2 实验方法
1.2.1 培养基的配制
1.2.1.1 菌种分离培养基(PDA) 马铃薯200g,葡萄糖20g,琼脂20g,水1000m L,pH 6.8[9]。
1.2.1.2 初筛培养基 FeSO4·7H2O 0.01g,NaNO32.0g,KCl 0.5g,MgSO4·7H2O 0.5g,K2HPO41.0g,蔗糖30g,琼脂20g,蒸馏水1L,pH自然;121℃灭菌20m in。每个平板倒入约20m L培养基后,立即加入0.3m L无菌的含阿魏酸乙酯的二甲基甲酰胺溶液(质量体积比为10%),摇匀至平板呈均匀的乳白色[10]。
1.2.1.3 复筛培养基(发酵培养基) FeSO4·7H2O 0.01g,NaNO32.0g,KCl0.5g,K2HPO40.76g,MgSO4·7H2O 0.5g,蒸馏水1L,pH 6.8,取50m L培养基,1g黑毛茶于250m L三角瓶中,于121℃灭菌20min。将培养24h的种子液按体积比为4%的接种量接种到50m L发酵培养基中,于30℃,180r·min-1下培养3d[11]。
1.2.2 菌种的筛选与鉴定 将茶叶样品湘益茯砖茶用中药粉碎机粉碎至100目过筛后,称取粉碎后的样品25g,放置在含225m L无菌生理水与玻璃珠的500m L三角瓶内,盖上封口膜,在振荡仪上200r·min-1振摇30m in,使其中微生物充分分散,制成10-1倍样品稀释液。在超净工作台上用梯度稀释法得到10-2、10-3、10-4、10-5、10-6倍样品稀释液,取10-4、10-5、10-6三个稀释度样液各1m L涂布于改良PDA,放置在28℃培养箱内倒置培养2d。
分离纯化后的单菌落接种到初筛培养基的平板上,于30℃培养5d;然后将产生透明圈的菌落用划线分离的方法再一次接种于初筛培养基的平板上,培养4d得到纯菌落平板。最后,从纯化后的平板上选取1株透明圈最大的菌种,接种于50m L的PDA种子培养基,于30℃培养1d后以体积比为4%的接种量接于50m L复筛培养基中,于30℃培养7d,每24h取样1次测定酶活。在马铃薯琼脂平板上培养菌株,观察菌落培养特征和显微形态,依照《食品微生物学标准鉴定图谱》[12]以及《中国真菌志》[13]对其进行鉴定。
1.2.3 固态发酵剂的制备 15g粉碎后的黑毛茶加水10m L充分混匀于三角瓶中121℃灭菌20m in,接种,30℃培养3d后开始每4h检测,称取1g干燥后的发酵产物,加入90m L无菌水振荡10m in,用三层纱布过滤,滤液制成孢子悬浮液,用血球计数板倍量稀释法镜检其孢子量,每处理设5个重复,直至孢子量达到1010CFU/g,32℃干燥5h制成固体发酵剂。
1.2.4 阿魏酸酯酶产酶条件的确定
1.2.4.1 接种量的确定 15g黑毛茶加水10m L充分混匀于三角瓶中灭菌,固体发酵剂接种量为0.4‰、0.6‰、0.8‰、1.0‰、1.2‰、1.4‰,在1.2.4.1的温度结果下培养4d,测定阿魏酸酶活力。
1.2.4.2 温度的确定 15g黑毛茶加水10m L充分混匀于三角瓶中灭菌,接种0.8‰固体发酵剂至灭菌的黑毛茶上,于24、26、28、30、32、34℃培养4d,测其阿魏酸酯酶酶活变化。
1.2.4.3 黑毛茶含水量的确定 取干燥的黑毛茶添加蒸馏水至含水量分别为14%、18%、22%、26%、30%、34%,各取15g于6个三角瓶中灭菌,在1.2.4.1~1.2.4.2的结果下培养4d,测定阿魏酸酶活力。
1.2.4.4 发酵时间的确定 在1.2.4.1~1.2.4.3的结果下培养2、3、4、5、6、7d,测其阿魏酸酯酶酶活变化。
1.2.5 粗酶液的制备 加入75m L去离子水,于40℃水浴锅中浸提1h,再在70℃下浸提1h,于10000r·m in-1离心15min,上清液即为粗酶液。
1.2.6 阿魏酸酶活力的测定 阿魏酸酯酶的酶活定义:在50℃,pH为6.0的条件下,每分钟酶解阿魏酸乙酯,生成1μmol阿魏酸所需的酶量。
取250μL粗酶液于2m L离心管中,于50℃保温5m in;然后,加入250μL一定浓度的阿魏酸乙酯溶液,反应10min,再加入体积比为10%的500μL的冰乙酸终止反应。空白样品为煮沸失活的发酵上清液,处理方法同上。空白样品中冰乙酸在反应前加入,其他处理同上。样品离心后于4℃保存。取250μL上清酶液于离心管中,再加入去离子水1750μL,再用紫外分光光度计测定314nm条件下样品的吸光度[14]。
2 结果与分析
2.1 菌种筛选
2.1.1 菌种初筛实验 从茶叶样品中筛选出菌落生长快、透明圈大的菌株13株,包括5株真菌和8株细菌,初筛结果见图1和图2。

图1 初筛试验结果(真菌)Fig.1 Screening test result(Fungus)
如图1~图2所示,图1中真菌F1、F2的透明圈直径明显大于F3、F4、F5,阿魏酸酯酶酶活较高;图2中细菌B3、B7的透明圈直径明显大于B1、B2、B4、B5、B6、B8,产阿魏酸酯酶较多,故选择初筛结果较好的2株真菌和2株细菌进行复筛实验。

图2 初筛试验结果(细菌)Fig.2 Screening test result(Bacteria)
2.1.2 阿魏酸标准曲线制作及线性关系考察 以阿魏酸浓度(μg/m L)为横坐标,吸光度值A为纵坐标做标准曲线,结果见图3,回归方程y=0.0811x+0.0113,R2=0.9993。
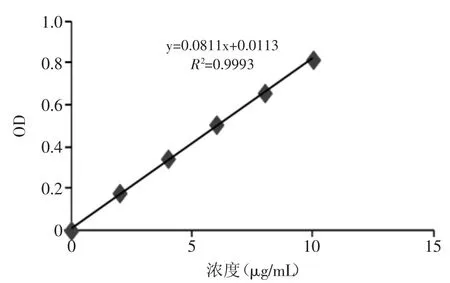
图3 阿魏酸标准曲线Fig.3 Standard curve of FEA
2.1.3 菌种复筛实验 将初筛所得的2株真菌和2株细菌进行分离纯化,再进行固态发酵产酶实验即复筛实验,测定其阿魏酸酯酶酶活,结果见图4。
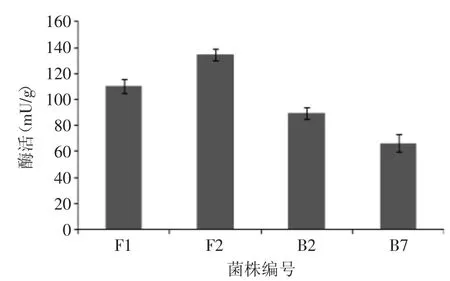
图4 复筛试验结果Fig.4 Result of second screening
从复筛实验结果可以看出,F2菌株固态发酵产阿魏酸酯酶酶活相对较高,可达130mU/g,明显高于其他菌株酶活水平。因此,选取F2菌株进行鉴定并优化其产酶条件。
2.1.4 菌株初步鉴定 阿魏酸酯酶活力较高的菌株F2在马铃薯培养基上生长3d后菌落直径达5~10mm,呈淡黄色;5d后,直径达12~16mm,周边淡黄色,内部颜色稍深,呈黄色;10d后见图5,直径达18~22mm,菌落边缘呈淡黄色,接近于橄榄浅黄色,内部颜色较深,近于橄榄褐至丁香褐色,老后变成褐色;21d后,直径达20~25mm,颜色全部变成褐色,菌落周围的培养基呈黑褐色。这与温琼英[15]观察的冠突散囊菌的菌落形态变化结果一致。
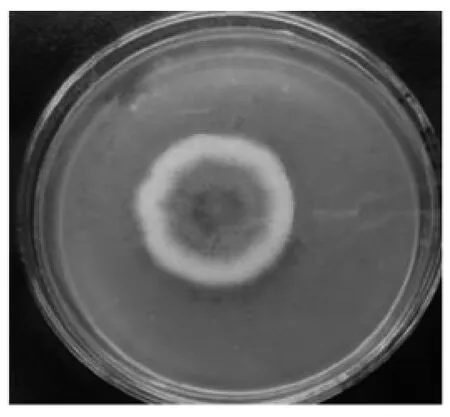
图5 纯化后PDA培养基上菌落形态Fig.5 Colonymorphology on the PDA plate after Purification
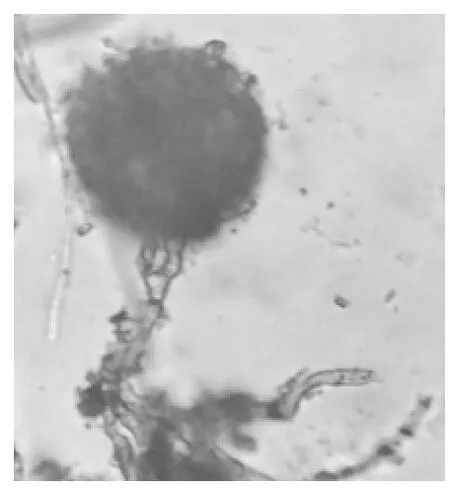
图6 菌株个体形态图Fig.6 Individualmorphology figure of the strain
菌株的个体形态中(图6)可以看出,分生孢子头辐射状,灰绿色,分生孢子梗壁光滑,顶囊近球形,表面粗糙具小刺,与《中国真菌志》[13]中冠突散囊菌的个体形态描述相符。综上所述,可初步鉴定菌株F2为冠突散囊菌。
2.2 阿魏酸酯酶产酶条件的确定
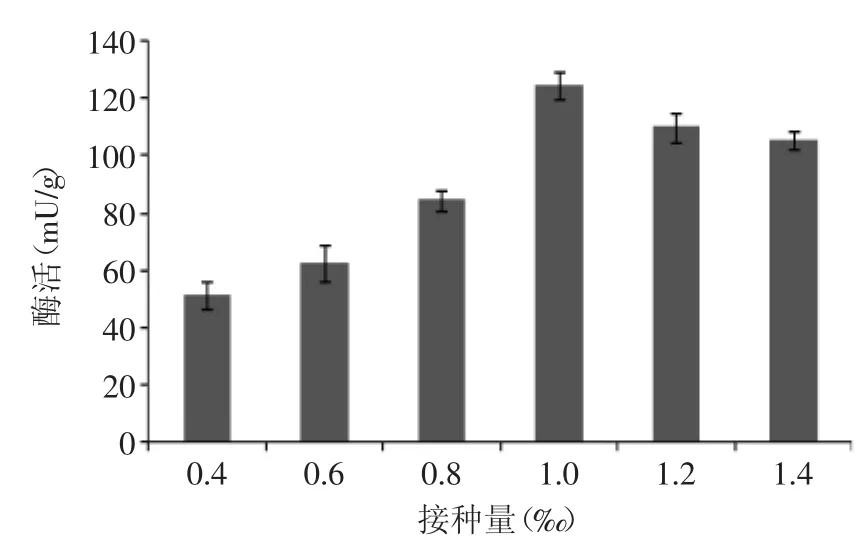
图7 接种量对产酶的影响Fig.7 Effects of bacteria concentration on FAE
2.2.1 接种量的确定 接种量对产酶量的影响如图7所示,从图7中可以看出,随着菌体浓度的增多,阿魏酸酯酶的产量也随着增加,当接种量高为1‰,酶活达到129mU/g,之后随接种量增加产酶量已无明显增加。出现这一结果的原因可能是由于微生物生长繁殖到一定数量后,黑毛茶的营养物质有限,菌体的代谢产物堆积,抑制了菌体的继续大量增殖。
2.2.2 培养温度对阿魏酸酯酶产酶量的影响 考察温度对产酶量的影响,如图8所示,培养温度在28~32℃之间酶的活性较强,这是由于28~32℃是该菌株的最适宜生长温度,即在此条件下,酶活较高,产酶能力也比较强,其中30℃时阿魏酸酯酶活性136mU/g,因此确定培养温度为30℃。
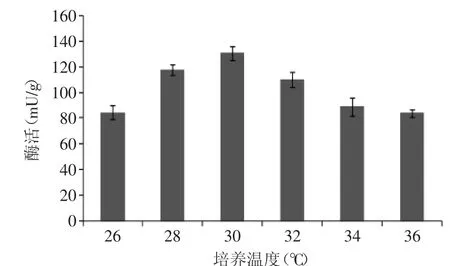
图8 培养温度对产酶的影响Fig.8 Effect of cultivation temperature on feruloyl esterase production
2.2.3 黑毛茶含水量对阿魏酸酯酶产酶量的影响 考察黑毛茶含水量对产酶量的影响,由图9可以看出,黑毛茶中加水量对产酶影响较为明显,当含水量达到26%时,产酶量最大,随后逐渐减少,这可能是因为含水量对供氧量及黑毛茶中营养物质的浓度有一定影响,从而影响菌体的生长。因此,确定含水量为26%。
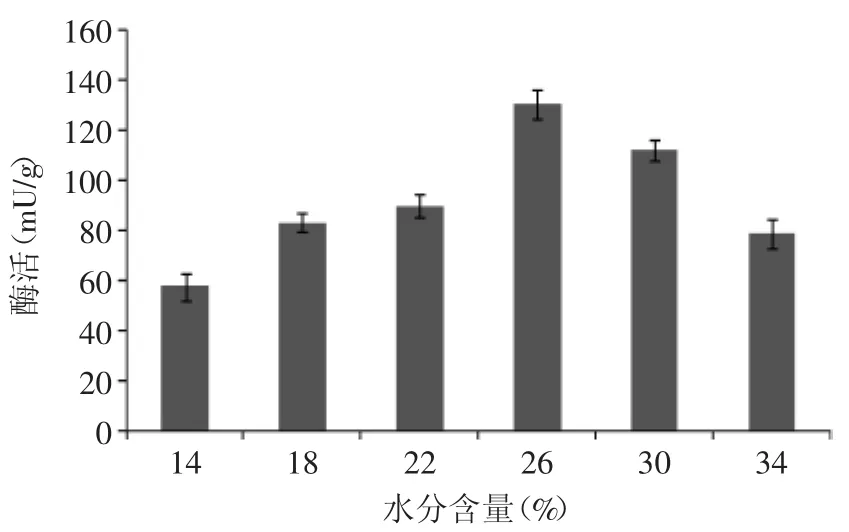
图9 黑毛茶含水量对产酶的影响Fig.9 Influence of black primarytea moisture content on the enzyme production
2.2.4 发酵产酶的时间对产酶量的影响 该菌株产酶的时间对产酶量的影响如图10所示。从图10可知,发酵酶活以每天10%左右的速度增长,培养至第4d达到最高,之后开始有所下降。这与微生物典型的生长曲线相吻合,可能是由于随着发酵时间的延长,菌体数量开始增长,到达稳定期后菌体数量开始减少,酶活自然降低。由此确定4d为产酶时间,酶活性可达142mU/g。
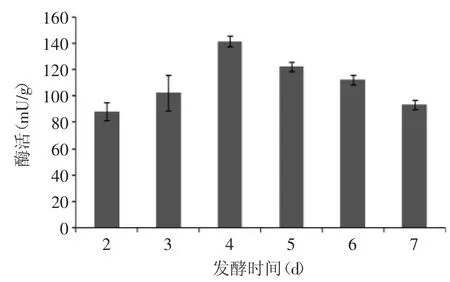
图10 发酵时间对产酶量的影响Fig.10 Effect of fermentation time on the quantity of enzyme production
3 结论
通过梯度稀释的方法从茶叶中筛选到能产生透明圈,即阿魏酸酯酶酶活性较高的菌株13株,通过复筛实验后获得高产阿魏酸酯酶的菌株F2,由菌落形态和个体形态特征初步鉴定为冠突散囊菌,并通过单因素实验确定了发酵黑毛茶产阿魏酸酯酶的条件:接种量为1‰,培养温度30℃,黑毛茶含水量26%,培养4d,此时阿魏酸酯酶酶活可达142mU/g。
[1]CJGreenwalt,RA Ledford,KH Steinkraus.Detennination and Characterization of the Atimicrobial Aotivity of the Fermented Tea Kombucha[J].Lebensmittel-wissenschaft und-Technologie,1998,31(3):291-296.
[2]Zhouen Z,Side Y,Weizhen L,etal.Mechanism of reaction of nitrogen dioxide radical with hydroxycinnamic acid derivatives:a pulse radiolysis study[J].Free Radic Res,1998,21(2):13-16.
[3]周洲,蒋丽媛,张奕华,等.乙酰水杨酰阿魏酸与呋咱氮氧化物和硝酸酯偶联物的合成及其抗血栓作用[J].医药学报,2006,41(11):1050-1056.
[4]马红艳,徐勇,肖斌,等.阿魏酸钠对2型糖尿病并血脂紊乱、高血压及大血管并发症的疗效观察[J].四川医学,2002,23(4):391-392.
[5]Hirabayashi T,OchiaiH,Sakai S.Inhibitory effect of ferulic acid and isoferulic acid on murine inerleukin-8 production in reponse to influenza infections in vitro and in vivo[J].Planta Med,1995,61(3):221.
[6]Kawabata K,Yamamoto T,Hara A,et al.Modifying effects of ferulic acid on azoxymethane-induced colon carcinogenesis in F344 rats[J].Cancer let,2000,157(1):15.
[7]Crepin V,Faulds C,Connerton I.Functional classification of the microbial feruloyl esterases[J].Applied Microbiology and Biotechnology,2004,63(6):647-652.
[8]Mathew S,Abraham T E.Ferulic acid:An antioxidant found naturally in plant cellwalls and feruloyl esterases involved in its release and their applications[J].Critical Reviewsin Biotechnology,2004,24(2/3):59-83.
[9]刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006.
[10]JDonaghyáP F,KellyáA M Mckay.Detection of ferulicacid esterase production by Bacillus spp.And Lactobacilli[J]. Appl Microbiol Biotechnol,1998,50:257-260.
[11]邓轶韬,李夏兰,陈宗香,等.阿魏酸酯酶产生菌的筛选及产酶条件的优化[J].华侨大学学报:自然科学版,2011,32(3):300-303.
[12]刘云国.食品微生物学标准鉴定图谱[S].科学出版社.
[13]齐祖同.中国真菌志:第五卷:曲霉属及其相关有性型[M].北京:科学出版社,1997:18-20,139-142.
[14]欧仕益,张璟,汪勇,等.采用黑曲霉发酵制备阿拉伯木聚糖酶和阿魏酸酯酶的研究[J].食品科技,2004(4):90-92,95.
[15]温琼英.茯砖茶中主要微生物的研究[J].茶叶通迅,1986(4):19-21.
Selection of high-yield ferulic acid esterase strain and optimization of enzyme production conditions
CHEN Jin1,HU Mao-feng2,WU Zhang-hua3,LIU Su-chun1,4,*
(1.College of Food Science and technology Hunan Agricultural University,Changsha 410128,China;2.College of Bioscience and Biotechnology Hunan Agricultural University,Changsha 410128,China;3.Changsha Seasoning Food Engineering Technology Research Center,Changsha 410000,China;4.Hunan Key Laboratories of Food Science and Biotechnology,Changsha 410128,China)
Through preliminary and secondary screening,a strains with high enzyme activity which could produceferuloyl esterase was screened out from Fu-brick tea,according to its individual and colony characteristics,itwas identified as Eurotium cristatum. Feruloyl esterase enzyme activity was used as measurable indicator,watercontent,inoculums-size,temperature and time was chosen as variables,the solid-state fermentation conditionsof chosen Eurotium cristatum were optimized. The results showed that black primarytea the optimal conditionwas 1‰ inoculums size,26%moisture content and cultivated at 30℃ for 4 days,the highest enzyme activityreached 142mU/g in the black Maocha solid-state fermentation experiment.
ferulic acid esterase;activity;fermented tea;Eurotium cristatum;screening
TS201.1
A
1002-0306(2015)08-0218-05
10.13386/j.issn1002-0306.2015.08.037
2014-11-26
陈锦(1989-),女,硕士研究生,研究方向:营养与食品卫生学。
*通讯作者:刘素纯(1966-),女,博士,教授,研究方向:营养与食品卫生学。
湖南省科技计划项目(2012NK3072)。
