煮制时间与二次煮制对紫娟普洱茶抗氧化性的影响
2015-10-24倪翠阳王丽英华佳甜
汤 晓,倪翠阳,王丽英,王 珊,王 云,华佳甜
(宁波职业技术学院化工学院,浙江宁波315800)
煮制时间与二次煮制对紫娟普洱茶抗氧化性的影响
汤 晓,倪翠阳,王丽英,王 珊,王 云,华佳甜
(宁波职业技术学院化工学院,浙江宁波315800)
分析不同煮制时间以及二次煮制对紫娟普洱茶中主要活性成分浸出情况的影响。测定茶汤的总花青素、总酚及总黄酮等抗氧化成分含量,分析茶汤的·OH清除能力、DPPH自由基清除能力、总抗氧化性、还原能力与这些抗氧化成分的相关性。结果表明,紫娟普洱茶汤中的抗氧化成分随煮制时间延长而增加,第一次煮制7min后,各活性成分总含量的增加大多趋于平缓;第二次煮制后,各类活性成分总含量下降显著(p<0.05)。紫娟普洱茶汤的·OH清除能力、总抗氧化性与其活性成分含量呈线性正相关,且与总花青素、总酚含量的相关性更加明显(R2>0.8)。
煮制,紫娟普洱茶,抗氧化
紫娟普洱茶是云南大叶种茶中的一种特异品种,属于普洱茶变种,其芽、叶、茎均为紫色,茶汤呈淡紫色,香气醇正。研究表明,紫娟普洱茶含有丰富的花青素、茶多酚、总黄酮、氨基酸、总儿茶素、茶褐素、茶红素、茶黄素等活性成分[1-2],且紫娟普洱茶中的花青素、总黄酮等成分含量高于一般的大叶种茶[3],长期饮用紫娟普洱茶具有较好的保健功效,能起到延缓衰老、预防心血管疾病等作用[4]。
紫娟普洱茶中的活性成分含量,随茶树生长年龄、生长条件,及茶叶加工方式、发酵时间、储藏条件等因素而变化,而不同的煮制方式则会影响这些活性成分的浸出。本文以产自云南省普洱市的紫娟普洱茶生茶为对象,研究不同煮制时间对花青素、多酚、总黄酮、儿茶素类等活性成分的浸出以及茶汤抗氧化能力的影响,为紫娟普洱茶的科学饮用提供实验依据。
1 材料与方法
1.1 材料与仪器
紫娟普洱茶生茶饼 购于云南省普洱市宁洱兴隆茶厂,生产时间为2013年10月;飞燕草素、矢车菊素、天竺葵素、芍药花青素、锦葵色素、矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、儿茶素、表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、槲皮素-3-O-β-半乳糖苷、槲皮素-3-O-β-葡萄糖苷、槲皮素-3-O-α-L-鼠李糖苷、山萘酚-3-O-β-半乳糖苷、山萘酚-3-O-β-葡萄糖苷、芦丁、槲皮素、杨梅素、山奈酚、金丝桃苷、芹菜素 上述标准品为色谱纯,纯度>98%,由上海源叶生物科技有限公司提供;乙腈、甲酸 为色谱纯;其余试剂 分析纯。
高效液相色谱仪(LC-20AT) 岛津中国上海分公司;UV759紫外可见分光光度计 上海精密科学仪器有限公司;超纯水器 重庆摩尔水处理设备有限公司。
1.2 实验方法
1.2.1 样品处理 取6g紫娟普洱茶,按料液比(1∶30)加入沸水,密闭后煮制2、5、7、10m in,不同时间下各煮制两次,第一次煮制成品为第一道茶汤,第二次煮制成品为第二道茶汤,过滤后分别保存。
1.2.2 总花青素含量的测定 取200μL普洱茶汤,分别加入1.8m L氯化钾缓冲液(pH 1.0)、乙酸钠缓冲液(pH 4.5),于暗处反应1h后,再分别测定2个pH条件下,520nm与700nm的吸光度值,根据下式计算pH示差:
A=(A520-A700)pH 1.0-(A520-A700)pH 4.5
总花青素含量计算公式为:
总花青素含量(mg/L)=(A×MW×DF×1000)/(ε×1)
式中,A为pH差值;MW为花青素分子量(449.2);DF为稀释倍数;ε为矢车菊素3-葡萄糖苷的分子吸收(26900)[5]。
1.2.3 总酚含量的测定 取0.2m L茶汤,加入1m L福林-酚试剂、0.8m L 7.5%碳酸钠,室温下轻轻振荡30m in,测定765nm吸光度值。以没食子酸溶液做标准曲线(50~250μg/m L)[6]。
1.2.4 总黄酮含量的测定 取5m L样品,与等体积2%AlCl3的甲醇溶液混合,反应10min后测定415nm处吸光度值,以5m L样品与等体积不加A lCl3的甲醇混合液为空白对照。以槲皮素标准品溶液做标准曲线(20~100μg/m L)[7]。
1.2.5 紫娟普洱茶汤成分的分析 采用ODSC18色谱柱(150mm×6.0mm,5μm);柱温30℃;流速1.0m L/m in;流动相A为水/乙腈/甲酸(87/3/10),流动相B为乙腈;进样量20μL。
采用梯度洗脱:0~45min,3%~25%B相;46min,30%B相;47m in,3%B相[6]。
花青素类检测波长为520nm,儿茶素类检测波长为280nm,其他黄酮类检测波长为360nm[8]。
1.2.6·OH清除能力的测定 试管内依次加入1m L 1.5mmol/L FeSO4溶液,0.7m L 6mmol/L H2O2,0.3m L 20mmol/L水杨酸钠溶液,再加入1m L茶汤。37℃水浴反应1h后,测定562nm处吸光度值[9]。根据下式计算·OH清除能力:
·OH清除能力(%)=[A0-(A1-A2)]/A0×100
式中,A0为空白对照的吸光度值,A1为样品的吸光度值,A2为不加水杨酸钠的吸光度值。
1.2.7 DPPH自由基清除能力的测定 取0.1m L茶汤,加入1m L 0.2mmol/L DPPH的甲醇溶液,置于暗处,28℃反应20m in,测定517nm处吸光度值,以不加茶汤为空白对照[10]。
DPPH自由基清除率(%)=(1-A茶汤/A空白)×100
1.2.8 总抗氧化性的测定 取0.1m L茶汤,加入1m L反应试剂(0.6mol/L硫酸,28mmol/L磷酸钠以及4mmol/L钼酸铵),95℃水浴90m in。冷却至25℃,测定695nm处吸光度值,以不加茶汤为空白对照[11]。
1.2.9 还原能力的测定 取0.1m L茶汤,加入2.5m L 0.2mol/L磷酸缓冲液(pH6.6)以及2.5m L 1%铁氰化钾,充分混匀。50℃水浴20m in后,加入2.5m L 10%三氯乙酸,2.5m L去离子水以及0.5m L 0.1%三氯化铁,测定700nm处吸光度值,以不加茶汤为空白对照[12]。
1.3 数据分析
所有测试均重复三次,采用单因素方差分析(ANOVA),结果以±s表示。
2 结果与分析
2.1 紫娟普洱茶汤的总花青素含量变化
紫娟普洱茶中的总花青素含量随煮制时间的变化如图1所示。随煮制时间延长,茶汤的总花青素含量增加。但是,煮制两次后,第二道茶汤的总花青素含量下降较多(p>0.05),不同煮制时间下,第二道茶汤的总花青素含量均比第一道下降55%以上。这表明,紫娟普洱茶中的总花青素含量,在煮制10min内并未受加热对花青素结构破坏的影响,且时间越长,总花青素浸出量越多;而煮制两次后,不同煮制时间茶汤的总花青素含量都有较多下降,可能是因为花青素经多次加热后,结构受到较多破坏。
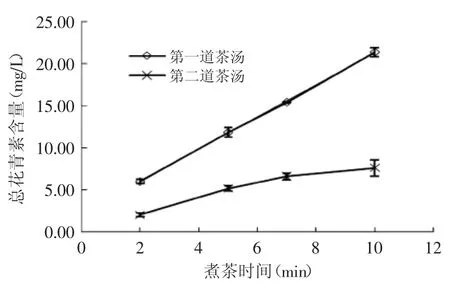
图1 不同煮制时间对总花青素浸出量的影响Fig.1 The effect of tea cooking time on total monomeric anthocyanin content
2.2 紫娟普洱茶汤的总酚含量变化
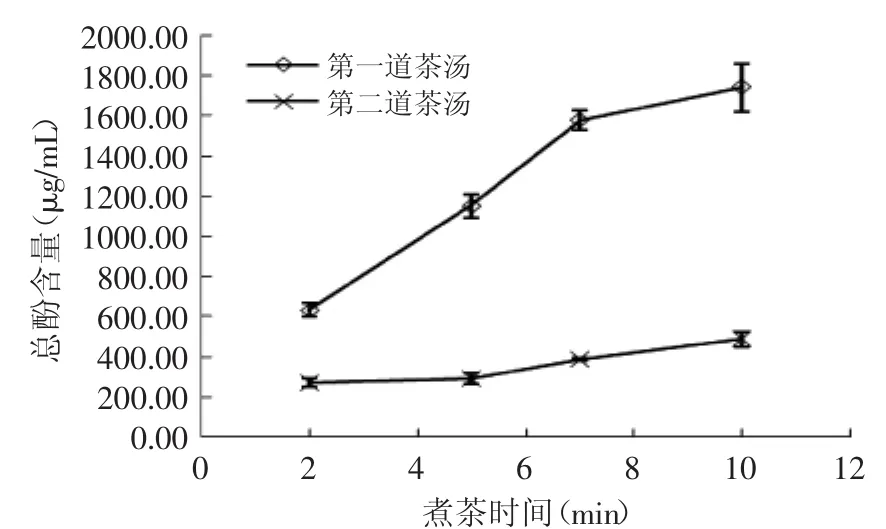
图2 不同煮制时间对总酚浸出量的影响Fig.2 The effect of tea cooking time on total phenols content
总酚含量随煮制时间的变化如图2所示。随煮制时间延长,茶汤的总酚含量增加,但7m in后增幅减缓。煮制两次后,第二道茶汤的总酚含量显著下降(p<0.05),其中,煮制2m in的茶汤,第二道的总酚含量比第一道下降约57%,而煮制5~10m in的茶汤,第二道的总酚含量比第一道下降70%以上。由此推测,紫鹃普洱茶中的酚类物质可能有较多水溶性组分,因此,煮制一次后,总酚已能在短时间内较快被浸出,而煮制二次后,总酚含量下降率随时间延长而增加。
2.3 紫娟普洱茶汤的总黄酮含量变化
总黄酮含量随煮制时间的变化如图3所示。随煮制时间延长,茶汤的总黄酮含量增加;煮制两次后,第二道茶汤的总黄酮含量下降(p>0.05)。与总花青素、总酚不同的是,煮制2、5m in的茶汤,经二次煮制后,其总黄酮含量下降率(60%以上)高于煮制7、10m in的茶汤,这可能是由于紫娟普洱茶中的黄酮类物质水溶性成分更多,因此较短时间煮制两次后,总黄酮含量已明显下降。而10m in煮制两次后的茶汤,其总黄酮含量下降率又上升(约50%),同时第一次煮制10m in的茶汤的总黄酮增幅也最高,这表明紫娟普洱茶经一定时间煮制后,可能有更多对热稳定的黄酮类组分被浸出。
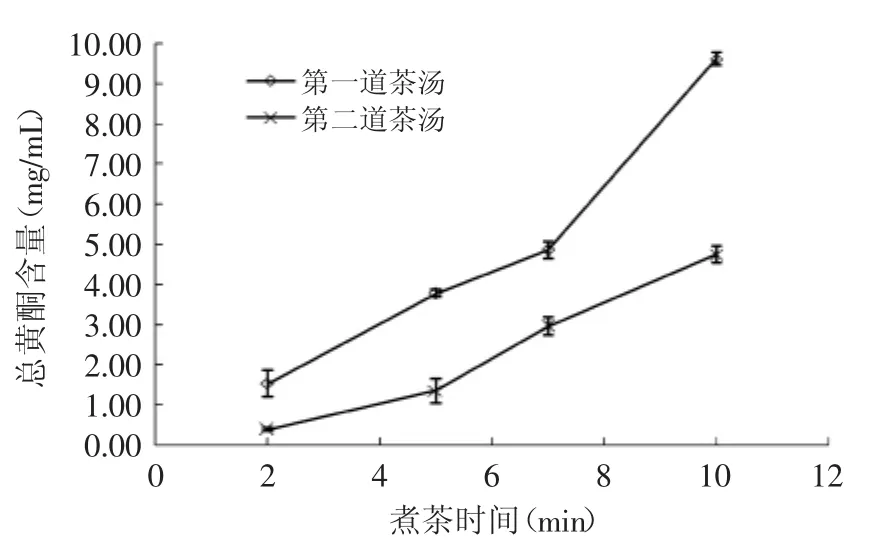
图3 不同煮制时间对总黄酮浸出量的影响Fig.3 The effect of tea cooking time on total flavonoids content
2.4 紫娟普洱茶汤中花青素成分的变化
经HPLC分析,紫娟普洱茶汤中含7种花青素,按洗脱先后顺序分别为:矢车菊素-半乳糖苷、矢车菊素-葡萄糖苷、飞燕草素、矢车菊素、天竺葵色素、芍药素、锦葵色素(图4)。不同煮制时间的花青素含量如表1所示。除煮制5m in的第一道茶汤外,其他茶汤均含7种花青素,且它们的总含量随煮制时间及二次煮制的变化趋势与pH示差法结果相近(图1)。随煮制时间延长,7种花青素的含量大多呈增加趋势,但是,增幅随煮制时间延长而减小。煮制5m in的第一道茶汤的花青素总含量比2m in第一道的增加28.24%,10min的第一道茶汤的花青素总含量仅比7m in第一道增加9.79%;而第二道茶汤的花青素总含量,在煮制7m in后,也并无明显增加(表1)。经二次煮制后,各花青素组分的含量均下降较多,其中,矢车菊素-半乳糖苷、矢车菊素-葡萄糖苷的含量下降更明显。这可能是由于其他花青素缺乏糖苷,水溶性下降,因此,经过二次煮制后,它们的含量下降率不及两种花色苷类。与pH示差法结果不同的是,煮制10m in内,第二道茶汤的花青素总含量显著下降(p<0.05)。
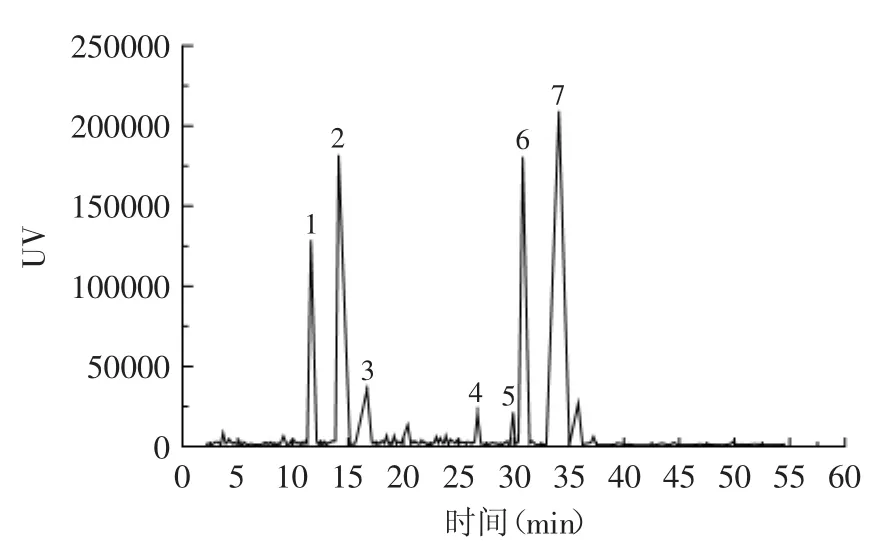
图4 紫娟普洱茶汤的花青素类HPLC图(10min第一道茶汤)Fig.4 The HPLC analysis of the anthocyanidin in Zijuan puer tea extraction(the firstextraction of 10min cooking sample)

表1 紫娟普洱茶汤的花青素类定量分析(μg/mL)Table 1 The anthocyanidin concentrations(μg/mL)in Zijuan puer tea extraction
2.5 紫娟普洱茶汤中儿茶素类成分的变化
经HPLC分析,紫娟普洱茶汤中含5种儿茶素类活性成分,按洗脱先后顺序分别为:儿茶素、表没食子儿茶素没食子酸酯、表没食子儿茶素、表儿茶素、表儿茶素没食子酸酯(图5)。不同煮制时间的儿茶素类含量如表2所示。除2min的煮制两次的茶汤外,其他茶汤均含5种儿茶素类。表没食子儿茶素的含量高于其他儿茶素类。随煮制时间延长,紫娟普洱茶第一道茶汤的儿茶素类含量较稳定,煮制2~7m in的第一道茶汤,其儿茶素类总含量几乎没有变化,而煮制10m in第一道茶汤的儿茶素类总含量也仅比7m in第一道的增加11.04%。第二道茶汤的儿茶素类总含量,在煮制5m in后的增幅也较稳定(约10%)(表2)。经二次煮制后,各儿茶素类含量基本下降50%以上。这表明,煮制时间以及二次煮制,对水溶性相近的儿茶素类的浸出趋势(不同时间的总浸出量、二次煮制的总含量下降率)的影响无显著差异。煮制10m in内,第二道茶汤的儿茶素类总含量显著下降(p<0.01)。
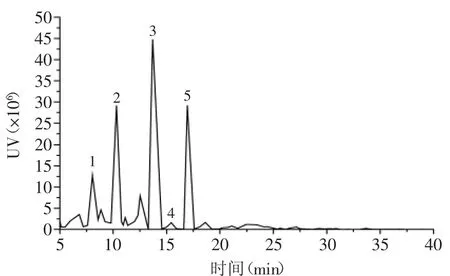
图5 紫娟普洱茶汤的儿茶素类HPLC图(10min第一道茶汤)Fig.5 HPLC analysis of the catechins in Zijuan puer tea extraction(the firstextraction of 10min cooking sample)
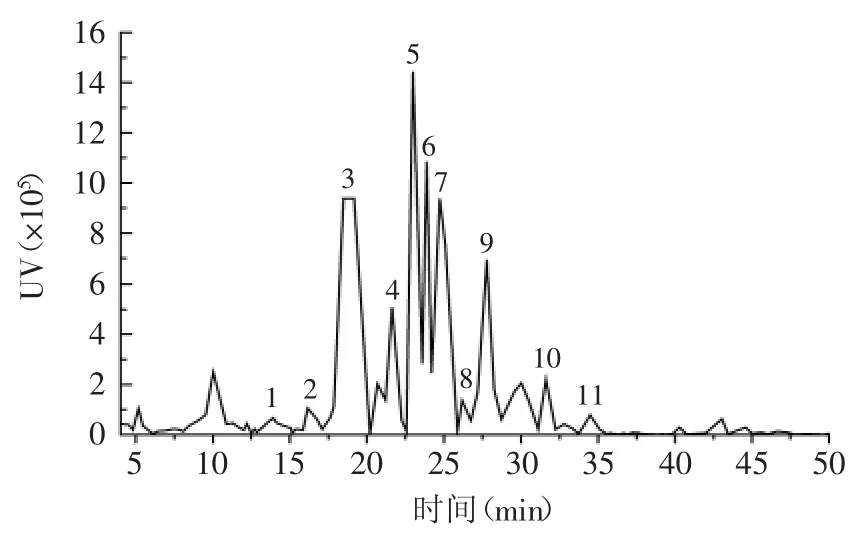
图6 紫娟普洱茶汤的其他黄酮类HPLC图(10min第一道茶汤)Fig.6 HPLC analysis of other flavonoids in Zijuan puer tea extraction(the first extraction of 10min cooking sample)
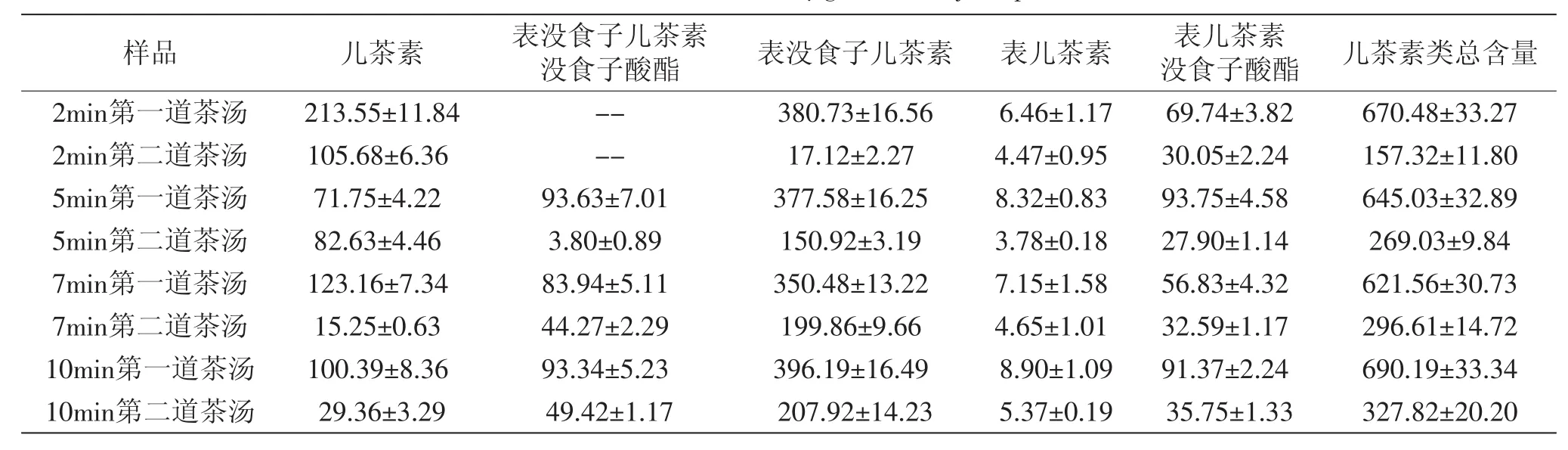
表2 紫娟普洱茶汤的儿茶素类定量分析(μg/mL)Table 2 The catechins concentrations(μg/mL)in Zijuan puer tea extraction

表3 紫娟普洱茶汤的其他黄酮类定量分析(μg/mL)Table 3 The other flavonoids concentrations(μg/mL)in Zijuan puer tea extraction
2.6 紫娟普洱茶汤中其他黄酮类成分的变化
紫娟普洱茶汤中亦含其他11种黄酮类活性成分(图6),不同煮制时间下,黄酮含量如表3所示。其他黄酮类成分以黄酮醇苷类为主,随煮制时间延长,它们的总含量增加,这与分光光度法的变化趋势(图3)一致。其中,第一道茶汤的黄酮总含量随时间的增幅基本大于25%,而第二道茶汤的黄酮总含量随时间的增幅也在15%以上,这可能是由于紫娟普洱茶中含有较多黄酮类成分,因此,随煮制时间延长,有更多的黄酮类物质被持续浸出。经二次煮制后,各黄酮含量下降较多,尤其是短时间煮制的茶汤,这可能是由于紫娟普洱茶中的黄酮类成分多为苷类,因此,水溶性较好,能较快被浸出。二次煮制7m in后,茶汤的黄酮总含量下降率再次升高,这可能是由于热稳定性较好的黄酮成分在第一次煮制时,随时间延长才被较多地浸出。因此,在相对较长时间下煮制两次后,茶汤中的总黄酮含量下降率才得以提高。与分光光度法结果不同的是,煮制10m in内,第二道茶汤的黄酮总含量显著下降(p<0.01)。
2.7 茶汤抗氧化能力的变化
2.7.1 茶汤清除·OH能力 不同煮制时间下,紫娟普洱茶煮制两次的茶汤及它们的等体积合并液的·OH清除能力随活性成分含量的变化如图7所示。煮制时间越长,总花青素、总酚及总黄酮的浸出量越多,而茶汤的·OH清除能力也随之增强。9个样品的·OH清除能力与总花青素、总酚及总黄酮含量均呈线性关系(R2分别为0.843、0.902、0.613),其中,·OH清除能力与总花青素及总酚含量呈明显的线性正相关。这表明,紫娟普洱茶的·OH清除能力可能由总花青素及总酚含量所决定。

图7 ·OH清除能力随活性成分含量的变化Fig.7 The·OH scavenging activity with the change of active ingredient content
2.7.2 茶汤清除DPPH自由基能力 不同煮制时间下,经适当稀释后的茶汤DPPH自由基清除能力随活性成分含量的变化如图8所示。与·OH清除能力不同的是,DPPH自由基清除能力并未随煮制时间延长而增强,即DPPH自由基清除能力与总花青素、总酚及总黄酮含量之间并无线性关系(R2分别为0.237、0.183、0.416)。
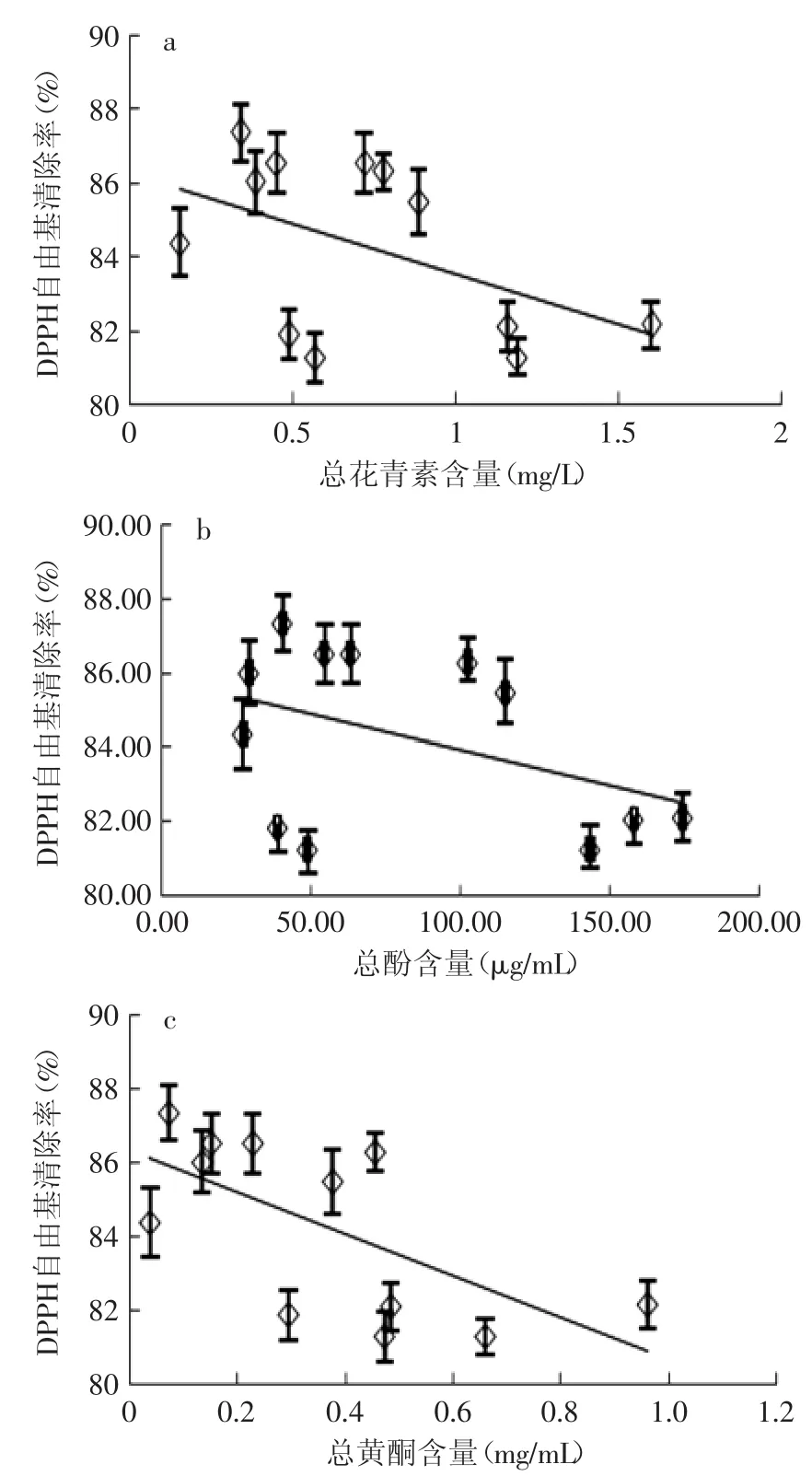
图8 DPPH自由基清除能力随活性成分含量的变化Fig.8 DPPH scavenging activity with the change of active ingredient content
2.7.3 茶汤的总抗氧化性 不同煮制时间下,经适当稀释后的茶汤总抗氧化性随活性成分含量的变化如图9所示。茶汤的总抗氧化性与总花青素、总酚及总黄酮含量均呈明显的线性正相关(R2分别为0.950、0.931、0.828)。
2.7.4 茶汤的还原能力 不同煮制时间下,经适当稀释后的茶汤还原能力随活性成分含量的变化如图10所示。还原能力与与总花青素、总酚及总黄酮含量之间并无线性关系(R2分别为0.513、0.435、0.349)。
以上结果表明,紫娟普洱茶的总抗氧化性可能由总花青素、总酚及总黄酮含量所决定,而DPPH自由基清除能力以及还原能力却并不受这些活性成分的影响。
3 结论与讨论
3.1 紫娟普洱茶煮制10m in内(一次煮制与二次煮制),总花青素、总酚及总黄酮含量随煮制时间增加较多,儿茶素类含量则较稳定。由于煮制7m in与10m in,各类活性成分浸出总量增加并不显著,因此,煮饮紫娟普洱茶时可控制煮制时间为7m in。而煮制两次后,这些活性成分的总含量均显著下降(p<0.05,图4~图6)。因此,饮用紫娟普洱茶应以第一道茶汤为主。
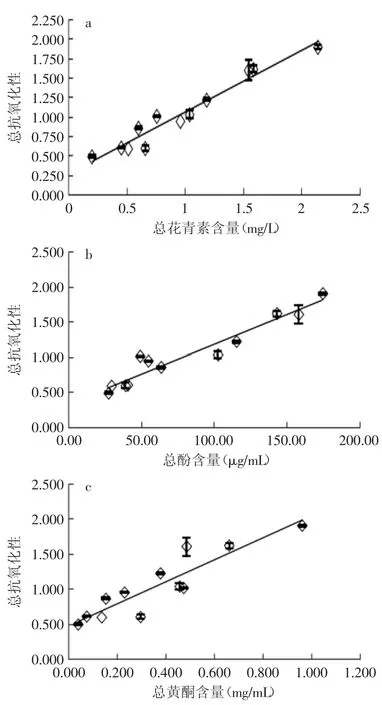
图9 总抗氧化性随活性成分含量的变化Fig.9 Total antioxidant activity with the change of active ingredient content

图10 还原能力随活性成分含量的变化Fig.10 Reducing powerwith the change of active ingredient content
3.2 紫娟普洱茶含有花青素、多酚、黄酮等多种活性成分,花青素含量尤其丰富。尽管花青素被认为在加热过程中特别不稳定,但是有研究表明,当用不同加热方法提取土豆中的多酚时,沸水煮15min所得花青素含量最高,且水煮前后花青素含量稳定[13],这与本研究的花青素稳定性结果一致。紫鹃普洱茶中的花青素,其花色苷类含量较高,研究表明,黄酮类物质能显著提高花色苷类的热稳定性[14],由于紫娟普洱茶中含有较多黄酮,因此,煮制10m in内,其茶汤的花青素总含量随时间延长而增加。煮制两次后,由于茶汤中的黄酮类物质含量下降,导致花色苷的热稳定性降低,且花色苷类的水溶性较好,易在第一次煮制时较快被浸出,因此,二次煮制后的茶汤花青素总含量下降较多。
儿茶素类成分是茶多酚的重要组成,紫娟普洱茶经二次煮制后,儿茶素类总含量随时间的变化都不大,这可能是因为以儿茶素类成分为主的茶多酚,在沸水中煮制一定时间的热稳定性较好,有研究表明,茶多酚在沸水中保持60m in的消耗率为6%[15]。但是,儿茶素、表儿茶素没食子酸酯(ECG),经二次煮制后的含量下降率却高于其他儿茶素类,由此表明,这两种组分在茶汤中的热稳定性可能低于其他儿茶素类。
3.3 紫鹃普洱茶汤的·OH自由基及总抗氧化性,与总花青素、总酚及总黄酮含量呈较好的线性正相关,其中,与总花青素、总酚含量呈明显的正相关(R2>0.8),而茶汤的DPPH自由基清除能力、还原能力则与这些活性成分不呈线性相关。因此,紫鹃普洱茶汤的抗氧化性主要与总花青素及总酚有关。
对于上述抗氧化指标与总花青素、总酚以及总黄酮含量之间的关系,不同学者的研究结果不尽相同[16-21]。这可能是由于评价结果受这些活性成分的具体组成以及所用的抗氧化指标测试方法的影响。尽管紫鹃普洱的DPPH自由基清除能力及还原能力与活性成分含量之间不呈线性正相关,但是,由于·OH等自由基是生物体内最常见的活性氧簇,而过氧化氢所诱发的自由基又最易通过细胞膜[22]。因此,控制合适的煮制时间,尽可能多地浸出花青素与多酚类物质,可有效起到保护细胞免受活性氧簇侵袭的作用。
[1]张钦,董立星,李改青,等.“紫娟”普洱茶褐素的膜分离及其理化性质的初步研究[J].茶叶科学,2012,32(3):189-196.
[2]谭超,龚加顺,保丽萍.“紫娟”绿茶发酵过程中茶褐素理化性质及微生物变化[J].食品与发酵工业,2011,37(12):43-48.
[3]梁名志,夏涛.特种紫茶降压活性物质初探[J].云南农业大学学报,2003,18(4):378-381.
[4]隋秀芳,王玉株,黄涛,等.紫娟茶和苦丁茶中功效成分的提取分离[J].食品科学,2011,32(20):72-78.
[5]KERIO L C,WACHIRA F N,WANYOKO J K,et al. Characterization of anthocyanins in Kenyan teas:Extraction and identification[J].Food Chemistry,2012,131(1):31-38.
[6]WANG Sunan,MECKLING K A,MARCONE M F,et al. Synergistic,additive,and antagonistic effects of food mixtures on total antioxidant capacities[J].Journal of Agricultural and Food Chemistry,2011,59(3),960-968.
[7]MEDA A,LAMIEN C E,ROMITO M,et al.Determination of the total phenolic,flavonoid and proline contents in Burkina Fasan honey,as well as their radical scavenging activity[J].Food Chemistry,2005,91:571-577.
[8]PASQUALE C,ARIANNA P,TEODORA B,et al.Postharvest stilbenes and flavonoids enrichment of table grape cv Redglobe(Vitis vinifera L.)as affected by interactive UV-C exposure and storage conditions[J].Food Chemistry,2013,141(2):802-808.
[9]SMIRNOFF N,CUMBES Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[10]BLOIS M S.Antioxidant determinations by the use of a stable free radical[J].Nature,1958,181(4617):1199-1200.
[11]PRIETO P,PINEDA M,AGUILAR M.Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomolybdenum complex:specific application to the determination of Vitamin E[J].Analytical Biochemistry,1999,269(2):337-341.
[12]OYAIZU M.Studies on products of browing reaction:Antioxidative activity of product of browing reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44(6):307-315.
[13]LACHMAN J,HAMOUZK,MUSILOVÁJ,et al.Effect of peeling and three cooking methods on the content of selected phytochemicals in potato tubers with various colour of flesh[J]. Food Chemistry,2013,138(2):1189-1197.
[14]董楠,雷丹,刘佳佳,等.花色苷的热稳定性及其影响因素研究[J].食品工业科技,2012,33(7):393-396.
[15]姜绍通,潘丽军,汪国庭.食品抗氧化剂茶多酚热稳定性的研究[J].合肥教院学报,1998,15(4):11-13.
[16]ZHANG Ruifen,ZENG Qingshuai,DENG Yuanyuan,et al. Phenolic profiles and antioxidant activity of litchi pulp of different cultivars cultivated in Southern China[J].Food Chemistry,2013,136(3-4):1169-1176.
[17]AKTUMSEK A,ZENGIN G,GULER G O,et al.Assessment of the antioxidant potential and fatty acid composition of four Centaurea L.taxa from Turkey[J].Food Chemistry,2013,141(1):91-97.
[18]GARCÍA-SALASP,GÓMEZ-CARAVACA A M,ARRÁEZROMÁND,etal.Influence of technological processes on phenolic compounds,organic acids,furanic derivatives,and antioxidant activity of whole-lemon powder[J].Food Chemistry,2013,141(2):869-878.
[19]BREWER LR,KUBOLA J,SIRIAMORNPUN S,etal.Wheat bran particle size influence on phytochemical extractability and antioxidant properties[J].Food Chemistry,2014,152:483-490.
[20]MENA P,VEGARA S,MARTÍN,etal.Changeson indigenous microbiota,colour,bioactive compounds and antioxidant activity of pasteurised pomegranate juice[J].Food Chemistry,2013,141:2122-2129.
[21]ZHAO Yan,DU Shuang-kui,WANG Hanxin,et al.In vitro antioxidant activity of extracts from common legumes[J].Food Chemistry,2014,152:462-466.
[22]BI Xiuli,ZHANG Jiangli,CHEN Changsheng,et al. Anthocyanin contributes more to hydrogen peroxide scavenging than other phenolics in apple peel[J].Food Chemistry,2014,152:205-209.
Effect of tea cooking time on antioxidant activities of Zijuan puer tea
TANG Xiao,NICui-yang,WANG Li-ying,WANG Shan,WANG Yun,HUA Jia-tian
(College of Chemical Engineering,Ningbo Polytechnic College,Ningbo 315800,China)
It was investigated that the effect of tea cooking time and two times of cooking on antioxidant activitiesof Zijuan puer tea. The contents of total monomeric anthocyanin , total phenols and total flavonoids weredetermined. The relation between hydroxyl radical scavenging activity,DPPH radical scavenging activity,totalantioxidant activity and reducing power of tea extractions and the contents of these active ingredients wastested. The results indicated that within 10 minutes of tea cooking,the contents of active ingredients enhancedwith time,however,the amplification decreased with time. After 7 minutes of tea cooking for one time,theincrease of total contents of different types of active ingredients almost tended to be steady. The total contentof different types of active ingredients in Zijuan puer tea apparently decreased after two times of cooking (p<0.05). The hydroxyl radical scavenging activity and total antioxidant activity of Zijuan puer tea showed apositive linear correlation with the contents of active ingredients,which was more apparent with the contents oftotal monomeric anthocyanin and total phenols(R2>0.8).
tea cooking;Zijuan puer tea;antioxidant activity
TS201.2
A
1002-0306(2015)08-0141-07
10.13386/j.issn1002-0306.2015.08.020
2014-11-13
汤晓(1981-),女,硕士,讲师,研究方向:黄酮类化合物的提取与应用。
