酶法酯交换制备塑性脂肪工艺优化及氧化稳定性研究
2015-10-24张超然孙晓洋王胜男齐宝坤马文君江连洲隋晓楠
张超然,李 杨,孙晓洋,王胜男,齐宝坤,李 丹,马文君,江连洲,*,隋晓楠
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.诺维信(中国)山东创新与发展中心,山东济南250101)
酶法酯交换制备塑性脂肪工艺优化及氧化稳定性研究
张超然1,李 杨1,孙晓洋2,王胜男1,齐宝坤1,李 丹1,马文君1,江连洲1,*,隋晓楠1
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.诺维信(中国)山东创新与发展中心,山东济南250101)
以棕榈硬脂、油茶籽油及棕榈仁油为原料,利用酶法酯交换制备塑性脂肪。在单因素实验的基础上,采用Design Expert软件进行响应面优化设计,反应条件包括:反应时间、反应温度和酶添加量,以滑动熔点作为衡量指标。优化后得到最优反应条件为:反应时间4.2h,反应温度64℃,酶添加量为7.2%,在最优反应条件下的酶法酯交换产物的实际滑动熔点可达37.9℃。对物理混合、酶法酯交换以及化学酯交换样品进行了氧化稳定性研究,在储藏30d内物理混合样品的过氧化值为1.13~120.46meq/kg,低于酶法酯交换样品(1.16~138.88meq/kg)及化学酯交换样品(1.26~148.49meq/kg)。物理混合样品的氧化稳定性高于酶法酯交换样品,酶法酯交换样品的氧化稳定性高于化学酯交换样品。
塑性脂肪,酶法酯交换,响应面设计,油茶籽油,氧化稳定性
塑性脂肪是一种半固体的食品产品,其中含有液体的油和固体的脂。在对塑性脂肪基本理化性质的要求上,国内外研究的热点在于丰富其营养组成以及降低胆固醇含量,制备出营养健康的人造奶油等塑性脂肪产品。塑性脂肪中的改性油脂选择胆固醇含量较低的植物油脂,如大豆油,玉米油,菜籽油和橄榄油等。植物油脂的加入可降低产品的饱和度并增加产品塑性[2]。油茶籽油是从油茶籽中提取的油脂成分,其不饱和脂肪酸含量高达90%以上,其中油酸含量在80%左右,亚油酸含量在7%~13%,达到了FAO和WHO推荐的最佳食用油标准[6-7],为使其塑性脂肪产品的脂肪酸组成更加合理,选择棕榈仁油作为另一种改性油脂,为人造奶油产品提供中链脂肪酸。
然而,将不同脂肪酸链长,不饱和键数量的甘三酯进行单纯的物理混合会使最终产品的相容性出现差异,而导致产品的不良口感。酯交换技术则可在不同种类油脂的甘三酯碳骨架上进行脂肪酸的重排,使得混合物系呈现一种共晶状态[4-5],酯交换技术分为两种,分别为化学酯交换和酶法酯交换。
对于人造奶油产品来说,除对其营养组成及理化性质的研究以外,对产品的氧化性研究也尤为重要。酯交换反应会使产品中自身的抗氧化成分遭到破坏,而使得产品的氧化稳定性下降,所以要全面的研究人造奶油产品性质,氧化稳定性也作为其重要的考察指标。
本文以棕榈硬脂、油茶籽油和棕榈仁油为原料,利用响应面设计对酶法酯交换工艺参数进行优化,以滑动熔点作为响应值[1],制备出以油茶籽油为改性油的塑性脂肪,并对酶法酯交换产品的氧化稳定性与相同底物的化学酯交换产物及物理混合产物进行对比研究。
1 材料与方法
1.1 材料与仪器
52°分提棕榈硬脂和棕榈仁油 中粮集团;油茶籽油 江西好口福油脂公司;植物人造奶油 购自当地超市;Lipozyme TL IM 诺维信(中国)生物技术有限公司,酶活性为175IUN/g(IUN为酯交换活力单位),该酶的固定化材料为硅胶,酶的堆积密度为0.54g/m L,颗粒度为0.3~1.0mm,含水量为5%;冰醋酸 郑州百佳化工有限公司;异辛烷 滁州市润达溶剂公司;乙醚 庆茂化工有限公司;p-茴香胺 武汉福德精细化工有限公司;可溶性淀粉 郑州阳光化工产品有限公司;碘化钾 郑州博轩化工产品有限公司;氯仿 济南国光精细化工有限公司;柠檬酸 分析纯,吴江奥康化学品有限公司。
1600PC紫外-可见分光光度计 上海美谱达仪器有限公司;低频脉冲核磁共振仪 Bruker公司;SHA-B恒温水浴振荡器 国华仪器公司;FA 1204B分析天平 上海天平仪器厂;HH-4丹瑞数显恒温水浴锅 金坛市双捷实验仪器厂;BGZ-246电热鼓风干燥箱 上海博讯实业有限公司医疗设备厂;BCD-215cm美的冰箱 合肥美的荣事达电冰箱有限公司。
1.2 实验方法
1.2.1 样品混合制备 将棕榈硬脂在70℃下完全熔融,将棕榈仁油在50℃下完全融化,与油茶籽油按照棕榈硬脂:油茶籽油:棕榈仁油为60∶30∶10(质量比)的比例进行混合(混合物的脂肪酸饱和度为50%左右),每份100g装入250m L锥形瓶中,制得物理混合样品及进行酯交换反应的混合油样。
1.2.2 酶法酯交换反应 将混合油样加热至60℃后,根据实验设计要求加入一定量的固定化酶,并将瓶中充满氮气后封口,在水浴摇床中进行酶法酯交换反应,水浴摇床的速度为200r/min。反应在指定温度下进行,反应结束后,将反应瓶在60℃下静置5m in待反应样品与酶完全分离后,将上层油样通过滤纸滤出,并放置在4℃下进行储存备用[14-15]。
1.2.3 滑动熔点测定 根据AOCS Cc3-25[18]敞开式毛细管测定方法进行滑动熔点的测定。将油样在60℃下完全融化,充分混匀后,静置5m in至油样中无气泡,用两只干净的毛细管蘸入油样中,样品在毛细管中上升的高度为10mm时,立即放置在冰块中冷冻样品,使样品凝固。并将毛细管放置在4~10℃下的冰箱中16h。取出毛细管后,用橡皮筋将毛细管绑在温度计上,使得毛细管的底部与温度计水银球相平,并将绑好的温度计放入装有600m L冰水混合物的烧杯中,使温度计的底部浸入到水中,调整起始水浴温度使其低于样品滑点温度的8~10℃,打开电源,并搅拌,使加热速率为1℃/m in,当接近滑点温度时,速率降为0.5℃/min。记录每根毛细管柱中油样开始上升时的温度,取平均值作为测定结果。
1.2.4 单因素及响应面实验设计 以产物滑动熔点作为考察酶法酯交换程度的指标,对反应时间(A)为0、1、2、3、4、5、6、7、8h,反应温度(B)为40、45、50、55、60、65、70、75、80℃及酶添加量(C)为4%、6%、8%、10%、12%(质量比)进行单因素实验。在单因素实验的基础上,确定各因素的最佳水平范围,利用Design Expert 8.0.6软件进行Box-Benhnken响应面实验设计,研究酶法酯交换工艺参数对产物滑动熔点的影响。以酶法酯交换反应时间(A),反应温度(B)及酶添加量(C)为自变量,以滑动熔点(Y)为响应值,设计了三因素三水平的响应面分析实验,因素水平编码见表1。
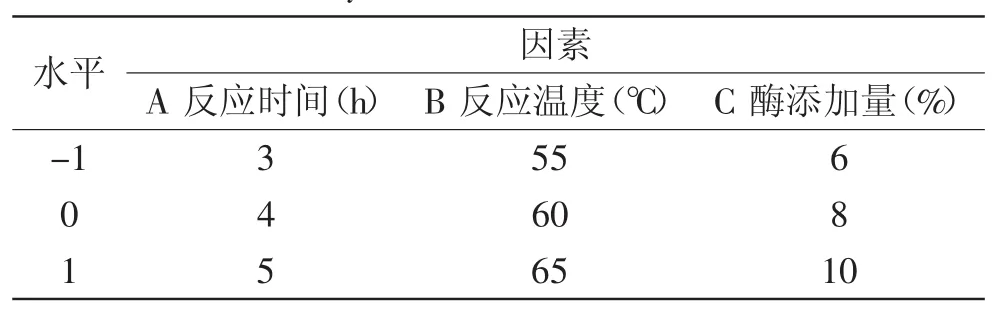
表1 酶法酯交换实验因素水平编码表Table 1 Coding table of experiment factor for enzymatic interesterfication
1.2.5 化学酯交换 将制备好的混合油样在60℃下完全融化倒入平底烧瓶中,在真空状态下,利用加热套将其加热至105℃进行脱水,时间为30m in,然后迅速加入甲醇钠,反应开始是以油样变为红褐色为标志,反应在105℃下反应30m in,加入10%的柠檬酸溶液终止反应。得到的反应产物需进行水洗至中性(pH=7)以去除多余的柠檬酸以及皂化物等。最后重复第一步对油样进行脱水。脱水后制得的油品放置在4℃下进行储藏[3]。
1.2.6 油脂氧化稳定性的测定 将物理混合样品,酶法酯交换样品及化学酯交换样品放置在60℃烘箱中存放0~30d,每隔5d对其指标进行检测,检测指标为过氧化值和P-茴香胺值。
1.2.6.1 过氧化值的测定 根据AOCSCd 8b-9-2009标准进行乙酸-异辛烷方法测定[16],由于样品在常温下易于凝固,故样品测定前放置在水浴锅中保温。

其中:S—样品滴定体积,m L;B—空白样品滴定体积,m L;M—Na2S2O3标准溶液的摩尔浓度,mol/L;m—样品质量,g。
1.2.6.2 P-茴香胺值的测定 根据AOCS Cd 18-90-2011标准进行测定[17]。准确称量2g油样置于25m L容量瓶中,用异辛烷溶解并稀释到刻度成为未反应溶液,用异辛烷溶剂作空白。用移液管吸取未反应溶液5m L置于试管中,另一试管加入5m L异辛烷溶剂,分别加入1m L甲氧基苯胺试剂,振摇后静置10min,在350nm处分别测定上述溶液吸光度。按下式计算p-茴香胺值:

其中:As—加入甲氧基苯胺试剂后油脂样品的吸光度;Ab—未加入甲氧基苯胺试剂的油脂样品的吸光度;m—油脂样品的质量,g。
2 结果与讨论
2.1 酶法酯交换反应条件优化
2.1.1 反应时间对酶法酯交换实验的影响 Lipozyme TL IM酶添加量为8%(质量比)作为催化剂,反应在60℃下进行,测定不同反应时间下反应产物的滑动熔点变化结果见图1。
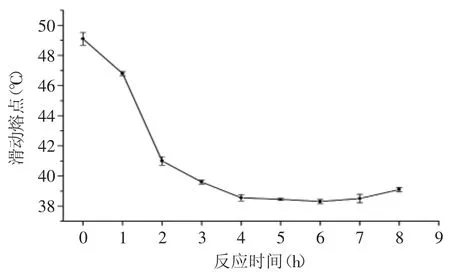
图1 反应时间对酶法酯交换反应的影响Fig.1 Effect of reaction time on enzymatic interesterification
反应时间0h时为棕榈硬脂/油茶籽油/棕榈仁油(60∶30∶10,质量比)物理混合后的滑动熔点(48.5℃)。通过结果可得出2~4h滑动熔点变化显著(p<0.05),4~6h滑动熔点变化不显著,6h后滑动熔点略有上升,所以确定4h反应基本达到平衡状态,滑动熔点作为指标值较为宏观的反映了酯交换的反应程度,其主要可以代表酯交换产物的甘三酯中脂肪酸位置上的变化,反应时间不宜过长,因为随着时间的延长,发生酰基位移的几率会增加,所以选择反应时间为4h。
2.1.2 反应温度对酶法酯交换实验的影响 确定反应时间为4h,酶添加量为8%(质量比),测定不同温度下产物的滑动熔点结果见图2。
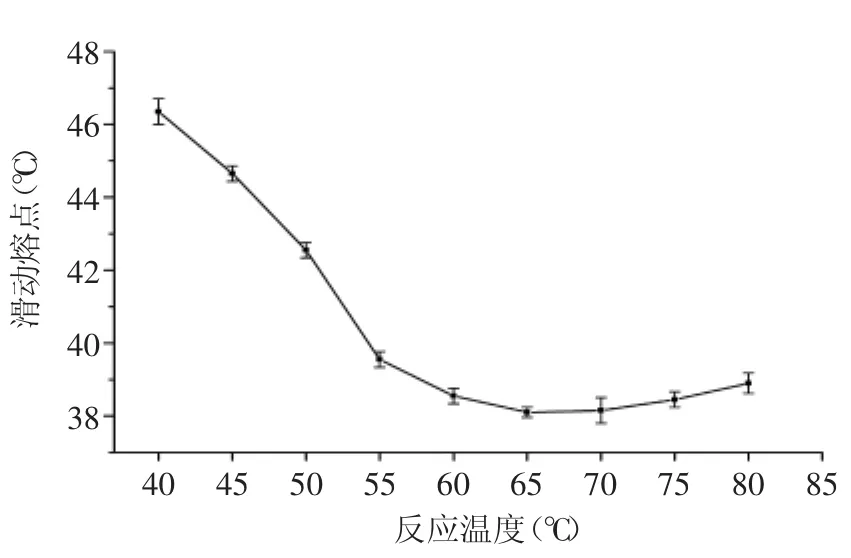
图2 反应温度对酶法酯交换反应的影响Fig.2 Effect of reaction temperature on enzymatic interesterification
通过图2可得出,40~60℃滑动熔点呈线性下降趋势,变化显著(p<0.05);70℃下的滑动熔点虽低于60℃,但因为酶法酯交换反应为热动力学过程,反应温度对酯交换反应影响较大,反应温度过低使得酶活无法达到最大,反应温度升高会加快反应速率和酯交换程度,但反应温度过高却会使酶失活,导致反应速率下降。综合考虑后最终选择的反应温度为60℃。2.1.3 酶添加量对酶法酯交换实验的影响 确定反应时间为4h,反应温度为60℃,测定不同酶添加量下,反应后产物的滑动熔点结果见图3。
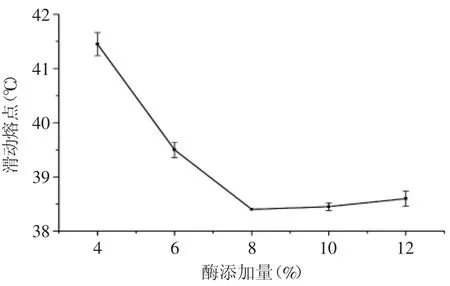
图3 酶添加量对酶法酯交换反应的影响Fig.3 Effect of enzyme addition on enzymatic interesterification
通过实验可以看出,当酶添加量小于8%时,产物的滑动熔点随酶添加量的增加而降低,这表明酯交换程度随酶添加量的增加而增加;当酶添加量为12%时,滑动熔点略有上升,这是由于当酶添加量增加到一定量时,底物和产物传质阻力的影响已开始大于酶反应催化速率的影响,使得酶的催化效率降低。
滑动熔点的变化主要是由混合物甘三酯组成中的高熔点甘三酯,中熔点甘三酯及低熔点甘三酯的含量变化导致的,酯交换为碳骨架上的脂肪酸位置的重排,使得高熔点甘三酯含量下降,中熔点甘三酯含量增加,使得滑动熔点降低,所以滑动熔点能宏观的反映酯交换程度。通过结果可知,当酶添加量达到8%时,随着酶添加量的增加,产物滑动熔点降低幅度减少,故选择酶添加量为8%。
2.2 酶法酯交换反应条件响应面优化
以单因素实验为基础,利用Design Expert 8.0.6软件中的Box-Benhnken进行三因素三水平的实验设计,以棕榈硬脂/油茶籽油/棕榈仁油(60∶30∶10,质量比)作为底物,其中影响因子为反应时间(3、4、5h),反应温度(55、60、65℃)及酶添加量(6%、8%、10%),响应值为产物的滑动熔点。实验方案及结果见表2。

表2 响应面试验方案及结果Table 2 Response surface design and rerults
通过统计分析软件Design Expert8.0.6进行多元回归拟合,以滑动熔点(Y)与反应时间(A),反应温度(B)以及酶添加量(C)之间建立响应面回归模型如下:
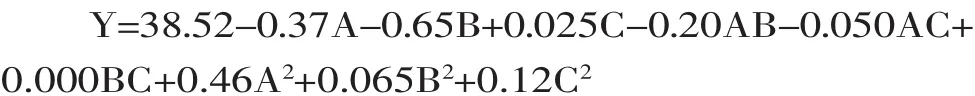
对其数据分析结果进行方差分析,结果如表3。
通过方差分析结果可以看出,模型中整体拟合度显著(p<0.05),且R2=96.65%,R2adj=92.34%,说明该模型的建立与实验的拟合度良好,可预测性高达96.65%,具有高度的可信性,A、B、A2极显著(p<0.01),AB显著(p<0.05),其余项均无显著影响。通过方差分析的F值可知三个因素对响应值滑动熔点的影响程度的排序为:B>A>C,即反应温度>反应时间>酶添加量。
统计分析后,以滑动熔点作为响应值,根据市售塑性脂肪产品的滑动熔点作为衡量标准,滑动熔点在38℃左右的产品具有良好的塑性性质,所以优化时以滑动熔点38℃为最优条件,得到酯交换反应最优的工艺参数为反应时间为4.2h,反应温度为64℃,酶添加量为7.2%,在此条件下的理论响应值为38.0℃。通过验证实验,得到的实际滑动熔点为37.9℃,表明实际反映使得高熔点甘三酯明显下降,中熔点和低熔点甘三酯含量升高,但其误差小于1%,即说明该模型对酯交换反应的条件优化具有实际意义。通过与物理混合滑动熔点对比得出(见表4),酶法酯交换后的滑动熔点明显降低,而化学法酯交换产物的滑动熔点低于酶法酯交换产物,这是由于化学酯交换为随机酯交换,其甘三酯组成与酶法酯交换的存在差异。

表3 方差分析结果Table 3 ANOVA for response surface model
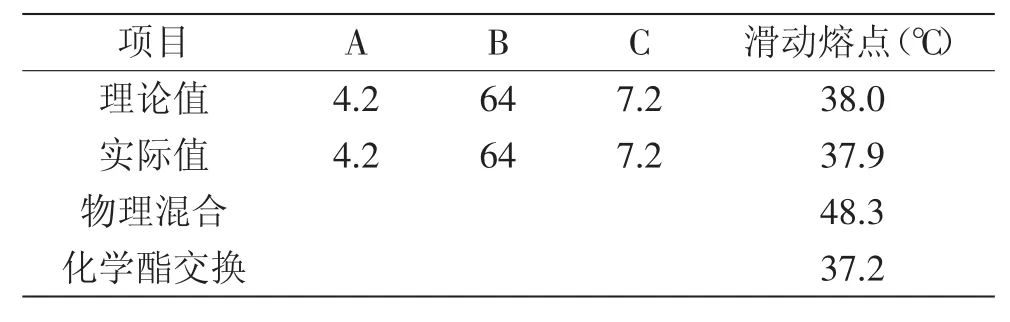
表4 验证实验理论值及实际值结果Table 4 Results of the verification test
2.3 酯交换产品氧化稳定性
过氧化值是评价油脂氧化程度的重要指标,从整体上看,物理混合样品的过氧化值在储藏过程中低于酶法酯交换产物及化学法酯交换产物,而酶法酯交换产物的过氧化值低于化学法酯交换产物(见表5),Fauzi等[10-13]在之前的研究中也得到了相似的结论。这是由于物理混合样品中含有天然抗氧化剂,并且未被破坏,而化学法酯交换在三种改性方式中反应条件最为剧烈,抗氧化剂在此过程中遭到破坏,使得其抗氧化效果明显降低。相较于化学酯交换,酶法酯交换反应条件温和,氧化稳定性优于化学法酯交换。
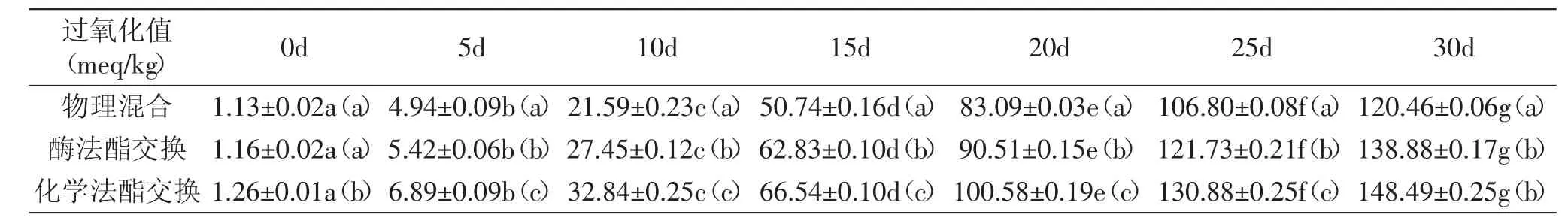
表5 三种样品的过氧化值Table 5 Peroxide value of the three samples
P-茴香值是氢过氧化物产生的二级氧化产物的标志,用于衡量油脂氧化的次级阶段。通过表6得出,随着时间的增加,P-茴香胺值随之增加,当储藏时间为20d时,P-茴香胺值有明显上升,这是由于不稳定的初级氧化产物(氢过氧化物)分解形成了醇、醛、酮、酸以及环状化合物等次级氧化产物,物理混合样品P-茴香胺值最低,酶法酯交换产物P-茴香胺值略低于化学酯交换产物,其整体变化趋势与过氧化值相似,同样在相关文献中得出了相似的结论[8]。
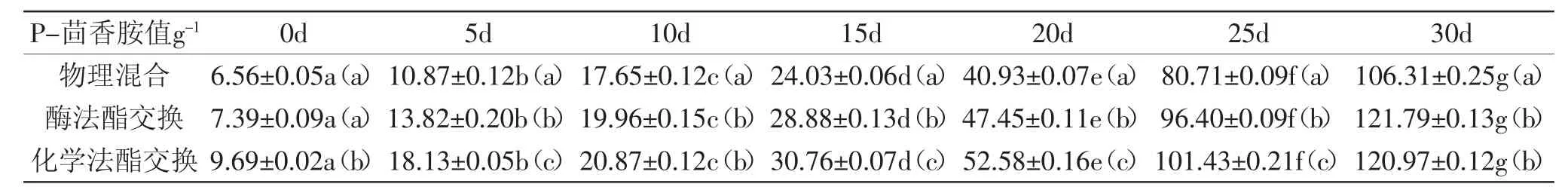
表6 三种样品的P-茴香胺值Table 6 P-Anisidine of the three samples
3 结论
以棕榈硬脂,油茶籽油和棕榈仁油为原料进行酶法酯交换制备塑性脂肪的反应条件优化,反应条件包括反应时间,反应温度及酶添加量,响应值为产物滑动熔点,以单因素实验为基础,确定中心点后,进行响应面设计,得出最佳的反应条件参数为反应时间4.2h,反应温度为64℃,酶添加量为7.2%,并且在最佳反应条件下的滑动熔点可达37.9℃。通过30d的储藏时间对物理混合样品、酶法酯交换产物及化学酯交换产物性质进行对比后发现,物理混合氧化稳定性高于酶法酯交换样品,而化学酯交换产物的氧化稳定性低于酶法酯交换样品,说明以油茶籽油、棕榈仁油作为改性油脂,利用酶法酯交换可制备塑性脂肪。
[1]张霞.贮藏过程中棕榈油基塑性脂肪结晶网络结构与宏观物理性能变化研究[D].广州:华南理工大学,2013.
[2]Pande G,Akoh CC.Enzymatic modification of lipids for trans free margarine[J].Lipid Technology,2013,25(2):31-33.
[3]Adhikari P,Hu P.Enzymatic and chemical interesterification of rice bran oil,sheaolein,and palm stearin and comparative study of their physicochemical properties[J].Journal of Food Science,2012,77(12):C1285-C1292.
[4]Adhikari P,Shin JA,Lee JH,et al.Production of trans-free margarine stock by enzymatic interesterification of rice bran oil,palm stearin and coconut oil[J].Journal of the Science of Food and Agriculture,2010,90(4):703-711.
[5]张婷,金青哲,王兴国.棕榈仁油与五种油脂相容性的研究[J].中国油脂,2006,31(11):26-29.
[6]柏云爱,宋大海,张富强,等.油茶籽油与橄榄油营养价值的比较[J].中国油脂,2008,33(3):39-41.
[7]罗晓岚,朱文鑫.油茶籽油加工和油茶资源综合利用[J].中国油脂,2010(9):13-17.
[8]Ruan X,Zhu X M,Xiong H,et al.Characterisation of zerotrans margarine fats produced from camellia seed oil,palm stearin and coconutoilusing enzymatic interesterification strategy[J].International Journal of Food Science&Technology,2014,49(1):91-97.
[9]王丽霞,庞杰,陆蒸.茶油的加工和利用[J].粮油食品科技,2004,12(3):33-36.
[10]Fauzi S H M,Rashid N A,Omar Z.Effects of chemical interesterification on the physicochemical,microstructural and thermal properties of palm stearin,palm kernel oil and soybean oil blends[J].Food Chemistry,2013,137(1):8-17.
[11]Martin D,Reglero G,Señoráns F J.Oxidative stability of structured lipids[J].European Food Research and Technology,2010,231(5):635-653.
[12]Seriburi V,Akoh C C.Enzymatic interesterification of lard and high-oleic sunflower oil with Candida antarctica lipase to produce plastic fats[J].Journal of the American Oil Chemists' Society,1998,75(10):1339-1345.
[13]Adhikari P,Hu P,Yafei Z.Oxidative stabilities of enzymatically interesterified fats containing conjugated linoleic acid[J].Journal of the American Oil Chemists' Society,2012,89(11):1961-1970.
[14]Zhao M L,Tang L,Zhu X M,et al.Enzymatic Production of Zero-Trans Plastic Fat Rich inα-Linolenic Acid and Medium-Chain Fatty Acids from Highly Hydrogenated Soybean Oil,Cinnamomum camphora Seed Oil,and Perilla Oil by Lipozyme TL IM[J].Journal of Agricultural and Food Chemistry,2013,61(6):1189-1195.
[15]Shin JA,Akoh C C,Lee K T.Enzymatic interesterification of anhydrous butterfat with flaxseed oil and palm stearin to produce low-trans spreadable fat[J].Food Chemistry,2010,120(1):1-9.
[16]AOCS Cd 8b-90,Peroxide Value Acetic Acid-Isooctane Method[S].2009.
[17]AOCSCd 18-90,p-Anisidine Value[S].2011.
[18]AOCS Cc3-25,Slip Melting Point AOCS Standard Open Tube Melting Point[S].1997.
Optimization enzymatic interesterification process to produce p lastic fat and study of oxidative stability
ZHANG Chao-ran1,LIYang1,SUN Xiao-yang2,WANG Sheng-nan1,QIBao-kun1,LIDan1,M AW en-jun1,JIANG Lian-zhou1,*,SUIXiao-nan1
(1.Department of Food Science,Northeast Agricultural University,Harbin 150030,China;2.Novozymes(Shandong)Innovation&Business Center,Ji'nan 250101,China)
Plastic fatwas produced by enzymatic interesterification with palm stearin and camellia seed oil.Based on single factor experiments,the interesterification conditions was optimized by a response surface design through the Design Expert software,which included reaction time,reaction temperature and enzyme addition. The response value was the slipping melting point.The result of the op timization was 4.2h(reaction time),64℃(reaction temperature),7.2%(enzyme add ition).Under this condition,the real response value was 37.9℃. Oxidative stability was com pared to the samples physical blends,the enzymatic and chemical interesterified blends.The peroxidate values of the physicalb lend during the storage time for 30 days were 1.13~120.46meq/kg which were lower than those of the enzymatic interesterified blends(1.16~138.88meq/kg)and the chem ical interesterified blends(1.26~148.49meq/kg).The study demonstrates the oxidative stability of physical b lend was higher than that of the enzymatic interesterified blends and the enzymatic interesterified blends was more stability than the chemical interesterified blends.
plastic fat;enzymatic interesterification;response surface design;camellia seed oil;oxidative stability
TS225.6
A
1002-0306(2015)08-0114-05
10.13386/j.issn1002-0306.2015.08.014
2014-07-24
张超然(1989-),女,硕士研究生,研究方向:粮食、油脂及植物蛋白工程。
*通讯作者:江连洲(1960-),男,教授,研究方向:粮食、油脂及植物蛋白工程。
国家“863”计划(2013AA102104-1);大豆产业技术体系岗位专家(CARS-04-PS25)。
