双抗夹心酶联免疫吸附法检测荞麦过敏蛋白
2015-10-24张新瑀崔晓东王转花
张新瑀,崔晓东,杨 欢,葛 川,王转花,*
(1.山西大学生命科学学院,山西太原030006;2.山西省科学技术情报研究所,山西太原030001)
双抗夹心酶联免疫吸附法检测荞麦过敏蛋白
张新瑀1,崔晓东1,杨 欢1,葛 川2,王转花1,*
(1.山西大学生命科学学院,山西太原030006;2.山西省科学技术情报研究所,山西太原030001)
提取制备荞麦过敏原蛋白(TBt)并免疫动物,分别制备鼠多克隆抗体和兔多克隆抗体,建立了双抗夹心酶联免疫吸附检测法(ELISA)用于检测食品中的荞麦过敏原。SDS-PAGE结果表明,纯化的TBt纯度达到98%以上,鼠抗血清效价为1∶6400。建立的双抗夹心ELISA法对荞麦过敏原蛋白的最低检测限为0.16μg/mL,线性范围为0.16~16μg/mL。并采用建立的双抗夹心ELISA法对市场出售的15种食品中荞麦过敏成分进行了检测。结果显示,该方法对绝大多数食品中的荞麦过敏原都有很好的特异性及灵敏性,说明该法可用于食物过敏原的诊断及食品中微量荞麦过敏成分的检测。
荞麦,过敏蛋白,多克隆抗体,酶联免疫吸附法
荞麦属蓼科双子叶植物,有甜荞麦(Fagopyrum esculentum Moench)和苦荞麦[Fagopyrum tataricum(L.)Gaertn]两个栽培种,在我国西南云贵高原和北方长城沿线地区被广泛种植。荞麦种子中含有较高的营养成分和药用活性物质,其中富含的黄酮类化合物能够有效地预防糖尿病、高血压和冠心病等多种慢性疾病[1],已经成为“三高”患者的最佳食物选择。但是有报道称荞麦食品可导致特定人群发生过敏反应,发生哮喘和红斑,严重时甚至引发休克和死亡[2-3]。日本已把荞麦列为五大食物过敏原之一,其病理机制为IgE介导的Ⅰ型速发型过敏反应[4]。近年来,随着荞麦功能食品的问世,有关荞麦食品潜在的致敏问题也引起了国内外学者的普遍关注。由过敏引起的临床症状如过敏性哮喘,痉挛等被世界卫生组织定为二十一世纪重点防治三大疾病之一,且发病率逐年增高[5]。有关食物过敏的报道时有发生,寻找荞麦含有的潜在过敏原,研究其结构及致敏机理,并开发检测相关过敏原的试剂,对于控制因摄入荞麦食品而引起的过敏,提高人类健康具有重要意义。
酶 联 免疫 吸 附 测 定 法(enzyme-linked immunosorbent assay,ELISA)是1971年由荷兰学者Van Weerman和瑞典学者Engvail等建立的以免疫学反应为基础,利用抗原、抗体的特异性反应与酶对底物的高效催化两者相结合的一种敏感性很高的实验技术[6-7]。该技术可以检测到大分子抗原以及特异性抗体等物质,具有快速、灵敏、特异、简便,以及载体可标准化等优点[8-9]。双抗体夹心ELISA(Sandwich ELISA)法在原有实验技术的基础上经过改良,使放大倍数和检测灵敏度得到了较大提高,避免了标记特异性抗体。
本课题组前期已从荞麦中提取分离并克隆表达获得了分子量约为24、35、58ku的三种过敏型蛋白,对其结构特征、表位及免疫活性进行了较为系统的研究,结果发现三者均是荞麦中的主要过敏原[10-11],都可以与过敏患者血清特异性IgE结合,根据人群的耐受性不同,表现出不同的过敏症状。进一步通过免疫动物制备了荞麦过敏蛋白的兔多克隆抗体,兔抗血清效价为1∶256000[12-13],为深入研究荞麦过敏原的作用机理及对荞麦食品中过敏成分的检测奠定了良好的基础。本研究在前期研究基础上,采用鼠多克隆抗体和兔多克隆抗体,建立了双抗体夹心ELISA方法,并对其中关键因素进行了摸索,同时应用建立的方法对多种食品中的致敏成分进行了检测。本文旨在优化和建立检测食品中荞麦过敏蛋白的最佳方法,为开发过敏原检测试剂盒提供理论依据。
1 材料与方法
1.1 材料与仪器
荞麦 品种为湖南一号,系2013年收获的种子;BALB/c小鼠 购自山西医科大学医学实验动物中心;特异性过敏原TBt多克隆抗体(兔抗TBt) 本实验室自制;辣根过氧化物酶(HRP) 购自Southernbiotech公司;底物-邻苯二胺、弗氏完全佐剂和弗氏不完全佐剂 均购自Sigma公司;其余试剂 均为国产分析纯;抗原包被液 50mmol/L碳酸盐缓冲液,pH 9.6;抗体稀释液 0.01mmol/L PBST,NaCl 8g,KH2PO40.2g,Na2HPO41.15g,Tween-20 0.5m l,蒸馏水加至1L,pH 7.4;底物-邻苯二胺溶液 临用前配制:0.1mol/L柠檬酸,0.2mol/L Na2HPO4,12.5m L蒸馏水,10mg邻苯二胺,临用前加30%H2O2(m/m)40μL。
Resource Q、Superdex G-75层析柱和AKTA Explorer蛋白质纯化系统 美国GE HEALTHCARE公司;ELx800酶标仪 美国BIO-RAD公司;-80℃低温冰箱 丹麦HETO BIOTECH公司。
1.2 实验方法
1.2.1 荞麦过敏蛋白的分离和纯化 参照实验室之前建立的制备过敏原蛋白的方法[11],脱脂荞麦粉经缓冲液抽提、盐析、离子交换层析、凝胶层析等分离纯化步骤,获得电泳纯的过敏原蛋白TBt,用于多克隆抗体的制备。
1.2.2 多克隆抗体(鼠抗TBt)的制备及纯化 首先使采购的小鼠在新环境中稳定(12d左右),在尾部进行取血,取血量约50μL,-40℃保存,作为阴性血清对照。初次免疫,将弗氏完全佐剂与TBt抗原(100μg/m L)按1∶1(v/v)比例混合,采用皮下多点注射,以刺激机体发生免疫反应。免疫10d后取血,-40℃保存。加强免疫,后续用弗氏不完全佐剂与TBt抗原(100μg/m L)以1∶1的比例充分乳化后,采用腹腔注射进行免疫,每周免疫一次,共免疫三次,免疫10d后进行取血,-40℃保存。用间接ELISA法测定血清效价值。效价值达到2000以上,并有明显上升的趋势,再加强免疫一次,加强免疫后的第7d,摘眼球取血约500μL,将采集的新鲜血液37℃静置60m in,凝固后4℃冰箱过夜,吸取上清,3000r/m in离心10m in。用辛酸-硫酸铵沉淀法纯化鼠多克隆抗体,SDS-PAGE法鉴定纯化后的抗体纯度,用凝胶成像系统进行分析。抗体于-80℃保存。
1.2.3 抗体与HRP偶联 称取适量HRP酶,溶于蒸馏水中,加入新鲜配制的过碘酸钠溶液,混匀,4℃下放置30m in;加入乙二醇溶液,室温放置30m in;加入适量纯化鼠多克隆抗体,混匀,调pH至9.0,4℃下过夜;加入硼氢化钠,混匀,置4℃下2h;在酶标抗体混合液中加入等体积饱和硫酸铵溶液,4℃下放置30m in;离心后,用pH7.4的磷酸盐缓冲液透析过夜[8]。
1.2.4 鼠多克隆抗体效价的测定 用抗原包被液稀释TBt至100μg/m L,包被96孔酶标板,每孔加入100μL,4℃过夜,弃去孔内液体,洗涤液洗3次,每次10min。每孔加入1%脱脂奶粉100μL,37℃封闭1h,洗涤液洗3次,每次10m in。加入不同稀释度(1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200、1∶6400、1∶12800、1∶25600、1∶51200)的HRP-多克隆抗体,每孔加入100μL,37℃结合1h,洗涤液洗3次,每次10m in。加入100μL底物邻苯二胺溶液,暗处显色20m in,每孔加入5μL的稀硫酸(1mol/L),终止反应,酶标仪上测490nm处的光密度值,每个稀释度设定3个重复实验孔,计算光密度值A490平均值,同时设空白对照、阴性对照和阳性对照孔。按照以下公式计算P/N值:
P/N=(测试孔A490-空白孔A490)/(阴性孔A490-空白孔A490)
1.2.5 双抗体夹心ELISA法 包被:将兔抗TBt多克隆抗体用包被液稀释为1∶1000,每孔加入100μL,包被96孔酶标板,4℃过夜,弃去孔内液体,洗涤液洗3次,每次10m in。
封闭:每孔加入1%脱脂奶粉100μL,37℃封闭1h,洗涤液洗3次,每次10m in。
加入抗原:用抗体稀释液稀释TBt为不同浓度(100、50、25、16、8、4、2、1、0.5、0.25、0.16、0.08μg/m L),每孔分别加入100μL,37℃结合1h,洗涤液洗3次,每次10m in。
加入酶标二抗:HRP-鼠抗多克隆抗体用抗体稀释液稀释1∶1000,每孔加入100μL,37℃结合1h,洗涤液洗3次,每次10m in。
显色:加入100μL底物邻苯二胺溶液,暗处显色20m in,每孔加入50μL的稀硫酸(1mol/L),终止反应,酶标仪上测490nm处的光密度值。
以上每组数据设定3个重复实验孔,计算光密度A490平均值,同时设空白对照、阴性对照和阳性对照孔。
1.2.6 最低检测浓度的测定 通过双抗体夹心ELISA法检测不同稀释度的TBt溶液,以待测孔的A490值与阴性血清A490值之比大于等于2.1为阳性(P/N≥2.1),以结果呈现阳性的最高稀释倍数为终点检测浓度。每组数据设定3个重复实验孔,计算光密度A490平均值,根据测量得到的光密度值平均值,绘制光密度值与TBt稀释度曲线,得出最低检测浓度。
1.2.7 食品中荞麦过敏成分的特异性检测 取市售食品15种(8种标示含荞麦成分,7种标示未含荞麦成分),每种取3g(液体取3m L),研磨成粉末,用pH为7.4的30mmol/L PBS缓冲液20m L提取总蛋白2h,离心取上清,利用双抗体夹心ELISA法,测定食品中荞麦过敏原成分。以待测孔的A490值与阴性A490值之比大于等于2.1为阳性(P/N≥2.1),以小麦面粉提取物为阴性对照。同时进行加标实验,在每种食品的PBS提取缓冲液中添加5μg纯化的TBt,来检测基质对荞麦过敏成分测定的影响。
2 结果与分析
2.1 过敏蛋白TBt的SDS-PAGE分析
荞麦过敏原蛋白经提取纯化等步骤后,SDSPAGE(图1)显示所提取的蛋白纯度较高,达到了98%以上的纯度。其非还原性样品(泳道1)在58ku处有条带,而还原性样品(泳道2)在24、35ku处分别有两个条带,说明在还原剂的存在下58ku蛋白的二硫键断开,出现两个大小不等的亚基。纯化的蛋白可用于下一步多克隆抗体的制备。
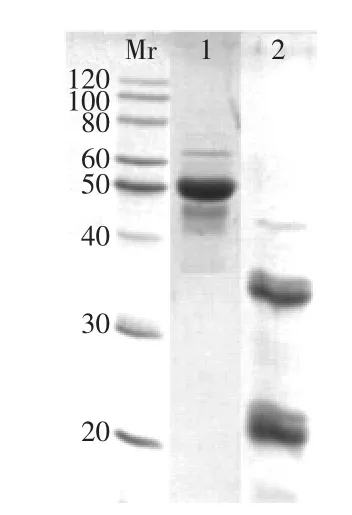
图1 荞麦过敏蛋白的SDS-PAGE分析Fig.1 SDS-PAGE of allergenic protein from buckwheat
2.2 TBt多克隆抗体效价的测定
如图2所示,以免疫前小鼠血清为阴性对照,免疫后小鼠血清为阳性组,A490为纵坐标,血清稀释度为横坐标作图。图2中随着抗体稀释倍数的增加相应的光密度吸收值明显降低,效价逐渐上升,以免疫前血清作为阴性对照,分别减去空白对照,计算P/N值大于2.1时的多抗血清的滴度约为6400,TBt多克隆抗体的效价值为1∶6400。
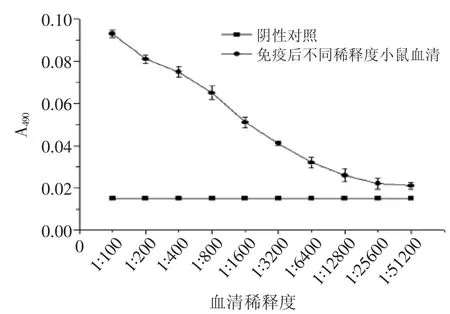
图2 TBt多克隆抗体效价曲线Fig.2 The titer curve of TBt polyclonal antibody
2.3 双抗体夹心ELISA法测定最低检测TBt浓度
如图3,随着TBt的稀释度不断下降,A490值下降,两者成正相关,计算P/N值。当P/N值大于等于2.1时,荞麦过敏蛋白TBt的最低浓度为0.16μg/m L。曲线显示在0.16~16μg/m L区间内,其线性方程为y=0.0285x+ 0.0482,R2=0.9945。即当TBt浓度在0.16~16μg/m L的浓度范围时,检测值与TBt浓度呈正相关。
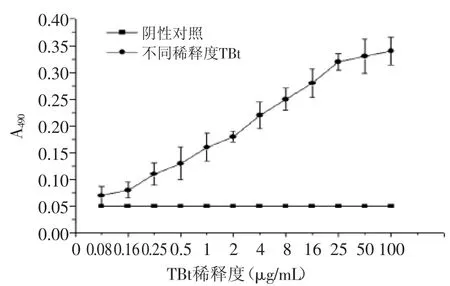
图3 双抗体夹心ELISA法检测荞麦过敏蛋白Fig.3 Double-Antibody Sandwich ELISA method for detection of buckwheat allergenic protein
2.4 食品中荞麦过敏原成分的检测
提取15种食品中的总蛋白,采用双抗体夹心ELISA法检测其中是否含有荞麦过敏蛋白TBt,重复测定3次。检测结果如表1,在所选15种食品中,6种标记以荞麦为原料的食品呈现阳性结果,7种没有标记含有荞麦的食品呈现阴性结果,2种标记以荞麦为原料的食品呈现阴性结果,未检测出含有过敏蛋白。阳性食品P/N值范围在2.2~2.7之间,阴性食品P/N值则在1.1~1.8之间,在所选的产品中基本可检测出微量的荞麦过敏成分。由于各种食品未明确标示出所添加荞麦面粉的含量,另外也可能由于食品加工使过敏蛋白失活等原因,使个别食品未能检测出过敏成分。加标实验表明,除了苦荞保健醋,其他食品的基质对测定结果没有影响。苦荞保健醋的基质对测定结果有一定的影响,可能是醋的pH较低,影响TBt与相应抗体的结合。
检测结果说明采用本实验建立的双抗体夹心ELISA法对检测荞麦过敏蛋白具有较好的实用性。
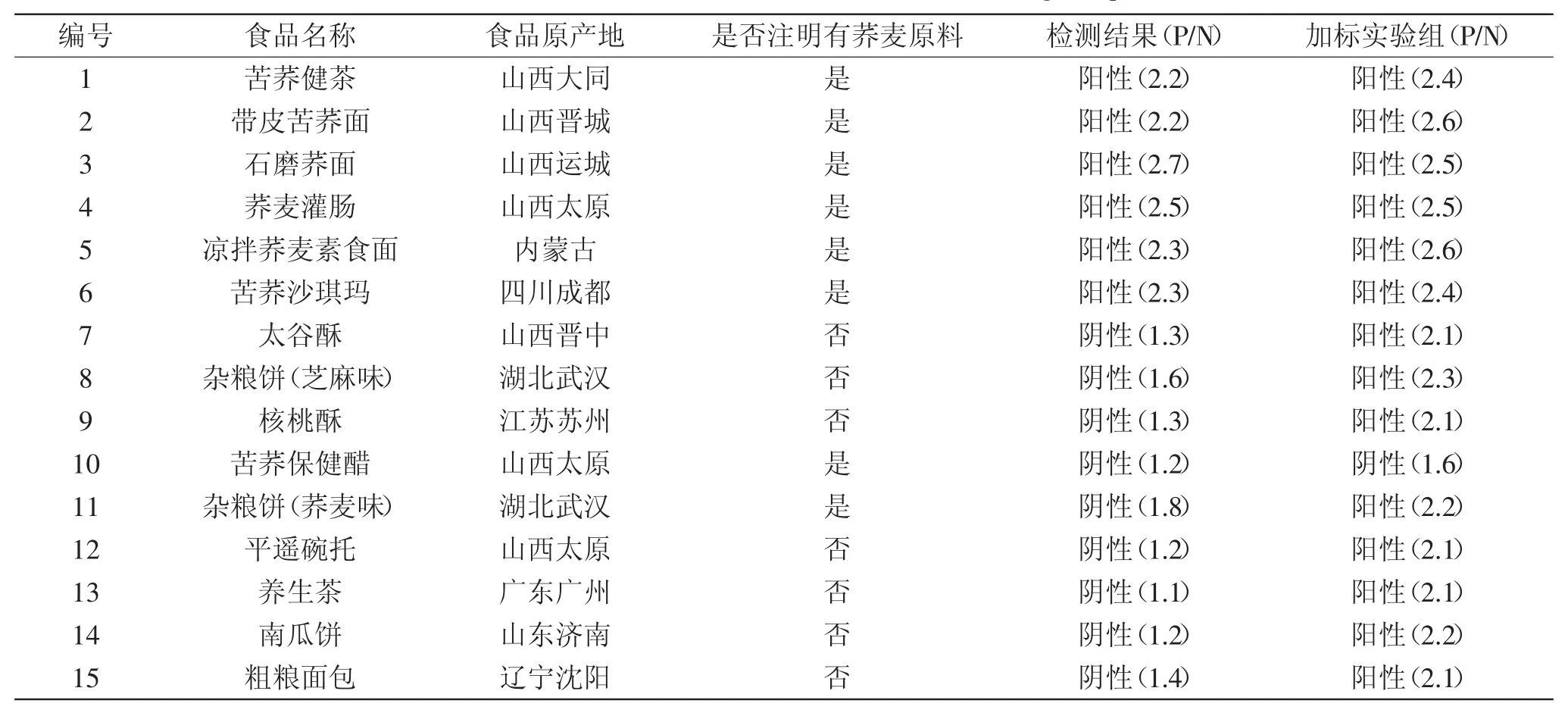
表1 双抗夹心ELISA法检测食品中荞麦致敏成分Table 1 Sandwich ELISA method for detection of buckwheat allergenic protein in foods
3 结论与讨论
本实验从荞麦中提取、纯化得到TBt过敏蛋白,利用此过敏蛋白制备多克隆抗体,并建立双抗体夹心ELISA法,用来检测食品中是否含有该过敏蛋白成分。由于各种食品加工条件不同,往往经过不断的加热,酸碱处理等,食物中的过敏蛋白会发生变化,可能含量也会有所减少,但运用双抗体夹心ELISA法可以极大的提高检测的灵敏度,检测荞麦过敏蛋白成分的灵敏度达到0.16μg/m L。
此外对现售食品中,已经标记为含有荞麦成分和未标记含荞麦成分的食品进行检测,结果发现有6种标记有荞麦成分的食品检测结果呈阳性,2种食品的原料中标明有荞麦成分,但是结果检测为阴性。其中苦荞保健醋检测呈阴性,P/N值仅为1.2,这可能是由于保健醋在制作过程对原料要进行粉碎、蒸煮、发酵、陈醋、灭菌等过程所致,这些发酵过程使得大分子蛋白降解为多肽,氨基酸等小分子物质,使得检测结果呈阴性。同时加标实验也表明,苦荞保健醋的基质(pH较低)对检测结果影响很大。这两者可能都是造成测定结果呈阴性的原因。荞麦味杂粮饼干食品中的主要材料是小麦面粉,食品说明中对荞麦的加入量未详细说明,加标实验表明基质对其测定无影响,则可以初步推断其中荞麦成分较少是其过敏蛋白检测呈阴性的原因。市场上销售的碗托分为两种,一种为适量荞麦为原料加工而成,另一种以小麦面粉为原料加工而成,本实验中购买的平遥碗托,检测结果为阴性,可以判断其原料成分为小麦面粉。由此说明本方法不仅可检测到添加有荞麦成分的相应过敏原,而且对未添加或未知成分的食品中的过敏原也可做出相应的判断。本方法可用于食品中荞麦过敏原的检测。
[1]谭玉荣,陶兵兵,关郁芳,等.苦荞类黄酮的研究现状及展望[J].食品工业科技,2012,33(18):377-381.
[2]任晓霞,张昕,蔡桂红,等.苦荞过敏原TBa表位区段的表达及免疫活性分析[J].细胞与分子免疫学杂志,2010,26(6):543-545.
[3]POMS RE,KLEIN CL,ANKLAM E.Methods for allergen analysis in food:a review[J].Food additives and contaminants,2004,21(1):1-31.
[4]HORESH AJ.Buckwheat sensitivity in children[J].Annals of allergy,1972,30(12):685-689.
[5]李国平.支气管哮喘特异性免疫治疗与变应原疫苗的研究进展[J].国外医学(呼吸系统分册),2004,24(1):34-37.
[6]ENGVALLE,PERLMANN P.Enzyme-linked immunosorbent assay(ELISA) Quantitative assay of immunoglobulin G[J]. Immunochemistry,1971,8(9):871-874.
[7]VAN WEEMEN BK,SCHUURS AH.Immunoassay using antigen-enzyme conjugates[J].FEBS Letters,1971,15(3):232-236.
[8]王守法,阚春月,许学书.酶联免疫吸附实验在食品检测中的应用[J].食品科学,2009,30(23):489-492.
[9]张小兵,邸禄芹,吴萌,等.单克隆抗体与多克隆抗体配对ELISA方法比较[J].生物技术通报,2009(11):125-129.
[10]Wang Z H,Wang L,Chang W J,et al.Cloning,expression,and identification of immunological activity of an allergenic protein in tartary buckwheat[J].Biosci Biotechnol Biochem,2006,70(5):1195-1199.
[11]Ren X X,Zhang X,Li Y Y,et al.Epitope mapping and immunological characterization of amajor allergen TBa in tartary buckwheat[J].Biotechnology letters,2010,32(9):1317-1324.
[12]张昕,崔晓东,王转花.荞麦过敏原特异性抗体酶联免疫吸附法检测试剂制备[J].食品科学,2011,32(20):327-330.
[13]杨振煌,崔晓东,李平,等.特异性过敏原TBt多克隆抗体的制备与鉴定[J].细胞与分子免疫学杂志,2011,27(9):1000-1002.
Double-antibody sandwich enzyme linked immunosorbent assay for the detection of buckwheat allergen protein
ZHANG Xin-yu1,CUIXiao-dong1,YANG Huan1,GE Chuan2,WANG Zhuan-hua1,*
(1.School of Life Science,Shanxi University,Taiyuan 030006,China;2.Shanxi Science and Technology Information Research Institute,Taiyuan 030001,China)
In the p resent study,buckwheat allergenic p rotein(TBt)from tartary buckwheat seeds was extracted and purified,and specific antibodies against TBtwere produced.A double-antibody sandwich enzyme linked immunosorbent assay(ELISA)based on rabbit polyclonal antibody and mouse polyclonal antibody was established.This method could be used for the detection of buckwheat allergenic protein in food.SDS-PAGE experiments showed that the purified TBt reached a purity of more than 98%.The serum antibody titers from mouse was 1∶6400.The sandwich ELISA could detect buckwheat allergenic protein at levels as low as 0.16μg/m L,and the linear range was at 0.16~16μg/m L.Using the ELISA to detect 15 kinds of food commercially available in the market,it was found that the newly established ELISA had specificity and sensitivity toward different foods expect vinegar.It provided a method for the diagnosis of food allergenic and the detection of trace allergens in food.
buckwheat;allergen;polyclonal antibody;enzyme linked immunosorbent assay
TS207.3
A
1002-0306(2015)08-0053-04
10.13386/j.issn1002-0306.2015.08.002
2014-06-17
张新瑀(1990-),男,硕士研究生,研究方向:食品科学。
*通讯作者:王转花(1956-),女,教授,研究方向:生物活性物质与蛋白质工程。
国家自然基金项目(31171659);青年科学基金项目(31300653);山西省科技平台项目(2014091028)资助。
