RGO-MWNTs/铁氰化镍复合材料构筑无酶葡萄糖传感器
2015-10-24黄富英陈国良李艳彩
莫 韬,黄富英,陈国良,李艳彩
(闽南师范大学化学与环境学院,福建 漳州 363000)
RGO-MWNTs/铁氰化镍复合材料构筑无酶葡萄糖传感器
莫 韬,黄富英,陈国良,李艳彩*
(闽南师范大学化学与环境学院,福建漳州363000)
将制备的铁氰化镍纳米颗粒(NiHCF)与石墨烯-碳纳米管(RGO-MWNTs)混合,分散于壳聚糖(Chit)溶液中,形成新的纳米复合材料(RGO-MWNTs/NiHCF/Chit),将其修饰在玻碳电极表面.由于RGO-MWNTs具有良好的电子传递性能和NiHCF与RGO-MWNTs之间的协同作用,促使NiHCF电催化氧化能力有了很大的提高.与NiHCF/ Chit膜相比,RGO-MWNTs/NiHCF/Chit复合膜的氧化还原峰电流增大了5倍,且在较低电位下对葡萄糖具有很好的电催化性能.该复合膜电极对葡萄糖的线性响应范围为0.03~0.096 mM,检测限为0.016 mM,可用于葡萄糖的电化学传感检测.
铁氰化镍纳米颗粒;石墨烯/碳纳米管复合材料;壳聚糖;葡萄糖传感器
传统的葡萄糖传感器通过葡萄糖氧化酶在电极上的固载从而实现对葡萄糖高选择性、高灵敏度的检测.然而酶自身很容易受外界温度、pH值等因素的影响而丧失活性,因此电极稳定性不高.各种金属电极,例如Pt、Au等对葡萄糖具有较好的电催化氧化作用,因此近年来人们探讨了这些材料对葡萄糖的直接电催化氧化,发展了无酶葡萄糖电化学传感器.但是贵金属价格比较昂贵,且这些电极在使用过程中其表面也容易受到污染及毒害等.近年来很多研究发现Ni[1-2]、Cu[3]、金属氧化物(MnO2,Co3O4)[4-5]、金属铁氰化物[6]等材料具有良好的电子传递速率,且对葡萄糖的氧化具有较好的电催化作用.其中金属铁氰化物制备方法简单、化学性质稳定、电催化效果好且价格低廉,因而成为电化学传感器的研究热点[7-8].
由碳元素构成的低维碳纳米材料,具有独特的结构和物理化学性能,因此引起了研究者的广泛关注,在纳米领域得到了广泛应用[9-12].为了得到性能更好的新材料,人们尝试将这些低维碳纳米材料进行复合.目前已获得一些新型的碳纳米复合材料,例如富勒烯/碳纳米管[13-14]、富勒烯/石墨烯[15-16]等,而制备碳纳米管/石墨烯复合材料的报道还较为少见.
将制备的铁氰化镍纳米颗粒分散在壳聚糖溶液中,并加入RGO-MWNTs,得到新型纳米复合材料RGOMWNTs/NiHCF/Chit,将其固定在玻碳电极表面,从而得到RGO-MWNTs/NiHCF/Chit复合膜修饰电极.通过电化学实验表明,加入RGO-MWNTs后,所得到的RGO-MWNTs/NiHCF/Chit复合膜的电化学活性大大提高,对葡萄糖具有很好的电催化氧化效果,可用于葡萄糖的无酶电化学传感检测.
1 材料与方法
1.1试剂
硫酸镍、葡萄糖购于北京化工有限公司;醋酸、铁氰化钾、氯化钾均购于西陇化工(广东省汕头市);壳聚糖在厦门星隆达化学试剂有限公司购买;MWNTs(纯度超过95%)购自深圳纳米港;其他化学药品均为分析纯,实验前无须纯化.支持电解质采用0.1M NaOH溶液.采用超纯水配制实验中所用到的溶液.
1.2仪器与设备
在电化学工作站(CHI650C,上海辰华)上进行电化学相关实验,采用三电极系统:用修饰或未修饰的玻碳电极(GCE,CHI104,直径3mm)做工作电极,用铂丝电极做辅助电极,用Ag/AgCl(3.0mol/L KCl)电极做参比电极.纳米材料的形貌利用透射电子显微镜(TEM,Tecnai G220 ST,美国FEI公司)来表征.
1.3方法
1.3.1RGO-MWNTs的制备 将53.7 mg氧化石墨烯(GO)和53.7 mg MWNTs加入到10 mL二次蒸馏水中连续超声至溶液呈黑色均匀的悬浊液.然后加入0.1 mL 3%的聚乙烯亚胺(PEI)到混合溶液(pH=1),在135℃下回流3h.黑色溶液通过用二次蒸馏水洗涤几次,最后在常温干燥,得到RGO-MWNTs.
1.3.2铁氰化镍纳米材料的制备 在搅拌下,取10.0 mL、0.01 mol/L NiSO4水溶液逐滴加入10 mL、0.025 mol/L K3[Fe(SCN)6](含有0.05mol KCl)的水溶液中.NiSO4滴完后,继续搅拌5min,将溶液进行离心分离,所得沉积物用水洗再离心,然后干燥,得到铁氰化镍纳米颗粒.
1.3.3RGO-MWNTs/NiHCF/Chit/GCE的制备 依次用1.0、0.3和0.05 μm的α-Al2O3粉末对玻碳电极的表面进行抛光,然后分别置于蒸馏水、乙醇、蒸馏水中超声清洗三次,并利用铁氰化钾溶液检测电极的可逆性,最后用氮气吹干电极的表面.RGO-MWNTs纳米复合材料(2 mg/mL)与1 mL的铁氰化镍纳米材料溶液混合,分散于Chit溶液中,超声搅拌数分钟,得到黑色均匀分散的RGO-MWNTs/NiHCF/Chit溶液.然后,取10μL RGO-MWNTs/NiHCF/Chit溶液滴加在新处理的玻碳电极上并于4℃下晾干,即得到RGO-MWNTs/Ni-HCF/Chit/GCE.而取10 μL NiHCF/Chit溶液滴加在新处理的玻碳电极上并于4℃下晾干,可得到NiHCF/ Chit/GCE.
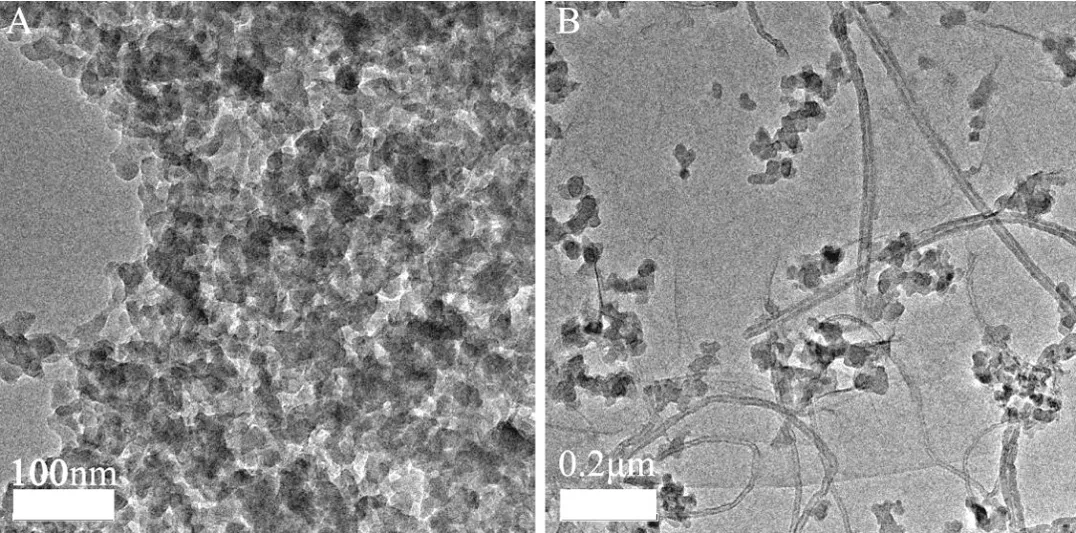
图1 NiHCF(A),RGO-MWNTs/NiHCF(B)的透射电镜图Fig.1 TEM images of NiHCF(A)and RGO-MWNTs/NiHCF(B)
2 结果与讨论
2.1纳米材料的TEM表征
图1A为NiHCF纳米材料的TEM图,从图中可以看到NiHCF颗粒的粒径为20~30 nm左右;图1B为RGO-MWNTs/NiHCF纳米材料的TEM图,可以观察到MWNTs和片层状的RGO,同时还有颗粒状的NiHCF分散在RGO-MWNTs复合材料中.
2.2电化学表征
本文研究了NiHCF/Chit/GCE和RGOMWNTs/NiHCF/Chit/GCE的电化学行为,如图2所示.由图2a可知,NiHCF/Chit/GCE的循环伏安曲线呈现一对可逆的氧化还原峰,这是由于纳米颗粒中Fe3+和Fe2+之间的电子转移引起的.而RGO-MWNTs/NiHCF/Chit/GCE的循环伏安曲线上(图2b),氧化峰和还原峰电位向两侧移动,且背景电流和峰电流都有所增大,背景电流增大主要是RGO-MWNTs增大了电极的有效比表面积;而峰电流与NiHCF/Chit电极相比增大了近5倍,主要是由于RGO-MWNTs和NiHCF之间的协同作用,使NiHCF的氧化还原活性得到了很大的提高[17-18],因此RGOMWNTs/NiHCF/Chit/GCE具有更高的电催化活性.两电极循环伏安曲线的峰形状和峰电位都没发生明显变化,表明石墨烯和碳纳米管的加入并没有改变纳米颗粒和电极之间电子传递的途径[19].
RGO-MWNTs/NiHCF/Chit/GCE在0.1M NaOH溶液中扫速为10到500mV/s时的循环伏安曲线,如图3所示.从图中可见,随着扫描速度增加,氧化还原峰电流相应地增加,与扫速呈线性关系(如图4),说明该电极反应过程为表面控制过程.RGO-MWNTs/NiHCF/Chit/GCE的氧化还原峰电流与扫描速度的线性方程分别为Ipc=-508.4+207.8v(R=0.999)和Ipa=415.6-212.4v(R=0.998).

图2 NiHCF/Chit/GCE(a)和RGO-MWNTs/ NiHCF/Chit/GCE(b)在0.1M NaOH溶液中的循环伏安曲线,扫速100mV/sFig.2 Cyclic voltammograms of NiHCF/Chit/GCE(a)and RGO-MWNTs/NiHCF/Chit/GCE(b)in 0.1M NaOH,respectively at 100mV·s-1

图3 RGO-MWNTs/NiHCF/Chit/GCE在0.1M NaOH中在不同扫速时测得的循环伏安曲线(从内到外扫速分别为:10,25,50,75,100,150,200,250,300,350,400,450和500mV/s)Fig.3 The cyclic voltammograms of the RGOMWNTs/NiHCF/Chit/GCE in 0.1M NaOH from 10 to 500mV/s(from inner to outer)
2.3RGO-MWNTs/NiHCF/Chit/GCE对葡萄糖的电催化氧化
图5为RGO-MWNTs/NiHCF/Chit/GCE在氢氧化钠溶液中及加入不同浓度葡萄糖后的循环伏安曲线.如图5所示,当在NaOH溶液中加入1.0mM葡萄糖后,修饰电极的氧化峰电流明显增加,说明了该电极对葡萄糖具有电催化氧化作用,可归于电极表面所修饰的RGO-MWNTs/NiHCF/Chit复合材料;而且随着葡萄糖浓度的增加,氧化峰电流也逐渐增加,同时氧化峰电位则不断地向正电位方向移动,这属于典型的媒质介导氧化行为.根据相关参考文献[7],该修饰电极对葡萄糖的电催化氧化机理可描述如下:

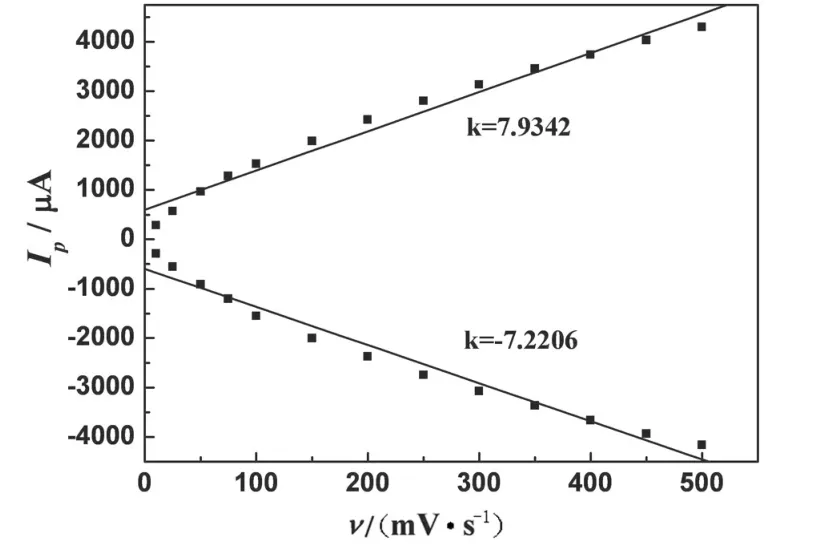
图4 RGO-MWNTs/NiHCF/Chit/GCE在0.1M NaOH溶液中阴极峰电流、阳极峰电流与扫速的关系曲线Fig.4 The relationship between cathodic peak current,anodic peak current and scan rate of RGO-MWNTs/NiHCF/Chit/GCE
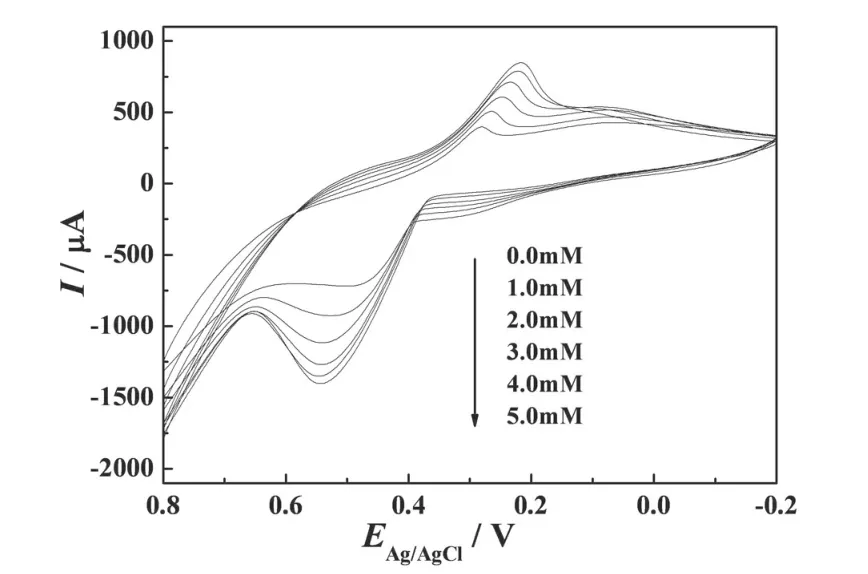
图5 RGO-MWNTs/NiHCF/Chit/GCE对0.0,1.0, 2.0,3.0,4.0,5.0mM葡萄糖的循环伏安曲线Fig.5 Cyclic voltammograms of the RGO-MWNTs/ NiHCF/Chit/GCEin 0.0,1.0,2.0,3.0,4.0,5.0mM glucose,respectively at 50mV·s-1
2.4RGO-MWNTs/NiHCF/Chit/GCE对葡萄糖的安培响应
利用恒电位法研究了RGO-MWNTs/NiHCF/Chit/GCE对葡萄糖的电催化氧化性能.图6给出工作电位为0.4V,复合膜电极在连续加入15μL 10mM的葡萄糖到5mL 0.1M NaOH溶液中的电流-时间曲线.从图6可以看出,随着葡萄糖浓度的不断增加,催化电流呈现阶梯性增大,稳态电流响应在5 s内可达到95%.图6的插图是稳态电流和葡萄糖浓度的关系曲线,在葡萄糖的浓度为0.030~0.096 mM的范围内,它们呈现出良好的线性关系,检测限为0.016mM(信噪比为3).
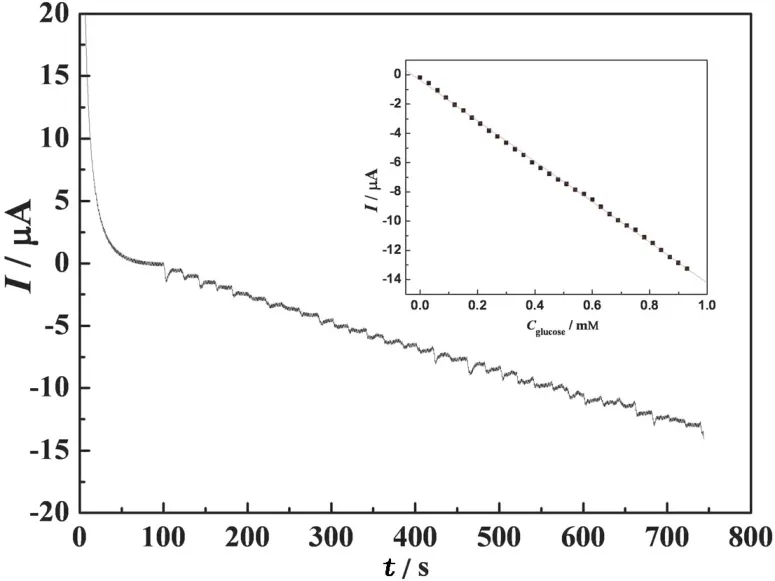
图6 RGO-MWNTs/NiHCF/Chit/GCE在连续加入15μL 10mM的葡萄糖到5mL 0.1M NaOH溶液中的电流-时间曲线,工作电位为0.4V,插图为稳态电流与葡萄糖浓度的关系曲线Fig.6 Amperometric I-t curves of RGO-MWNTs/ NiHCF/Chit/GCE with successive additions of 15μL 10mM glucose to 5mL 0.1M NaOH at 0.4V.Inset:the calibration curve of oxidation currents vs.glucose concentrations
2.5RGO-MWNTs/NiHCF/Chit/GCE的选择性、重现性和稳定性
实际样品中总是共存一些能同时被氧化的物质从而干扰葡萄糖的测定,比如:抗坏血酸、尿酸、多巴胺.因此,本文进行了干扰实验,即在0.1M NaOH中加入可能产生干扰的三种电活性物质进行干扰测定(图没给出来).干扰实验表明加入相同浓度的葡萄糖、抗坏血酸、尿酸及多巴胺所产生的电流响应不同,其中加入葡萄糖时产生的电流信号是最大的,而抗坏血酸、多巴胺只有非常弱的电流响应,加入尿酸时则没产生明显的电流信号.而且,在实际样品中葡萄糖的浓度最大,其浓度大概是抗坏血酸,多巴胺和尿酸浓度的十倍.所以和葡萄糖产生的电流信号相比,干扰物质产生的电流信号肯定会更小,因此对实际样品中葡萄糖的测定不产生干扰.
将RGO-MWNTs/NiHCF/Chit/GCE放在pH 7.0的缓冲溶液中置于冰箱中4℃下保存4周后,复合膜电极仍具有其最初电流响应的92%,说明该修饰电极具有较好的稳定性.对浓度为1 mM的葡萄糖连续测定10次,得到的相对标准偏差是5.8%.该修饰电极在连续使用20 d之后,对葡萄糖的稳态响应电流仍可保持在98%左右.说明RGO-MWNTs/NiHCF/Chit/GCE具有良好稳定性和重现性.
3 结论
本文将制备的铁氰化镍纳米颗粒与石墨烯-碳纳米管进行混合,分散于Chit溶液中,形成RGOMWNTs/NiHCF/Chit纳米复合材料,将其修饰于玻碳电极表面,得到的修饰电极对葡萄糖具有良好的电催化作用,可用作无酶葡萄糖电化学传感器.该葡萄糖传感器制备方法可操作性强,线性范围宽、检测限低,而且具有较好的选择性和稳定性.
[1]LIU Y,TENG H,HOU H Q,et al.Nonenzymatic Glucose Sensor Based on Renewable Electrospun Ni Nanoparticle-loaded Carbon Nanofiber Paste Electrode[J].Biosensors and Bioelectronics,2009,24(11):3329-3334.
[2]俞建国,李建平.高选择性的镍基无酶葡萄糖微传感器的研制及应用[J].分析化学,2008,36(9):1201-1206.
[3]YANG J,ZHANG W D,GUNASEKARAN S.An Amperometric Non-enzymatic Glucose Sensor by Electrodepositing Copper Nanocubes onto Vertically Well-aligned Multi-walled Carbon Nanotube Arrays[J].Biosensors and Bioelectronics,2010,26(1):279-284.
[4]CHEN J,ZHANG W D,Ye J S.Nonenzymatic Electrochemical Glucose Sensor Based on MnO2/MWNTs Nanocomposite[J].Electrochemistry Communications,2008,10(9):1268-1271.
[5]DING Y,WANG Y,SU L,et al.Electrospun Co3O4Nanofibers for Sensitive and Selective Glucose Detection[J].Biosensors and Bioelectronics,2010,26(2):542-548.
[6]WANG X Y,ZHANG Y,BANKS C E,et al.Non-enzymatic Amperometric Glucose Biosensor Based on Nickel Hexacyanoferrate Nanoparticle Film Modified Electrodes[J].Colloids and Surfaces B:Biointerfaces,2010,78(2):363-366.
[7]FIORITO P A,CÓRDOBA de Torresi S I.Hybrid Nickel Hexacyanoferrate/polypyrrole Composite as Mediator for Hydrogen Peroxide Detection and Its Application in Oxidase-based Biosensors[J].Journal of Electroanalytical Chemistry,2005,581(1):31-37.
[8]NOROOZIFAR M,KHORASANI-Motlagh M,Taheri A.Preparation of Silver Hexacyanoferrate Nanoparticles and Its Application for the Simultaneous Determination of Ascorbic Acid,Dopamine and Uric Acid[J].Talanta,2010,80(5):1657-1664.
[9]KROTO H W,HEATH J R,O'BRIEN S C,et al.C60:Buckminsterfulleren[J].Nature,1985,318:162-163.
[10]SUMIO Iijima.Helical Microtubules of Graphitic Carbon[J].Nature,1991,354:56-58.
[11]NOVOSELOV K S,GEIM A K,MOROZOV S V,et al.Electric Field Effect in Atomically Thin Carbon Films[J].Science,2004,306:666-669.
[12]BAUGHMAN R H,ZAKHIDOV A A,de Heer W A.Carbon Nanotubes-p the Route toward Applications[J].Science,2002,297:787-792.
[13]汪多仁.聚氧化乙烯的合成与应用[J].上海造纸,2001,32(1):45-46.[14]TOL R T,MATHOT V B F,GROENINCKX G.Confined Crystallization Phenomena in Immiscible Polymer Blends with Dispersed Micro-and Nanometer Sized PA6 Droplets,part 1:Uncompatibilized PS/PA6,(PPE/PS)/PA6 and PPE/PA6 Blends[J].Polymer,2005,46(2):369-382.
[15]YU D S,PARK K,DURSTOCK M,et al.Fullerene-grafted Graphene for Efficient Bulk Heterojunction Polymer Photovoltaic Devices[J].The Journal of Physical Chemistry Letters,2011,2(10):1113-1118.
[16]YAMAMOTO Y,ZHANG G X,JIN W S,et al.Ambipolar-transporting Coaxial Nanotubes with a Tailored Molecular Graphene-fullerene Heterojunction[J].Proceedings of theNational Academy of Sciences,2009,106(50):21051-21056.
[17]DARENSBOURG D J,MACKIEWICZ R M.Role of the Cocatalyst in the Copolymerization of CO2and Cyclohexene Oxide Utilizing Chromium Salen Complexes[J].Journal of the American Chemical Society,2005,127(40):14026-14038.
[18]ZHANG M,GORSKI W.Electrochemical Sensing Based on Redox Mediation at Carbon Nanotubes[J].Analytical chemistry,2005,77(13):3960-3965.
[19]JOSHI P P,MERCHANT S A,WANG Y D,et al.Amperometric Biosensors Based on Redox Polymer-carbon Nanotube-enzyme Composites[J]. Analytical chemistry,2005,77(10):3183-3188.
责任编辑:高 山
A Non-enzymatic Glucose Sensor Based on RGO-MWNTs/NiHCF Nanocomposites
MO Tao,HUANG Fuying,CHEN Guoliang,LI Yancai*
(College of Chemistry and Environment,Minnan Normal University,Zhangzhou 363000,China)
Nickel hexacyanoferrate nanoparticles(NiHCF)can be easily prepared by mixing hexacyanoferrate and nickel sulfate solution at room temperature.The nanoparicles were solubilized in a biopolymer chitosan(Chit)aqueous solution.With the introduction of RGO-MWNTs,the formed RGO-MWNTs/Ni-HCF/Chit film shows synergy between RGO-MWNTs and NiHCF with the significant improvement of redox activity of NiHCF due to the excellent electron-transfer ability of RGO-MWNTs.The RGO-MWNTs/ NiHCF/Chit/GCE amplified the redox peak currents by 5 times compared with the NiHCF/Chit/GCE. The RGO-MWNTs/NiHCF/Chit/GCE allows low potential detection of glucose with high sensitivity and fast response time.The glucose sensor showed a linear dependence from 0.03 to 0.096 mM with a low detection limit of 0.016 μM(S/N=3).
nickel hexacyanoferrate nanomaterials;RGO-MWNTs nanocomposites;chitosan;glucose sensor
TS210.1
A
1008-8423(2015)04-0453-04DOI:10.13501/j.cnki.42-1569/n.2015.12.024
2015-10-24.
闽南师范大学新世纪优秀人才支持计划(MX14003).
莫韬(1979-),男,硕士生,主要从事电分析化学的研究;*
李艳彩(1980-),博士,副教授,主要从事新型纳米材料的合成及电化学生物传感等的研究.
