脑梗死大鼠CD4+CD25+调节性T 细胞的作用
2015-10-22白宏英
李 楠 白宏英
郑州大学第二附属医院神经内科 郑州 450014
脑梗死是继恶性肿瘤、心肌梗死后第三大严重影响人类健康的疾病。同时是致残率最高的原因。脑梗死是当今世界成人死亡和致残的主要原因之一,2008年调查显示,脑梗死已成为中国人口致死的首要原因。由于急性脑梗死的溶栓时间窗限制(发病后3~6h),溶栓治疗受益率极低,目前对大部分病人存在的神经功能损伤尚无确实有效的临床治疗手段。脑梗死组织周边炎性免疫反应的轻重与梗死后神经损害程度密切相关[1]。CD4+CD25+调节性T 细胞是一种具有免疫调节作用的细胞,本研究拟动态观察脑梗死后CD4+CD25+调节性T 细胞的表达,探讨其在脑梗死后的免疫调节作用。
1 材料和方法
1.1 实验动物及分组 成年雄性wistar大鼠40只(郑州大学实验动物中心培育),体质量200~220g,随机分为5组,分别为大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)24h、72h、1周、2周组和假手术组,每组8只。采用线栓法制作MCAO 模型,术后24h动物清醒后,应用Zea等[4]方法进行神经功能评分。0分:无神经功能缺损症状;1分:不能完全伸展左前肢;2分:行走时向左侧转圈;3分:自主行走时向左侧倾倒;4分:存在意识障碍。l~3分定义为模型制作成功,模型制作不成功者随机补充。
1.2 外周血中CD4+CD25+调节性T 细胞的检测 大鼠麻醉后心 脏 取 血,依 次 加CD4-FITC lμL、CD25-Percp 和Ig-Glk-Percp0.5ul(美国eBoiscience公司)到检测管和对照管,加0.5mL破膜液(博士德生物技术有限公司),4 ℃冰箱(日本三洋电机公司)孵45 min,加2 mL 破膜液,加Foxp3-PE和IgG2ak-PE 5ul(美国eBoiscience公司),洗涤1次;加0.5 mL 1%的多聚甲醛重悬,上流式细胞仪(美国贝克曼库尔特公司)检测,进行流式检测。
1.3 统计学分析 应用SPSS 11.0软件处理,数据用均数±标准差表示,组间比较用单因素方差分析(ANOVA),变量间用Spearman相关分析,P<0.05为有差异有统计学意义。
2 结果
MCAO 组外周血中CD4+CD25+调节性T 细胞的表达在模型制备后24h、72h时与假手术组比较差异无统计学意义(P>0.05),在1周、2周时明显高于假手术组,差异有统计学意义(P<0.05)。不同时间水平之间CD4+CD25+调节性T 细胞的表达有显著差异性(P<0.05)。见表1。梗死后的24h、72h、1周、2周CD4+CD25+调节性T 细胞的表达逐渐增高,而假手术组表达相对保持恒定,无显著变化趋势。不同组别的表达有显著差异性,MCAO 组明显高于假手术组(P <0.01)。时 间 与 分 组 之 间 有 显 著 交 互 效 应(P <0.01),但变化趋势不同。见表2。
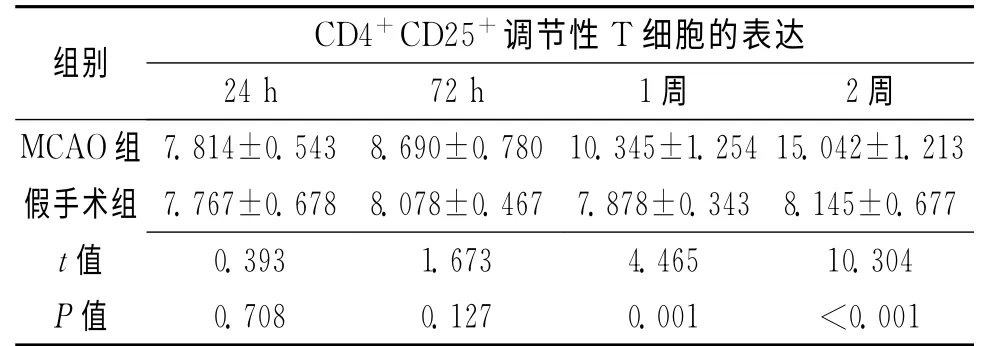
表1 2组不同时期CD4+CD25+调节性T 细胞的表达 [n(%)]
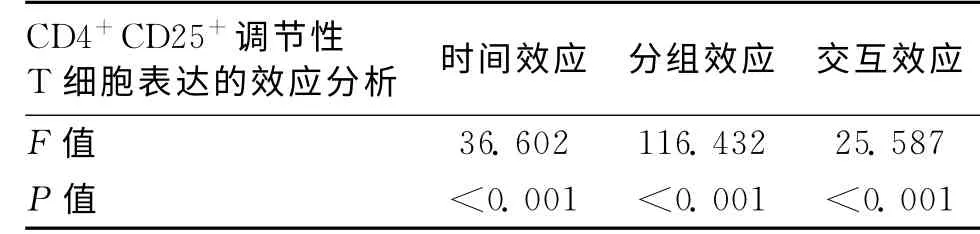
表2 CD4+CD25+调节性T 细胞表达的时间和分组效应分析 [n(%)]
3 讨论
脑梗死日益呈增长及年轻化趋势,致残率和病死率逐年增高,严重威胁人们健康和生命。已经证实脑梗死后的炎症反应会加重颅脑受损部位的脑损伤,甚至有人认为脑内过度表达的炎性反应对病灶区脑组织的损伤比缺血本身更严重。所以对过度表达的炎性反应的抑制,越来越受到人们的关注和研究。近年来,多个课题组通过对外周免疫的大量研究证实,CD4+CD25+调节性T 细胞对其维持起重要作用。随着对CD4+CD25+调节性T 细胞在体内、外具体机制的深入研究,已经证实其具有免疫抑制性和免疫无能性两大特征。而其具有的对效应性T 细胞的抑制特性,使其在脑梗死后的机制成为近期研究的热点。
研究表明,炎症因子和趋化因子在脑梗死后增高,脑梗死后缺血灶周围活跃的炎症反应,如细胞因子、趋化因子、内皮细胞黏附分子和蛋白酶的活动等,会加重脑组织损伤[2],CD4+CD25+调节性T 细胞主要在机体免疫中通过复杂的作用机制维持外周免疫耐受,限制效应细胞的应答程度,从而防止过度免疫反应所致的组织损伤,发挥负向调节作用。Brusko等[3-4]认为,CD4+CD25+调节性T 细胞具有免疫抑制作用,既可抑制CD4+和CD8+效应性细胞介导的免疫反应,也可抑制树突状细胞和自然杀伤细胞的功能,可有效抑制反应性T 细胞的增殖和细胞因子分泌,继而可能改善脑梗死的结果。CD4+CD25+调节性T 细胞可能在梗死后神经功能的再生和修复中起重要作用。
本实验发现,不同时间点随着CD4+CD25+调节性T 细胞的表达增多,表明CD4+CD25+调节性对脑梗死有潜在的脑保护作用,但具体机制仍不清楚,仍需进一步研究。
[1] Offner H,Vandenbark AA,Hum PD.Effect of experimental stroke on peripheral immunity:CNS ischemia induces profound immunosuppression[J].Neuroscience,2009,158(3):1 098-1 111.
[2] Gee JM,Kalil A,Shea,C,et al.Lymphoeytes:pomntial mediators of postischemic injury and neuroprotection[J].Stroke,2007,38(2Suppl):783-788.
[3] Brusko TM,Hulnk MA,Myhr CB,et al.Assessing the in vitro suppressive capacity of regulatory T cells[J].Immunol Invest,2007,36(3/5):607-628.
[4] Cuenca-López MD,Biea D,Galindo MF.Inf1ammatory response during ischemic processes:adhesion molecu1es and immunomodulation[J].Rev Neurol,2010,51(1):30-40.
