γ干扰素对高磷诱导大鼠血管平滑肌细胞钙化的影响研究
2015-10-22白亚玲徐金升钱玥彤张俊霞张胜雷崔立文张慧然
白亚玲 徐金升 钱玥彤 张俊霞 张胜雷 崔立文 张慧然
γ干扰素对高磷诱导大鼠血管平滑肌细胞钙化的影响研究
白亚玲 徐金升 钱玥彤 张俊霞 张胜雷 崔立文 张慧然
目的 探讨γ干扰素(IFNγ)对大鼠血管平滑肌细胞(VSMCs)钙化的影响,为临床治疗血管钙化提供新的线索。方法 大鼠胸主动脉VSMCs原代培养,采用免疫细胞化学方法鉴定。将VSMCs随机分为阴性对照组、高磷组、IFNγ干预组(在高磷培养基的基础上加入100 U/L重组大鼠IFNγ),刺激3 d后RT-PCR对各组细胞内核心结合因子α1(Cbfα1)、骨形态发生蛋白2(BMP2)、Smad 1以及Smad 7的mRNA进行检测,刺激14 d后,对各组细胞进行钙化染色,钙含量及碱性磷酸酶(ALP)活性测定。结果 与阴性对照组比较,高磷组及IFNγ干预组VSMCs均有钙盐沉积,ALP活性及Cbfα1的mRNA及蛋白表达均增高,BMP 2、Smad 1 mRNA表达也增高(均为P<0.05),与高磷组比较,IFNγ干预组VSMCs的钙盐沉积、ALP活性及Cbfα 1 mRNA和蛋白表达均显著降低(均为P<0.05),BMP 2、Smad 1 mRNA表达也降低,而正常组和IFNγ干预组的VSMCs中Smad 7 mRNA表达均高于高磷组(均为P<0.05)。结论 IFNγ对高磷诱导的VSMCs钙化有抑制作用,其可能机制之一是通过抑制了VSMCs Cbfα1的表达,进而抑制了VSMCs的转分化来实现的。
β-甘油磷酸盐; 血管平滑肌细胞; IFNγ; 钙化; 钙含量
血管钙化是慢性肾脏病(chronic kidney diseases,CKD)患者发生心血管疾病(cardiovascular diseases,CVD)的独立主要危险因素,血管钙化与其心血管疾病的高发病率和高死亡率有关[1-2]。与传统的血管钙化不同,CKD患者的血管钙化主要发生在中膜,而血管平滑肌细胞(vascular smooth muscle cells,VSMCs)作为构成血管中膜的主要细胞成分,是血管中膜发生钙化的结构基础。近年来,有研究证实,VSMCs的成骨/软骨样表型转化是CKD患者血管钙化发生的重要机制之一[3]。另有研究证实,γ干扰素(IFNγ)对成骨细胞和破骨细胞的生成有一定的调节作用,而VSMCs发生表型转化的过程恰恰与此过程相似[4]。本研究旨在高磷诱导的VSMCs钙化模型基础上,观察IFNγ对VSMCs表型转化及钙化的影响。
1 材料和方法
1.1实验动物
5周龄80~100 g健康雄性SD大鼠(清洁级)购自河北医科大学实验动物中心(合格证编号:1310058)。
1.2主要试剂和仪器
胎牛血清(Hyclone),低糖DMEM培养基(GIBCO),β-甘油磷酸(scientific research special),兔抗鼠平滑肌肌动蛋白(SMA)单克隆抗体(北京博奥森生物有限公司),Trizol(Invitrogen),反转录试剂盒(Thermo);CO2培养箱(Thermo),倒置相差显微镜(Nikon,TE2000-U),凝胶成像系统(Image),PCR仪(ABI,5700型)。
1.3VSMCs的原代培养及实验分组
SD大鼠麻醉后在超净工作台内迅速取出胸主动脉,直视下剥除血管外膜,纵行剖开血管,无菌纱布擦除内膜,应用组织块贴壁法进行VSMCs原代培养,并进行鉴定。经自然纯化后,选取生长良好的3~5代细胞进行实验。将VSMCs应用随机数字表分组方法分为空白对照组(control),β甘油磷酸组(HP组,培养基含10 mmol/L β甘油磷酸)以及IFNγ干预组(10 mmol/L β甘油磷酸+100 U/mL重组大鼠IFNγ)。每24 h更换一次培养液,刺激3 d后,提取各组细胞RNA及蛋白,进行mRNA及蛋白水平检测,刺激14 d进行钙化检测。
1.4细胞鉴定[3]
1.4.1形态学观察 应用倒置相差显微镜观察细胞大小、形态、生长特点及排列方式等。免疫。
1.4.2细胞化学染色 六孔板内用消毒的盖玻片制作细胞爬片,待细胞贴壁生长至60%~70%时,弃去培养基,用免疫细胞化学方法鉴定平滑肌细胞特异性抗体a-SM-actin。DAB显色,苏木素轻度复染,经分化,脱水,透明,封片,在显微镜下观察。
1.5钙化检测
1.5.1茜素红染色[5-6]取4~5代细胞以5×104/孔密度接种于6孔板内,刺激14 d,茜素红进行钙化染色,倒置显微镜下观察照相。结果判断标准:钙盐沉积为橘红色。
1.5.2细胞内钙含量测定[7]取4~5代细胞以2×105/孔密度接种于6孔板,干预14 d,细胞用0.6 mmol/L盐酸脱钙取上清,钙定量检测试剂盒测定钙含量,脱钙后的细胞用0.1 mol/L NaOH和0.1%的SDS溶解30 min,BCA法测定细胞蛋白含量,结果用细胞钙含量比蛋白含量表示(μg/mg蛋白)。实验每组设6个复孔。
1.5.3碱性磷酸酶活性测定[7]取4~5代细胞以2×105/孔密度接种于6孔板,干预14 d,弃去培养液,用PBS洗涤细胞3次,每孔加入500 μl 0.1% Triton X-100置4℃环境中约12~24 h,然后反复吹打裂解细胞后置于离心管中离心,按化学发光法检测ALP活性。
1.6mRNA测定
Trizol法提取细胞总RNA,应用反转录聚合酶链反应(RT-PCR)检测核心结合因子α1(core binding factor α1,Cbfα1)、骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)、Smad 1以及Smad 7的转录情况。应用primer 5.0软件设计引物,由生工生物工程(上海)股份有限公司合成,见表1。均采用目的基因与内参进行同管扩增,计算相对含量。实验重复3次,以GAPDH作为内对照,计算相对含量。

表1 RT-PCR引物序列
1.7蛋白印迹法检测
取干预3 d的各组细胞,按常规方法提取蛋白质并用BCA法进行蛋白定量,十二烷基硫酸钠一聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜、封闭,加一抗(β-actin 1∶1 000,Cbfα1 1∶500)稀释液,4℃孵育过夜。洗膜,加入荧光二抗稀释液(1∶2 000),室温下孵育2 h,用免疫荧光成像系统显色,图像分析软件扫描条带灰度值,计算蛋白表达相对定量,实验重复3次。
1.8统计学方法
采用SPSS 13.0统计学软件对所有数据进行统计学处理,符合正态分布的计量资料用均数±标准差()表示,两组间均数比较用t检验,多组间均数比较采用单因素方差分析(ANOVA),不符合正态分布的计量资料用中位数表示,用秩和检验进行多组间比较,用SNK检验(student-Newman-Keuls,SNK)作多组间均数两两比较。P<0.05为差异有统计学意义。
2 结果
2.1平滑肌细胞原代培养及鉴定
2.1.1细胞原代培养 大鼠胸主动脉组织块贴壁3~4 d后可见细胞从组织块边缘爬出,细胞为长梭形,呈束状排列,5~6 d行成细胞团,形成明显的细胞生长晕,并围绕组织块边缘呈束状向外呈放射状延伸,约6~7 d后融合成片,细胞可达亚融合状态,呈接触抑制状态,此时可传代。细胞传代后,未贴壁时细胞呈椭圆型,不透明,4 h后开始贴壁,贴壁后的细胞逐渐伸展,星型或不规则形,以梭形为主,细胞核呈卵圆形,透明度增加,相互重叠生(图1)。

图1 SD大鼠胸主动脉VSMCs原代培养(×100)
2.1.2细胞鉴定 HE染色及瑞氏-姬姆萨染色可见细胞呈梭形,胞浆丰富,核大而圆或椭圆(图2A、B)。免疫细胞化学法检测平滑肌肌动蛋白抗体(α-SMA actin)可见细胞胞浆表达强阳性,免疫反应产物呈棕黄色(图2C、D)。传代纯化,细胞生长特性未见异常改变。

图2 SD大鼠平滑肌细胞鉴定
2.2钙化检测
2.2.1茜素红染色结果显示 与阴性对照组比较,高磷组及IFNγ干预组的VSMCs钙化染色均加重。与高磷组比较,IFNγ干预组钙化结节染色减轻(图3)。
2.2.2VSMCs钙含量测定 与阴性对照组相比,高磷组及IFNγ干预组刺激VSMCs后,钙含量均显著增加,与高磷组比较,IFNγ干预组钙含量有所降低(图4)(P<0.05)。

图3 SD大鼠各组VSMCs钙化染色(×100)

图4 IFNγ对VSMCs钙含量的影响(μg/mg蛋白)
2.3碱性磷酸酶(ALP)活性测定 与阴性对照组相比,高磷组及IFNγ干预组的VSMCs ALP水平均不同程度地增加。与高磷组比较,IFNγ干预组ALP活性降低(图5)。

图5 IFNγ对VSMCs碱性磷酸酶活性的影响(U/L)
2.4IFNγ对VSMCs Cbfα1、BMP2、Smad 1、Smad 7 mRNA表达的影响
与阴性对照组相比,高磷组及IFNγ干预组的VSMCs Cbfα1、BMP2、Smad 1 mRNA水平均不同程度地增加;与高磷组比较,IFNγ干预组VSMCs Cbfα1、BMP2、Smad 1 mRNA水平有所降低(图6)。

图6 表型转化相关基因mRNA表达情况
2.5IFNγ对VSMCs Cbfα1蛋白水平表达的作用
与阴性对照组相比,高磷组及IFNγ干预组的VSMCs Cbfα1蛋白水平均增加;与高磷组比较,IFNγ干预组VSMCs Cbfα1、蛋白水平有所降低(图7)。
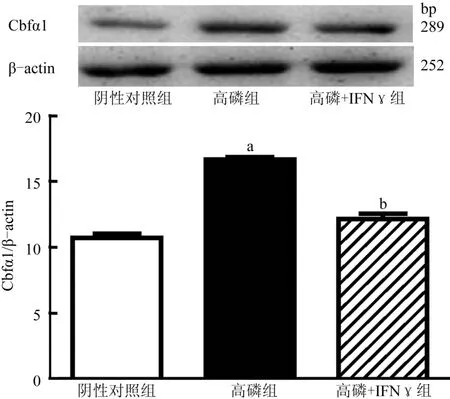
图7 Cbfα1蛋白表达情况
3 讨论
近年来多项研究发现CKD的患病率逐渐上升,其死亡率也随之居高不下[8],而导致CKD患者死亡的主要风险因素为心血管疾病,而导致CKD发生心血管疾病的主要机制之一为血管钙化[9]。与普通人群发生的动脉粥样硬化不同,CKD血管钙化的主要特点表现为血管中膜钙化。目前已有文献证实血管钙化是一种高度可调的生物学过程,其发生的中心环节是VSMCs向成骨/成软骨样表型转化,然后启动一系列异位成骨的过程[3]。有文献经多因素分析认为高磷血症是CKD患者CVD死亡的主要独立危险因素[10],体内的磷可能加速了VSMCs的表型转化过程,但其中具体的机制仍不明确。
VSMCs是组成血管中膜的主要成分,是血管中膜发生钙化结构基础,本研究通过使用含有10 mmol/ L的β-甘油磷酸钠的培养基诱导大鼠VSMCs发生表型化和钙化,这与Adeney等[11-12]的研究结果相似。茜素红矿化结节染色和细胞钙含量检测可反映VSMCs钙盐沉积及钙含量的情况,在本研究中茜素红矿化结节染色发现,与对照组比较,高磷组及IFNγ干预组的VSMCs钙化染色均加重,但与高磷组相比较,IFNγ干预组的钙化结节显著减少。钙含量检测发现,与对照组比较,高磷组及IFNγ干预组刺激VSMCs后,钙含量均显著增加,与高磷组比较,IFNγ干预组钙含量明显降低。钙含量检测结果与钙化染色结果基本一致,二者均提示IFNγ可以抑制高磷诱导的VSMCs钙化。另一方面,碱性磷酸酶(alkaline phosphatase,ALP)是VSMCs发生表型转化的早期标志物,其在正常的VSMCs中活性水平较低,但在钙化的VSMCs中其活性水平明显增高[13-14]。本研究发现,高磷组及IFNγ干预组的VSMCs ALP活性水平均有不同程度地增加,而对照组ALP活性水平较低。与高磷组比较,IFNγ干预组ALP活性有所降低,进一步验证了IFNγ具有抑制VSMCs表型转化和钙化的作用。
本研究还发现了IFNγ能够抑制VSMCs表型转化过程中的重要转录因子Cbfα1 mRNA和蛋白水平的表达。Cbfα1是成骨/成软骨样细胞表型转化的核心转录因子,是骨形成过程中的主要调节因子[15]。其在发生钙化的过程中表达,说明了VSMCs已经发生了表型转化[16],而且Cbfα1也参与调节ALP的活性。大量研究证明成骨细胞和软骨细胞分化中关键的转录因子Cbfα1受TGF-β/BMP信号通路的调节,而且在高磷诱导的VSMCs发生表型转化的过程中TGF-β/BMP信号通路也对Cbfα1的表达起到了至关重要的调节作用[17],其具体机制可能是磷通过该通路中的功能蛋白Smads(其中包括)而使cbfα1的上游基因BMP2表达增加进而引起了cbfα1的表达[18-19],也有文献表明Smad 7作为Smads的抑制剂,可能对上述过程起到阻断作用。因此本研究进一步研究了IFNγ对VSMCs Smad1、BMP2及Smad 7 mRNA表达的作用,结果显示,高磷组及IFNγ干预组的VSMCs Smad1、BMP2 mRNA水平均有不同程度地增加,而对照组Smad1、BMP2 mRNA水平则较低。与高磷组比较,IFNγ干预组Smad1、BMP2 mRNA水平有所降低,相反,正常组和IFNγ干预组的VSMCs中Smad 7 mRNA水平却均高于高磷组,因此,IFNγ抑制VSMCs表型转化和钙化的可能机制是其通过上调了Smad 7来抑制了Smad1及BMP2的表达,进一步抑制了cbfα1的表达来实现的。
综上所述,本研究发现了IFNγ在高磷诱导的VSMCs钙化中起抑制作用,为临床治疗血管钙化提供了新的发现。这种作用可能是IFNγ通过上调Smad 7抑制Smad1及BMP2的表达,进一步抑制了cbfα1表达而抑制VSMCs发生表型转化来实现的。但目前有关IFNγ在抑制血管钙化中的确切作用的报道较少,仍需进行深入的、多方面的研究来明确其对血管钙化的抑制作用。
[1]Pun PH,Smarz TR,Honeycutt EF,et al.Chronic kidney disease is associated with increased risk of sudden cardiac death among patients with coronary artery disease[J].Kidney Int,2009,76:652-658.
[2]Kanbay M,Goldsmith D,Uyar ME,et al.Magnesium in chronic kidney disease:challenges and opportunities[J].Blood Purif,2010,29:280-292.
[3]Demer LL,Tintut Y.Inflammatory,metabolic,and genetic mechanisms of vascular calcification[J].Arterioscler Thromb Vasc Biol,2014,34:715-723.
[4]Kelchtermans H,Struyf S,De Klerck B,et al.Protective role of IFN-gamma in collagen-induced arthritis conferred by inhibition of mycobacteria-induced granulocyte chemotactic protein-2 production[J].J Leukoc Biol,2007,81:1044-1053.
[5]Idelevich A,Rais Y,Monsonego-Ornan E.Bone Gla protein increases HIF-1alpha-dependent glucose metabolism and induces cartilage and vascular calcification[J].Arterioscler Thromb Vasc Biol,2011,31:e55-71.
[6]Aoshima Y,Mizobuchi M,Ogata H,et al.Vitamin D receptor activators inhibit vascular smooth muscle cell mineralization induced by phosphate and TNF-a[J].Nephrol Dial Transplant,2012,27:1800-1806.
[7]Louvet L,Büchel J,Steppan S,et al.Magnesium prevents phosphate-induced calcification in human aortic vascular smooth muscle cells[J].Nephrol Dial Transplant,2013,28:869-878.
[8]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379:815-822.
[9]Covic A,Kanbay Met.Vascular calcification in chronic kidney disease[J].Clin Sci(Lond),2010,119:111-121.
[10]Catherine MS,Crouthamel MH,Kapustin A,et al.Arterial calcification in chronic kidney disease:key roles for calcium and phosphate[J].Circ Res,2011,109:697-711.
[11]Adeney KL,Siscovick DS,Ix JH,et al.Association of serum phosphate with vascular and vascular calcification in moderate CKD[J].J Am Soc Nephrol,2009,20:381-387.
[12]Ellen Neven1,Tineke M,De Schutter,et al.Cell biological and physicochemical aspects of arterial calcification[J]. Kidney Int,2011,79:1166-1177.
[13]Lomashvili KA,Garg P.Upregulation of alkaline phosphatase and pyrophosphatehydrolysis:Potentialmechanismforuremic vascular calcification[J].Kidney Int,2008,73:1024-1030.
[14]Narisawa S,Harmey D.Novel inhibitors of alkaline phosphatase suppress vascular smooth muscle cell calcification[J].J Bone Miner Res,2007,22:1700-1710.
[15]Steitz SA,Speer MY,Curinga G,et al.Smooth muscle cell phenotype transition associated with calcification:upregulation of Cbfα1 and downregulation of smooth muscle lineage markers[J]. Cirs Res,2011,89:1147-1154.
[16]Mundlos S,Otto F,Mundlos C,et al.Mutations involving the transcription factor Cbfα1 cause cleidocranial dysplasia[J]. Cell,1997,89:773-779.
[17]Pardali E,ten Dijke P.TGF-bate signaling and cardiovascular diseases[J].Int J Biol Sci,2012,8:195-213.
[18]Hruska KA,Mathew S,Saab G.Bone morphogenetic proteins in vascular calcification[J].Circ Res,2005,97:105-114.
[19]Caia J,Pardalib E,Sánchez-Duffhues G,et al.BMP signaling in vascular diseases[J].FEBS Letters,586:1993-2002.
Effect of IFNγ on high phosphorus-induced calcification in rat vascular smooth muscle cells
Bai Yaling,Xu Jinsheng,Qian Yuetong,Zhan Junxia,Zhang Shenglei,Cui Liwen,Zhang Huiran.Department of Nephrology,Fourth Hospitla of Hebei Medical University,Shijiazhuang 050011,China
Xu Jinsheng,Email:xjs5766@126.com
Objective To explore the effect of IFNγ on rat vascular smooth muscle cell(VSMCs)calcification.Methods VSMCs were obtained from rat aortic,and identified by immunocytochemistry,then randomly divided into control group,high phosphorus group and IFNγ intervention group.Calcification staining,calcium content and alkaline phosphatase activity were measured and the expressions of BMP2,Smad 1 and Cbfα 1 mRNA were detected by RT-PCR and the expression of Cbfα1 protein was detected by western blot,after stimulating 3 days.Results Compared with the control group,the high phosphorus groups cell calcification,alkaline phosphatase activity and the expressions of Cbfα1,BMP2,Smad1 mRNA were increased significantly(all P<0.05).Compared with the high phosphorus group,the calcium deposition,ALP activity and the expressions of BMP2,Smad 1 and Runx 2 mRNA in IFNγ intervention group were decreased significantly(all P<0.05).Conclusions IFNγ can reduce the calcification in rat vascular smooth muscle cells,may be due to inhibiting the transdifferentiation of vascular smooth muscle cells.
β-glycerophosphate; Vascular smooth muscle cells; IFNγ; Calcification;Calcium content
2014-10-15)
(本文编辑:周白瑜)
10.3969/j.issn.1007-5410.2015.01.014
河北省自然科学基金(H2012206157)
050011石家庄河北医科大学第四医院肾内科
徐金升,电子信箱:xjs5766@126.com
This work was supported by Natural Science Foundation of HeBei province(No:H2012206157)