超声波辅助酶解制备猪肩胛骨降血压肽的工艺及酶解效果比较
2015-10-21陈昌琳陈茂林四川农业大学食品学院四川雅安625014
陈昌琳,李 诚,付 刚,赖 利,陈茂林,肖 岚,杨 勇,何 利,胡 滨(四川农业大学食品学院,四川雅安625014)
超声波辅助酶解制备猪肩胛骨降血压肽的工艺及酶解效果比较
陈昌琳,李诚*,付刚,赖利,陈茂林,肖岚,杨勇,何利,胡滨
(四川农业大学食品学院,四川雅安625014)
采用超声波辅助风味蛋白酶酶解制备猪肩胛骨降血压肽并与常规酶解(未经超声处理的酶解)所得酶解液做比较。以酶解液的血管紧张素转化酶(ACE)抑制率为主要指标,考察超声功率、超声时间、超声温度、超声工作间隙、超声后酶解时间对酶解液ACE抑制率的影响,并在此基础上进行响应面优化实验。通过实验,获得的最佳超声条件为:超声时间25min,超声功率717W,超声温度40℃,超声工作间隙比1∶1.5(s/s),酶解时间3h,在该条件下,得到的酶解液ACE抑制率理论值为75.29%。此条件下制备出ACE抑制率为75.58%的猪肩胛骨降血压肽,比常规酶解提高了10.27%。半数抑制浓度(IC50)值下降32.8%,酶解时间缩短1.5h。
超声波,酶解,降血压肽,猪肩胛骨
长久以来,食源性的降血压肽以其副作用少、来源广泛、降血压效果温和且对正常血压无影响[1]的特点一直是研究的热点。制备食源性降血压肽常用的方法是酶解法[2],但是,传统的酶解法存在费时长、酶利用率低、水解效率低等问题。研究者们开始尝试一些不同的物理方法处理底物蛋白或者酶,比如煮沸、高压[3]、微波[4-5]、超微粉碎[6]、超声波[7]、超声波-微波协同法[8]等,这些方法以改变生物大分子的分子构型及空间结构,不同程度地提高产物的活性。其中超声波处理具有廉价、操作简单、易于推广的优点,因此,研究使用超声波辅助酶解具有实际意义。
我国的畜禽资源十分丰富,每年有大量的畜禽骨资源被浪费。研究者们利用废弃的畜禽骨做了许多研究[9]。目前已有利用猪股骨头制备降血压肽的报道[10-12],不过,常规的酶解法制备降血压肽存在猪骨中胶原蛋白利用度不高,制备的降血压肽活性较低等缺点。超声波的空化效应、机械作用和热效应[13],可以使底物结构变得松散,利于酶与底物接触,提高酶解效率,提高蛋白质转化率[14]。还可使蛋白质疏水基团暴露、增加疏水基团含量[15],根据学者对降血压肽构效关系的研究可知,疏水基团对ACE抑制肽活性起重要作用[16],可使酶解产物ACE抑制率增加。
用超声波直接处理骨粉制备降血压肽还未见报道,本实验采用超声波细胞破碎仪处理底物,在已优化出的酶解工艺的基础上[17],以ACE抑制率为指标,通过单因素和响应面实验优化出超声辅助酶解制备猪肩胛骨降血压肽的最佳超声条件,并以常规酶解制得的降血压肽为对照,探索利用超声波技术提高降血压肽ACE抑制率的可能性,为猪肩胛骨降血压肽的理论研究和进一步的产品开发提供理论依据。
1 材料与方法
1.1材料与仪器
新鲜猪肩胛骨购自雅安农贸市场;风味蛋白酶(酶活23.43U/mg) 上海Kayon公司;血管紧张素转化酶(ACE)、马尿酰组氨酰亮氨酸(Hip-His-Leu,HHL) Sigma公司;其他化学试剂为国产分析纯。
PHS-3C+酸度计成都世纪方舟科技有限公司;UV-3200型紫外分光光度计上海美普达仪器有限公司;ULT型冷冻干燥机美国Thermo Scientific公司;D37520 Osterode型高速冷冻离心机美国Thermo有限公司;QT-2型漩涡混合器上海琪特分析仪器有限公司;ULUP-IV-10T型超纯水装置西安优普仪器设备有限公司;JY 92-IID型超声波细胞破碎仪SCIENTZ有限公司。
1.2实验方法
1.2.1工艺流程将猪肩胛骨剔净非骨骼成分,清洗,121℃蒸煮4h,烘干,粉碎制成骨粉,冷藏备用。
称取一定量的骨粉(蛋白含量19.96%),以底物浓度5%的比例加入蒸馏水制成骨粉悬浊液,在指定的超声条件下超声处理指定的时间。超声结束后,按照先前实验优化得出的常规酶解(以风味蛋白酶为水解酶,酶底比6900U/g,底物浓度5%,酶解pH7.0,酶解时间4.5h[17])的条件,酶解一定时间,酶解完成后,沸水浴灭酶10min,4℃10000r/min离心10min,得到上清液,测定其ACE抑制率。
1.2.2单因素实验
1.2.2.1超声工作间隙比对酶解液ACE抑制率的影响配制底物蛋白浓度为5%的骨粉悬浊液在超声功率630W、超声温度20℃、不同的超声工作间隙比条件下超声10min后再在最适酶解条件下酶解3h。超声工作间隙比分别为0.5/2、1/2、1.5/2、0.5/1、0.5/1.5、1/1.5(s/s)。
1.2.2.2超声功率对酶解液ACE抑制率的影响配制底物蛋白浓度为5%的骨粉悬浊液在超声温度20℃、超声工作间隙比1.5∶2(s/s)、不同的超声功率下超声10min后,再在最适酶解条件下酶解3h。超声功率分别为:450、540、630、720、810、900W。
1.2.2.3超声时间对酶解液ACE抑制率的影响配制底物蛋白浓度为5%的骨粉悬浊液在超声功率为630W、超声温度20℃、超声工作间隙比1.5∶2(s/s)下超声不同时间后再酶解3h。超声时间分别为5、10、15、20、25、30min。
1.2.2.4超声温度对酶解液ACE抑制率的影响配制底物蛋白浓度为5%的骨粉悬浊液在超声功率630W、超声工作间隙比1.5∶2(s/s)、不同的超声温度下超声10min后再酶解3h。超声温度分别为20、30、40、50、60℃。
1.2.2.5超声后酶解时间对酶解液ACE抑制率的影响配制底物蛋白浓度为5%的骨粉悬浊液在超声功率为630W、超声温度20℃、超声工作间隙比1.5∶2(s/s)下超声10min后,分别在最适酶解条件下酶解2、2.5、3、3.5、4h。
以酶解液ACE抑制率为指标,筛选出最适超声条件。
1.2.3响应面优化实验在单因素实验的基础上,以超声功率、超声时间、超声温度为影响因素,以ACE抑制率为响应值,进行优化实验,采用Box-Behnken进行实验设计和结果分析,得出超声辅助酶解制备降血压肽的最佳工艺条件,实验设计见表1。
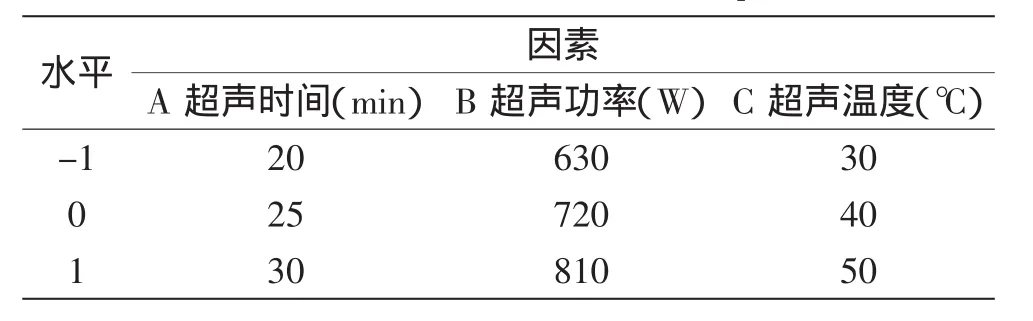
表1 响应面实验因素水平表Table 1 Factors and levels of RSM experiment
1.2.4ACE抑制率的测定在Cushman等[18]所用的方法的基础上进行改进。方法如下:将酶解液稀释5倍,将ACE酶配制成0.1U/mL溶液,将HHL溶解在0.1mol/L、pH8.3的硼酸缓冲液(含有0.3mol/L NaCl)中配制成5mmol/L的HHL溶液,在10mL试管中加入100μL 5.0mmol/L的HHL溶液和20μL样品液,混匀后于37℃水浴中保温5min后,加入20μL的ACE酶液启动反应,混匀后于37℃水浴中保温60min,从水浴锅中取出,加入150μL 1mol/L的HCl终止反应,再加入1.2mL冷冻后的乙酸乙酯,强烈振荡混匀后,静置5min,然后以4000r/min离心20min,用移液管吸取1.0mL的乙酸乙酯层(上层),在110℃烘箱中经1h烘干,最后加入4mL的蒸馏水充分溶解后于228nm处检测吸光值。平行对照管除在反应前先加入150μL 1mol/L的HCl以终止反应外,其余成分、操作步骤同反应管。
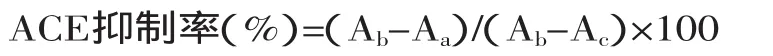
式中,Aa是样a的吸光度,样a加入了样品液,与ACE、HHL共同反应的测定值;Ab是样b的吸光度,样b为反应中未加入样品液,反应结束后添加样品液以维持整个反应体系平衡,是ACE与HHL完全反应的参照的测定值;Ac是样c的吸光度,样c在反应前先使ACE失活,再加入样品液,是ACE与HHL反应的空白对照的测定值。
1.2.5IC50值测定方法将酶解液稀释成不同浓度(实验点≥5),分别测定其ACE抑制率。以样品浓度为横坐标,ACE抑制率为纵坐标,绘制成圆滑曲线,从曲线中计算出IC50值。
1.2.6多肽得率测定在付玉海等[19]所用方法的基础上改进。多肽含量测定程序:取一定量样品等体积加入15%(W/V)的三氯乙酸(TCA),混匀,静置10min,以沉淀大分子蛋白,然后在4000r/min离心20min,以Lowry法测定上清液蛋白含量。肽得率的计算公式如下:
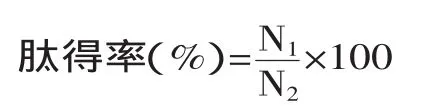
式中,N1为TCA可溶性肽含量,N2为底物总蛋白含量[20]。
1.2.7水解度的测定方法计算公式如下:
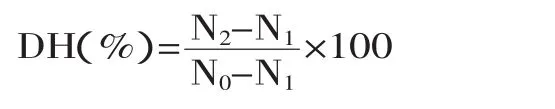
式中,N2为酶解后游离氨基氮含量,采用中性甲醛滴定法[21];N1为酶解前游离氨基氮含量;N0为总氮含量。
1.2.8统计分析实验结果以方差分析ANOVA来检测平均值之间的差异,以p<0.05为差异显著。统计分析使用Design Expert、SPSS和Origin 8.1软件。
2 结果与分析
2.1单因素实验
2.1.1超声工作间隙比对酶解液ACE抑制率的影响
图1表示骨粉悬浊液在不同超声工作间隙比处理下对酶解液ACE抑制率的影响,当工作间隙比为1∶1.5(s/s)时,酶解液ACE抑制率最高,其可能的原因是在这样的时间配比下,底物蛋白能够充分的被超声波作用。

图1 不同超声工作间隙比对酶解液ACE抑制率的影响Flg.1 Influence of on-time and off-time of ultrasonic on inhibitory activity of the hydrolysate
2.1.2超声功率对酶解液ACE抑制率的影响图2表示不同超声功率处理底物对酶解液ACE抑制率的影响。其中,在超声功率为720W时,酶解液有最高的ACE抑制率,再继续增大超声功率,酶解液抑制率下降。其可能的原因是底物经过一定程度的超声处理后,结构变得松散,有利于酶和蛋白质接触。而随着功率的进一步加大,蛋白质的结构被破坏,由于超声波对底物蛋白质化学键的破坏没有选择性,超声波可能将有利于酶解液ACE抑制率的肽链破坏,从而降低酶解液ACE抑制率。
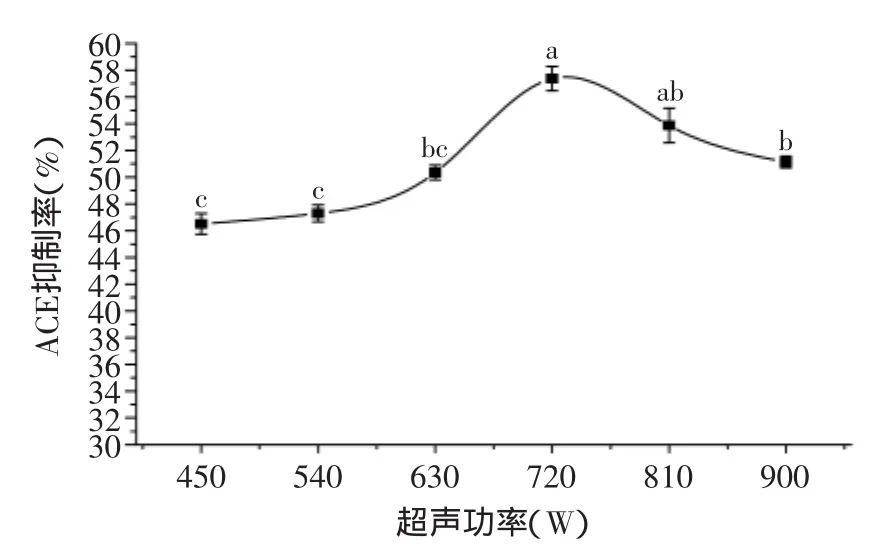
图2 不同超声功率对酶解液抑制活性的影响Flg.2 Influence of ultrasonic power on inhibitory activity of the hydrolysate
2.1.3超声时间对酶解液ACE抑制率的影响图3表示不同超声时间对酶解液的ACE抑制率的影响。超声处理到25min后,酶解液的ACE抑制率为最高,之后随着超声时间增加,抑制率反而下降,这是因为长时间的超声处理会使暴露的疏水性基团又重新结合形成较低疏水性的稳定结构[22]。

图3 不同超声时间对酶解液ACE抑制率的影响Flg.3 Influence of ultrasonic treatment time on inhibitory activity of the hydrolysate
2.1.4超声温度对酶解液ACE抑制率的影响图4表示酶解液的ACE抑制率随超声温度变化的趋势。超声处理温度为40℃时,酶解液有最高抑制率,这可能是因为蛋白质在40℃下更容易发生变性。

图4 不同超声温度对酶解液ACE抑制率的影响Flg.4 Influence of ultrasonic treatment temperature on inhibitory activity of the hydrolysate
2.1.5超声后酶解时间对酶解液ACE抑制率的影响
图5表示经超声波处理后的底物再进行不同时间的酶解对酶解液ACE抑制率的影响。结果显示,酶解3h所得到的酶解液ACE抑制率最高,时间延长,底物被过度酶解,ACE抑制率下降。
2.2响应面实验
在单因素研究的基础上,选取对酶解液ACE抑制率影响较大的3个因素,即超声功率、超声时间、超声温度为自变量,以ACE抑制率为响应值,设计响应面分析实验,其因素编码表及结果见表2。
通过统计分析软件Design Expert 8.0.6进行数据分析,建立二次响应面回归模型如下:


图5 超声后酶解时间对酶解液ACE抑制率的影响Flg.5 Influence of enzymolysis time after ultrasonic pretreatment on inhibitory activity of the hydrolysate
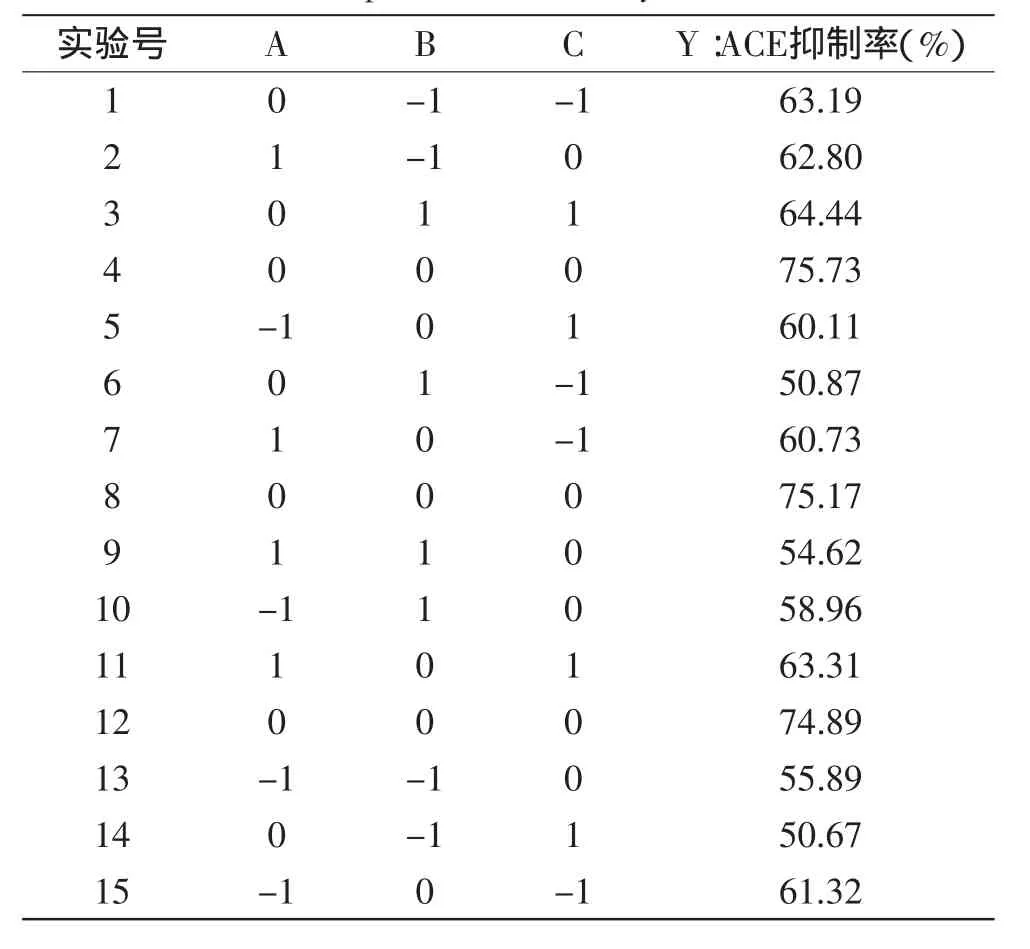
表2 响应面实验设计方案及分析结果Table 2 Experimental design and results for response surface analysis

表3 实验结果方差分析表Table 3 Analysis of varlance for the fitted regression model
由表3可知,回归方程失拟检验p=0.0939>0.05,差异不显著,回归方程F检验p<0.0001,差异极显著,说明该模型与实际实验拟合较好,模型可用。方程中AB、BC、A2、B2、C2的p<0.01,差异极显著。总回归的相关性系数R2=0.9936,决定系数R2adj=0.9820,说明方程的因变量与全体自变量之间线性关系明显。因此,回归方程可以较好地描述各因素与响应值之间的真实关系,可以利用该方程确定最佳超声工艺条件。
结合表4可知,在实验所选3个因素中,对超声辅助酶解得到的酶解液的ACE抑制率的影响大小:超声时间>超声功率>超声温度。
通过ACE抑制率模型的二元多次回归方程所作的响应面曲面图见图6、图7,分别表示的是超声时间与超声功率(AB)及超声温度与超声功率(BC)交互作用对水解物ACE抑制率的影响。响应曲面坡度较大,说明响应值对于处理条件较敏感,与表3结果一致。

图6 超声功率与超声时间交互影响酶解液ACE抑制率的响应曲面图Flg.6 Response surface showing the effects of ultrasonic power and ultrasonic time on ACE inhibitory rate
由图6可以看出,在C=0时,当超声时间较短时,酶解液ACE抑制率随超声功率的加大,升高较快,当超声时间较长时,ACE抑制率随超声功率的加大而下降,下降趋势较进行短时超声时变得平缓。由图7可知,当A=0时,抑制率随温度升高先上升后下降,随着超声功率增大先上升后下降。
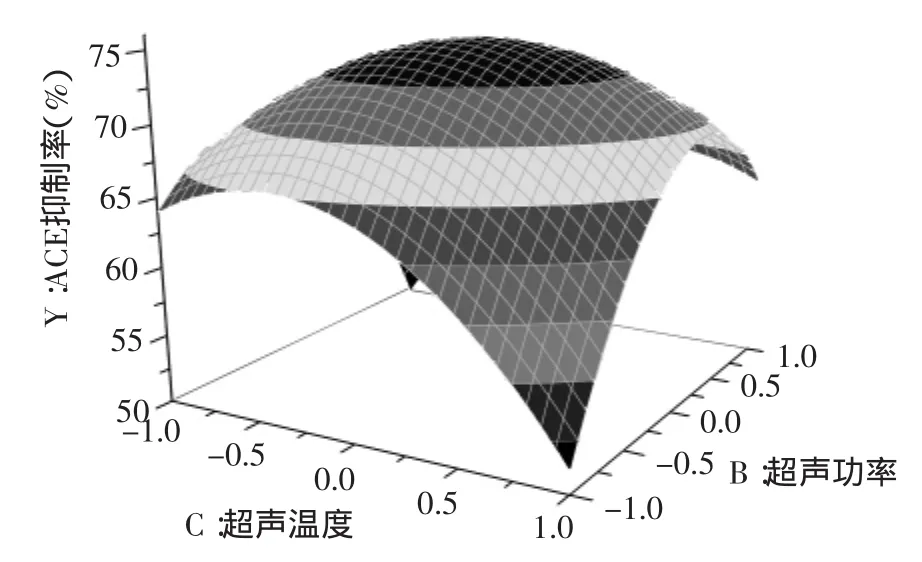
图7 超声功率与超声温度交互影响酶解液ACE抑制率的响应曲面图Flg.7 Response surface showing the effects of ultrasonic power and ultrasonic temperature on ACE inhibitory rate
经软件分析得到,ACE抑制率最大时的超声条件是:超声时间25min,超声功率717W,超声温度40℃。在该条件下,得到的酶解液ACE抑制率理论值为75.29%。经实验验证,此条件下制备出猪肩胛骨降血压肽的ACE抑制率为75.58%,接近于理论值。
2.3常规酶解和超声波辅助酶解效果比较
将常规酶解及超声辅助酶解制得酶解液IC50值、水解度、肽得率及酶解时间进行比较,结果如表4所示。

表4 常规酶解和超声辅助酶解效果比较Table 4 Consequent of the hydrolysates of pig scapula protein with/without ultrasonic pretreatment
由表4可知,采用超声波辅助酶解得到的ACE抑制率较常规酶解高,酶解所用时间少,肽得率差异不显著,说明酶解液ACE抑制率的上升不是因为肽浓度的增加。得到的酶解液水解度差异极显著(p= 0.005),在许多研究中都证明了,酶解液的水解度与ACE抑制率不呈线性关系[23]。
3 结论
超声波辅助酶解制备猪肩胛骨降血压肽的最佳超声工艺是:超声功率717W,超声时间25min,超声温度40℃,超声工作间隙比1∶1.5(s/s),再经过3h的酶解处理可以获得抑制率为75.58%酶解液。采用超声波辅助酶解得到的降血压肽的IC50值较常规酶解得到的降血压肽IC50值低32.8%,酶解时间缩短1.5h,肽得率差异不显著,水解度显著降低。
超声波对底物的作用十分复杂,本实验仅对经过超声预处理的猪肩胛骨粉的酶解产物的ACE抑制率进行了研究,而超声波对底物分子结构上的作用还有待研究。
[1]尹波欢,王燕.食源性降血压肽研究进展[J].农产品加工·学刊,2011,7(7):141-144.
[2]Yesim Akagündüz,Mauricio Mosquera,Bego a Giménez,et al.Sea bream bones and scales as a source of gelatin and ACE inhibitory peptides[J].LWT-Food Science and Technology,2014,55(2):579-585.
[3]Yuhao Zhanga,Karsten Olsenb,Alberto Grossib.Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation of ACE-inhibitory peptides[J].Food Chemistry,2013,141(3):2343-2354.
[4]龚琴.绿豆粉丝废水生物法制备降血压肽的研究[D].武汉:湖北工业大学,2011.
[5]吕莹,杨柏崇,王莹,等.预处理对核桃肽抗氧化活性的影响[J].食品工业科技,2013,34(2):286-289.
[6]李珂.猪髋骨胶原多肽的制备及其生物活性研究[D].长沙:湖南农业大学,2009.
[7]Cunshan Zhoua,Haile Maa,Xiaojie Yua,et al.Pretreatment of defatted wheat germ proteins(by-products of flour mill industry)using ultrasonic horn and bath reactors:Effect on structure and preparation of ACE-inhibitory peptides[J].Ultrasonics Sonochemistry,2013,20(6):1390-1400.
[8]康永锋,康俊霞,吴文惠,等.超声波-微波对鲑鱼肽结构及抗氧化性的影响[J].食品工业科技,2013,34(5):66-70.
[9]孙蓓,王龙刚.畜禽骨的综合利用现状及发展前景[J].中国调味品,2011,36(4):1-13.
[10]刘小红,李诚,付刚,等.猪股骨头胶原蛋白降血压肽的分离纯化[J].食品科学,2014,35(6):50-54.
[11]陈硕,李诚,李娜,等.猪股骨头胶原蛋白水解产物的降血压作用[J].食品科学,2013,34(11):285-287.
[12]李娜,李诚,陈硕,等.猪股骨不同部位胶原蛋白水解产物降血压作用[J].食品科学,2013,34(13):289-292.
[13]Mason T J,M J W Povey.Ultrasound in Food Processing[M]. London:Blackie Academic&Professional,1998:103-126.
[14]Junqiang Jia,Haile Ma,Weirui Zhao.The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J].Food Chemistry,2010,119(1):336-342.
[15]黄雨洋,李杨,李永平,等.超声波辅助酶解膨化玉米蛋白制肽工艺的响应面优化[J].粮食加工,2010,35(3):56-60.
[16]Blanca Hernández-Ledesma,María del Mar Contreras,Isidra Recio.Antihypertensive peptides:Production,bioavailability and incorporation into foods[J].Advances in Colloid and Interface Science,2011,165(1):23-35.
[17]陈昌琳,李诚,张姝莹,等.酶解法制备猪肩胛骨降血压肽[J].食品工业科技,2014,35(18):211-215.
[18]Cushman DW,Cheung HS.Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Bioch-emical Pharmacology,1971,20(7):1637-1648.
[19]付玉梅,许锦珍,廖群,等.Lowry法测定寡肽的研究[J].药物分析杂志,2011,31(4):739-741.
[20]中华人民共和国卫生部.GB/T 5009.5-2010食品安全国家标准食品中蛋白质的测定[S].2012.
[21]郭蔼光.基础生物化学[M].北京:高等教育出版社,2004:89-92.
[22]Wang XS,Li BS,Tang CH,et al.Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids,2008,22(4):560-567.
[23]Marla M Yust,Justo Pedroche,Julio Girón-Calle,et al. Production of ace inhibitory peptides by digestion of chickpea legumin with alcalase[J].Food Chemistry,2003,81(3):363-369.
Preparation of ACE-inhibitory peptides from pig scapula protein by enzymatic with ultrasonic pretreatment and comparison of enzymatic effect
CHEN Chang-lin,LI Cheng*,FU Gang,LAI Li,CHEN Mao-lin,XIAO Lan,YANG Yong,HE Li,HU Bin
(College of Food,Sichuan Agriculture University,Ya’an 625014,China)
Antihypertensive peptides were made from pig scapula protein through ultrasonic assisted flavourzyme enzymatic method and drew a parallel between them with those without ultrasonic pretreatment.The singlefactor method was used to analyze the effect of ultrasonic power,ultrasonic time,ultrasonic temperature,ontime and off-time of ultrasonic,enzymolysis time after ultrasonic on Angiotensin-converting enzyme(ACE)inhibitory activity of pig scapula protein hydrolysate.Operating parameters such as ultrasonic power,ultrasonic time and ultrasonic temperature were optimized using response surface analysis based on ACE inhibitory rate. The results indicated that the optimal ultrasonic conditions of pig scapula peptide were ultrasonic power of 717W,ultrasonic time of 25min,ultrasonic temperature of 40℃,on-time and off-time of 1∶1.5(s/s),enzymolysis time after ultrasonic of 3h.The theoretical value of ACE inhibitory activity was 75.29%,which was close to the actual value of 75.58%.It was 10.27%higher than that of the peptides without ultrasonic pretreatment.Halfinhibitory concentration(IC50)decreased by 32.8%,enzymolysis time shorten by 1.5h.
ultrasonic;enzyme;antihypertensive peptides;pig scapula
TS209
A
1002-0306(2015)02-0217-06
10.13386/j.issn1002-0306.2015.02.038
2014-05-26
陈昌琳(1989-),女,在读硕士研究生,研究方向:功能性食品。
李诚(1964-),男,教授,研究方向:畜产品加工与质量安全控制。
