离子液体微乳液预浸渍对桉木酶解效率的影响*
2015-10-21杨仁党李龙杨飞
杨仁党 李龙 杨飞
(华南理工大学 制浆造纸工程国家重点实验室,广东 广州510640)
生物质基燃料乙醇、平台化合物已成为当前可再生资源领域的研究热点[1-2]. 自上世纪中后期起,包括巴西、美国在内的一些国家开始大规模选用玉米和木薯作为原料进行能源乙醇的生产和应用,但由此带来的与人类争粮的困惑使人们将目光转向储量丰富的木本生物质原料. 天然木质纤维原料结构的致密性较高,药液渗透性困难.传统造纸的酸碱法蒸煮污染较大,而蒸汽爆破等机械法耗能和设备投入大[3-4].离子液体是一种低蒸气压、高稳定性的功能性溶剂,多种烷基取代类的咪唑离子液体(如[Bmim]Cl)可溶解提纯后的微晶纤维素[5-6]. 在木本生物质的预处理中,由于纤维素被半纤维素和木素包裹,预处理的目的并不在于大量破坏和降解纤维素,而在于适当破坏纤维素氢键网络结构和结晶结构,改善木材疏松性和药液可及度,为提高后续酶解效率奠定基础[7].
离子液体的黏度相对传统有机溶剂通常会高出1 ~3个数量级,严重限制其直接作为反应溶剂的应用,较低的流动性也会限制它对木本生物质的渗透效果[8-9].微乳液是由水相、油相、表面活性剂构成的具有超小粒径、高流动性、高增溶性的优秀载体[10].同传统微乳液一样,当表面活性剂浓度超过临界胶束浓度(CMC)后,原本不互溶的亲水/亲油离子液体可以以吸附或包裹的方式形成胶束,实现对彼此的增溶作用,使浑浊的体系变得均一透明[11].在此过程中,助表面活性剂可降低界面张力和体系黏度,改变油相的极性及调节界面膜的亲水疏水平衡值(HLB),与表面活性剂共同构筑微乳液的界面膜[12].因此用离子液体取代微乳液中的油水相,可结合微乳液的增溶性和离子液体的功能性,获得具有超强渗透能力和超低界面张力的离子液体微乳体系. 该体系在药物传输领域研究较多,如周刚[13]研究了离子液体微乳液反应体系中淀粉微球载药的方式和应用,为淀粉纳米微球在药物传输系统中的应用提供了理论指导,但在生物质预处理领域的应用较为鲜见,离子液体微乳液可以推动离子液体渗透到生物质结构内核中,甚至破坏纤维素结晶区结构,有利于后续的酶解反应以及化学处理,文中也拟为此提供一种新的方法和思路[14].在实验室条件下调制出双离子液体微乳体系(DILMS)[8,15],进一步结合乙二胺的碱性预浸渍作用,通过复合浸渍处理的方式考察它对木本生物质——桉树阔叶材酶解效率的影响,有助于提高生物质的综合应用效率,降低生产成本.
1 实验材料和方法
1.1 主要原料及设备
桉木:产自广西,树龄5年;学名为桉树,属小叶桉;取自东莞某木片场,选取木质部均一、无腐木片,粉碎、筛选后进行密封存放.离子液体[BMIM]Cl和[BMIM]PF6,纯度≥99%;正丁醇、十六烷基三甲基溴化铵(CTAB)、无水乙二胺,均为分析纯;乙二胺溶液(乙二胺/去离子水体积比为1∶5);纤维素酶:Sigma C-1184,滤纸酶活6 047 U/g;柠檬酸-柠檬酸钠缓冲液(pH=4.8),实验室自制.
主要设备:DF-101S 型集热式恒温加热磁力搅拌器(郑州宏朗仪器设备有限公司);SHA-B 型恒温水浴震荡器(上海上天精密仪器有限公司);DL-6000B 型高速离心机(新芝生物科技有限公司);S-3700N型扫描电子显微镜(日本日立公司);Dionex ICS3000 型离子色谱仪(美国戴安公司);高压反应釜(上海岩征仪器公司的YZPR 系列微型反应釜:容积10 ~500 mL;最大压力10 MPa;最高温度300 ℃).
1.2 实验方法
1.2.1 DILMS 的调制
将[BMIM]Cl(亲水相)、[BMIM]PF6(亲油相)、CTAB(表面活性剂)、正丁醇(助表面活性剂)按适当比例混合于封口烧瓶中,在50 ℃条件下恒温水浴搅拌直至体系呈无色透明状,随后在10000 r/min 条件下高速离心15min,体系不分层则表明DILMS 调制成功.
1.2.2 预浸渍处理
桉木材预浸渍处理流程见图1. 预浸渍处理结束后,通过高速离心法分离浸渍液和残渣. 移取2 mL 上层预浸渍液于锥形瓶中,加入20 mL 4%的H2SO4,密闭后置于高压反应釜中并在121 ℃温度下反应1 h[16].
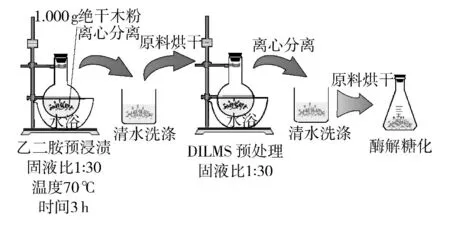
图1 预浸渍处理流程示意图Fig.1 Schematic diagram of preimpregnation process
水洗涤方法:取浸渍后经离心分离(3000 r/min,5 min)的底部物料,加蒸馏水20 mL,用玻璃棒快速搅拌约30 s,而后再次离心分离;然后将上述过程重复3 次,完成水洗涤过程.
1.2.3 酶解及酸解处理
分别对预浸渍前后的桉木粉进行酶解和酸解处理.酶解条件为:纤维素酶用量200 U/g;固液比1∶30;酶解温度(50 ±1)℃;反应时间24 h;摇振频率120 次/min. 酸解方法参照美国NREL 实验室的标准方法[17].
1.2.4 葡萄糖的离子色谱测定
上述处理过程(1.2.2 和1.2.3 节)结束后,将产物在10000r/min 条件下离心分离15 min,稀释后用0.22 μm 滤膜过滤并进行离子色谱分析.离子色谱法葡萄糖标准曲线计算方法参照式(1):

式中:Y 为峰面积;x 为葡萄糖质量浓度.
2 结果与讨论
2.1 DILMS 配比对酶解效率的影响
微乳体系的稳定性主要受两个因素的影响:一是是否有适量的亲水性物质对亲油性物质进行有效包裹;二是是否有适量的乳化剂构成混合界面膜,保证亲水亲油组分的有序分布.故在此提出两个参数:亲水亲油比K 和乳化比M.
K=m([BMIM]Cl)/m([BMIM]PF6),代表亲水相物质和亲油相物质的质量比,可以表现连续相对分散相的包覆比例和难易程度,在此取1.5 和3.0 进行对比.M =m(CTAB +正丁醇)/ m([BMIM]Cl +[BMIM]PF6),为乳化剂和非乳化剂的质量比,可以体现出混合界面膜的比例和构成情况,在此取0.6和1.0 进行对比.
如表1 所示,实验组1、4 的得率明显高于实验组2、3,这是因为后者过多的乳化剂会使混合界面膜过厚甚至剩余,因微乳体系是个动态平衡体系,各相在不停的流动交换过程中实现平衡与稳定,而过厚甚至过剩的界面膜会减弱这种流动平衡性和自由性,不利于微乳体系的动态稳定,故预浸渍效果不佳.然而在乳化剂含量较高的情况下,亲水亲油值较低可形成双连续体系,此体系对乳化剂的需求量较高,较少造成混合界面膜的剩余,故相对于亲水亲油型的体系更加稳定,预浸渍效果相对更好,也正如实验组2 和3 的结果所示.

表1 离子液体微乳液体系配比对葡萄糖酶解得率的影响1)Table 1 Effect of components ratio of DILMS on yield of enzymatic hydrolysis of glucose
对于M=0.6 的两个实验组(1 和4),K =3.0实验组的预浸渍效果明显高于K =1.5 的实验组.其原因是在乳化剂含量较低的条件下,须有足够的亲水性[BMIM]Cl 对亲油性[BMIM]PF6进行球形包覆,否则两者将呈现管状的相互包覆形态,微乳液类型也就由亲水包亲油型微乳液转化为双连续型微乳液.从实验结果看来,双连续型微乳液对生物质的预浸渍效果并不如前者,为保证良好的预浸渍效果,应保证亲水性[BMIM]Cl 相对于亲油性[BMIM]PF6在质量方面的绝对优势.同时,进一步提高乳化剂比例后(实验组5、6),葡萄糖酶解得率在M =1.0 的基础上明显降低,表明过高含量的乳化剂会进一步增加界面膜厚度,阻碍有效成分的自由流动和反应,并不利于酶解效率的提升.同时,若乳化剂含量过低(实验组7、8),则界面膜形成不完整,一来体系稳定性降低,二来不利于酶解效率的提升.所以在保证界面膜有效形成的基础上,乳化剂应处于合适的低含量状态.经过综合比较,在后续的实验中采用K =3.0,M=0.6的离子液体微乳体系.
结合前期实验得到的结论:CTAB/正丁醇质量比为1∶18 可以使DILMS 获得良好的电导率水平,对改善[BMIM]Cl 中Cl-的自由流动和氢键结合能力有利[7]. 综上所述,DILMS 各组分的理想质量比确定为m(CTAB)∶m(正丁醇)∶m([BMIM]Cl)∶m([BMIM]PF6)=1∶18∶24∶8,既满足m(CTAB)∶m(正丁醇)=1∶18,又满足K=3.0,M=0.6,后续实验的DILMS 均以此配比调制.
2.2 预浸渍方法对酶解效率的影响
如表2 所示,不同预浸渍方法对酶解效率的影响相差较大.未经任何预浸渍的木粉葡萄糖酶解得率仅为35.8%,单纯乙二胺处理的木粉葡萄糖酶解得率相对空白组提升46%,改善作用有限,单纯[BMIM]Cl的预浸渍组木粉葡萄糖酶解得率相对空白组提升78%,而采用DILMS 可将葡萄糖酶解得率提高至69.3%,相对于[BMIM]Cl 实验组还高出6%,而且相同固液比条件下DILMS 中[BMIM]Cl 的用量比单纯使用[BMIM]Cl 节省了51%,这也正是选用DILMS 替代单纯离子液体进行预浸渍的原因所在.

表2 预浸渍方案对酶解过程中葡萄糖酶解得率的影响1)Table 2 Effect of preimpregnation methods on yield of enzymatic hydrolysis of glucose
通过对一步法和两步法的实验组进行对比发现,两步法具有更好的预浸渍效果.这是由于在一步法中,虽然将乙二胺直接混入DILMS 后体系仍呈现透明状态,但是过于复杂的成分会降低油水相之间混合界面膜的稳定性,尤其是加热条件下的均一稳定性会受到影响,致使预浸渍对酶解效率的提升作用不如两步法.
2.3 DILMS 预浸渍温度对后续酶解效率的影响
温度过高或过低都会明显影响预浸渍的效果.如图2 所示,未经任何预浸渍(空白组)的木粉葡萄糖酶解得率仅为35.8%,而经过预浸渍的木粉葡萄糖酶解得率均升至65%以上,最高得率(83.2%)出现在预浸渍温度100 ℃的实验组,相比未处理原料组上升至其2.32 倍. 从葡萄糖酸解得率的角度分析,未处理木粉的葡萄糖酸解得率为44.7%,而酶解残渣中的葡萄糖酸解得率最多可降至15.7%,此结果亦从侧面反映出预浸渍过程对底物酶解效率的大幅提升作用.
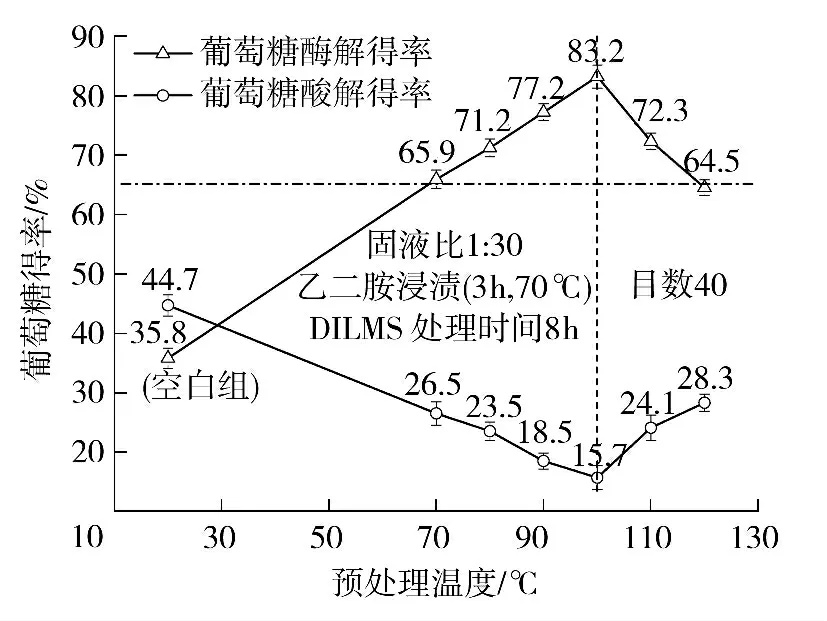
图2 预浸渍温度对酶解过程中葡萄糖得率的影响Fig.2 Effect of preimpregnation temperature on yield of glucose
从70 ℃到100 ℃,不断上升的葡萄糖酶解得率表明预浸渍效果逐步攀升. 这是由于随着温度的升高,离子液体的黏度和流动性得到有效改善,可以更加完美地融入微乳液体系,[BMIM]Cl 作为连续相通过乳化剂构成的混合界面膜可以更有效对[BMIM]PF6实现包覆;同时,高温下较低的黏度有利于[BMIM]Cl 游离出的Cl-自由移动并与纤维素上氢键的H+进行结合,破坏原始氢键网络,使生物质原料结构疏松. 但由于助表面活性剂正丁醇的沸点为108 ℃,所以当温度接近甚至超过此临界值时,正丁醇变得不稳定,从而影响微乳体系中混合膜的构成,微乳体系稳定性下降并开始失效,预浸渍效果随之降低.尤其在120 ℃时,作用效果仅和70 ℃时相当.
图3 中,葡萄糖酶解得率V酶和葡萄糖酸解得率V酸的计算公式如下:

2.4 预浸渍时间和底物目数对后续酶解效率的影响
如表3 所示,实验组1 至4 的变量是DILMS 预浸渍时间,此因素对酶解效率的影响较大,说明对纤维素间氢键网络的有效破坏可以更直接地改善底物的疏松和多孔性,对葡萄糖酶解得率提升具有最为直接的影响,但将实验组3 与4 相比,其他预浸渍条件一致,只是DILMS 处理时间延长了1 h,葡萄糖酶解得率仅从83.2%上升到83.5%,表明单纯延长DILMS 处理时间所能达到的提升效果饱和,所以DILMS 处理时间确定为8 h 比较合适;实验组2、5 探讨的因素是木粉的目数,虽然粒径减小对葡萄糖酶解得率的上升具有帮助,但效果有限,得率仅从80.3%上升到80.9%,所以40 目已经可以满足预浸渍效果的需求.因此,后续实验中的预浸渍条件统一为:乙二胺预浸渍(3 h,70 ℃),DILMS 浸渍(8 h,100 ℃),原料目数40,固液比1∶30.

表3 100 ℃条件下其他影响因素对葡萄糖酶解得率的影响1)Table 3 Effect of other factors on yield of enzymatic hydrolysis of glucose at 100 ℃
2.5 扫描电镜分析
图3 给出了预浸渍前后桉木粉微观结构的电镜图.由图3(a)可以观察到,木粉表面结构平滑有序,纹理清晰,孔洞封闭且边缘周长较小,整体木质结构致密;而由图3(b)可以发现,平滑的表面结构被破坏,凸起和褶皱明显增多,孔洞结构被溶穿且周长增大,比表面积增大且木质结构致密性整体降低,预处理前后结构的改变对于后续酶解过程中酶液渗透性和反应性有重要的作用.通过比较,能更加直观地看到预浸渍过程对木质微观结构的改善程度,客观地解释预浸渍后酶解效率升高的原因.

图3 预浸渍前后桉木粉微观结构电镜图Fig.3 SEM pictures of Eucalyptus microstructure before and after preimpregnation
2.6 预浸渍前后原料中单糖含量分析
如表4 所示,未经预浸渍的原料酸解后,葡萄糖在总还原糖中的比重为64.3%,其次为木糖,其他单糖含量较低.由于葡萄糖的主要来源为纤维素,在预浸渍后,葡萄糖含量百分比上升至96.34%,这表明纤维素结构在预浸渍过程中受到了很好的保护.半纤维素的大量去除导致其他单糖含量急剧减少,其中损失程度最大的为木糖,其次为半乳糖. 结合表4的数据,进一步观察和对比图4 中葡萄糖含量百分比的增加程度,可以更加直观地认识到乙二胺/DILMS 处理方法确实达到了预期效果.
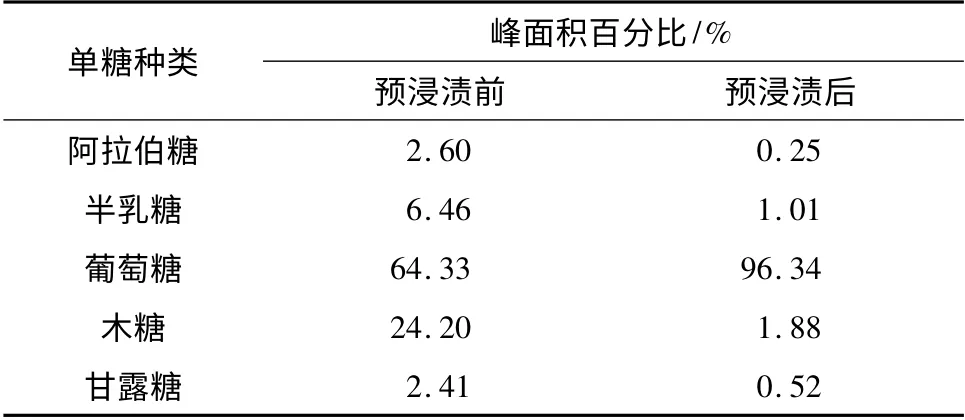
表4 预浸渍前后原料酸解过程中出峰面积百分比Table 4 Peak area preimpregnation of eucalyptus acidolysis process before and after preimpregnation
2.7 浸渍液中单糖成分分析
由表5 可知,乙二胺和DILMS 预浸渍过程中都会有少量单糖脱落进入浸渍液中,由于阿拉伯糖、甘露糖含量过少,通过离子色谱仪无法检测出.经过乙二胺预浸渍中,半纤维素的主要单糖成分木糖脱除量最大,可达到0.082 g(以1.000 g 绝干原料为基准,余同);由于纤维素被半纤维素和木素包裹,所以被破坏程度有限,损失的葡萄糖含量仅有0.022 g.DILMS 预浸渍过程对各种单糖的溶出作用有限,在离子液体对纤维素中氢键网络结构的适当破坏作用下,约有0.02 g 的葡萄糖损失量.因此可以说,DILMS 处理只是改善了木粉微观结构的致密性,但对于纤维素和半纤维素的破坏作用极为有限.
以1.000 g 绝干原料为例进行定量计算,发现:两步预浸渍后的浸渍液中葡萄糖共计0. 041 g(0.022 g+0.019 g)(见表5),由于预浸渍前底物的葡萄糖总量为0. 447 g,酶解得率为35. 8% (见图2),所以酶解1.000g原料实际获得葡萄糖产量为0.160 g;经过预浸渍,虽然损失了少量葡萄糖而只剩下0.406(0.447 -0.041)g,但酶解效率大幅上升至83.2%(见图2),最终获得葡萄糖0.337 g,所以实际的葡萄糖产量提高了1.11 倍.

图4 预浸渍前后原料酸解过程中的出峰时间与面积Fig.4 Appearance time and peak area of eucalyptus acidolysis process before and after preimpregnation

表5 乙二胺预浸渍+DILMS 处理后预浸渍液成分分析1)Table 5 Analysis of preimpregnation liquids after quadrol impregnation+ DILMS treatment
3 结论
文中对DILMS 配比优化实验、预浸渍工艺优化实验及底物残渣(浸渍液)中单糖含量检测实验进行了分析,主要结论如下:
(1)DILMS 配比优化实验表明:高效稳定的微乳体系需要有足够的亲水性[BMIM]Cl 对疏水性[BMIM]PF6进行有效包覆,并且由乳化剂构成的复合界面膜厚度要适中,以此维持体系的动态平衡,实现良好的渗透和预浸渍效果.
(2)预浸渍工艺优化实验表明:碱加强的离子液体微乳液对桉木的浸渍效果明显优于纯离子液体[BMIM]Cl,且在(乙二胺预浸渍(70 ℃,3 h)、DILMS预浸渍(100 ℃,8 h)、固液比1∶30、目数40)的条件下可对阔叶材桉木的酶解效率起到大幅的促进效果.预浸渍前后微观结构的SEM 图对比表明:预浸渍后褶皱明显增多,比表面积有效增大.
(3)底物残渣及浸渍液中单糖含量分析实验表明:经过有效的乙二胺/DILMS 预浸渍,底物中葡萄糖占总还原糖的百分比由64.33%上升至96.34%,表明纤维素结构获得了有效保护;酶解得率由35.8%上升到83.2%,单位质量底物的葡萄糖产量提高了1.11倍,两步预浸渍法达到了良好的预期效果.
[1]Zhang S J,Gilless J K,Stewart W.Modeling price-driven interactions between wood bioenergy and global wood product markets[J]. Biomass and Bioenergy,2014,60:68-78.
[2]Arthur Redding,Chen Yuan-cai,Fu Shi-yu,et al.Bioethanol production and dilute acid pretreatment of lignocellulosic materials:a review[J].Journal of South China University of Technology:Natural Science Edition,2012,40(3):1-9.Arthur Redding,陈元彩,付时雨,等. 生物乙醇生产及木质纤维素稀酸预处理的研究进展[J].华南理工大学学报:自然科学版,2012,40(3):1-9.
[3]Lau M J,Lau M W,Gunawan C,et al.Ammonia fiber expansion (AFEX)pretreatment,enzymatic hydrolysis,and fermentation on empty palm fruit bunch fiber(EPFBF)for cellulosic ethanol production [J]. Applied Biochemistry and Biotechnology,2010,162(7):1847-1857.
[4]张毅民,杨静,吕学斌,等. 木质纤维素类生物质酸水解研究进展[J].世界科技研究与发展,2007,29(1):48-54.Zhang Yi-min,Yang Jing,Lü Xue-bin,et al. Research processes in acid hydrolysis of lignocellulosic biomass[J].World Sci-Tech R&D,2007,29(1):48-54.
[5]李秋瑾,殷友利,苏荣欣,等.离子液体[BMIM]Cl 预处理对微晶纤维素酶解的影响[J]. 化学学报,2009,67(1):88-92.Li Qiu-jin,Yin You-li,Su Rong-xin,et al. Enzymatic hydrolysis of microcrystalline cellulose with an ionic liquid pretreatment step [J]. Acta Chimica Sinica,2009,67(1):88-92.
[6]罗志刚,周刚,周子丹.蜡质玉米淀粉在BMIMCL 介质中的均相乙酰化[J]. 华南理工大学学报:自然科学版,2012,40(8):133-138.Luo Zhi-gang,Zhou Gang,Zhou Zi-dan. Homogeneous acetylation of waxy maize starch in ionic liquid BMIMCL[J]. Journal of South China University of Technology:Natural Science Edition,2012,40(8):133-138.
[7]武书彬,徐绍华. 蔗渣乙醇预处理及其对酶解的影响[J].华南理工大学学报:自然科学版,2014,42(7):124-131.Wu Shu-bin,Xu Shao-hua.Ethanol pretreatment of sugarcane bagasse and its effect on enzymatic hydrolysis[J].Journal of South China University of Technology:Natural Science Edition,2014,42(7):124-131.
[8]Li L,Yang R D,Liu D T,et al.Influence of combined pretreatment of quadrol and anhydrous ionic liquid microemulsion on the physicochemical property of Masson pine[J].Journal of Applied Polimer Science,2013,131(2):1-9.
[9]王颖,苏宝根,邢华斌,等. 离子液体在微乳液聚合中的应用[J].现代化工,2014,34(2):38-43.Wang Ying,Su Bao-gen,Xing Hua-bin,et al. Application of ionic liquids in microemulsion polymerization [J].Modern Chemical Industry,2014,34(2):38-43.
[10]王军,杨许召.微乳液的制备及其应用[M].北京:中国纺织出版社,2011:25-29.
[11]白婷婷.离子液体微乳液体系相图构筑、增溶方式与性质的研究[D].济南:山东师范大学化学化工与材料学学院,2013.
[12]孙浩.离子液体与正丁酸对微乳液相行为和增溶能力的影响[D].济南:山东师范大学化学化工与材料学学院,2013.
[13]周刚.含离子液体微乳液体系下淀粉纳米微球的制备及性质研究[D].广州:华南理工大学轻工与食品学院,2014.
[14]汪滨.离子液体微乳液预处理技术在生物质转化中的应用研究[D].广州:华南理工大学轻工与食品学院,2012.
[15]李龙,黄豆豆,汪滨,等.新型离子液体微乳液的制备及其对马尾松的渗透性能研究[J].中国造纸,2012,31(12):21-26.Li Long,Huang Dou-dou,Wang Bin,et al.Preparation of new-type ILs microemulsion and its permeability on Masson pine[J].China Paper,2012,31(12):21-26.
[16]李萍萍.松木溶解浆的制备及预水解液的研究[D].广州:华南理工大学轻工与食品学院,2013.
[17]张红缦,郑荣平,陈敬文,等.NREL 法测定木质纤维素原料组分的含量[J].分析实验室,2010,29(11):15-18.Zhang Hong-man,Zheng Rong-ping,Chen Jing-wen,et al. Measurement of lignocellulose component of NREL method[J].Analysis Laboratory,2010,29(11):15-18.
