炎症性肠病治疗新进展
——干细胞治疗
2015-10-21智发朝
徐 隽 智发朝
·综述·
炎症性肠病治疗新进展
——干细胞治疗
徐隽智发朝
【提要】干细胞治疗是一种新兴的炎症性肠病的治疗手段,其通过免疫调节和免疫重建等机制缓解黏膜炎症。目前用于治疗炎症性肠病的干细胞主要有造血干细胞和间充质干细胞,主要方法有干细胞移植(自体或异体)及局部注射。临床研究证实干细胞移植对难治性炎症性肠病有一定效果,并能够使部分患者长期维持缓解。但干细胞疗法仍处于研究阶段,其安全性和长期有效性等仍有待进一步评估。
炎症性肠病;造血干细胞;间充质干细胞
一、干细胞治疗炎症性肠病概述
炎症性肠病(Inflammatory bowel disease,IBD)是一类免疫介导的以消化道炎症为主要表现的系统性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD),其治疗主要以缓解临床症状和控制炎症发展为主,包括药物治疗和必要时的手术治疗。治疗IBD的药物主要包括氨基水杨酸制剂、类固醇激素、免疫调节剂(硫唑嘌呤、6-巯嘌呤、甲氨蝶呤)以及生物制剂(单克隆抗体)等,但以上治疗手段均无法达到根治,且有部分患者对上述疗法均无反应。
干细胞是一类具有不对称分裂能力的细胞,主要分为胚胎干细胞(embryonic stem cells,ESCs),多能成体干细胞及诱导多能干细胞(induced pluripotnent stem cells,iPSCs)。近十几年来,不断有干细胞移植或局部注射治疗难治性IBD(绝大多数为CD)及其并发症的案例被报道,且有相当一部分患者病情得到缓解,因此,干细胞成为IBD治疗的又一重要方向。
干细胞治疗IBD及其并发症的主要手段有干细胞移植及干细胞局部注射。干细胞移植是研究最多的治疗方式,包括自体干细胞移植和同种异体干细胞移植。目前用于治疗IBD的干细胞为成体干细胞,主要有造血干细胞(hematopoietic stem cells,HSCs)和间充质干细胞(mesenchymal stem cells,MSCs)两种类型,其主要机制是利用干细胞自我更新、免疫调节及营养等特性,实现“肠道免疫的重建”[1],从根本上避免免疫介导的肠道炎症的发生,改变患者的遗传易感性。胚胎干细胞在再生医学领域有重要地位,但其对IBD的治疗仍处在基础研究层面。
干细胞移植主要包括如下步骤。第一步是干细胞采集。自体造血干细胞移植时,需对患者行外周血造血干细胞动员后进行采集;同种异体造血干细胞移植时,则需进行人白细胞抗原(HLA)匹配。第二步是干细胞筛选和体外扩增,即通过一定方式对所采集的细胞进行纯化,去除其它类型细胞(主要是淋巴细胞),并采用体外培养扩增干细胞。第三步是患者的预处理,即用化疗等方式清除患者体内的免疫细胞,为移植做准备。最后一步是干细胞输注,即将体外培养和筛选的干细胞输入到患者体内。图1展示了干细胞移植的具体步骤。
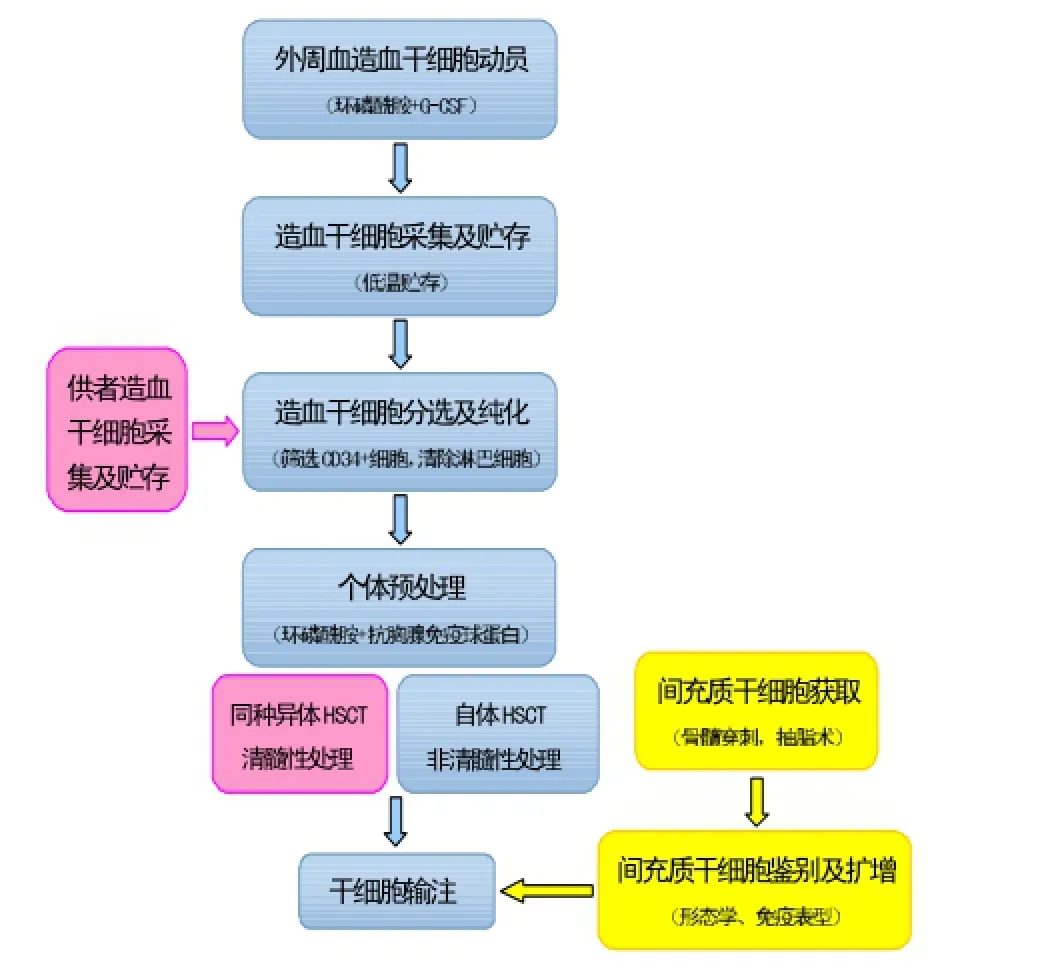
图1 干细胞移植治疗IBD步骤
二、造血干细胞治疗IBD
1.造血干细胞特点及作用机制
造血干细胞是一类具有自我更新和向成熟血细胞分化能力的细胞,主要用于血液系统恶性肿瘤的治疗。在IBD治疗中,HSCs可定植于肠黏膜受损处,并分化为肠上皮,修复损伤;也具有免疫调节作用,分裂产生免疫原性低的细胞,减轻肠道的炎症反应[2]。
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)治疗免疫介导性疾病(Immune-mediated disease,IMID)的机制尚无明确结论,多认为与HSC的免疫调节功能有关,即通过干细胞移植,使免疫原性低的细胞代替了患者体内反应性淋巴细胞,从而避免肠道异常免疫反应导致的黏膜损伤。Clerici M等[3]比较了难治性克罗恩病患者行造血干细胞移植前后血液中免疫细胞及细胞因子水平的变化,并与正常人进行比较,发现克罗恩病患者的调节T细胞(Treg)、表达TLR4的细胞、肿瘤坏死因子α(TNF-α)、白介素10(IL-10)在移植前均高于正常人,且以上细胞及细胞因子在移植后均出现明显下降,提示造血干细胞具有免疫调节作用,能够降低患者炎症反应。Alexander等[4]则认为HSCs的免疫调节功能与患者胸腺的改变有关,即在HSCT后受者胸腺功能被再次激活,并产生原始的免疫耐受性高的T淋巴细胞,从而减轻免疫介导的机体损伤。
自体HSCT和同种异体HSCT的机制既有相似之处也有不同之处。自体HSCT是通过化疗(淋巴消融)清除患者体内的反应性T淋巴细胞,取代以免疫耐受性更高的淋巴细胞,以重建免疫系统,由于移植物为自体细胞,且多采取非清髓性处理,故无法在基因层面改变患者的遗传易感性,在一定诱因作用下,IBD仍可复发。同种异体HSCT是用供者的免疫细胞完全替代受者的免疫细胞,完成免疫系统的替换,从遗传水平改变患者对IBD的易感性,但由于其致死率高,目前较少用于非恶性疾病的治疗。
2.造血干细胞移植治疗IBD
造血干细胞是干细胞治疗IBD最先采用的细胞,该治疗手段的出现源于对同时患有IBD及恶性血液系统肿瘤患者行HSCT后,IBD出现临床缓解或内镜下缓解的个案报道[5-6],也有报道霍奇金淋巴瘤患者接受造血干细胞移植后出现“获得性”克罗恩病的案例[7],以上研究均提示HSCT可能是治疗IBD的新靶点。此外,HSCT在治疗其它免疫介导的疾病已取得一定成果,这也增加了研究人员对HSCT治疗IBD的信心,已有组织提出对某些严重且其它治疗方法无效的免疫介导的疾病采取造血干细胞移植治疗,其中就包括了难治性克罗恩病[8]。
此后,有学者对难治性IBD患者采取了造血干细胞移植(自体或同种异体),并对其有效性和安全性做出评估。表1为近年来有关造血干细胞治疗IBD的临床试验。综合回顾以下临床试验,可以看出造血干细胞移植的确能够使某些难治性IBD患者的病情得以缓解,生活质量显著提高,避免激素的大剂量使用,有一定应用前景。但也能看出,HSCT治疗IBD仍处在研究阶段,存在一定缺陷:第一,各研究结论缺乏说服力,需进行样本量更大、随访时间更长的临床试验以得出更为可靠的结论;第二,从现有数据能看出HSCT治疗IBD仍存在一定的复发率;第三,HSCT尤其是同种异体HSCT的风险大,已有死亡案例的报道;第四,HSCT治疗UC的研究数据极少,仅Ditschkowski M[10]及Yu LZ[17]对此进行了报道,虽然上述UC患者均通过行HSCT使病情获得缓解,但由于例数过少(5例),难以证实HSCT对UC的有效性。
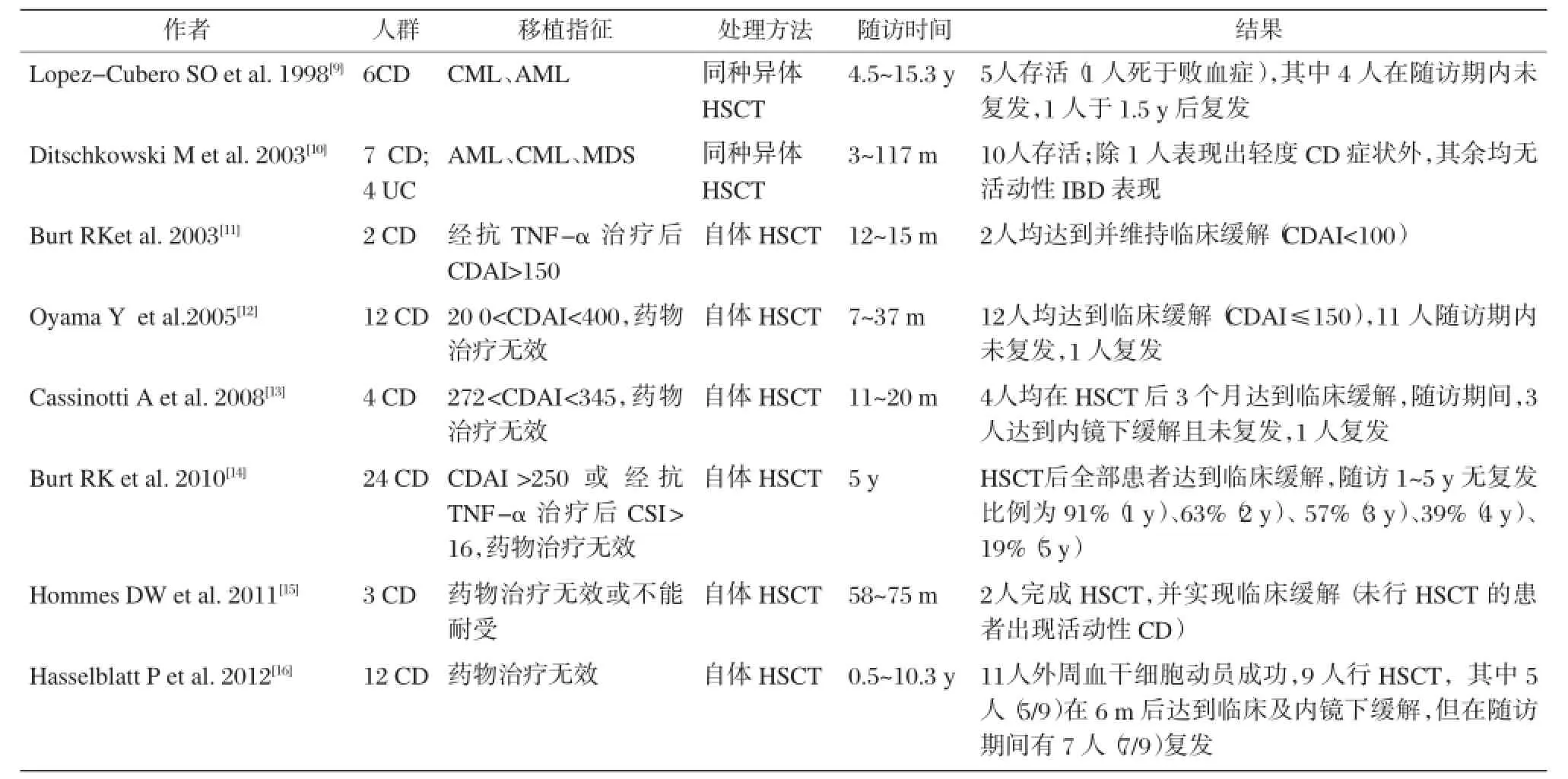
表1 造血干细胞移植治疗IBD的临床试验
需要说明的是,虽然同种异体HSCT治疗IBD前景堪忧,但仍有一类人群适合采用此疗法:即IL-10基因缺陷的低龄IBD患者。Kotlarz D等[18]对66名发病年龄<5岁的IBD进行IL-10、IL-10R1及IL-10R2的基因检测,发现共16名患者存在上述基因缺陷,其中5名患者进行了同种异体HSCT,并在此后2年的随访时间内未出现复发。因此,对于发病年龄较早的IBD患者,可进行IL-10基因检测,若存在此类基因缺陷,则适合采用同种异体HSCT。
3.造血干细胞移植的安全性
安全性问题是关乎HSCT治疗IBD发展前景的重要问题。干细胞的免疫原性、细胞培养安全性、异位组织形成的可能、细胞的体外扩增时发生转化都是能够影响移植成功率及安全性的重要环节。Snowden等[19]回顾了1997~2009年数据库所纳入的造血干细胞移植治疗免疫介导的疾病的临床试验,发现自体HSCT的一年和五年生存率分别为85%及78%,同种异体HSCT的一年和五年生存率分别为87%和65%,感染是造成患者死亡的最主要原因。通过以上数据可看出造血干细胞移植治疗免疫介导疾病的安全性仍是一项亟待解决的问题,但对于HSCT治疗IBD的安全性问题报道较少。
三、间充质干细胞
1.间充质干细胞的特点及作用机制
间充质干细胞又称成人干细胞,是一种来源于外胚层及中胚层的多能成体干细胞,主要位于结缔组织和器官间质中。此类细胞大多表达CD105、CD73及CD90,并可在体外可分化为成骨细胞、软骨母细胞和脂肪细胞[20]。
与造血干细胞类似,间充质干细胞也具有增殖分化、免疫调节及营养的作用,并在再生医学领域占据重要地位。目前已有报道采用间充质干细胞治疗急性激素抵抗的移植物抗宿主病、儿童成骨不全症、强直性脊柱炎、椎间盘突出症及一些神经系统疾病等[21]。
间充质干细胞主要通过释放多种可溶性因子(细胞因子、趋化因子、生长因子等),诱导淋巴细胞的细胞周期停滞及细胞凋亡,以实现免疫调节和炎症控制,进而实现组织再生[22]。相关研究发现,骨髓间充质干细胞(BMMSCs)及脂肪间充质干细胞(ASCs)能够增强免疫抑制分子的活性,如肝细胞生长因子(HGF)、转化生长因子-β(TGF-β)、前列腺素E2(PGE-2)、吲哚胺2,3-双加氧酶(IDO)、IL-6、IL-10、一氧化氮、血红素加氧酶-1、HLA-G5等[23]。值得注意的是,MSC的免疫调节作用在炎症环境中更为突出,体现在某些促炎因子(TNF-α、IFN-γ等)的存在是干细胞发挥免疫调节作用的前提[24]。
2.间充质干细胞治疗IBD
作为多能干细胞的一员,间充质干细胞对IBD的疗效也被许多学者所研究。多个动物实验已证实MSC能够缓解药物所致结肠炎,表现在临床症状缓解、黏膜炎症及炎症因子水平降低[25-27]。
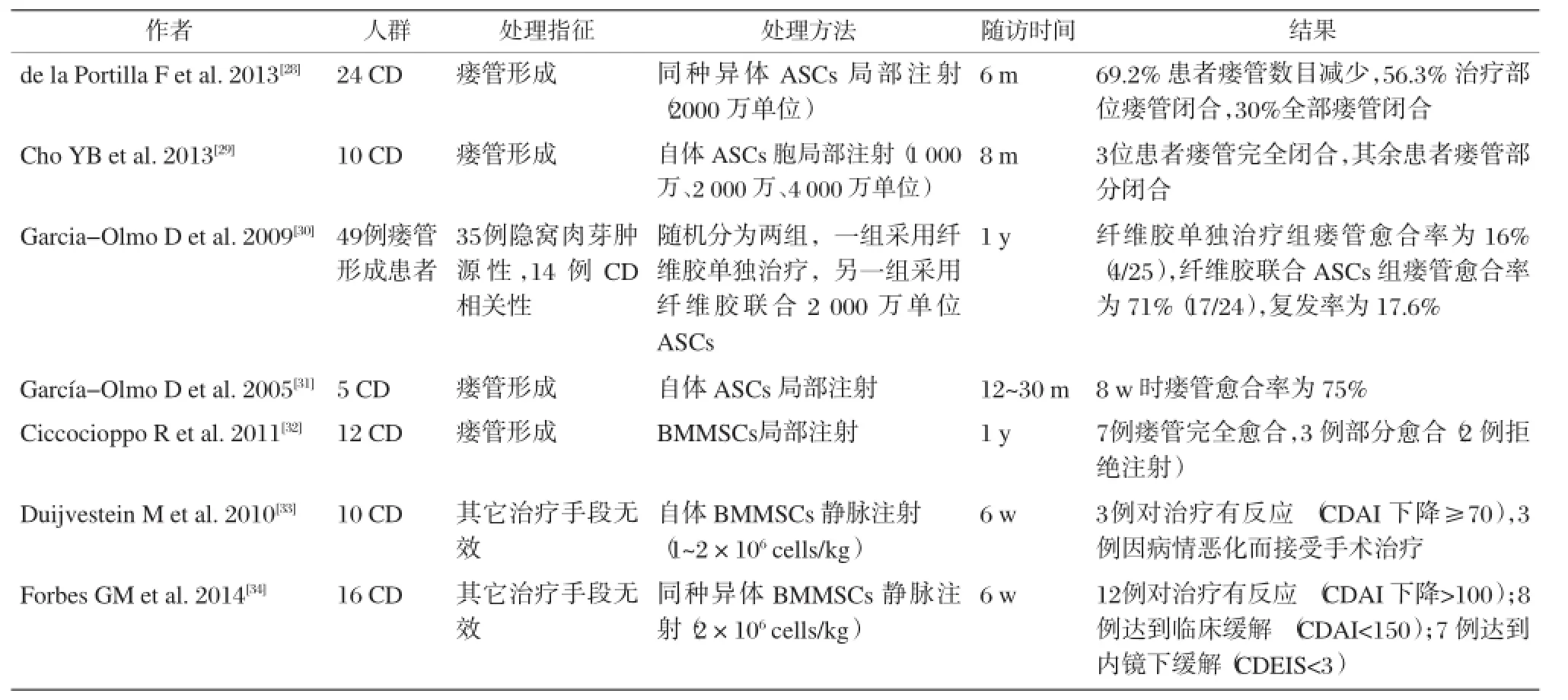
表2 间充质干细胞治疗IBD的临床试验
MSC治疗IBD的相关临床试验也取得了一定进展。目前用于治疗IBD的间充质干细胞主要有骨髓间充质干细胞(BMMSCs)和脂肪间充质干细胞(ASCs)两种类型。骨髓间充质干细胞是研究最多的MSCs,但由于骨髓间充质干细胞的含量较少,提取有一定难度,且随着年龄增长,骨髓间充质干细胞数目逐渐减少,其临床应用存在一定局限性。此后,随着脂肪间充质干细胞的出现,克服了BMMSC的缺陷,具有良好的应用前景。MSC治疗IBD主要有两种手段:干细胞移植治疗肠腔IBD(luminal IBD)以及干细胞局部注射治疗IBD(主要是CD)所致瘘管(fistula IBD)。表2为MSC治疗IBD的主要临床试验。
MSC治疗肠腔IBD的报道较少,Liang J等[35]回顾分析了7例难治性IBD(UC 3例、CD 4例)患者经同种异体BMMSCs移植后症状减轻,炎症活动度降低。对于IBD所致瘘管的治疗,García-Olmo D团队提供了一系列的研究报道。García-Olmo D等在2003年报道了1例ASCs成功治疗克罗恩病引起的直肠阴道瘘的案例[36],认为干细胞治疗有可能应用与此类情况。此后,该团队于2009年报道了一项Ⅱ期临床试验,通过比较局部注射ASCs联合纤维胶与单独使用纤维胶治疗复杂性瘘管,发现ASCs联合纤维胶组的瘘管闭合率明显高于单独使用纤维胶组[30],但经过长达3年随访发现在联合治疗组中仅有少部分人(7/24)没有复发[37],因此ASCs的长期效果仍不确切。基于以上研究,该团队于2012年报道了一项ASCs治疗肛周瘘管的Ⅲ期临床试验[38],比较ASCs、ASCs联合纤维胶以及纤维胶3种方法的疗效,发现经过24~26周时3组的瘘管闭合率分别为39.1%,43.3%,37.3%(P =0.79),而1年后三组的瘘管闭合率为57.1%,52.4%,37.3%(P=0.13),3种治疗手段均未出现严重的副反应。
3.MSC治疗IBD的安全性问题
MSC治疗IBD的安全性问题目前存在着两种截然相反的研究结果,至今仍无确切结论。基于MSC的增殖及多向分化潜能,有学者提出此类疗法能够增加肿瘤发生风险。并有相关动物实验将ASCs与肿瘤细胞同时输注到小鼠体内,发现与对照组(输入肿瘤细胞)相比,该组小鼠的肿瘤出现时间更早,体积更大[39]。但也有研究发现MSC能够抑制肿瘤发生。Nasuno M等[40]发现MSC通过诱导细胞凋亡及控制细胞分裂等机制实现抑瘤作用。Chen Z[41]等发现BMMSCs能够降低结肠炎导致的肿瘤形成风险,MSC能够在大体水平减轻炎症,降低促炎因子(TNF-α、IL-1β、IL-6)的表达,下调STAT3磷酸化表达,减少肿瘤数目,降低瘤负荷。除致癌性外,MSC的其它不良反应也得到系统性的评估。Lalu MM等[4 2]对2011年前系统性使用间充质干细胞(动脉、静脉注射)的前瞻性临床试验进行系统回顾,发现除一过性发热外,MSC的使用并未出现明显副作用,是一种相对安全的治疗手段。
四、总结及展望
总体来说,干细胞治疗IBD有较好的应用前景。目前已有一定数目的临床试验证实造血干细胞和间充质干细胞对难治性克罗恩病有较好疗效,使部分患者达到治愈。然而,现有治疗手段均有待改进:造血干细胞移植需对病人进行严格筛选,且需在技术条件成熟、有能力处理原发病及移植并发症的机构进行;间充质干细胞移植的成功与否取则决于多种因素[43],如MSC类型、自身特点、移植策略(途径、时间间隔、剂量、细胞因子及趋化因子的预处理)等,以上条件的选择和优化均有待进一步研究。因此,IBD的干细胞疗法仍处于起步阶段,某些研究结果相互矛盾,缺乏定论,因而有许多需要进行深入研究的问题,主要包括移植的安全性、长期有效性及对溃疡性结肠炎的治疗效果等。
胚胎干细胞(ESCs)同样具有免疫调节和缓解炎症等特性,且较成体干细胞而言生长速度更快、分化能力更强,有可能成为继成体干细胞后又一种用于治疗IBD的干细胞[44]。对于ESCs治疗IBD仍缺乏相关文献报道,只有Srivastava AS等[45]报道了经诱导后的分化前胚胎干细胞(pre-differentiated ESCs)能够定植于小肠、结肠、肝脏,并通过修复受损上皮和重建免疫体统等机制缓解炎症。目前ESCs应用最大的挑战是控制分化,即通特定的外部环境诱导细胞沿着所需的路径生长分化,此外关于该细胞的安全性、分离纯化技术以及免疫排斥等问题[46]仍需进一步研究。
1García-Bosch O,Ricart E,Panés J.Review article:stem cell therapies for inflammatory bowel disease-efficacy and safety.Aliment Pharmacol Ther,2010,32(8):939-952.
2Gazouli M,Roubelakis MG,Theodoropoulos GE.Stem cells as potential targeted therapy for inflammatory bowel disease.Inflamm Bowel Dis,2014,20(5):952-955.
3Clerici M,Cassinotti A,Onida F,et al.Immunomodulatory effects of unselected haematopoietic stem cells autotransplantation in refractory Crohn′s disease.Dig Liver Dis,2011,43(12):946-952.
4Alexander T,Thiel A,Rosen O,et al.Depletion of autoreactive immunologic memory followed by autologous hematopoietic stem cell transplantation in patients with refractory SLE induces long-term remission through de novo generation of a juvenile and tolerant immune system.Blood,2009,113(1):214-223.
5Hu C,Lv L,Liu D,et al.Treatment of Crohn′s disease complicated with myelodysplastic syndrome via allogeneic hematopoietic stem cell transplantation:case report and literature review.Clin J Gastroenterol,2014,7:299-304.
6Nishimoto M,Nakamae H,Watanabe K,et al.Successful treatment of both acute leukemia and active Crohn′s disease after allogeneic hematopoietic stem cell transplantation using reduced-intensity conditioning with fludarabine and busulfan:a case report.Transplant Proc,2013,45(7):2854-2857.
7Sonwalkar SA,James RM,Ahmad T,et al.Fulminant Crohn′s colitis after allogeneic stem cell transplantation.Gut,2003,52(10):1518-1521.
8Tyndall A,Gratwohl A.Blood and marrow stem cell transplants in auto-immune disease:a consensus report written on behalf of the European League against Rheumatism(EULAR)and the European Group for Blood and Marrow Transplantation(EBMT)Bone Marrow Transplant,1997,19(7):643-645.
9Lopez-Cubero SO,Sullivan KM,McDonald GB.Course of Crohn′s disease after allogeneic marrow transplantation.Gastroenterology,1998,114(3):433-440.
10 Ditschkowski M,Einsele H,Schwerdtfeger R,et al.Improvement of inflammatory bowel disease after allogeneic stem-cell transplantation.Transplantation,2003,75(10):1745-1747.
11 Burt RK,Traynor A,Oyama Y,et al.High-dose immune suppression and autologous hematopoietic stem cell transplantation in refractory Crohn disease.Blood,2003,101(5):2064-2066.
12 Oyama Y,Craig RM,Traynor AE,et al.Autologous hematopoietic stem cell transplantation in patients with refractory Crohn′s disease. Gastroenterology,2005,128(3):552-563.
13 CassinottiA,AnnaloroC,ArdizzoneS,etal.Autologous haematopoietic stem cell transplantation without CD34+cell selection in refractory Crohn′s disease.Gut,2008,57(2):211-217.
14 Burt RK,Craig RM,Milanetti F,et al.Autologous nonmyeloablative hematopoietic stem cell transplantation in patients with severe anti-TNF refractory Crohn disease:long-term follow-up.Blood,2010,116(26):6123-6132.
15 Hommes DW,Duijvestein M,Zelinkova Z,et al.Long-term follow-up of autologous hematopoietic stem cell transplantation for severe refractory Crohn′s disease.J Crohns Colitis,2011,5(6):543-549.
16 Hasselblatt P,Drognitz K,Potthoff K,et al.Remission of refractory Crohn′s disease by high-dose cyclophosphamide and autologous peripheral blood stem cell transplantation.Aliment Pharmacol Ther,2012,36(8):725-735.
17 Yu LZ,Qian S,Hong M,et al.A case of ulcerative colitis associated with autoimmune hemolytic anemia successfully treated by autologous hematopoietic stem cell transplantation.Am J Gastroenterol,2010,105(10):2302-2304.
18 Kotlarz D,Beier R,Murugan D,et al.Loss of interleukin-10 signaling and infantile inflammatory bowel disease:implications for diagnosis and therapy.Gastroenterology,2012,143(2):347-355.
19 Snowden JA,Saccardi R,Allez M,et al.Haematopoietic SCT in severe autoimmune diseases:updated guidelines of the European Group for Blood and Marrow Transplantation.Bone Marrow Transplant,2012,47(6):770-790.
20 Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement.Cytotherapy,2006,8(4):315-317.
21 Uccelli A,Laroni A,Freedman MS.Mesenchymal stem cells for the treatment of multiple sclerosis and other neurological diseases. Lancet Neurol,2011,10(7):649-656.
22 Burdon TJ,Paul A,Noiseux N,et al.Bone marrow stem cell derived paracrine factors for regenerative medicine:current perspectives and therapeutic potential.Bone Marrow Res,2011,2011:207326.
23 Melief SM,Zwaginga JJ,Fibbe WE,et al.Adipose tissue-derived multipotent stromal cells have a higher immunomodulatory capacity than their bone marrow-derived counterparts.Stem Cells Transl Med,2013,2(6):455-463.
24 Duijvestein M,Wildenberg ME,Welling MM,et al.Pretreatment with interferon-γ enhances the therapeutic activity of mesenchymal stromal cells in animal models of colitis.Stem Cells,2011,29(10):1549-1558.
25 Tanaka H,Arimura Y,Yabana T,et al.Myogenic lineage differentiated mesenchymal stem cells enhance recovery from dextran sulfate sodium-induced colitis in the rat.J Gastroenterol,2011,46(2):143-152.
26 Qu B,Xin GR,Zhao LX,et al.Testing stem cell therapy in a rat model of inflammatory bowel disease:role of bone marrow stem cells and stem cell factor in mucosal regeneration.PLoS One.2014,9(10):e107891.
27 Abdel Salam AG,Ata HM,Salman TM,et al.Potential therapeutic utility of mesenchymal stem cells in inflammatory bowel disease in mice.Int Immunopharmacol,2014,22(2):515-521.
28 de la Portilla F,Alba F,García-Olmo D,et al.Expanded allogeneic adipose-derived stem cells(eASCs)for the treatment of complex perianal fistula in Crohn′s disease:results from a multicenter phase I/IIa clinical trial.Int J Colorectal Dis,2013,28(3):313-323.
29 Cho YB,Lee WY,Park KJ,et al.Autologous adipose tissue-derived stem cells for the treatment of Crohn′s fistula:a phase I clinical study.Cell Transplant,2013,22(2):279-285.
30 Garcia-Olmo D,Herreros D,Pascual I,et al.Expanded adipose-derived stem cells for the treatment of complex perianal fistula:a phase II clinical trial.Dis Colon Rectum,2009,52(1):79-86.
31 García-Olmo D,García-Arranz M,Herreros D,et al.A phase I clinical trial of the treatment of Crohn′s fistula by adipose mesenchymal stem cell transplantation.Dis Colon Rectum,2005,48(7):1416-1423.
32 Ciccocioppo R,Bernardo ME,Sgarella A,et al.Autologous bone marrow-derived mesenchymal stromal cells in the treatment of fistulising Crohn′s disease.Gut,2011,60(6):788-798.
33 Duijvestein M,Vos AC,Roelofs H,et al.Autologous bone marrowderived mesenchymal stromal cell treatment for refractory luminal Crohn′s disease:results of a phase I study.Gut,2010,59(12):1662-1669.
34 Forbes GM,Sturm MJ,Leong RW,et al.A phase 2 study of allogeneic mesenchymal stromal cells for luminal Crohn′s disease refractory to biologic therapy.Clin Gastroenterol Hepatol.2014,12(1):64-71.
35 Liang J,Zhang H,Wang D,et al.Allogeneic mesenchymal stem cell transplantation in seven patients with refractory inflammatory bowel disease.Gut,2012,61(3):468-469.
36 García-Olmo D,García-Arranz M,García LG,et al.Autologous stem cell transplantation for treatment of rectovaginal fistula in perianal Crohn′s disease:a new cell-based therapy.Int J Colorectal Dis,2003,18(5):451-454.
37 Guadalajara H,Herreros D,De-La-Quintana P,et al.Long-term follow-up of patients undergoing adipose-derived adult stem cell administration to treat complex perianal fistulas.Int J Colorectal Dis,2012,27(5):595-600.
38 Herreros MD,Garcia-Arranz M,Guadalajara H,et al.Autologous expanded adipose-derived stem cells for the treatment of complex cryptoglandular perianal fistulas:a phase III randomized clinical trial(FATT 1:fistula Advanced Therapy Trial 1)and long-term evaluation.Dis Colon Rectum,2012,55(7):762-772.
39 Bassi G,Pacelli L,Carusone R,et al.Adipose-derived stromal cells(ASCs).Transfus Apher Sci,2012,47(2):193-198.
40 Nasuno M,Arimura Y,Nagaishi K,et al.Mesenchymal stem cells cancel azoxymethane-induced tumor initiation.Stem Cells,2014,32(4):913-925.
41 Chen Z,He X,He X,et al.Bone marrow mesenchymal stem cells ameliorate colitis-associated tumorigenesis in mice.Biochem Biophys Res Commun,2014,450(4):1402-1408.
42 Lalu MM,McIntyre L,Pugliese C,et al.Safety of cell therapy with mesenchymal stromal cells(SafeCell):a systematic review and meta-analysis of clinical trials.PLoS One,2012,7(10):e47559.
43 Nagaishi K,Arimura Y,Fujimiya M.Stem cell therapy for inflammatory bowel disease.J Gastroenterol,2015,50(3):280-286.
44 Sánchez L,Gutierrez-Aranda I,Ligero G,et al.Enrichment of human ESC-derived multipotent mesenchymal stem cells with immunosuppressive and anti-inflammatory properties capable to protect against experimental inflammatory bowel disease.Stem Cells,2011,29(2):251-262.
45 Srivastava AS,Feng Z,Mishra R,et al.Embryonic stem cells ameliorate piroxicam-induced colitis in IL10-/-KO mice.Biochem Biophys Res Commun,2007,361(4):953-959.
46 Murry CE,Keller G.Differentiation of embryonic stem cells to clinically relevant populations:lessons from embryonic development. Cell,2008,132(4):661-680.
2015-03-27)
(本文编辑:王新颖)
10.3969/j.issn.1672-2159.2015.04.055
510515南方医科大学南方医院消化内科
