小麦蛋白酶解制备多肽过程中褐变的抑制
2015-10-21戚春江谷中华田启梅马叶胜
戚春江,孙 超,谷中华,田启梅,马叶胜
(安徽瑞福祥食品有限公司,安徽亳州236800)
小麦蛋白酶解制备多肽过程中褐变的抑制
戚春江,孙超*,谷中华,田启梅,马叶胜
(安徽瑞福祥食品有限公司,安徽亳州236800)
为了抑制小麦蛋白在酶解制备小麦多肽过程中大量色素物质的生成,通过添加柠檬酸、L-半胱氨酸、葡萄糖氧化酶等抑制剂研究褐变抑制的规律,并通过单因素实验和Box-Behnken实验对褐变抑制工艺进行优化。结果表明,对褐变抑制率影响大小顺序依次为柠檬酸、L-半胱氨酸、葡萄糖氧化酶,且三者对褐变抑制率都呈显著影响(p<0.05)。响应面实验获得的优化工艺条件为:葡萄糖氧化酶0.02%、L-半胱氨酸0.75%、柠檬酸0.16%,在此条件下褐变抑制率可达44.35%。在本实验范围内建立的二次线性回归模型拟合较好,在一定条件下抑制剂能有效抑制褐变在小麦蛋白酶解过程中的发生,减少色素物质的生成,且不影响小麦蛋白的降解率。
小麦蛋白,酶解,抑制剂,褐变抑制
小麦蛋白是从小麦加工中得到的一种优质蛋白质,其蛋白质含量约为80%,具有极佳的延伸性、吸水性、薄膜成形等特性,但是,由于小麦蛋白的分子量较大,在水中的溶解性很差[1-3],严重影响了小麦蛋白在生产中的应用。近年来,国内相关企业通过酶法水解小麦蛋白来提高其营养保健价值及加工功能特性。小麦蛋白多肽不仅具有很好的溶解性、乳化性、起泡性及良好的流动性,而且在体内吸收快、利用率高。小麦蛋白经酶解生成的分子量较小的肽后还具有抑制血压、降低胆固醇、提高机体免疫力等生物活性作用。
但是植物蛋白酶解转化为多肽的过程中会伴随着大量色素物质的生成,造成得到的多肽混合物呈现出乌褐色乃至黑褐色,从而影响市场竞争力,因此在保证产品质量的前提下制备过程中必须抑制色素物质的生成[4]。目前,国内外的脱色方法多为采用活性炭粉末、硅藻土等吸附剂进行吸附脱色,虽然效果较为理想,但都是在色素物质生成以后再进行脱除,不仅增加了设备投资,且蛋白酶解液中多肽损失率较高,造成生产成本的增加,营养功能的降低[5]。根据近代波谱理论,有机物的颜色是由含共轭双键系统的生色团、发色团引起的,使用还原剂可与共轭双键形成加成物,使用氧化剂可有效破坏共轭双键体系,使用含硫亲核化合物可捕获自由基抑制类黑精的产生[6]。
由于氧化剂会破坏小麦多肽中的抗氧化成分[7],因此针对小麦蛋白酶解过程中的褐变原因,在生产过程中最大限度的抑制色素生成,本文研究了非氧化型抑制剂葡萄糖氧化酶(GOD)、L-半胱氨酸、柠檬酸的添加来抑制褐变的形成[8-11],以期对产业化利用抑制剂抑制褐变具有一定的指导和应用价值。
1 材料与方法
1.1材料与仪器
中性蛋白酶0.8L(EC 3.4.23.6,9.62×105U/g)、碱性蛋白酶2.4L(EC 3.4.21.62,4.3×105U/g) 丹麦NOVO公司;木瓜蛋白酶(EC 3.4.22.2,9.8×104U/g)AB酶制剂公司;小麦蛋白(蛋白含量81%,湿基) 安徽瑞福祥食品有限公司;L-半胱氨酸(食品级) 国药集团化学试剂有限公司;葡萄糖氧化酶(EC 1.1.3.4,3.52×104U/g)诺维信酶制剂公司;柠檬酸国药集团化学试剂有限公司;其他所用试剂均为国产分析纯。
TU-1810型紫外可见分光光度计北京普析通用仪器有限公司;PHS-2C型酸度计上海雷磁仪器厂;TG16-WS型高速离心机长沙平凡仪器仪表有限公司;PL303型电子天平梅特勒-托利多仪器(上海)有限公司;CU-420电热恒温水浴上海齐欣科学仪器有限公司;HJ-2A型磁力搅拌器江苏省金坛市医疗仪器厂。
1.2实验方法
1.2.1小麦多肽的制备参考谷中华等[12]的实验方法,并稍作改变。将小麦蛋白按3∶10(m/v)的比例混匀在水溶液中,均质后配制成质量浓度300g/L的悬浮液,调节至合适的pH与温度后加入一定比例抑制剂,在温度50℃的条件下,先用碱性蛋白酶在pH为8.5的条件下酶解1h,然后调节酶解溶液的pH至中性条件下用中性蛋白酶和木瓜蛋白酶酶解3h。待酶解反应结束后,在沸水浴中灭酶10m in,制得小麦蛋白的多肽酶解物。待上述酶解物冷却至室温条件下,酶解液经喷雾干燥后即得固体小麦多肽。
1.2.2小麦多肽降解率准确称取5g固体小麦多肽样品溶于250m L蒸馏水中,1500r/m in离心10m in。收集上清液并采用微量半自动凯氏定氮仪测定其蛋白质含量,以此计算小麦多肽的降解率(HR)。
HR(%)=(上清液蛋白含量/小麦蛋白蛋白含量)×100
1.2.3小麦多肽酶解液色素抑制率计算参照刘慧宾等[13]的实验方法,取上述蛋白酶解上清液用紫外可见分光光度计在色素的最大光谱吸收处(波长400nm)测其吸光度值。由测得的吸光度计算蛋白酶解液的色素抑制率,计算公式为:
色素抑制率(%)=(A-B)/A×100
式中:A—未经抑制色变的酶解液吸光度;B—抑制色变的酶解液吸光度。
1.3多肽降解率与色素抑制率的单因素实验
分别称取一定浓度梯度的非氧化性抑制剂,加入到各自的酶解溶液中,待酶解反应结束后,测定酶解物中多肽的降解率与色素的抑制率,以此确定较优的抑制剂的添加量。
1.4响应面实验设计
运用Box-Behnken实验设计方法对小麦蛋白酶解液褐变抑制效果进行响应面优化研究。以褐变抑制率为响应值(Y),建立模型方程并分析各设定因素及其交互作用的显著性,以此预测最佳的抑制褐变的各种因素水平组合,并以实验验证该组合是否最优。
按照Box-Behnken响应面实验设计原理,结合前述的研究结果,将葡萄糖氧化酶、L-半胱氨酸、柠檬酸这三个影响因素设计为三因素三水平的响应面法实验,具体响应面法实验的因素与水平值见表1。

表1 响应面实验因素与水平Table 4 Independent variables and their levels used in the response surface design
1.5数据处理
运用Design Expert 7.0软件对数据进行回归分析得到二次多项回归方程模型,其他数据采用SPASS 17.0进行ANOVA单因素方差分析及Ducan’s多重检验(p<0.05),数据以平均值±标准偏差的形式表示。
2 结果与讨论
2.1葡萄糖氧化酶对小麦蛋白酶解液色泽变化的影响

表2 葡萄糖氧化酶对小麦蛋白酶解液色泽变化的影响Table 2 Effectof GOD on color formation of hydrolysis of wheat protein
由表2可知,随着葡萄糖氧化酶添加量的增加,酶解液中小麦蛋白多肽的降解率没有显著的变化,但是酶解液的色素抑制率增加的较为显著(p<0.05),当葡萄糖氧化酶添加量为0.03%时,酶解液中色素抑制率达到最高水平,再进一步增加其添加量时,色素抑制率没有显著性的变化,因此在多肽酶解物制备的过程中,葡萄糖氧化酶的添加量为0.03%是一个较为优化的水平。葡萄糖氧化酶对蛋白酶解效率有一定的抑制作用,这主要是因为葡萄糖氧化酶在催化葡萄糖生成葡萄糖酸和过氧化氢时,过氧化氢将面筋蛋白分子中巯基氧化为二硫键,增强了面筋的网络结构[14-17],不利于酶解的进行,从而可以减缓美拉德反应,所以对色素有一定的抑制作用。
2.2L-半胱氨酸对小麦蛋白酶解液色泽变化的影响

表3 L-半胱氨酸对小麦蛋白酶解液色泽变化的影响Table 3 Effectof L-Cysteine on color formation of hydrolysis of wheat protein
如表3所示,L-半胱氨酸添加量在0%~1.4%内,随着添加量的增加,酶解液中小麦蛋白多肽的降解率变化显著,但呈现逐渐上升的趋势,而酶解液的色素抑制率呈现出显著性的增加趋势,当L-半胱氨酸的添加量为0.8%时,酶解物中色素的抑制率达到较为优化的水平,再进一步增加其添加量时,色素抑制率的变化幅度很小,因此在多肽酶解物制备的过程中,L-半胱氨酸的添加量为0.8%是一个较为优化的水平。由于L-半胱氨酸是一种脂肪族的含巯基的极性α-氨基酸,具有较强的还原性,能够与多酚氧化酶氧化成的醌类物质加成,生成无色稳定的L-半胱氨酸衍生物,还能将体系中的醌类及其衍生物还原成酚类,并通过自身氧化降低体系中的含氧量,从而到达抑制褐变的目的。同时L-半胱氨酸还能够通过改变小麦蛋白分子间或分子内的二硫键,减弱蛋白质结构的紧密性,使得蛋白质伸展开来,进而使得小麦蛋白内部原本隐藏的酶切位点暴露出来,加速了酶制剂的酶解进程[18],所以,L-半胱氨酸添加量在0~1.4%内,随着添加量的增加,降解率也有升高的趋势。
最新研究表明L-半胱氨酸抑制因美拉德反应引起的色泽变化的原理是作用于氨基化合物和还原糖缩合重排形成的Amadori产物,干扰肽和糖的Amadori形成,进而有效地阻止Amadori化合物的进一步生成脱氧还原酮以及环化,抑制呈色物质的生成,实现了色泽形成的抑制作用[10]。
2.3柠檬酸对小麦蛋白酶解液色泽变化的影响

表4 柠檬酸对小麦蛋白酶解液色泽变化的影响Table 4 Effectof citric acid on color formation of hydrolysis of wheat protein
随着柠檬酸添加量的增加,小麦蛋白多肽降解率呈现先增加后下降的趋势,因为适量的柠檬酸能够对小麦蛋白进行脱酰胺改性,使得酰胺基团中氨基变成高亲水的羧基,减少蛋白质分子内氢键的作用,增大分子间静电排斥,改善小麦蛋白溶解性,暴露出更多的酶切位点,从而提高了降解率[19],但是当柠檬酸添加量超过一定范围时,反应体系pH不再适合于酶解反应,降解率就会出现一定程度的下降。抑制褐变的效果随柠檬酸浓度的增加而增加,当柠檬酸的添加量为0.2%时,酶解物中色素的抑制率达到较为优化的水平,再进一步增加其添加量时,色素抑制率的变化幅度很小,这是因为柠檬酸降低了反应体系的pH,并螯合多酚氧化酶活性集团中的金属离子,降低多酚氧化酶活性,抑制酶促褐变及非酶促褐变[20],因此在多肽酶解物制备的过程中,柠檬酸的添加量为0.2%是一个较为优化的水平。
2.4复合抑制剂对小麦蛋白酶解液色泽变化的影响
对实验数据进行回归分析,得到褐变抑制率(Y)对自变量A(葡萄糖氧化酶)、B(L-半胱氨酸)、C(柠檬酸)的二次多项回归方程模型:Y=41.80+2.48A+ 2.58B+8.17C+0.87AB+0.61AC-0.36BC-1.78A2-1.29B2-2.92C2。实验结果的回归模型方程系数、方差分析,以及各因素的显著性检验的结果见表5、表6。
由表6结果可知,回归模型具有高度的显著性(p<0.01),说明实验所选用的二次多项模型具有高度的显著性。此外还可以明显看出A、B、C、C2有极显著影响(p<0.01),而F失拟=6.24,失拟项p=0.0546>0.05,表明失拟不显著。由此可以得出,该模型能够较好的描述各因素与响应值之间的真实关系,可以利用该回归方程确定最佳的分离纯化工艺条件。该回归模型的调整确定系数为R2=0.9736,即该模型能解释97.36%响应值的变化,表明此模型对实验的拟合度较好,可用于指导抑制剂抑制褐变结果的分析和预测。
根据响应面实验设计原理及分析[21],结合图1形状及表6结果分析,葡萄糖氧化酶、L-半胱氨酸、柠檬酸对褐变抑制率都呈显著影响,各因素对褐变抑制率的影响依次为:柠檬酸>L-半胱氨酸>葡萄糖氧化酶。同时,实验中所设置的3个因素各水平之间交互作用对褐变抑制率的影响不显著。
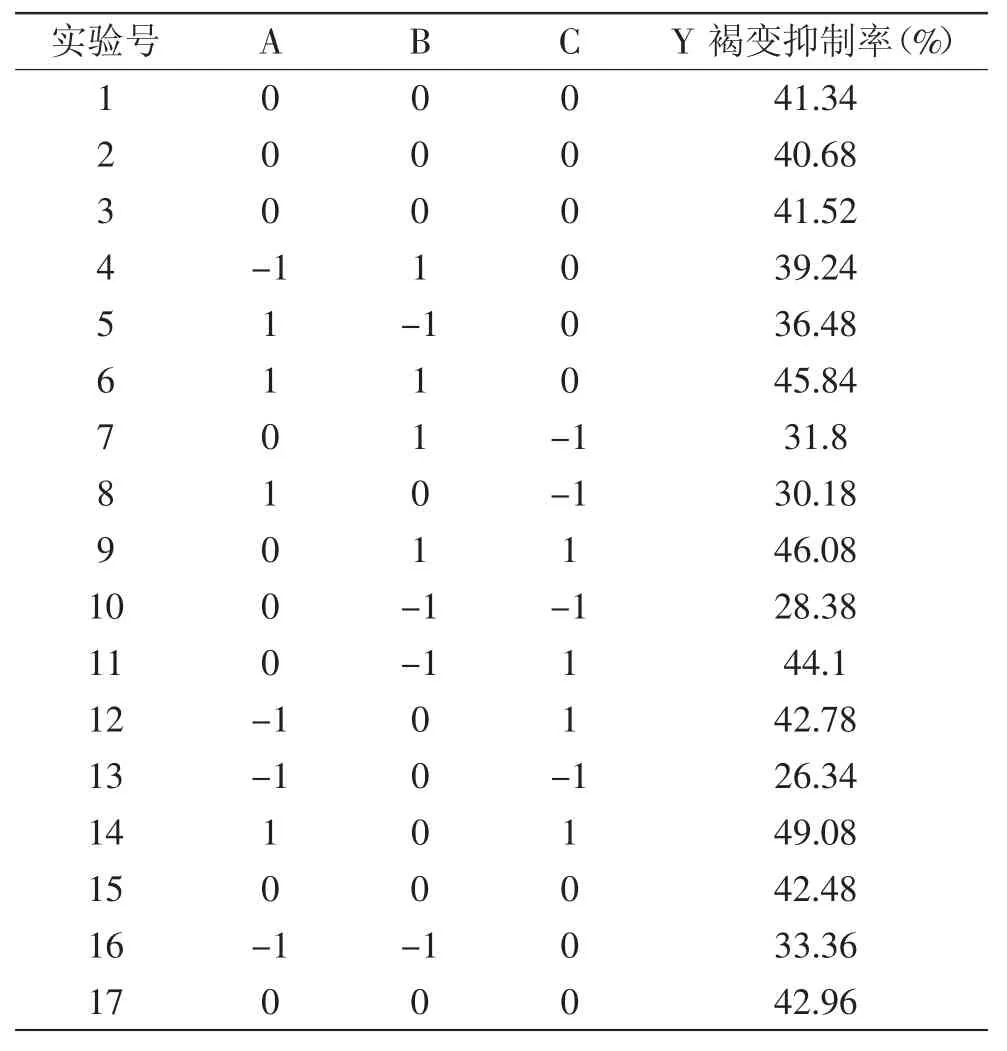
表5 实验设计与结果Table 5 The experimental design and results for response surface analysis

表6 实验结果的方差分析Table 6 Analysis of variance for the experimental results of response surface design
由图1可以看出,三种抑制剂的添加都能使得小麦蛋白多肽酶解液中色素的抑制率提高,对回归方程求一阶偏导,令其等于零,求解得各因素的最佳水平值,经过数据转换后得到抑制褐变的最佳条件为葡萄糖氧化酶添加量为0.02%、L-半胱氨酸0.75%、柠檬酸0.16%,在此条件下该工艺条件褐变抑制率的理论值为44.59%。在此条件下,进行三次平行实验,得到褐变抑制率的平均值为44.35%,与理论预测值的误差仅为0.54%,说明采用响应面法得到的优化结果可靠。

图1 两因素交互作用对抑制率影响的响应面图Fig.1 Response surface contour plots showing the interactive effectof three extraction conditions on the yield of inhibition rate
3 结论
通过单因素实验和Box-Behnken实验对小麦蛋白酶解制备多肽过程中褐变抑制工艺进行优化。实验结果表明所选择各因素对褐变抑制率影响大小顺序为:柠檬酸>L-半胱氨酸>葡萄糖氧化酶,且葡萄糖氧化酶、L-半胱氨酸、柠檬酸对褐变抑制率都具有显著影响(p<0.05)。通过响应面实验获得的优化工艺条件为:葡萄糖氧化酶添加量为0.02%、L-半胱氨酸0.75%、柠檬酸0.16%,在此条件下褐变抑制率可达44.35%。在本实验范围内建立的二次线性回归模型准确有效,对实验拟合较好,对产业化利用抑制剂抑制褐变具有一定的指导和应用价值。
[1]朱帆,徐广文,丁文平.基于管式模型的小麦面筋系统流变行为的解析[J].农业工程学报,2007,23(7):24.
[2]钟昔阳,姜绍通,潘丽军,等.超高压对麦醇溶蛋白/麦谷蛋白功能性质的影响[J].中国粮油学报,2000,24(8):8-11.
[3]Day L,Augustin MA,Batey IL,et al.Wheat-gluten uses and industry needs[J].Food Science and Technology,2006,17(2):82-90.
[4]朱海峰,班玉凤,赵薇,等.大豆蛋白酶解制寡肽过程中褐变的抑制[J].食品科技,2004,(5):14-16.
[5]姚成虎,王志耕,许飞,等.活性炭脱除猪血红蛋白酶解液色泽的技术研究[J].食品工业科技,2007,28(9):107-109.
[6]沈淑娟,方绮云.波谱分析的基本原理及应用[M].高等教育出版社,1988:1-33.
[7]黄达明,张玲,崔凤杰,等.小麦蛋白肽的纯化及抗氧化性研究[J].食品工业科技,2010(4):322-324.
[8]黄梅佳.大豆肽美拉德反应体系中色泽抑制及其机理研究[D].无锡:江南大学,2012.
[9]YILMAZER M,STEVENS J F,BUHLER D R.In vitro glucuronidation of xanthohumol,a flavonoid in hop and beer,by ratand human livermicrosomes[J].FEBSLetters,2001,491(3):252-256.
[10]Jan Hirsch,Valeri V Mossine,Milton S.The detection of some dicarbonyl intermediates arising from the degradation of Amadoricompounds(theMaillardreaction)[J].Feather Carbohydrate Research,1995,273(2):171-177.
[11]王雪,于鹏,周雪松,等.碱法制取米糠蛋白过程中美拉德反应的抑制[J].食品工业科技,2013,,34(12):279-283.
[12]谷中华,朱旭,钱海峰,等.小麦面筋蛋白酶解制备合适分子量小肽的研究[J].食品工业科技,2013,34(24):105-109.
[13]刘慧宾,赖其法,金承涛.活性炭对鱼蛋白水解液脱色效果的探究[J].食品科学,1998,19(7):17-20.
[14]王树春,刘秀华.葡萄糖氧化酶及其在食品工业上的应用[J].食品科技,2001(3):30-31.
[15]梅丛笑,方元超.葡萄糖氧化酶在食品及饮料中的应用[J].江苏食品与发酵,2000(1):22-25.
[16]Decamps K,Joye I J,Haltrich D,et al.Biochemical characteristics of Trametes multicolor pyranose oxidase and Aspergillus niger glucose oxidase and implications for their functionality in wheat flour dough[J].Food Chemistry,2012,131(4):1485-1492.
[17]赵晓芳,张宏福.葡萄糖氧化酶的功能及在畜牧业中的应用[J].广东饲料,2007,16(1):34-35.
[18]张海华.小麦面筋蛋白源谷氨酰胺肽的酶解制备、结构分析与生理活性研究[D].无锡:江南大学,2011.
[19]刘晓丹,黄璜,陈清西.苯甲酸对蘑菇酪氨酸酶抑制作用机理的研究[J].厦门大学学报,2003,42(1):102-106.
[20]RihaW E,Izzo H V,Zhang J,etal.Nonenzymatic deamidation of food proteins[J].Food Science and Nutrition,1996,36(6):225-255.
[21]乐龙,覃艳,王志祥.响应曲面法优化超声提取辣椒中辣椒红素的工艺研究[J].中国药科大学学报,2011,42(6):573-577.
Browning inhibition in polypeptides produced from the hydrolysis of wheat protein by proteases
QIChun-jiang,SUN Chao*,GU Zhong-hua,TIAN Qi-mei,MA Ye-sheng
(AnhuiRuifuxiang Food Co.,Ltd.,Bozhou 236800,China)
In order to inhibit p igment substance in the p rocess of p reparation of wheat g luten polypep tides,the law of inhibiting browning stain was studied by experiment of add ing d ifferent b rowning inhibitors.Itwas found thatb rowning inhibitors could effec tively control the b rown stain in hyd rolysis ofwheat p rotein and decrease the color value under the certain cond itions.The results showed that the fac tors affec ting the inhibiting browning rate of citric acid,L-cysteine,g lucose oxidase were offered in turn,and the three browning inhibitors had significant influences on b rowning stain(p<0.05).The op timal p rocess conditions were obtained by Box-Behnken design as follows:0.02%g lucose oxidase,L-cysteine 0.75%,citric acid 0.16%,under the cond ition of theoreticalbrowning inhibition rate was up to 44.35%.Themodelof the two linear regressions was good based on the range of the experiment,the inhibitors could inhibit b rowning in wheat p rotein enzymolysis p rocess under the certain of cond itions,reduce the formation of pigmentmaterials,and d id not influence the deg radation rate ofwheat p rotein.
wheat p rotein;enzymolysis;b rowning inhibitors;b rowning inhibition
TS201.1
A
1002-0306(2015)06-0171-05
10.13386/j.issn1002-0306.2015.06.030
2014-04-28
戚春江(1969-),男,本科,研究方向:食品工程。
孙超(1987-),男,硕士研究生,研究方向:生物工程。
国家高技术研究发展计划(863计划)(2013AA102201)。
