交联聚乙烯吡咯烷酮(PVPP)对山核桃多酚去除效果的毒理学评价
2015-10-21黄坚钦王向军钱永常
周 瑜,黄坚钦,高 飞,王向军,钱永常
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安311300)
交联聚乙烯吡咯烷酮(PVPP)对山核桃多酚去除效果的毒理学评价
周瑜,黄坚钦,高飞,王向军,钱永常*
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安311300)
有关植物源饮料和食品原料中多酚的去除已有报道,但大多数是用多酚去除率等理化指标进行效果评估,很少有用生物学毒性指标来评估多酚去除的效果。本研究以山核桃鲜果仁水提物为例,用PVPP吸附法去除山核桃水提物中的多酚,并利用神经细胞模型的毒理学检测,评估PVPP去除多酚的效果。数据显示,用PVPP吸附法处理山核桃水提物可以显著地去除多酚(p<0.01),以40mg PVPP对500mg山核桃仁的比例处理10min,多酚去除率可达到84.6%。进一步用荧光显微镜观察细胞形态和MTT法测定细胞活力的细胞毒理学测定表明,未经PVPP处理的山核桃水提物显著(p<0.01)地增加了人类SH-SY5Y-EGFP神经肿瘤细胞和人类HUVEC正常细胞的死亡率,并呈现明显的剂量效应;而PVPP去除多酚的山核桃水提物没有显著地引起SH-SY5Y-EGFP神经肿瘤细胞和HUVEC正常细胞的死亡(p>0.05)。以上结果表明山核桃鲜果仁水提物因为含有较多的多酚物质,对人类肿瘤细胞和正常细胞都具有显著的体外细胞毒性(p<0.01),以此为毒理学评估指标,发现PVPP处理可以大量地去除多酚,降低山核桃果仁水提物中多酚的细胞毒性。
山核桃,交联聚乙烯吡咯烷酮,毒理学评价,多酚
山核桃(Carya cathayensis Sarg.),胡桃科山核桃属落叶乔木,属胡桃科山核桃属,集中分布在中国江浙、湖南、湖北一带,是极具特色和经济价值的林产品。山核桃种仁含蛋白质7.8%~9.6%,含油率69.8%~74.01%,其中不饱和脂肪酸占88.38%~95.78%,并含有丰富的人体所必须的矿质元素。山核桃油味清香、营养丰富,是优良的食用油,具有润肺、滋补和康复之功效,还可降低血脂,预防心脑血管疾病。山核桃种仁中主要营养成分有17种氨基酸,8种脂肪酸,在营养价值和保健作用方面具有更独特的优点,是极具开发和研究价值的植物源天然产物[1-2]。
近几年,山核桃及其他植物源功能食品和保健产品增长十分迅速。然而对许多植物源天然产物而言,如山核桃、余甘果、三叶青、茶、铁皮石斛等,为了更好地提升其在食品饮料工业或生物技术领域的应用,要解决的一个难题是如何去除较高浓度的多酚类物质,其中山核桃多酚含量高达300~600mg/100g干质量核桃仁[3-5]。这些多酚类物质不仅能产生涩味,而且可引起饮料、啤酒、茶等产生沉淀,影响食品口感及美观。除此之外,多酚类物质还具有潜在的细胞毒性,大量研究证实较高浓度的多酚对体外肿瘤细胞株和正常细胞都具有显著的细胞毒性[6-9]。因此很多研究者用不同的方法对植物源天然产物提取物中多酚的去除效果和工艺进行了研究。但是,目前的研究只是着眼于植物源天然产物本身并对其多酚去除率等指标进行研究。在食品安全问题越发引人关注的今天,很少有人用生物学方法对去除多酚后植物源天然产物的细胞毒性进行毒理学评价。本研究拟以新鲜山核桃为原材料,通过PVPP吸附法去除其中的多酚,用人源神经肿瘤细胞系和人源正常细胞的体外细胞毒性为指标,对植物源天然产物的多酚去除效果进行评价。
1 材料与方法
1.1材料与仪器
当年新产未加工的新鲜山核桃临安天则山核桃有限公司采购;表达绿色荧光蛋白(EGFP)的人类神经母(SH-SY5Y-EGFP)细胞株、人脐静脉正常内皮细胞(HUVEC) 杭州纽龙生物科技有限公司;没食子酸、福林酚(Folin-Ciocalteu)试剂、PVPP(交联聚乙烯吡咯烷酮)、MTT试剂盒上海生工生物工程有限公司;DMEM/F12培养基、ECM培养基、青霉素(100mg/L)、链霉素(100mg/L) Gibco公司;96孔板康宁公司;胎牛血清杭州四季青生物工程有限公司。
M illi-Q超纯水系统美国M illipore公司;CF16RXⅡ高速冷冻离心机日本HITACHI公司;ClassⅡBSC生物安全柜新加坡ESCO公司;MCO-18AIC细胞培养箱日本三洋公司;PM I-3000B荧光倒置相差显微镜德国徕卡公司;MULTISKAN-FC酶标仪Thermo公司。
1.2实验方法
1.2.1山核桃水溶性成分的提取取山核桃仁15g,用液氮快速冷冻处理后研磨至粉状,加入0.2mol/L的磷酸盐缓冲液(phosphate buffer saline,PBS,pH7.2)30m L,置37℃摇床上以210r/m in的速度孵育2h。用移液器收集上清液,并用0.45μm滤膜处理上清液得到山核桃水提物溶液。
1.2.2标准曲线的绘制称取20mg没食子酸,用去离子水定容至100m L。从中分别取0.1、0.3、0.5、0.7、0.9、1.1、1.3和1.5m L,用去离子水定容至5m L,并各取1m L,在其中加入1m L福林酚试剂。静置1min后加入1mol/L的Na2CO3溶液2m L,置于30℃恒温水浴锅中显色1h。取300μL反应液加入96孔酶标板,于酶标仪上765nm波长处测定吸光度,每样品设置5个机械重复,用测得的吸光度扣除孔板本底后的平均值绘制标准曲线[10-12]。得到标准曲线的回归方程为:y=0.032x+ 0.063,回归系数为R2=0.999。
1.2.3总多酚的含量测定采用福林酚比色法[10-12]测定总多酚含量,即取1m L制备得到的水溶性成分待测样品,加入1m L福林酚试剂,静置1min,加入0.1g/m L的Na2CO3溶液2m L,置于30℃恒温水浴锅中孵育1h,于酶标仪中765nm处测定吸光度,并将吸光度拟合到标准曲线可得多酚含量。
1.2.4人类神经母瘤细胞(SH-SY5Y-EGFP)及人脐静脉正常内皮细胞(HUVEC)培养在专用的细胞瓶中培养,分别用含10%胎牛血清的DMEM/F12培养基和ECM培养基进行培养,细胞培养箱的条件设置为5%的环境CO2、37℃的环境温度,每两天更换一次培养基。
1.2.5山核桃水提液中多酚细胞毒性观察与测定取生长对数期细胞以每孔2×104细胞的初始密度接种于96孔板中,2d后更换细胞培养基。再加入未经PVPP处理的山核桃水提液,使山核桃水提液最终体积浓度分别为1%、5%、10%,对应的山核桃质量浓度(按生药量计算)分别为5、25和50mg/m L,空白对照组设置为加同样体积的PBS,阳性组则为100μg/m L的没食子酸。处理24h后,用倒置荧光电子显微镜观察SHSY5Y-EGFP细胞的存活量及状态(细胞带有EGFP,在荧光显微镜下可直接观察),并用MTT试剂盒法检测SH-SY5Y-EGFP和HUVEC细胞相对存活率[13-15]。
1.2.6PVPP对山核桃水提物中多酚的吸附处理分别称取10、20、30、40、50、60、70、80mg PVPP,加入1m L去离子水,室温摇床孵育过夜使PVPP充分吸涨。12000r/min离心5min并弃上清。每管中加入山核桃水提物1m L(山核桃仁0.5g),混匀之后摇床上处理1h,12000r/min离心5m in,收集上清。另取10m L干净离心管分别加入1m L上述上清,1m L福林酚试剂以及2m L浓度为1mol/L的新鲜Na2CO3溶液,30℃条件下处理1h,取300μL反应液加入96孔酶标板,于酶标仪上765nm波长处测定吸光度,每样品设置5个机械重复。参照1.2.2制作的标准曲线,计算PVPP不同量处理对山核桃水提物中多酚吸附的影响[16-17]。
称取8份40mg PVPP,分别加入1m L去离子水,室温摇床孵育过夜使PVPP充分吸涨。12000r/min离心5m in并弃尽上清。每管中加入山核桃水提物1m L(山核桃仁0.5g),混匀之后分别在摇床上孵育1、3、5、10、20、30、50、70m in,12000r/m in离心5m in,吸取上清。另取10m L干净离心管分别加入1m L上述上清,1m L福林酚试剂以及2m L浓度为1mol/L的新鲜Na2CO3溶液,30℃条件下处理1h,取300μL反应液加入96孔酶标板,于酶标仪上765nm波长处测定吸光度,每样品设置5个机械重复。参照1.2.2制作的标准曲线,计算PVPP不同处理时间对去除山核桃水提物中多酚的影响[16-17]。
1.3多酚去除率及细胞死亡率计算
分别测定处理前山核桃水提物中的多酚含量(A)和处理后山核桃水提物中的多酚含量(B);空白组细胞存活量(C),处理组细胞存活量(D)。按照下式计算:
多酚去除率(%)=(1-B/A)×100细胞死亡率(%)=(1-D/C)×100
1.4数据统计分析
应用SPSS l3.0统计软件进行分析,数据以x±s表示,各组之间的比较采用重复测量数据的多因素方差分析。
2 结果与分析
2.1总多酚含量测定
通过对比标准曲线,用福林酚法测得去壳未加工的新鲜山核桃仁中总多酚浓度为1.1mg/g。
2.2PVPP不同量处理对去除山核桃水提物中多酚的影响
不同量PVPP处理山核桃水提物后,用福林酚试剂法测定水提物中多酚残留来评估其去除效果。由图1可知,10mg PVPP处理1m L山核桃水提物(0.5g山核桃仁)明显地降低了水提物的多酚含量。随着PVPP量的增加,山核桃水提物中多酚去除率逐渐趋向饱和,PVPP的量达到40mg时多酚去除率不再明显增加。对不同量PVPP处理后山核桃水提物的多酚去除率进行测算,结果显示PVPP的量为10mg时多酚的去除率达到67%,随着PVPP量的增加,多酚的去除率快速上升。PVPP的量为40mg时去除率达到85%,此后去除率上升趋势变慢,PVPP的量为80mg时多酚去除率达到88.9%。
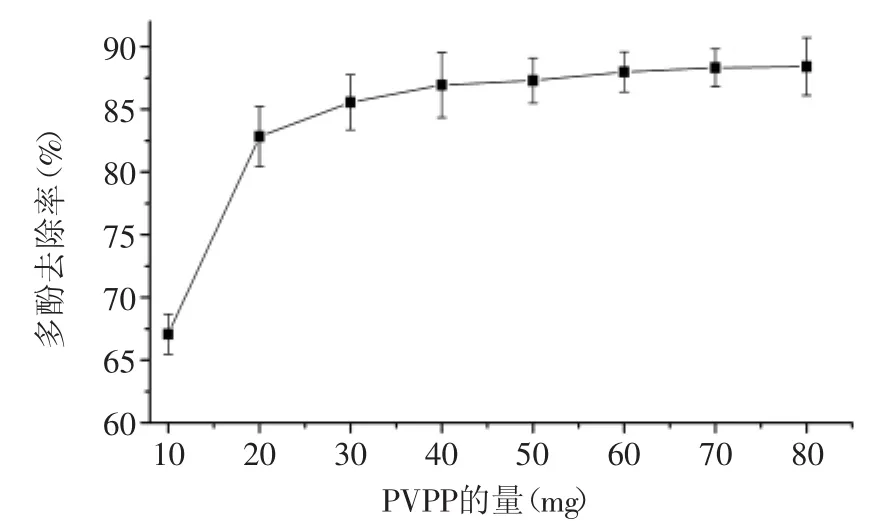
图1 PVPP不同量对多酚去除率的影响Fig.1 Effectof amountof PVPP treatment on removal of polyphenols
2.3PVPP不同处理时间对山核桃水提物中多酚吸附的影响
根据PVPP不同量去除山核桃水提物多酚含量的实验结果,选取40mg为后续实验的处理用量,对处理不同时间后山核桃水提物与福林酚反应液的吸光度计算多酚去除率。结果如图2所示,在1~10m in的处理时间段内,山核桃水提物中多酚的去除率明显增加,至10m in时去除率达到84.6%。此后多酚去除率随处理时间的增加并无太大变化。
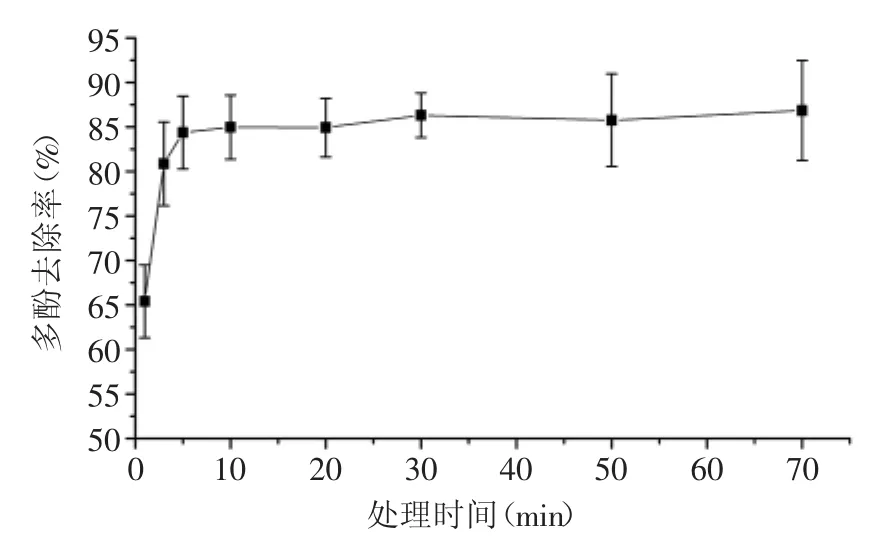
图2 PVPP不同处理时间对多酚去除率的影响Fig.2 Effectof time of PVPP treatmenton removal of polyphenols
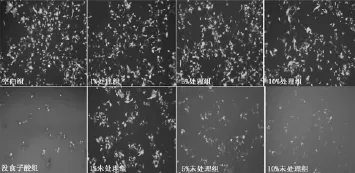
图3 PVPP处理前后山核桃水提液对SH-SY5Y-EGFP细胞的影响Fig.3 Effectof hickory nutswater extracts treated with and without PVPP on SH-SY5Y-EGFP cells
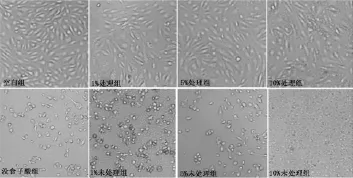
图4 PVPP处理前后山核桃水提液对HUVEC细胞的影响Fig.4 Effectof hickory nutswater extracts treated with and without PVPP on HUVEC cells
2.4PVPP处理前后山核桃水提液对SH-SY5YEGFP及HUVEC细胞存活的影响
PVPP处理前后的山核桃水提物用PBS稀释后,按浓度梯度处理细胞,使山核桃水提液最终体积浓度分别为1%、5%、10%,对应的山核桃质量浓度(按生药量计算)分别为5、25和50mg/m L。从图3可以看出,用PVPP未处理过的山核桃水提物处理SH-SY 5YEGFP细胞,其细胞的荧光强度明显低于PVPP处理过的山核桃水提物实验组。由图5A可以看出,通过MTT法检测细胞增殖抑制率发现,山核桃水提物PVPP未处理组的细胞存活率显著低于处理组(p<0.01),且有剂量效应。由图4和图5B可以看出,在HUVEC正常细胞中,山核桃水提物PVPP未处理组不仅细胞数量明显低于处理组,而且细胞形态明显畸形,MTT检测发现PVPP未处理组细胞存活率明显低于处理组(p<0.01),说明癌细胞株和正常细胞对山核桃多酚呈现同样的毒性反应。同时也说明PVPP处理前的山核桃水提液的细胞毒性要远远大于处理后的,因此用PVPP可以有效地将多酚去除到一个对细胞安全的水平。
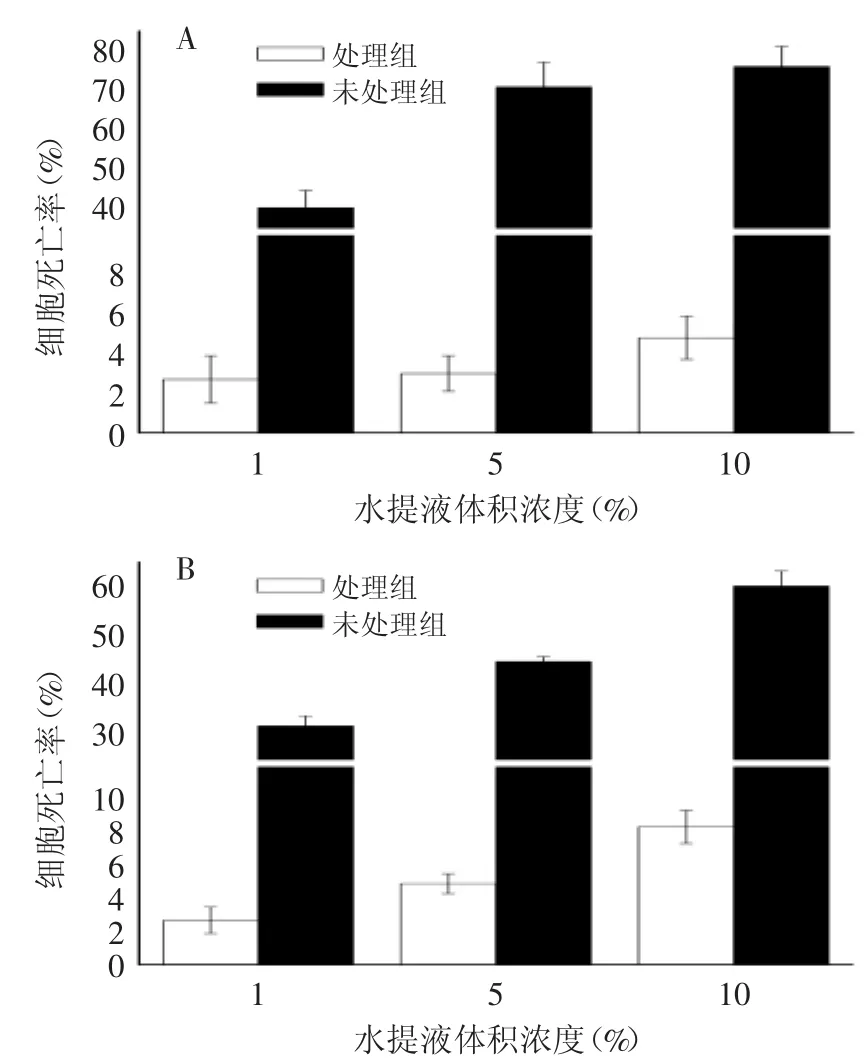
图5 PVPP处理前后山核桃水提液对SH-SY5Y-EGFP及HUVEC细胞死亡率的影响Fig.5 Effectof hickory nutswater extracts treated with and without PVPP on cells death rate
3 结论与讨论
本实验利用福林酚试剂法测得山核桃鲜果仁多酚含量。利用PVPP吸附技术对山核桃鲜果仁多酚含量进行去除,并研究PVPP用量及处理时间对山核桃多酚去除率的影响。分析得出新鲜山核桃仁中总多酚浓度为1.1mg/g,去除其多酚时,最佳量效比为8%(40mgPVPP/500mg鲜山核桃),时间为10m in,一次去除率可达84.6%。质量比为16%(80mgPVPP/500mg鲜山核桃),时间为1h时,去除率达到88.9%。对比之前关于多酚吸附的其他方法[18-20],发现PVPP有一系列优势,如表1所示。

表1 PVPP去除多酚的优势Table 1 The advantages of PVPP to remove polyphenols
再对比之前PVPP对其他植物多酚去除效率[21-22]的报道,比如对绿茶饮料中茶多酚以及余甘果汁中多酚的去除,其最佳去除率分别约为50%和89.2%,而本实验最佳去除率达到88.9%,用PVPP去除山核桃中多酚的效果已经达到之前文献报道的最佳水平。进一步,用生物毒理学评估方法验证PVPP去除多酚达到了一个生物安全的水平。
通过建立体外细胞模型,检测PVPP处理前后的山核桃水提液对细胞的毒性。未处理的山核桃水提物体积浓度为1%~10%时,无论是SH-SY5Y-EGFP肿瘤细胞还是HUVEC正常细胞均出现明显的细胞死亡,细胞死亡率从40%左右上升到70%左右,具有明显的剂量效应,说明山核桃含有的多酚对肿瘤细胞和正常细胞均具极为明显的细胞毒性。相反,PVPP处理后的山核桃鲜果仁水提物对肿瘤细胞和正常细胞均未呈现细胞毒性,说明肿瘤细胞株可以用来替代正常细胞进行细胞毒性评估,因为肿瘤细胞比正常细胞繁殖更快,所以可以节省毒理学评估时间,节约成本。PVPP处理方法可以将以山核桃为代表的植物源天然产物水溶性成分中多酚去除到一个对人体细胞安全的水平,有效消除可能会对人体产生的潜在危害。
由以上分析可知,按照文中的评估方法,用PVPP去除多酚并创新性地结合体外细胞模型,不仅得到更好的时间以及量效关系,而且体外细胞模型可以用来评估多酚去除到什么程度就达到安全水平,为工业界在多酚去除工艺上做到既降低成本又保障安全提供一种既科学,又简单、省钱的评价方法。为此类物质在食品和饮料等工业或者生物技术领域的进一步利用和研究提供了更多的选择,也为多酚研究开创了新思路。
[1]王冀平,李亚南,马建伟.山核桃仁中主要营养成分的研究[J].食品科学,1998,19(4):44-46.
[2]章亭洲.山核桃的营养、生物学特性及开发利用现状[J].食品与发酵工业,2006,32(4):90-93.
[3]Rubilar M,Pinelo M,Ihl M,et al.Murta Leaves(Ugnimolinae Turcz)as a source of antioxidant polyphenols.Alcoholic and aqueous extracts[J].Agric Food Chem,2006,54:59-64.
[4]Landbo A,MeyerA.Enzyme-assisted extraction ofantioxidative phenols from Black Currant juice press residues(Ribes nigrum)[J].JAgric Food Chem,2001,49(7):3169-3177.
[5]房祥军,郜海燕,陈杭君.山核桃加工、贮藏前后总多酚含量及其抗氧化活性的变化[J].食品科学,2011,32(5):104-107.
[6]谢冰芬,冯公侃,朱孝峰,等.茶多酚对人癌细胞和人体细胞增殖及凋亡的实验研究[J].癌症,2003,34(6):540-543.
[7]王立峰,陈静宜,谢慧慧,等.薏米多酚细胞抗氧化及HepG2细胞毒性和抗增殖作用[J].中国农业科学,2013,46(14):2990-3002.
[8]张国营,孙玉萍.茶多酚对人胚肺细胞和猴肾细胞毒性的实验研究[J].安徽农业大学学报,1994,21(4):454-457.
[9]卢虹玉,刘义,邵海艳,等.莫氏马尾藻褐藻(Sargassum mcclurei)多酚的抗氧化和抗肿瘤细胞增殖作用[J].食品科学,2012,33(23):103-106.
[10]AlexanderMR,Ana BG,Raúl ZR,etal.Rapid Folin-Ciocalteu method usingmicrotiter 96-well plate cartridges for solid phase extraction to assess urinary total phenolic compounds,as a biomarker of total polyphenols intake[J].Analytica Chimica Acta,2009,634(1):54-60.
[11]蔡文国,吴卫,邵金凤,等.Folin-Ciocalteu法测定鱼腥草多酚的含量[J].食品科学,2010,31(14):201-204.
[12]AtanassovaM,Georgieva S,Ivancheva1K,etal.Totalphenolic and total flavonoid contents,antioxidant capacity and biological contaminants in medicinal herbs[J].Journal of the University of Chemical Technology and Metallurgy,2011,46(1):81-88.
[13]Slavina EG,Chertkova AI,Zabotina TN,et al.Variations in the number of regulatory T Cells(CD4+CD25+)in patients with breastcancer during herceptin therapy[J].Bulletin of Experimental Biology and Medicine,2006,141(3):361-363.
[14]张建华,田志刚.MTT比色法测定细胞毒效应的应用进展[J].国外医学肿瘤学分册,1997,24(4):196-198.
[15]郝新保,张利朝,殷缨,等.MTT比色法测定细胞生长曲线[J].第四军医大学学报,1997,18(4):390-391.
[16]Simone GV,Cabral P,George GO.Study of the specificity of cross-povidone(PVPP)as binding agent in the quantification of polyphenolic compounds[J].Braz Chem Soc,2008,19(8):1627-1633.
[17]Yamauchi Y,Nakamura A,Kohno I,et al.Simple and rapid UVspectrophotometryofcaffeineinteacoupledwith sample pre-treatment using a cartridge column filled with polyvinylpolypyrrolidone(PVPP)[J].Chem Pharm Bull,2008,56(2):185-188.
[18]励建荣,周李婷,倪赟荣,等.PVPP吸附库拉索芦荟中多酚的研究[J].中国食品学报,2006,6(4):51-56.
[19]孔维宝,陆健,孙军勇,等.糖化阶段酚类氧化酶去除多酚物质的应用效果评价[J].西北师范大学学报,2008,44(4):106-110.
[20]叶俭慧,梁月荣.大孔吸附树脂分离茶多酚的研究[J].茶叶,2006,32(3):128-132.
[21]易国斌,崔英德,廖烈文,等.PVPP吸附绿茶饮料中茶多酚的研究[J].食品科学,2001,22(5):14-16.
[22]刘冬.PVPP吸附余甘果汁中多酚物质的研究[J].果树学报,2007,24(2):176-179.
Toxicologicalevaluation of polyphenol removal from hickory nuts by polyvinylpolypyrolidone(PVPP)
ZHOU Yu,HUANG Jian-qin,GAO Fei,WANG Xiang-jun,QIAN Yong-chang*
(Nurturing Station for the State Key Laboratory of Subtropical Silviculture,School of Forestry and Biotechnology,Zhejiang A&FUniversity,Lin’an 311300,China)
There were many studies for the removal of polyphenols in beverage and food industries which used fresh p lant-derived natural p roducts as raw materials.Most of the studies had used the percentage as an ind icator to assess the removal of polyphenols and there was a rare study to use any toxicological ind icator to evaluate the removal of p lant-derived polyphenols.This study used PVPP to remove polyphenols from water extracts of fresh hickory nuts and a neuronal cellmodel to test cytotoxicity of polyphenols for evaluation the efficiency of polyphenol removal by PVPP.Data showed that PVPP treatment could significantly remove polyphenols and the efficiency of removal reached at 84.6%when 40mg PVPP was used to treat the water extract from 500mg of fresh hickory nuts for 10m in.The efficiency of polyphenol removalwas further confirmed by observation of neuronal cellmorphology with fluorescencem icroscopy and determ ination of cell viability with MTT assay.Data showed that the extract w ithout PVPP treatment significantly(p<0.01)induced cell death in both SH-SY5Y-EGFP tumor cell line and HUVEC p rimary cell cultures in a dose-dependent manner.In contrast,the extractw ith PVPP treatmenthad no significant influence on viability of both SY5Y cells and HUVEC cells.These results suggested that the extrac t from hickory nuts contains polyphenols had showed a significant cytotoxicity to both tumor cells and normal cells.PVPP treatment could efficiently remove polyphenols and significantly reduced cytotoxicity ofwater extrac t from hickory nuts.
Carya cathayensis Sarg;polyvinylpolypyrolidone;toxicologicalevaluation;polyphenols
TS255.6
A
1002-0306(2015)06-0104-05
10.13386/j.issn1002-0306.2015.06.015
2014-06-09
周瑜(1989-),男,在读硕士研究生,主要从事天然产物活性因子的开发和利用方面的研究。
钱永常(1962-),男,博士,主要从事神经细胞生物学、肿瘤细胞生物学及天然药物方面的研究。
浙江农林大学科研发展基金(2012FR017);浙江省自然科学基金(LQ14H280007);浙江农林大学研究生科研创新基础项目(3122013240287)。
