翘嘴鳜miR—146a在胚胎发育过程中的表达及温度对其表达的影响
2015-10-20朱鑫易潭陈琳等
朱鑫 易潭 陈琳 等
摘要为了解翘嘴鳜胚胎发育中miR146a的表达规律以及温度对miR146a表达的影响,将翘嘴鳜受精卵分别在22 ℃和25 ℃水温下孵化,并利用实时荧光定量方法检测miR146a在各个发育阶段的表达.结果显示,在22 ℃孵化时,miR146a的表达在原肠期前处于较高水平且各时期表达没有显著性差异(P>0.05),在尾芽期后出现显著性降低(P<0.05),并在出膜时达到最低值;在25 ℃孵化时,miR146a的表达直到神经胚期仍处于较高水平且各时期表达没有显著性差异(P>0.05),发育进入尾芽期后表达显著降低(P<0.05),在肌效期达到最低值;miR146a在25 ℃水温孵化时的表达较22 ℃孵化同时期的表达都出现显著降低(P<0.05).研究表明,miR146a可能主要在胚胎发育后期起到调控胚胎发育的作用,在尾芽期后通过下调表达来促进胚胎的发育;并且温度能影响miR146a的表达,温度升高会降低miR146a在胚胎发育各个时期的表达,将有利于胚胎的发育.
关键词翘嘴鳜;miR146a;发育性表达;胚胎发育;温度调节
中图分类号Q752; S917.4文献标识码A文章编号10002537(2015)05002106
Expression Analysis of Siniperca Chuatsi MiR146a During Embryonic
Development and Effect of Temperature on MiR146a Expression
ZHU Xin 1,2#, YI Tan 1,2#, CHEN Lin1, WU Ping1, WANG Jianhua1,
CHEN Tao2, ZHANG Jianshe 1, CHU Wuying 1*
(1.Department of Biological and Environmental Engineering, Changsha University, Changsha 410003, China;
2. College of Veterinary Medicine, Hunan Agriculture University, Changsha 410128, China)
AbstractTo investigate the expression pattern of miR146a in embryonic developmental stage and the effect of temperature on the expression of miR146a in Siniperca chuatsi, the embryos were incubated under different temperatures and the expression of miR146a during embryonic developmental stage was detected by RTqPCR. The results showed that the expressions of miR146a were at a higher level and there is no significant difference before gastrula stage when the embryos incubated under 22 ℃ (P>0.05). And then the expressions of miR146a decreased after tailbud stage and decreased to the lowest level at larval stage (P<0.05). When the embryos incubated under 25 ℃, the expressions of miR146a were at a higher level and there is no significant difference till neurula stage (P>0.05). Once at tailbud stage, the expression of miR146a significantly decreased (P<0.05) and to the lowest level at muscular effect stage. It was interesting that the expressions of miR146a were significantly decreased at each developmental stage incubated under 25 ℃ when compared with 22 ℃ incubation (P<0.05). The results indicated that miR146a mainly involved in regulating embryonic development during later embryonic developmental stages and promoted embryonic development by down regulation its expression. In addition, the expressions of miR146a could decrease when the incubation temperature increased, and miR146a might involve in the effect of temperature on embryonic development of Siniperca chuatsi.
Key wordsSiniperca chuatsi; miR146a; developmental expression; embryonic development; temperature regulation
上世纪80年代,随着鳜鱼人工繁殖获得成功,我国开始大规模推广鳜鱼养殖,使之成为我国主要名贵养殖鱼类之一.翘嘴鳜因其肉质细嫩而鲜美,无小刺,且富含蛋白质,现已成为水产品市场的紧俏商品和水产养殖业的重要品种[1].深入探索翘嘴鳜的发育机制能够为鱼类发育生物学研究和水产养殖提供一些有价值的参考资料.
microRNA(miRNA) 是真核生物中一类进化上保守的参与调控基因表达的非编码小分子RNA.它通过与靶基因3′端非翻译区互补配对来促进靶mRNA 降解或翻译抑制,在基因表达中起着负调控作用[23].miRNA在胚胎发育、细胞增殖与分化、肿瘤发生和新成代谢等一系列生物过程中发挥重要的作用[45],但是有关miRNA在胚胎的表达特性及其在鱼类早期发育中的功能研究还很少.早期的研究表明miRNA对胚胎发育起到重要作用.鼠和人的胚胎干细胞在发育形成胚胎小体时,胚胎干细胞中一些特定的miRNA的表达会下调[67],缺失miRNA的鼠和斑马鱼胚胎在原肠胚形成、神经发育、体节形成时出现发育畸形甚至停滞[89].Kuang等[10]发现miR146a能够与Numb基因的3′端非翻译区互补配对,并且验证了miR146a能够抑制Numb的表达,而Numb调控的靶基因Notch参与一系列胚胎发育和形态形成过程,如成肌细胞的增殖、神经发育和体节形成[11],因此可以推断miR146a很可能参与调控胚胎的发育.
水温可以改变胚胎发育所需时间,较高的孵化温度能加速鱼类胚胎的发育速率,缩短孵化所需的时间[12].何利君[13]的研究显示,翘嘴鳜胚胎发育在21,25和27 ℃下,分别经过74.05,56.73和48.37 h孵育后出膜.在适宜温度范围内,适当升温可以加快胚胎发育的进程,但miRNA是否参与到水温影响翘嘴鳜胚胎发育的分子机制中尚不明确.在本研究中,我们分别在22和25℃水温下孵化翘嘴鳜的受精卵,并利用实时荧光定量的方法检测miR146a在几个重要发育阶段的表达,以此了解miR146a在胚胎发育进程中的表达模式及水温对miR146a表达的影响.
1材料与方法
1.1实验鱼
实验用亲鱼为湖南省水产科学研究所无病无伤、体格健壮、性腺成熟度好的翘嘴鳜,雌性个体为体质量1.0 kg以上的2~4龄鱼,雄性个体为体质量0.75 kg以上的2~4龄鱼.
湖南师范大学自然科学学报第38卷第5期朱鑫等:翘嘴鳜miR146a在胚胎发育过程中的表达及温度对其表达的影响1.2方法
1.2.1不同温度下胚胎的孵化和取样使用宁波市激素制品有限公司生产的绒毛膜促性腺激素(HCG)、促黄体生成素释放激素类似物和鲤鲫鱼脑垂体(PG)对亲鱼进行人工催产,操作方法参考刘希良[14]等文献报导.将受精卵置于直径15 cm的玻璃培养皿中,每个培养皿放200~300颗,分别在22 ℃和25 ℃的水温中孵化.期间,每半小时更换一次曝气水以保证溶氧充足.自受精后定时将翘嘴鳜鱼卵置于显微镜下观察翘嘴鳜胚胎的发育进程,当所有鱼卵半数以上达到某个时期时确定为到达该时期.当受精卵进入二细胞、囊胚、原肠、神经、尾芽、肌效、心搏、出膜期时,分别取适量受精卵置于装有Trizol的2 mL离心管中,每个时期取5管平行样,置于-20 ℃冰箱保存.
1.2.2总RNA的提取及cDNA第一链的合成保存于Trizol中的受精卵用破口枪头吸打数次,直至胚胎全部破碎,然后置于装有1 mL Trizol的离心管中.总RNA提取流程参照 Trizol Reagent(Invitrogen)说明书操作.所有总RNA样品分别取1 μL作为模板,按照One Step PrimeScript miRNA cDNA synthesis Kit试剂盒(宝生物公司,大连)的说明进行逆转录,合成的cDNA第一链,于4 ℃冰箱保存待用.
1.2.3实时荧光定量检测miR146a的表达根据Chu等[15]建立的鳜鱼miRNA文库,设计miR146a特异性的上游引物,以管家基因βactin作为胚胎发育阶段样品的内参基因[16].用Primer 5.0软件设计荧光定量PCR的引物,引物由上海铂尚生物公司合成 (见表1).取2 μL逆转录好的cDNA为模板,加入12.5 μL SYBR Premix Ex Taq Ⅱ (宝生物公司, 大连),1 μL特异性的上游引物和1 μL通用下游引物(UnimiR qPCR Primer, 10 μmol/L, 宝生物公司), 8.5 μL的无菌水,总体积25 μL,扩增反应在BioRad CFX96 system (USA)上进行.扩增条件为:(1)95 ℃预变性60 s;(2)扩增和定量,95 ℃变性5 s,60 ℃退火和延伸25 s,重复40个循环.(3) 绘制融解曲线(65~95 ℃,每0.1 ℃检测一次荧光值).
表1荧光定量检测用引物
Tab.1Primers used for miRNA detection
名称Name引物序列(5′→3′)miR146aFCGTGAGACTGATTCCATAGATGGβactinFGCCGTGACCTGACTGACTACCTβactinRCGCAAGACTCCATACCCAAGAAG注:miR146a定量所使用的下游引物为通用引物,序列未公布,购自宝生物工程(大连)有限公司(浓度:10 μmol/L).
1.2.4数据处理相对表达结果计算公式为R=2-ΔΔCt,其中Ct值为PCR反应循环阈值,ΔΔCt的计算公式为:ΔΔCt=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组.采用SPSS12.0软件对所得相对表达丰度数据进行单因素方差分析(Oneway ANOVA),并采用最小显著差数法(LSD)进行多重比较(P<0.05表示显著性差异,P<0.01表示差异极显著),结果以平均值±标准误差(Mean±SE,n=5)表示.
2结果与分析
2.1miR146a在胚胎发育性表达
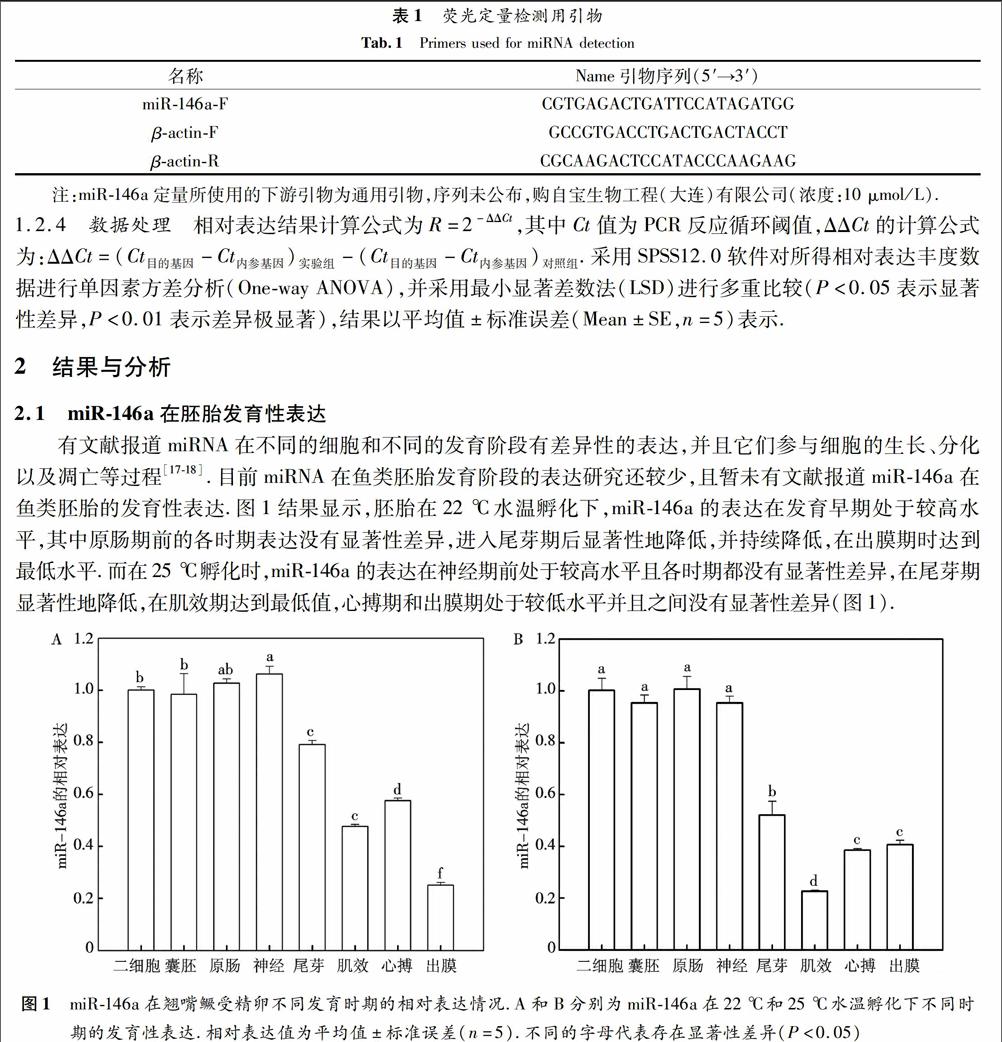
有文献报道miRNA在不同的细胞和不同的发育阶段有差异性的表达,并且它们参与细胞的生长、分化以及凋亡等过程[1718].目前miRNA在鱼类胚胎发育阶段的表达研究还较少,且暂未有文献报道miR146a在鱼类胚胎的发育性表达.图1结果显示,胚胎在22 ℃水温孵化下,miR146a的表达在发育早期处于较高水平,其中原肠期前的各时期表达没有显著性差异,进入尾芽期后显著性地降低,并持续降低,在出膜期时达到最低水平.而在25 ℃孵化时,miR146a的表达在神经期前处于较高水平且各时期都没有显著性差异,在尾芽期显著性地降低,在肌效期达到最低值,心搏期和出膜期处于较低水平并且之间没有显著性差异(图1).
图1miR146a在翘嘴鳜受精卵不同发育时期的相对表达情况.A和B分别为miR146a在22 ℃和25 ℃水温孵化下不同时期的发育性表达.相对表达值为平均值±标准误差(n=5).不同的字母代表存在显著性差异(P<0.05)
Fig.1Detection of miR146a expression at different embryonic developmental stages. A, B represent miR146a expressed at different embryonic developmental stages when incubation under 22 ℃and 25 ℃ water temperature, respectively. Values are the mean ±SE, n=5. The different letters indicate significant differences between columns (P<0.05)2.2miR146a在不同温度孵化下的差异性表达
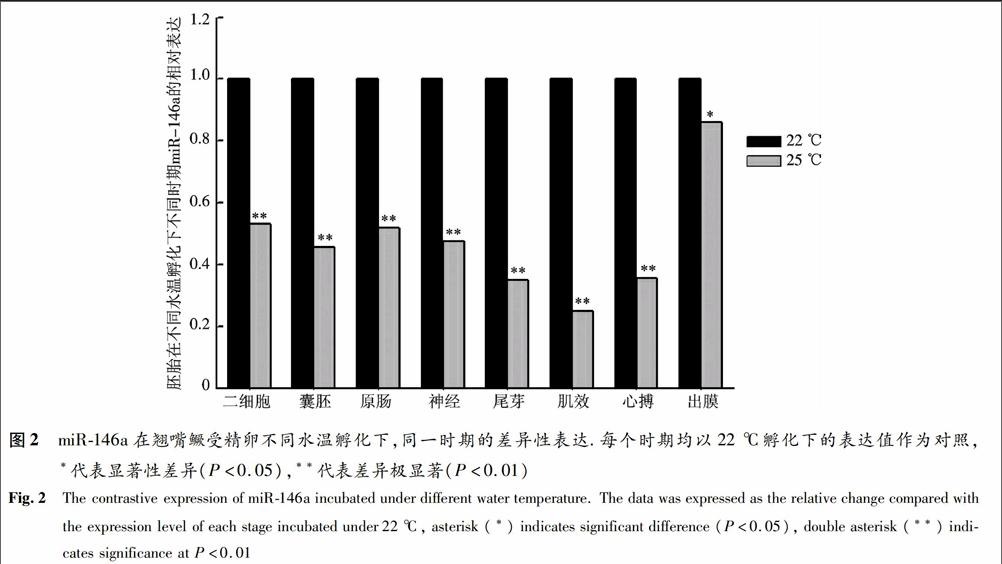
图1的结果显示温度影响了miRNA在胚胎发育中的表达.当比较胚胎发育同一时期在22 ℃和25 ℃水温孵化下miR146a的表达时发现,miR146a在25 ℃水温孵化时的表达较22 ℃孵化下同时期的表达都出现显著性地降低,其中除出膜期外,其他时期的表达差异极显著(P<0.01)(图2).
图2miR146a在翘嘴鳜受精卵不同水温孵化下,同一时期的差异性表达.每个时期均以22 ℃孵化下的表达值作为对照,*代表显著性差异(P<0.05),**代表差异极显著(P<0.01)
Fig.2The contrastive expression of miR146a incubated under different water temperature. The data was expressed as the relative change compared with the expression level of each stage incubated under 22 ℃, asterisk (*) indicates significant difference (P<0.05), double asterisk (**) indicates significance at P<0.013讨论
miR146a最初被发现在miRNA中参与天然免疫应答,当单核细胞受到细菌内毒素侵袭时,miR146a的表达显著上调[19].近年来许多文献报道,miR146a调节的许多靶基因参与了细胞分化的作用,但这些研究主要集中在分析miR146a对造血细胞的分化作用,而miR146a对胚胎发育的作用暂未见到相关报道.Kuang等[10]的研究验证了miR146a能够抑制Numb的表达.Numb是一种进化保守蛋白,其作为内源性细胞命运决定因子,对细胞分裂的命运起决定作用.Numb对胚胎早期神经和肌肉的发育作用也已经被证明[2021].Numb作为一个重要的细胞命运决定蛋白,参与Notch的负性调控,两者的平衡决定了细胞分化的方向[22].Notch信号转导通路作为生物发育分化中高度保守的通路,通过与配体的相互作用产生级联瀑布效应,参与细胞发育过程中分化方向的选择,并对细胞的增殖及凋亡也起着重要的作用[2324].Notch信号通路在胚胎发育中起到调节细胞增殖和决定细胞命运的作用[25].激活Notch信号能够促进肌原细胞的增殖,并降低MyoD和myogenin的表达来延迟成肌细胞的分化[26].miR146a及其靶基因的研究为进一步了解miR146a在胚胎发育中潜在的作用提供了一些重要的理论依据.
翘嘴鳜miR146a胚胎发育性表达结果显示,在22 ℃和25 ℃水温孵化下,miR146a表达规律趋势总体相似,但在不同温度下,miR146a的表达在几个时期经历了微调,说明温度确实影响了miR146a的表达.本文结果显示在胚胎发育早期(二细胞到神经胚期)miR146a的表达趋于稳定且处于较高水平(除22 ℃神经胚期有显著性上升),在进入尾芽期后表达都显著性地降低.Giraldez等[27]的研究表明miRNA的作用并不是在发育早期决定细胞的命运而是影响发育后期组织的发育和形成,而在神经胚期前胚胎的大部分组织器官还未开始分化,本文结果与Giraldez等的结论相符.胚胎发育经过神经胚期后,是器官形成的主要阶段,而本文结果显示miR146a的表达在尾芽期显著降低,表明miR146a的靶基因在这个阶段后受到其抑制作用将明显降低,并推测miR146a的靶基因的作用可能是促进胚胎发育的.Kuang等[10]的研究发现Numb是miR146a的靶基因,Numb能够促进胚胎早期神经和肌肉的发育[2021],Numb参与调节的Notch信号通路也对胚胎的发育起到重要的作用.
温度是影响鱼类胚胎发育的一个主要的外在因子.大量研究表明,在适宜温度下,随着水温的升高,胚胎的发育进程加快,孵化所需时间缩短[2829],但是miRNA的表达是否受到温度的影响还未见相关报道.从图2可以看出,在25 ℃孵化时,miR146a在不同阶段的表达都比22 ℃时出现显著性降低.这一结果表明温度升高能降低miR146a的表达,从而调节胚胎的发育.有研究表明肌纤维增生和增粗的速率在较高的水温孵化时都会升高,但是温度对肌纤维的增粗效果强于增生[5].在25 ℃孵化时,miR146a的表达显著性降低能增强Numb对Notch信号通路的抑制作用,促进成肌细胞的分化,从而有利于胚胎中肌肉组织形成.这一结果表明了miR146a在参与水温调节胚胎发育的过程中是通过下调来促进发育的.
4结论
研究表明,miR146a在胚胎发育早期(神经期前)的作用不明显.在胚胎发育后期(尾芽期至出膜),miR146a通过下调其表达来促进胚胎的发育.而水温升高能显著降低miR146a在胚胎发育每个时期的表达,减少其对靶基因Numb的抑制,发挥促进细胞分化的作用,从而有利于胚胎发育的进程.
参考文献:
[1]李玉珑,农小献,李虹辉,等. 鳜鱼生肌调节因子 MyoD 的克隆及其发育表达分析[J].湖南师范大学自然科学学报, 2013,36(4):6368.
[2]LIU J. Control of protein synthesis and mRNA degradation by microRNAs[J]. Curr Opin Cell Biol, 2008,20(2):214221.
[3]XIE X, LU J, KULBOKAS E J, et al. Systematic discovery of regulatory motifs in human promoters and 3′UTRs by comparison of several mammals[J]. Nature, 2005,434(7031):338345.
[4]FU Y, SHI Z, WU M, et al. Identification and differential expression of microRNAs during metamorphosis of the Japanese flounder (Paralichthys olivaceus)[J]. PLoS One, 2011,6(7):e22957.
[5]SONG L, TUAN R S. MicroRNAs and cell differentiation in mammalian development[J]. Birth Defects Res C Embryo Today, 2006,78(2):140149.
[6]HOUBAVIY H B, MURRAY M F, SHARP P A. Embryonic stem cellspecific microRNAs[J]. Dev Cell, 2003,5(2):351358.
[7]SUH M R, LEE Y, KIM J Y, et al. Human embryonic stem cells express a unique set of microRNAs[J]. Dev Biol, 2004,270(2):488498.
[8]BERNSTEIN E, KIM S Y, CARMELL M A, et al. Dicer is essential for mouse development[J]. Nat Genet, 2003,35(3):215217.
[9]GIRALDEZ A J, CINALLI R M, GLASNER M E, et al. MicroRNAs regulate brain morphogenesis in zebrafish[J]. Science, 2005,308(5723):833838.
[10]KUANG W, TAN J, DUAN Y, et al. Cyclic stretch induced miR146a upregulation delays C2C12 myogenic differentiation through inhibition of Numb[J]. Biochem Biophys Res Commun, 2009,378(2):259263.
[11]CONBOY I M, RANDO T A. The regulation of Notch signaling controls satellite cell activation and cell fate determination in postnatal myogenesis[J]. Dev Cell, 2002,3(3):397409.
[12]KINNE O, KINNE E M. Rates of development in embryos of a cyprinodont fish exposed to different temperaturesalinityoxygen combinations[J]. Can J Zool, 1962,40(2):231253.
[13]何利君. 温度对鳜鱼胚胎发育的影响[J]. 四川畜牧兽医学院学报, 1999,13(4):1922.
[14]刘希良,宾石玉,王开卓,等. 翘嘴鳜的人工繁殖与胚胎发育观察[J].广西师范大学学报:自然科学版, 2013,31(2):100106.
[15]CHU W Y, LIU L S, LI Y L, et al. Systematic identification and differential expression profiling of microRNAs from white and red muscles of Siniperca chuatsi[J]. Curr Mol Med, 2013,13(8):13971407.
[16]ZHOU R X, MENG T, MENG H B, et al. Selection of reference genes in transcription analysis of gene expression of the Mandarin fish, Siniperca chuasti[J]. Zool Res, 2010,31(2):141146.
[17]NEILSON J R, ZHENG G X, BURGE C B, et al. Dynamic regulation of miRNA expression in ordered stages of cellular development[J]. Genes Dev, 2007,21(5):578589.
[18]MCCARTHYJ J, ESSER K A. MicroRNA1 and microRNA133a expression are decreased during skeletal muscle hypertrophy[J]. J Appl Physiol, 2007,102(1):306313.
[19]TAGANOV K D, BOLDIN M P, CHANG K J, et al. NFkappaBdependent induction of microRNA miR146, an inhibitor targeted to signaling proteins of innate immune responses[J]. Proc Natl Acad Sci U S A, 2006, 103(33):1248112486.
[20]PETERSEN P H, ZOU K, HWANG J K, et al. Progenitor cell maintenance requires numb and numblike during mouse neurogenesis[J]. Nature, 2002,419(6910):929934.
[21]CONBOY I M, RANDO T A. The regulation of Notch signaling controls satellite cell activation and cell fate determination in postnatal myogenesis[J]. Dev Cell, 2002,3(3):397409.
[22]LIU X H, YAO S, QIAO R F, et al. Nandrolone reduces activation of Notch signaling in denervated muscle associated with increased Numb CXpression[J]. Biochem Biophys Res Commun, 2011,414(1):165169.
[23]LEONG K G, KARSAN A. Recent insishts into the role of Notch signaling in tumorigenesis[J]. Blood, 2006,107(6):22232233.
[24]NICOLAS M, WOLFER A, RAJ K, et al. Notchl functions as atumor suppressor in mouse skin[J]. Nat genet, 2003,33(3):416421.
[25]ARTAVANISTSAKONAS S, RAND M D, LAKE R J. Notch signaling: cell fate control and signal integration in development[J]. Science, 1999,284(5415):770776.
[26]NOFZIGER D, MIYAMOTO A, LYONS K M, et al. Notch signaling imposes two distinct blocks in the differentiation of C2C12 myoblasts[J]. Development, 1999,126(8):16891702.
[27]GIRALDEZ A J, CINALLI R M, GLASNER M E, et al. MicroRNAs regulate brain morphogenesis in zebrafish[J]. Science, 2005,308(5723):833838.
[28]胡振禧,黄洪贵,吴妹英,等. 温度对斑鳜胚胎发育的影响[J]. 淡水渔业, 2014,44(3):104107.
[29]陈昆慈,朱新平,杜合军,等. 温度和盐度对宝石鲈胚胎发育的影响[J].中国水产科学, 2007,14(6):10321037.
(编辑王健)