基于巯基-β-环糊精手性识别多巴对映体研究
2015-10-19郭冬梅冉佩瑶王庆红许娟娟傅英姿
郭冬梅,冉佩瑶,王庆红,许娟娟,傅英姿
(西南大学化学化工学院,重庆400715)
0 引言
手性是自然界和生物体的基本属性,酶、蛋白质、DNA和受体等生物大分子广泛存在于生物体中,构成了庞大且复杂的手性系统。手性药物进入生物体后,会与体内大分子进行严格的手性匹配,从而导致手性药物对映体的生理活性和药理作用存在显著差异。大多数情况下,一种对映异构体具有药理活性,而另一种却可能产生副作用,甚至毒性[1-3]。例如,作为多巴胺合成前体的L-多巴常被用于治疗帕金森病,但真正具有治疗作用的却是多巴胺,而多巴胺不能跨越脑屏障进入作用部位,因此只能服用多巴,再由体内的脱羧酶将其催化脱羧释放出多巴胺。然而脱羧酶仅对L-多巴具有脱羧作用,对D-多巴不具有脱羧作用。如果服用多巴消旋体,D-多巴将不能被酶代谢,会在体内聚集,从而对人体造成伤害[4]。因此,发展简单、快速、可靠和实用的手性药物对映体纯度分析和含量检测技术成为医药学和生物学等领域的研究热点。在众多的手性识别技术中,手性电化学传感器因具有操作简单、灵敏度和选择性高、成本低等优点,受到研究者的广泛关注[5]。
环糊精(cyclodextrin,CDs)作为手性分离和分析中重要的手性选择剂,具有高的分子选择性和对映选择性。它是由D-吡喃葡糖糖单元通过α-1,4-糖苷键连接而成的环状低聚糖,具有外亲水内疏水结构,其疏水空腔可以通过非共价键作用包络与其腔体形状、大小适宜的客体分子,形成主-客体包埋复合物,实现对有机分子、无机分子和生物分子等的识别[6-7]。根据D-吡喃葡糖糖单元个数的不同,环糊精主要有α-环糊精(α-CD),β-环糊精(β-CD)和 γ-环糊精(γ-CD)三种类型[8],其中β-CD在手性识别研究中应用最为广泛。
石墨烯(graphene)作为一种新型二维碳纳米材料,具有大的比表面积、优异的导电性能和高的稳定性,近年来在电化学传感器的构建上得到大量应用[9-11]。然而石墨烯难分散、易团聚的特点限制了其应用,因此得到分散性和稳定性良好的石墨烯溶液,仍是当今的研究难题之一。最近,Yang等[12]发现了一种用离子液体还原氧化石墨烯的方法,制得了分散性良好和电子传递能力优异的石墨烯衍生物。离子液体是一种亲水性强、电子传递能力好的绿色溶剂。氨基化的吡啶类离子液体具有带正电的官能团,可以通过氨基的还原作用同氧化石墨烯中的环氧基偶联,在还原氧化石墨烯的同时,引入较强的表面电荷,极大地改善了石墨烯的分散性,并加强其电子传递能力。
在此,首先通过氨基化离子液体(IL-NH2)还原氧化石墨烯(GO)制得离子液体修饰的氧化石墨烯复合物(IL-rGO),然后将其滴涂于玻碳电极表面,再电沉积纳米金,最后通过金-硫键结合巯基-β-环糊精(β-CD-SH),构建了一种新型的手性电化学传感器。该传感器可用于手性分子或手性药物的识别研究或对映体纯度分析。
1 实验部分
1.1 试剂和仪器
L-多巴 (99%)、D-多巴 (99%)和氯金酸(HAuCl4·xH2O,99.9%)均购于阿拉丁试剂公司(中国,上海),1-氨丙基-3-甲基咪唑氯盐离子液体(IL-NH2,>98%)购于上海成捷化学有限公司(中国,上海),氧化石墨烯(GO)购于南京先锋纳米材料科技有限公司(中国,南京),巯基-β-环糊精(β-CD-SH)购于山东滨州智源生物科技有限公司(中国,山东)。其余化学试剂均为分析纯,无需进一步纯化即可直接使用。所有实验用水均为二次蒸馏水。
所有电化学测试均在CHI 620D电化学工作站(中国,上海辰华)上进行。标准三电极体系中,以饱和银/氯化银电极(Ag/AgCl)为参比电极,铂丝电极为对电极,玻碳电极为工作电极。
1.2 IL-rGO复合物的制备
IL-rGO复合物的制备参照文献 [13]:称取25 mg GO分散于50 mL蒸馏水中,然后依次加入50 mg IL-NH2和50 mg KOH,超声至分散均匀,再将该混合溶液于80°C搅拌反应24 h。最后将所得的石墨烯复合物用乙醇和水离心洗涤数次,再分散于50 mL蒸馏水中。
1.3 传感界面的制备
裸玻碳电极(GCE,Φ=4mm)分别用 1.0、0.3 和0.05 μm的Al2O3抛光粉打磨抛光,依次在乙醇和二次蒸馏水中超声清洗,自然晾干。随后,在玻碳电极表面滴涂8 μL IL-rGO分散液,自然晾干。然后将电极置于1%HAuCl4中恒电位 (电位为-0.2 V)沉积180 s,取出并用蒸馏水清洗干净。最后将电极置于2.0 mg/mL β-CD-SH溶液中于4℃下浸泡过夜。测试时,用蒸馏水冲洗掉电极表面物理吸附的β-CD-SH,晾干后置于用0.25 mol/L硫酸溶液配制的D-多巴或L-多巴中进行DPV扫描测试。电极构建示意图如图1A所示。
2 结果与讨论
2.1 不同修饰电极的电化学特性
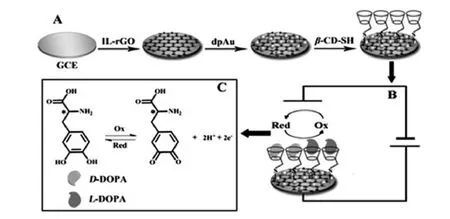
图1 (A)传感界面构建过程图,(B)传感界面和多巴对映体作用示意图,(C)多巴的氧化还原机理Fig.1 (A)Fabrication of the sensing platform,(B)Schematic illustration of the interaction between the sensing interface and DOPA enantiomers,(C)The oxidation-reduction reaction of DOPA
循环伏安技术(CV)是研究电极表面特性的常用方法,实验中采用其研究了电极修饰过程中电极表面电化学特性的变化。电化学测试在5.0×10-3mol/L[Fe(CN)6]4-/3-溶液中进行,扫速为0.1 V/s。如图2所示,裸GCE呈现一对可逆的氧化还原峰(曲线a)。滴涂IL-rGO后,峰电流响应明显增大,且氧化还原峰不再对称,还原峰电流明显高于氧化峰电流,这可能是IL-rGO带正电所致(曲线b)。电沉积纳米金后,氧化还原峰电流均明显增加,且氧化还原峰可逆对称(曲线c),可能是电沉积的纳米金带负电荷,中和了石墨烯表面的正电荷,从而导致氧化还原峰对称可逆。自组装β-CD-SH后,氧化还原峰电流显著减小(曲线d),这是由于β-CD阻碍电子的传递。

图2 电极修饰过程的CV响应:(a)裸GCE,(b)IL-rGO/GCE,(c)dpAu/IL-rGO/GCE,(d)β-CD-SH/dpAu/IL-rGO/GCEFig.2 CVs for different electrodes:(a)bare GCE,(b)IL-rGO/GCE,(c)dpAu/IL-rGO/GCE,(d)β-CD-SH/dpAu/IL-rGO/GCE
2.2 多巴对映异构体在不同修饰电极上的DPV响应
采用DPV技术研究了5.0×10-3mol/L多巴溶液(0.25 mol/L H2SO4溶液配制)在不同修饰电极表面的电化学行为。如图3所示,两种构型的多巴对映体在裸 GCE(图A)和IL-rGO/GCE(图B)上的DPV响应曲线几乎重合,说明这两种电极对多巴对映异构体无识别作用;但是多巴对映异构体在IL-rGO/GCE上的电流响应显著增强,说明IL-rGO能够促进多巴对映体在电极上的电子转移。在dpAu/IL-rGO/GCE上(图C),电流响应进一步增强,并出现了微小的电流信号差异,由此说明电沉积纳米金可进一步促进多巴的电子转移,且对两种构型的电子转移促进作用有微小的差别,更利于D-多巴的电子转移,从而使得D-多巴的电流响应信号更大。在dpAu/IL-rGO/GCE上自组装 β-CD-SH后,D-多巴 (曲线b)和L-多巴(曲线a)的电流响应均减小,说明环糊精的组装阻碍了多巴在电极上的电子转移,且对两者的电子阻碍作用不同,表现为更利于D-多巴在电极上的电子转移,因此D-多巴的电流响应信号明显大于L-多巴。实验结果表明:β-CD-SH可以有效识别多巴对映异构体。
2.3 实验条件的优化
2.3.1 电沉积纳米金时间

图3 L-多巴(a)和D-多巴(b)在不同电极表面的DPV响应:(A)裸GCE,(B)IL-rGO/GCE,(C)dpAu/IL-rGO/GCE,(D)β-CD-SH/dpAu/IL-rGO/GCEFig.3 DPVs for redox reactions of L-DOPA(a)and D-DOPA(b)on different electrodes:(A)bare GCE,(B)IL-rGO/GCE,(C)dpAu/IL-rGO/GCE,(D)β-CD-SH/dpAu/IL-rGO/GCE
纳米金层的厚度会对电子的转移产生影响,而电沉积时间是影响纳米金层厚度的重要因素。因此,探讨了电沉积时间对铁氰化钾电子转移的影响。如图4A所示,随着电沉积时间的增加,铁氰化钾的峰电流不断增大,180 s时,达到最大,说明电沉积纳米金量达到饱和。超过180 s后,随着时间的增加,峰电流反而下降,可能是由于纳米金层太厚,反而阻碍电子的转移。因此,选用180 s作为最佳沉积时间。
2.3.2 pH的影响

图4 实验条件优化:(A)电沉积纳米金时间,(B)pH的影响Fig.4 Optimization of experiment condition:(A)electrodeposition time of nanoAu,(B)effect of pH
由示意图1C可知,多巴的氧化还原反应有质子的参与,pH值会影响其氧化还原过程。当pH大于7.0时,多巴发生的是化学氧化反应而不是电化学氧化反应[14]。因此,采用DPV研究了在酸性条件下pH值对多巴对映体氧化反应的影响。 如图 4B 所示,在 pH 为 0.30~5.0 范围内,随着pH值的增加,峰电势负移,而峰电流降低。由此说明,质子的参与在多巴的氧化还原过程中起到了至关重要的作用。实验选用0.60作为识别多巴对映体的最佳pH。
2.4 线性

图5 峰电流与多巴对映体的响应关系:(a)L-多巴,(b)D-多巴Fig.5 Dependence of the peak current on the concentration of(a)L-DOPA and(b)D-DOPA in 0.25 mol/L H2SO4
在最佳实验条件下,用修饰电极检测不同浓度下L-多巴和D-多巴的电流响应。如图5所示,在 1.0×10-5mol/L 至 5.0×10-3mol/L 浓度范围内,L-多巴(曲线a)和D-多巴(曲线b)的峰电流信号与其浓度呈线性关系,线性方程分别为Ip=0.0083+30.75cL-DOPA(r2=0.9966)和 Ip=0.0110+47.01cD-DOPA(r2=0.9960),且检出限分别为 3.3×10-6mol/L 和 2.1×10-6mol/L(S/N=3)。 同时,在该浓度范围内,D-多巴的电流响应始终大于L-多巴,由此说明该传感器可以用于多巴对映异构体手性识别。
2.5 传感器的重现性和稳定性
为了测试该传感器的重现性,采用差分脉冲伏安法测试五对修饰电极对多巴对映体的识别差异,结果发现,五对电极的峰电流差接近(RSD=3.9%),说明该传感器具有较好的重现性。该传感器的稳定性采用循环伏安法进行测定,在多巴溶液中循环扫描50圈后,峰电流下降了4.9%。传感器的长期稳定性也进行了测定,当修饰电极不使用时,在4℃冰箱里储存,放置一周和两周,峰电流强度分别下降到初始电流的96.7%(RSD=4.5%)和 89.6%(RSD=5.1%),说明该传感器具有一定的稳定性。
2.6 不同电化学方法对比
将已有识别多巴对映体的电化学方法作对比,实验结果见表1。结果表明该电化学传感器不但能用于多巴对映体的手性识别,且能对多巴对映体进行定量检测,并具有较高的手性选择性、较宽的线性范围和较低的检出限。
2.7 传感器的实际应用
将该传感器用于检测多巴消旋体溶液中D-多巴的含量(D-DOPA%)。保持多巴总浓度为2.0×10-3mol/L 和 5.0×10-3mol/L,D-多巴的含量从0到100%变化。如图6所示,峰电流响应与D-多巴的含量呈线性增加,说明该传感器可用于多巴消旋体纯度的检测。
3 结论
实验利用氨基化离子液体修饰的氧化石墨烯、纳米金和巯基-β-环糊精构建具有手性选择性的传感界面,并采用差分脉冲伏安法研究了该传感界面对多巴对映异构体的手性识别作用。实验结果表明:构建的手性传感界面更利于D-多巴的电子传递,从而电流响应信号更强,由此说明巯基化β-环糊精与D-多巴的作用强于L-多巴。这为研究β-环糊精与其它手性分子和手性药物的识别作用提供了潜在应用价值,具有理论和实际研究意义。
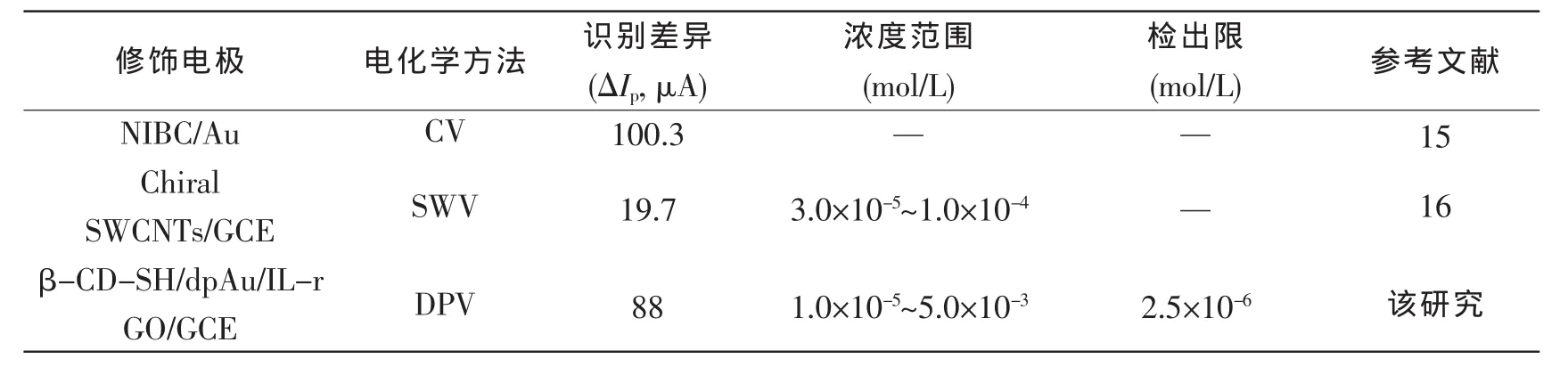
表1 识别多巴对映体的电化学方法对比Tab.1 Comparison of major electrochemical methods for recognition of DOPA enantiomers
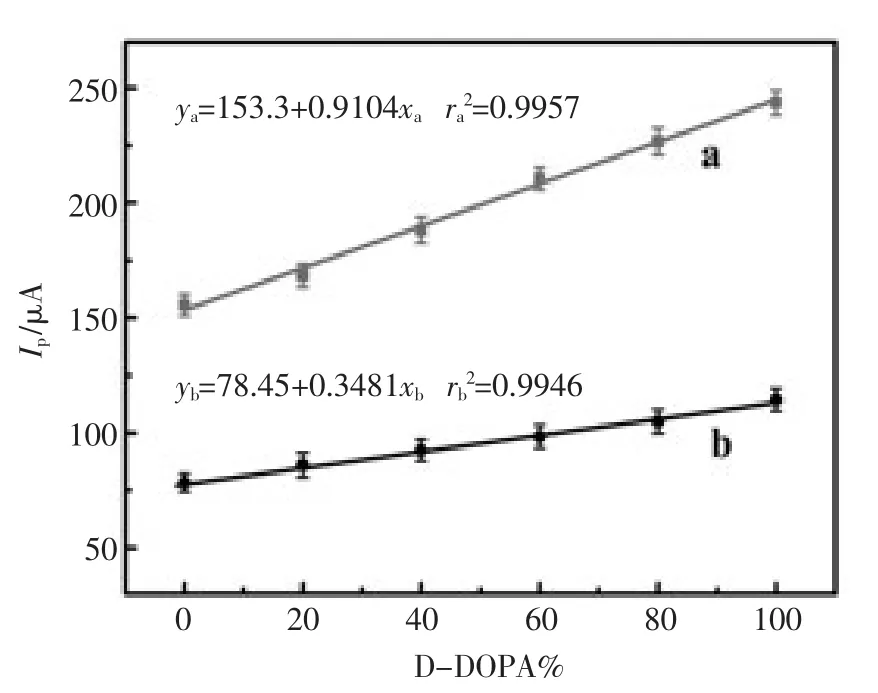
图6 传感器用于不同浓度多巴消旋体纯度的检测:(a)5.0×10-3mol/L,(b)2.0×10-3mol/LFig.6 Peak current response of enantiomeric composition D-DOPA and L-DOPA at different concentrations:(a)5.0 mmol/L,(b)2.0 mmol/L
[1]MurPhy-poulton S F,Boyle F,Gu X Q,et al.Thalidomide enantiomers:Determination in biological samples by HPLC and vancomycin-CSP[J].J.Chromatogr.B,2006,831:48-56.
[2]林国强,陈耀全,陈新滋,等.手性合成:不对称反应及其应用 [M].北京:科学出版社,2000.3-4.
[3]Wang Y,Cao J,Wang X,et al.Stereoselective transport and uptake of propranolol across human intestinal Caco-2 cell monolayers[J].Chirality,2010,22:361-368.
[4]Fukuda T,Maeda Y,Kitano H.Stereoselective inclusion of DOPA derivatives by a self-assembled monolayer of thiolated cyclodextrin on a gold electrode[J].Langmuir,1999,15:1887-1890.
[5]Goto H,Akagi K.Optically activeelectrochromism of poly(3,4-ethylenedioxythiophene)synthesized by electrochemical polymerization in lyotropic liquid crystal of hydroxypropyl cellulose/water:Active control of optical activity[J].Chem.Mater,2006,18:255-262.
[6]Ortega-Caballero R,Rousseau C,Christensen B,et al.Remarkable supramolecular catalysis of glycoside hydrolysis by a cyclodextrin cyanohydrin[J].J.Am.Chem.Soc.,2005,727:3238-3239.
[7]Chankvetadze B.Combined approach using capillary electrophoresis and NMR spectroscopy for an understanding of enantioselective recognition mechanisms by cyclodextrins[J].Chem.Soc.Rev.,2004,33:337-347.
[8]Bellia F,Mendola D L,Pedone C,et al.Selectively functionalized cyclodextrins and their metal complexes[J].Chem.Soc.Rev.,2009,38:2756-2781.
[9]Chang H X,Tang L H,Wang Y,et al.Graphene fluorescence resonance energy transfer aptasensor for the thrombin detection[J].Anal.Chem.,2010,82:2341-2347.
[10]Wang Y,Zhang S,Li Z H,et al.Self-assembly of acetylcholinesterase on a gold nanoparticles-graphene nanosheet hybrid for organophosphate pesticide detection using polyelectrolyte as a linker[J].J.Mater.Chem.,2011,21:5319-5326.
[11]Chen H Q,Müller M B,Gilmore K J,et al.Mechanically strong, electrically conductive and biocompatible graphene paper[J].Adv.Mater.,2008,20:3557-3561.
[12]Yang H F,Shan C S,Li F H,et al.Covalent functionalization of polydisperse chemically-converted graphene sheets with amine-terminated ionic liquid[J].Chem.Commun.,2009,3880-3882.
[13]Xu T,Ma J,Ma Z F.Dual tumor markers assay based on surface charged graphene[J].New J.Chem.,2015,39:1006-1012.
[14]Matsunaga M,Nagasaka M,Nakanishi T,et al.The phytotoxin coronatine contributes to pathogen fitness and is required for suppression of salicylic acid accumulation in tomato inoculated with pseudomonas syringae pv.tomato DC3000[J].Electroanal.,2008,20:955-965.
[15]Huang Y H,Han Q,Zhang Q,et al.A fast chiral sensing to DOPA enantiomers via poly-lysine f i lms matrixes[J].Electrochim.Acta,2013,113:564-569.
[16]Chen L S,Chang F X,Meng L C,et al.A novel electrochemical chiral sensor for 3,4-dihydroxyphenylalanine based on the combination of single-walled carbon nanotubes,sulfuric acid and square wave voltammetry[J].Analyst,2014,139:2243-2248.
