富含胸腺嘧啶DNA传感探针对水体中Hg2+的检测
2015-10-19文家意周银香徐思嘉许庭琦何婧琳
肖 慧,杨 婵,赵 珍,文家意,刘 凤,周银香徐思嘉,许庭琦,何婧琳,曹 忠
(长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,微纳生物传感与食品安全检测协同创新中心,湖南长沙410004)
0 引言
近年来汞污染成为威胁动物及人类健康的一种重要方式,它来源于天然和人为活动,如火山爆发,采矿业,皮革鞣制和电镀等[1]。因汞是一种毒性很强的元素,人体吸收环境中的汞之后,通过生物富集作用和食物链传递,进入人体内部,特别是中枢神经系统和内分泌系统,导致各种疾病[2]。当进入血液后,首先会同血液中的血浆蛋白或血红细胞结合,然后分布到肾脏与脑部,最后再分布到心、肺、肝、肠壁等处,而且对呼吸道、消化道也会有一定影响。由于汞元素对身体存在着极大的危害性,世界卫生组织把汞列为首要考虑的对环境有危害的污染物[3]。汞中毒一般是由汞离子引起的,由于它参与一些重要的生物反应,如和人体蛋白的巯基络合形成金属蛋白,从而抑制了酶活性,使人体的肝脏和肾脏等受到损害,引起尿毒白、血尿等病变,因此汞已被广泛认为可危害动物物种包括人类健康的重要来源[4]。
Thymine-Hg2+-Thymine(T-Hg2+-T)这种结构在近几年引起研究者们的广泛关注,T-T能与Hg2+特异性结合形成稳定的T-Hg2+-T结构,将T作为识别基团通过一定的连接体将其与信号转导基因连接起来就可以构建有机小分子Hg2+传感器[5]。T-T错配对汞离子有很高的选择性,而且T-Hg2+-T结构稳定性比匹配的A-T结构的稳定性高[6-8]。 例如:Bin Liu等[9]利用Hg2+不存在时,5'-18T-3'与5'-18A-3'由于碱基互补形成双链结构,加入荧光基团SYBR Green I,荧光信号减弱。标记核酸适体被广泛运用到基于T-Hg2+-T结构的 Hg2+检测中[10-11],例如:Ono 等[10]利用一条两端分别修饰了荧光基团和猝灭基团的DNA探针,在Hg2+存在时,形成T-Hg2+-T结构,荧光基团与猝灭基团相互靠近并发生荧光共振能量转换,使得荧光被猝灭。 还有很多传感平台被用来检测Hg2+,如基于聚合物[12]、小分子作为荧光基团[13]、DNA-zymes[14]、抗体[15]、脂质体[16]等化学生物传感器。由于基于核酶的荧光传感器快捷方便、分子结构易于修饰、重金属离子效应和灵敏度高等优点,引起研究者们的兴趣,但基于核酶荧光传感器大多数需要对核酸进行荧光标记,使得实验样品处理繁杂且花费较高[17-18],而且对核酸的标记可能导致合成过程中DNA损伤,使其对Hg2+的结合能力减弱,因此开发免标记荧光方法检测Hg2+显得较为必要。
实验设计了一种基于T-Hg2+-T结构和荧光增强的Hg2+传感器,利用Hg2+存在时,43mer-T18stem与Hg2+形成稳定的T-Hg2+-T结构,加入可嵌入DNA双链的SYBR Green I时,得到较强的荧光信号。Hg2+不存在时SYBR Green I与单链43mer-T18stem结合较弱,荧光信号较弱。该方法操作简单、价格低廉、选择性高,为快速检测Hg2+提供了一种新途径。这个新策略还可提供多通道检测、分子组装、分子逻辑门的研究方法[19-22]。
1 实验部分
1.1 试剂
核酸适体探针序列见表1,购买于生工生物工程(上海)有限公司;SYBR Green I(SG,20×)购于上海捷瑞生物工程有限公司;氯化钠、硝酸钠、硝酸钾、硝酸、三羟甲基氨基甲烷购自于湖南化学试剂厂,均为分析纯级别。
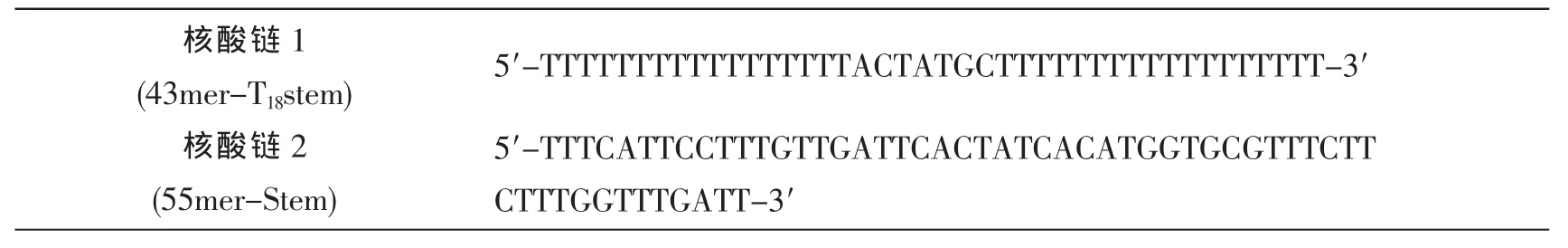
表1 核酸适体探针序列Tab.1 The sequence of the DNA probes
1.2 实验方法
1.2.1 核酸适体探针溶液的配制
配制含有 1.000×10-1mol/L NaNO3、5.000×10-3mol/L KNO3的 2.000×10-2mol/L Tris-HNO3溶液,用PHSJ-3F型实验室pH计 (上海雷磁仪器厂)将pH调至7.4。将此溶液作为43mer-T18stem的缓冲液。用相同的方法配置55mer-stem溶液。实验配备非生物试剂所用水均为超纯水,配备生物试剂所用水及实验器皿均用手提式压力蒸汽灭菌器(新丰医疗器械有限公司,浙江)进行高温高压灭菌,冲洗所用水均为蒸馏水。
1.2.2 Hg2+溶液的配制
配制1.000×10-1mol/L Hg(NO3)2溶液,用 pH=7.4的Tris-HNO3溶液稀释至所需浓度。同样方法分别配制 pH=5、pH=6、pH=8、pH=9 的 Tris-HNO3溶液稀释至所需浓度。
1.2.3 Hg2+的检测
43mer-T18stem(15 μL,5.000×10-4mol/L)和特定浓度的Hg2+在1 mL离心管中混合,将混合液置于室温下反应30 min后,加入1 μL 20×SG混合均匀,最后在激发光和发射光的狭缝宽度分别为 5.0 nm 和 10.0 nm,激发波长为 495 nm,发射光强度在494~620 nm范围的LS-45(美国Perkin Elmer公司)荧光分光光度计对混合液的荧光强度进行扫描。空白样品43mer-T18stem (15 μL,0.500 mmol/L)和 84 μL pH 为 7.4 的 2.000×10-2mol/L Tris-HNO3缓冲溶液在1 mL离心管中混合。所有检测均在室温下完成。
2 结果与讨论
2.1 基本原理

图1 发夹探针传感方法荧光检测Hg2+的原理图Fig.1 Schematic illustration of the 43mer-T18stem probe sensing method for the detection of Hg2+
实验原理如图1所示,富含18个胸腺嘧啶(T)的单链DNA在Hg2+存在的条件下由于二者的特异性识别作用可形成稳定的T-Hg2+-T结构,当加入SYBR Green I(SG)后,可以观察到明显的荧光信号。这是因为当Hg2+存在时,该单链寡聚核苷酸与Hg2+特异性结合形成类似杂交双链DNA的复合体,当双链嵌入剂SG嵌入该复合体内,荧光增强。而Hg2+不存在时,SG与单链寡聚核苷酸43mer-T18stem结合荧光较弱,甚至没有,故荧光信号较弱。
2.2 55mer-stem和43mer-T18stem核酸探针的选择
不同单链DNA探针与Hg2+结合能力不一样,为了得到最佳的信背比,选择能够形成最佳T-T错配双链DNA的探针序列,实验考察了两种不同的核酸DNA链55mer-Stem和43mer-T18Stem 对 Hg2+的响应。 在 55μL 1.000×10-6mol/L Hg2+15 μL 5.000×10-4mol/L 的 DNA 链探针及 1 μL 0.2×conc.SG 条件下, 按照 Hg2+的检测方法,探索表1中不同DNA链探针的荧光强度变化,空白样用Tris-HNO3代替。结果如图2所示,从结构上分析,55mer-Stem是一条含55个碱基的核酸链,其中T-T结合的序列为26个,加入Hg2+后形成T-Hg2+-T结构,信背比为0.3839。43mer-T18Stem中T-T结合的序列增多,加入Hg2+后形成T-Hg2+-T结构更多,SG更易于嵌入双链中,荧光强度明显增强,信背比为0.9911。因此,实验选43mer-T18Stem探针来完成接下来的实验。
2.3 传感体系制作过程荧光光谱考察
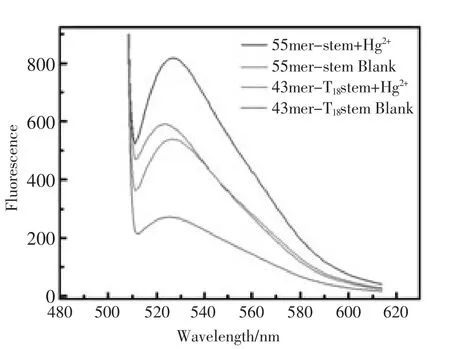
图2 核酸链1和核酸链2两种探针在空白和1.000×10-6mol/L Hg2+溶液中的荧光发射光谱图Fig.2 Fluorescence spectra of 55mer-Stem and 43mer-T18Stem probes in the absence or presence of Hg2+.The concentration of Hg2+was 1.000 × 10-6mol/L
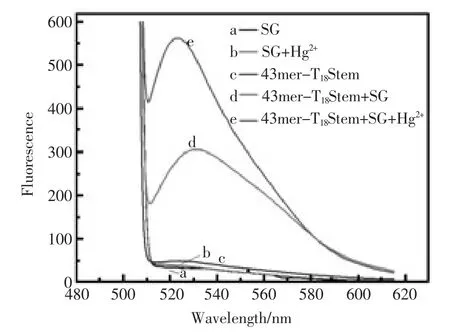
图3 荧光染料(a)、荧光染料+汞离子(b)、核酸链1(c)、核酸链1+荧光染料(d)、核酸链1+荧光染料+汞离子(e)的荧光光谱图。其中荧光染料的浓度是0.2×concFig.3 Fluorescence spectra of the following solutions.SG(a);the mixture of Hg2+and SG(b);43mer-T18Stem(c);the mixture of 43mer-T18Stem and SG in the absence(d)or presence(e)of Hg2+.The concentration of SG was 0.2×conc
为了考察传感体系中各组分的荧光性质,实验对各组分的溶液进行了荧光检测。实验结果如图3,当溶液中只加入SG(曲线a)时的荧光强度为55.70,表明SG本身具有微弱的荧光特性。当1.000×10-6mol/L Hg2+存在时(曲线 b)的荧光强度为42.97,曲线b的荧光强度比曲线a的荧光强度略低,表明Hg2+对SG本身具有微弱的荧光淬灭作用。当溶液中只有43mer-T18Stem时,荧光强度很微弱(曲线 c),即 60.05;这是因为 43mer-T18Stem链本身也有微弱荧光。而在43mer-T18Stem溶液中加入SG时,荧光强度增大到309.3(曲线d),该文课题组推测,这是因为43mer-T18Stem会发生自身的部分折叠而导致的。 当 1.000×10-6mol/L Hg2+存在时,43mer-T18Stem/SG传感体系的荧光强度为563.9(曲线e),这表明富含T碱基的43mer-T18Stem链与Hg2+能特异性的结合形成T-Hg2+T稳定结构,使SG更容易嵌入到T-Hg2+T结构中,发出强的荧光信号。因此,该传感体系可以用于Hg2+的检测。
2.4 pH值的优化
为了考察pH值对检测体系的影响,在传感器分别对 Tris-HNO3的 pH 为 5.0、6.0、7.4、8.0、9.0时的荧光进行比较。由图4可知,空白样的荧光强度随着pH值变化很小,而目标Tris-HNO3的荧光强度呈现先增大后减小的趋势。当Tris-HNO3的pH为7.4时,信背比最大,因此,pH=7.4是最佳的反应条件,在此条件下Hg2+能更好的形成T-Hg2+-T,从而达到最佳的荧光增强效果。

图4 核酸链1/荧光染料体系在空白和1.000×10-6 mol/L Hg2+溶液中随pH变化的荧光响应图Fig.4 Fluorescence responses of 43mer-T18Stem/SG system in the absence or presence of Hg2+at different pH of Tris-HNO3buffer solution.The pH was 5.0,6.0,7.4,8.0,9.0 and the concentration of Hg2+was 1.000×10-6mol/L
2.5 培育时间的优化
为了考察培育时间对检测体系的影响,在1.000×10-6mol/L Hg2+、43mer-T18Stem 及 0.2×conc.SG、Tris-HNO3pH为7.4的条件下,分别调整培育时间为 10 min、20 min、30 min、40 min、50 min。如图5所示,在空白实验中,培育时间对于荧光响应的影响不大。在检测1.000×10-6mol/L Hg2+时,当培育时间从10 min到30 min时,目标样品的荧光强度随着培育时间的增大而增大,30 min之后则随着培育时间的增大而荧光响应减小。因此,实验的最优培育时间为30 min。

图5 核酸链1与Hg2+及Tris-HNO3在不同反应时间(10、20、30、40、50 min)下与荧光强度响应图Fig.5 Time course of incubating proposed sensor(10 min,20 min,30 min,40 min and 50 min)in the absence or presence of 1.000×10-6mol/L Hg2+
2.6 分析性能
实验在最佳的条件下,对不同浓度的Hg2+进行了定量检测。如图6(A)所示,能观察到荧光强度随着 Hg2+浓度在 4.000×10-7~2.000×10-6mol/L的范围内增加而增加,这是因为随着Hg2+浓度的增加,T-Hg2+-T稳定结构越来越多,嵌入的SG也增多,所以荧光强度增大。图6(B)为Hg2+浓度与荧光强度的线性关系图,选择SG的最大发射波长525 nm处的荧光强度为定量依据并有良好的响应,且荧光强度与Hg2+浓度之间的线性关系为ΔF=0.4744c[Hg2+]+72.50,其中 r2=0.9874,线性范围是 4.000×10-7~2.000×10-6mol/L, 检 出限为3.900×10-7mol/L。
图6 (A)核酸链 1 探针传感体系对一系列浓度 Hg2+(从下至上:4.000×10-7、6.000×10-7、7.500×10-7、1.000×10-6,1.500×10-6和 2.000×10-6mol/L)的荧光光谱图;(B)荧光强度与 Hg2+浓度标准曲线图Fig.6 (A)Fluorescence spectra of 43mer-T18Stem with various concentrations of Hg2+(from bottom to top:4.000×10-7,6.000×10-7,7.500×10-7,1.000×10-6,1.500×10-6,2.000×10-6mol/L);(B)Linear fluorescence response to the Hg2+concentrations
2.7 干扰离子的影响
在最优实验条件下,考察常见的金属离子K+、Zn2+、Cu2+、Pb2+、Fe3+对 Hg2+检测的干扰程度,在没有 Hg2+存在的条件下,检测 K+、Zn2+、Cu2+、Pb2+、Fe3+的荧光强度。结果如图7所示:各金属离子对传感体系的荧光强度影响非常小,而目标物Hg2+存在时的荧光响应值最高,也就是说SG对Hg2+有特异的选择性。 说明该方法对Hg2+有良好的选择性。
2.8 回收率的测定
在最优实验条件下,将湘江水用缓冲溶液稀释20倍,制成含有5%湘江水的实际水样。滴加Hg2+标准溶液,浓度分别为 4.000×10-7、6.000×10-7、7.500×10-7、1.000×10-6、1.500×10-6和 2.000×10-6mol/L,测定各溶液的荧光强度,根据线性方程算出Hg2+含量,计算回收率(如表2所示),测得的回收率为 98.72%~104.5%,因此该传感器可用于实际水样中Hg2+的测量。
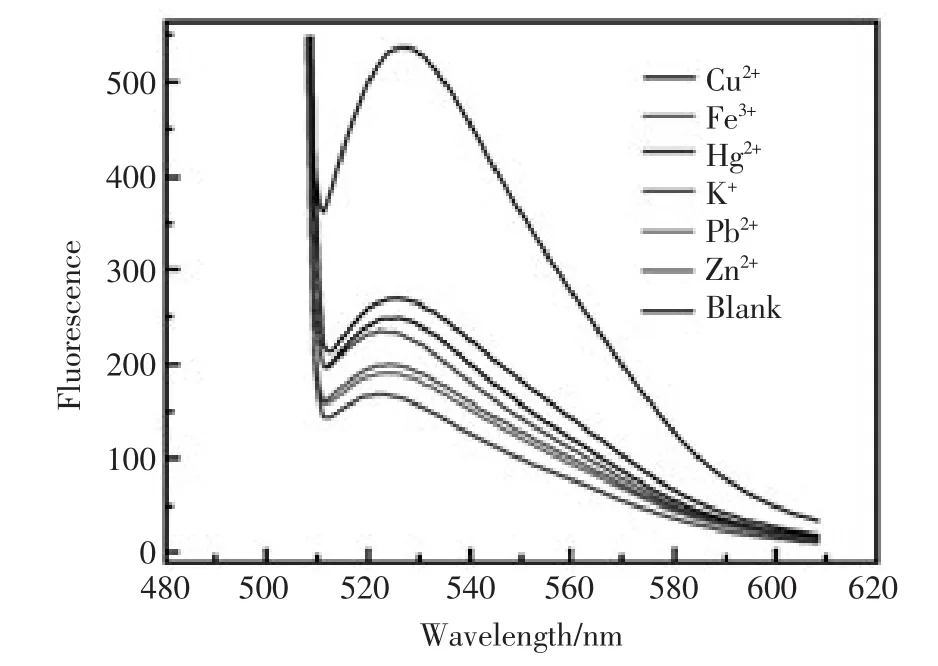
图7 传感探针检测干扰离子和Hg2+的荧光光谱图(从上至下:Hg2+,blank,Cu2+,Zn2+,Fe3+,Pb2+,K+)Fig.7 The fluorescence spectra of the proposed sensor in different metal ion solutions(from top to bottom:Hg2+,blank,Cu2+,Zn2+,Fe3+,Pb2+and K+)
3 结论
该文利用T-T与Hg2+特异性作用形成稳定的T-Hg2+-T结构与DNA嵌入剂(SG)设计了一种新型的汞离子荧光传感器。利用荧光染料SG嵌入双链DNA能产生较高荧光的作用,在不同浓度下Hg2+对传感体系的响应做了荧光定量分析。在最优实验条件下,汞(Ⅱ)离子浓度与荧光信号值在 4.000×10-7mol/L~2.000 ×10-6mol/L 范围内呈线性关系,最低检测浓度为 3.900×10-8mol/L。该方法对汞(Ⅱ)表现出较好的选择性,可用于实际环境水样中汞(Ⅱ)的灵敏检测,在设计上具有普遍应用性且不需要预处理,可直接进行测定,操作简单、价格低廉,整个操作过程绿色、环保,且检测响应快速,选择性良好,具有良好的应用前景。

表2 回收率的测定Tab.2 Recovery of Hg2+in Real Samples
[1]Yang J P,Lu F,Chen J,et al.Sensing and magnetic removal of Hg(II)using core-shell structured nanocomposite grafted with fluorescence “off-on” probe[J].Microporous and Mesoporous Materials,2015,202:175-182.
[2]Zhao C C,Li K B,Xie N,et al.Deprotonation and chelation synergically triggered near infrared fluorescence for selective detection of Hg(II)[J].Journal of Photochemistry and Photobiology A:Chemistry,2014,290:72-76.
[3]Yang J,Wang Z T,Yang D J.Progress in Method of Determination of Total Mercury in Foods[J].Chinese Joural of Food Hygene,2008,20(4):346-351.
[4]Tong S,Zhang L Q,Liu B,et al.Two rhodamine derived fluorescence turn-on chemosensors for Hg(II)recognition and sensing:synthesis,characterization and sensing performance[J].Sensors and Actuators B:Chemical,2014,203(3):157-164.
[5]Wang Y X,Li J S,Yang R H.Fluorescent probe based on the interaction between functional nucleic acids and metal ions[J].Chemical Sensors,2010,30:1-13.
[6]Yoko M,Humika T,Mitsuru T,et al.MercuryⅡ-mediated formation of thymine-HgⅡ-thymine base pairs in DNA duplexes[J].American Chemical Society,2006,128:2172-2173.
[7]Yoshiyuki T,Shuji O,Hiroshi Y,et al.15N-15N J-coupling across HgⅡ:Direct observation of HgⅡ-mediated T-T base pairs in a DNA duplexe[J].American Chemical Society,2007,129:244-245.
[8]Wang Z D,Jung H L,Lu Y.Highly sensitive “turn-on”fluorescent sensor for Hg2+in aqueous solution based on structure-switching DNA[J].Chemical Communications,2008,45:6005-6007.
[9]Liu B.Highly sensitive oligonucleotide-based fluorometric detection of mercury (Ⅱ )in aqueous media[J].Biosensors and Bioelectronics,2008,24:756-760.
[10]Akira O,Humika T.Highly sensitive Oligonucleotide-Based sensor for mercury(Ⅱ)in aqueous solutions[J].Angewandte Chemie International Edition,2004,43:4300-4302.
[11]Ye B C,Yin B C.Highly sensitive detection of mercury(Ⅱ)ions by fluorescence polarization enhanced by gold nanoparticles[J].Angewandte Chemie International Edition,2008,47:8386-8389.
[12]Hamid R R,Mahmoud R,Mojtaba S.Development of a highly selective voltammmetric sensor for nanomolar detection of mercury ions using glassy carbon electrode modified with a novel ion imprinted polymeric nanobeads and multi-wall carbon nanotubes[J].Journal of Electroanalytical Chemistry,2013,693:16-22.
[13]Elizabeth M N,Stephen J Lippard.Tool and tactics for the optical detection of mercuric ion[J].Chemical Reviews,2008,108:3443-3480.
[14]Jason M Thomas,Hua-Z Y,Dipankar S.A mechanoelectronic DNA switch[J].Journal of America Chemistry Society,2012,134:13738-13748.
[15]Wang Y Z,Yang H,Michael P,et al.Highly sensitive and specific determination of mercury(Ⅱ)ion in water,food and cosmetic samples with an ELISA based on a novel monoclonal antibody[J].Analytical and Bioanalytical Chemistry,2012,403:2519-2528.
[16]Jiseok L,Hayeon J,Jinsang K.Polydiacetylene-liposome microarrays for selective and sensitive mercury(Ⅱ)detection[J].Advanced Materials,2009,21:3674-3677.
[17]Liu J W,Lu Y.Rational design of “turn-on”allosteric DNAzyme catalytic beacons for aqueous mercury ions with ultrahigh sensitivity and selectivity[J].Angewandte Chemie,2007,119:7731-7734.
[18]Jalal I,Ahmida El Achari.A water soluble fluorescent BODIPY dye with azathiacrown ether functionality for mercury chemosensing in environmental media[J].Analyst,2013,138:3809-3819.
[19]Yuan M,Zhu Y G,Lou X H,et al.Sensitive label-free oligonucleotide-based microfluidic detection of mercury(II)ion by using exonuclease I[J].Biosensors and Bioelectronics,2012,31:330-336.
[20]He X X,Qing Z H,Wang K M,et al.Engineering a unimolecular multifunctional DNA probe for analysis of Hg2+and Ag+[J].Analytical Methods,2012,4:345-347.
[21]Liu F,Jong Y C,Tae S S.Graphene oxide arrays for detecting specific DNA hybridization by fluorescence resonance energy transfer[J].Biosensors and Bioelectronics,2010,25:2361-2365.
[22]Lin Y H,Tao Y,Pu F,et al.Combination of graphene oxide and thiol-activated DNA metallization for sensitive fluorescence turn-on detection of cysteine and their use for logic gate operations[J].Advanced Functional Materials,2011,21:4565-4572.
