HPLC-DAD-Q-TOF-MS/MS法的银黄颗粒主要成分定性与定量研究
2015-10-19王小花
向 青, 王小花, 林 慧, 林 婧, 许 文,*
(1.福建中医药大学生物医药研发中心,福建 福州 350122;2.福建中医药大学药学院,福建 福州 350122;3.福建中医药大学中西医结合研究院,福建 福州 350122)
[质 量]
HPLC-DAD-Q-TOF-MS/MS法的银黄颗粒主要成分定性与定量研究
向 青1,2,王小花2,林 慧2, 林 婧3, 许 文1,2,3*
(1.福建中医药大学生物医药研发中心,福建福州350122;2.福建中医药大学药学院,福建福州350122;3.福建中医药大学中西医结合研究院,福建福州350122)
目的 采用高效液相色谱串联四极杆飞行时间质谱(HPLC-Q-TOF-MS/MS)快速鉴定银黄颗粒化学成分和HPLC-DAD法同时定量测定银黄颗粒中15种成分(獐牙菜苷、马钱苷、新绿原酸、绿原酸、隐绿原酸、咖啡酸、芦丁、异绿原酸B、异绿原酸A、异绿原酸C、野黄芩苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素)。方法 分析采用月旭U1timate-XBC18色谱柱(4.6 mm×150mm,5μm),流动相为乙腈-0.1%甲酸水,梯度洗脱,体积流量0.8mL/min,柱温30℃。飞行时间质谱,采用负离子模式扫描。二极管阵列检测器的检测波长为240、276、326 nm。结果HPLC-Q-TOF-MS/MS法推断鉴定银黄颗粒中的44种成分,HPLC-DAD定量分析银黄颗粒中15种成分在考察的质量浓度范围内,与峰面积之间呈良好的线性关系(r>0.999 0);回收率均在97.3%~100.9%范围内,RSD为1.4%~2.8%。结论 通过HPLC-Q-TOF-MS/MS法和HPLC-DAD法鉴定银黄颗粒的化学成分优于HPLC法,尤其测定环烯醚萜苷类成分(獐牙菜苷、马钱苷)可为综合评价银黄制剂的质量提供参考。
银黄颗粒;高效液相色谱串联四级杆飞行时间质谱;HPLC-DAD;化学成分
银黄制剂是金银花提取物和黄芩提取物制备组成的复方制剂,具有清肺疏风、清热解毒之功效。临床上用于外感风热、肺胃热盛所致的咽干、咽痛、口渴、发热;急慢性扁桃体炎、急慢性咽炎、上呼吸道感染[1]。在银黄制剂的质量控制研究方面,《中国药典》2010年版一部只针对其中绿原酸及黄芩苷的量进行测定,针对其质量控制文献报道较多[2]:杨菲等[3]利用一测多评法测定了银黄制剂中4个黄酮的量,该4个成分均为黄芩的主要成分;王荣梅等[4]利用HPLC法测定银黄含片中6个咖啡酰奎宁类成分的量,该6个成分均为有机酸类成分;Chen Hui等[5]采用HPLC-DAD-MS/MS同时测定了银黄制剂中9种成分,并且采用四级杆质谱鉴定了其中20个成分,韩强等[6]利用HPLC法同时测定银黄制剂中9个成分的量,包括了2种有机酸和7种黄酮类成分,上述研究在银黄制剂质量控制中发挥了一定作用,但所测成分仍有一定的片面性,无法全面反映银黄制剂的整体质量。近年来,高效液相色谱串联四极杆飞行时间质谱(HPLC-QTOF-MS/MS)技术广泛运用于中药复方多成分的鉴定上[7-9],通过液相色谱分离,利用串联高分辨飞行时间质谱的精确分子质量定性优势,全面而快速地对复方多成分进行准确鉴定。另外,据文献报道金银花中环烯醚萜类化合物(如獐牙菜苷、马钱苷)具有广泛的生物活性,如抗病毒、抗菌、抗肿瘤、抗氧化、增强免疫等多种活性[10-12],与银黄制剂清热解毒功效相一致,而目前针对银黄制剂中环烯醚萜苷的定量测定尚未见报道。故本实验采用HPLC-Q-TOF-MS/MS对银黄颗粒制剂化学成分进行全面定性分析,同时采用HPLC-DAD法对其15种主要成分:獐牙菜苷、马钱苷、新绿原酸、绿原酸、隐绿原酸、咖啡酸、芦丁、异绿原酸B、异绿原酸A、异绿原酸C、野黄芩苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素进行同时定量研究,为银黄制剂的质量控制提供新的科学依据。
1 仪器与试药
飞行时间质谱仪(micrOTOF,德国Bruker公司);Shimadzu LC20A高效液相色谱仪(日本Shimadzu公司);CPA225D型十万分之一分析天平(德国Sartorius公司);KQ-500E台式超声波清洗器(昆山市超声仪器有限公司);FY135型中草药粉碎机(天津市泰斯特仪器有限公司);乙腈为色谱纯(德国Merck公司),Mi11i-Q超纯水仪(美国Mi11ipore公司),其余试剂均为分析纯。
对照品獐牙菜苷、马钱苷由上海同田生化有限公司提供,新绿原酸、绿原酸、隐绿原酸、咖啡酸、芦丁、异绿原酸B、异绿原酸A、异绿原酸C由北京赛百草科技有限公司提供,野黄芩苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素由成都曼思特生物科技有限公司提供,纯度均大于98.0%。银黄制剂(银黄颗粒,规格为4 g/袋,分别收集自西安博爱制药有限责任公司、成都第一药业有限公司、西安必康制药集团有限公司、云南永安制药有限公司、陕西天洋制药有限责任公司、郑州韩都药业集团有限公司,共收集6批次)。
2 方法与结果
2.1色谱及质谱条件
2.1.1HPLC-Q-TOF-MS/MS分析色谱条件 月旭U1timate-XB C18色谱柱(4.6mm×150mm,5μm),流动相为乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~5 min,5%~10%A;5~30 min,10%~15% A;30~40 min,15%~18%A;40~50 min,18%~23%A;50~60 min,23%~37%A;60~70 min,37%~70%A;70~100 min,70%A),体积流量0.8 mL/min,柱温30℃,进样量1μL。
2.1.2质谱条件 飞行时间质谱采用电喷雾负离子模式:毛细管电压4.5 kV,喷雾器压力2.0 bar,干燥气体(N2)体积流量4.0 L/min,干燥气体温度180℃,飞行迁移(funne11和2)参数200.0 Vpp,四级杆离子能量3.0 eV,碰撞池(co11ision Rf)150.0 Vpp,离子传输时间80μs,前脉冲存储时间5μs,碰撞气体氩气,碰撞能量30 eV。质谱测定数据采用全扫描模式采集,数据采集范围m/z 100~1000。
2.1.3HPLC-DAD法定量分析色谱条件 月旭U1-timate-XB C18色谱柱(4.6 mm×150 mm,5μm),流动相为乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~15 min,8%~10%A;15~30 min,10%~18%A;30~40 min,18%~23%A;40~50 min,23%~40%A;50~60 min,40%~70%A;60~65 min,70%A),体积流量0.8 mL/min,柱温30℃,检测波长240、276、326 nm,进样量5μL。
2.2溶液的制备
2.2.1供试品溶液的制备 银黄样品粉碎,过60目筛,精密称取1.00 g,置于50 mL量瓶中,先加75%甲醇40 mL超声(功率250 W,频率50 kHz)提取30 min,静置,放冷,再用75%甲醇定容,摇匀,静置,取上清液过0.22μm微孔滤膜,取续滤液,即得。
2.2.2对照品溶液的制备 取獐牙菜苷、马钱苷、新绿原酸、绿原酸、隐绿原酸、咖啡酸、芦丁、异绿原酸B、异绿原酸A、异绿原酸C、野黄芩苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素对照品,精密称定,加入甲醇分别制备含0.612、1.155、0.330、0.574、0.307、1.97、0.429、0.616、1.54、0.598、0.144、1.95、0.820、1.395、1.52、0.616 mg/mL的单一对照品贮备液。其他不同质量浓度的混合对照品溶液由50%甲醇稀释贮备液得到。
2.2.3阴性对照溶液 按银黄颗粒制剂工艺方法制备缺金银花和黄芩提取物的阴性对照,并按“2.2.1”项下制备阴性样品。
2.3银黄颗粒化学成分数据库的建立 根据国内外专业数据库Pubchem Compound,Chem ExperChemica1Directory,Combined Chemica1Dictionary,Natura1Products Dictionary、中科院化学专业数据库等及金银花、黄芩化学成分、质谱研究相关文献,收集了银黄制剂中各种非挥发性化学成分包括环烯醚苷类、有机酸酯类、黄酮类化学成分,并通过Compass IsotopePattern软件(含各元素精确质量数),根据各成分碳、氢、氧的个数,计算精确分子质量,建立包括化合物名称、分子式、精确分子质量的银黄颗粒化学成分数据库。
2.4银黄颗粒中主要化学成分的鉴定 银黄颗粒样品在“2.1.1”项色谱条件及“2.1.2”项质谱条件下进行分析,银黄颗粒的HPLC-Q-TOF-MS总离子流图见图1。化合物的鉴定方法是:首先,根据总离子流色谱峰上所得到的精确化合物分子质量信息,通过Compass DataAna1ysis SmartFormu1a Manua11y软件在5 ppm的质量偏差范围内计算其精确分子式,与所建的数据库进行比对,对各化合物进行初步鉴定。其次,选择分子离子峰进行碰撞诱导解离(CID),通过二级质谱的裂解,获得化合物相应的碎片离子,根据离子的裂解情况并结合文献进一步比对推测,最终鉴定化合物44个,其中15个化合物经与对照品比对确定。以绿原酸鉴定为例:首先根据TOF-MS给出的分子离子峰353.087 8,质谱软件计算出精确分子式为C16H18O9,然后与银黄颗粒化学成分数据库比对,绿原酸及其异构体分子质量与之一致,故初步推测其为绿原酸或其异构体。再根据TOF-MS二级碎片离子有m/z191、179、173、161、135,与文献[13]报道绿原酸二级质谱离子相一致,并且经裂解推测二级质谱图上m/z191峰为[M-H-caffeoy1]-,m/z 179峰为[caffeic acid-H]-,m/z 173峰为[M-H-caffeoy1-H2O]-,m/z 161峰为[caffeic acid-HH2O]-,m/z135峰为[M-H-caffeoy1-CO2]-,并且其色谱保留时间、分子离子峰和二级质谱碎片与对照品完全一致,故鉴定该化合物为绿原酸,其与黄芩苷质谱裂解过程见图2。其他化合物采用类似鉴定方法,同时参考文献[13-17]二级质谱数据进行鉴定,结果见表1。
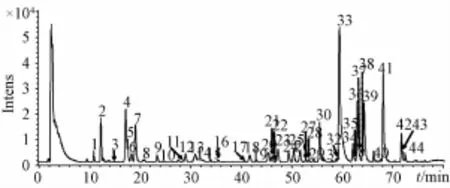
图1 银黄颗粒样品HPLC-Q-TOF-MS的负离子流图Fig.1 HPLC-Q-TOF-MS totaI ion chromatogram of Yinhuang preparations in negative ion mode
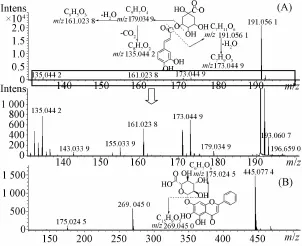
图2 绿原酸(A)和黄芩苷(B)质谱裂解过程Fig.2 DetaiI fragmentation pathway of ch Iorogenic(A)acid and baicaIin(B)

表1 银黄颗粒各化学成分的鉴定分析结果Tab.1 QuaIitative anaIysis of chem icaIconstituents in Yinhuang preparations
2.5HPLC-DAD定量方法学考察
2.5.1系统适应性及专属性试验 分别精密吸取混合对照品溶液、供试品溶液及阴性样品溶液各5μL,在“2.1.3”项色谱条件下分析,结果见图3。獐牙菜苷、马钱苷、新绿原酸、绿原酸、隐绿原酸、咖啡酸、芦丁、异绿原酸B、异绿原酸A、异绿原酸C、野黄芩苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素15种化合物在相应测定波长下与其相邻色谱峰的分离度均大于1.5,拖尾因子在0.95~1.10,理论塔板数以各色谱峰计均在10 000以上。阴性对照在相应位置上未见色谱峰,说明其他组分不干扰15种成分的测定。
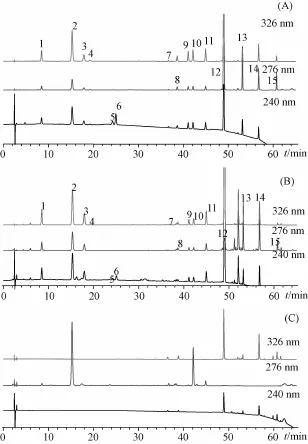
图3 对照品(A)、银黄样品(B)、阴性样品(C)的HPLC色谱图Fig.3 HPLC chromatograms of reference substances(A),Yinhuang samp Ie(B)and negative samp Ie(C)
2.5.2线性范围考察 取“2.2.2”项下方法制备的各对照品贮备液,用50%甲醇稀释,配制系列梯度质量浓度的对照品混合溶液。精密吸取5μL,依次注入液相色谱仪,在“2.1.3”项色谱条件下测定峰面积,以峰面积(Y)对分析物质量浓度(Ⅹ)作线性回归,绘制标准曲线,得到回归方程和相关系数,并以信噪比S/N=10计算定量限,以信噪比S/N=3计算检测限,结果见表2。
2.5.3精密度试验 精密吸取同1份对照品混合溶液5μL,在“2.1.3”项色谱条件下1日内连续进样6次,及连续6 d测定,分别记录15种分析物的峰面积,计算峰面积的RSD,结果日内、日间精密度良好,RSD均小于2.7%,见表3,结果表明仪器精密度良好。
2.5.4稳定性试验 取本品按“2.2.1”项下制备供试品溶液,分别于0、2、6、10、12和24 h注入HPLC仪,记录15种分析物峰面积并计算RSD均小于2.1%,结果见表3,结果表明样品在24 h内稳定。
2.5.5重复性试验 精密称取同1批(S1批)银黄颗粒样品6份,按“2.2.1”项下制备供试品溶液,依法测定峰面积,计算15种分析物的量,其RSD均小于3.2%,结果见表3,说明方法重复性良好。
2.5.6回收率试验 精密称取“2.5.5”项下已知含有量的银黄颗粒粉末6份,约0.50 g,精密加入近似等量的15种对照品,按“2.2.1”项下方法制备供试品溶液,依法测定,结果见表4。
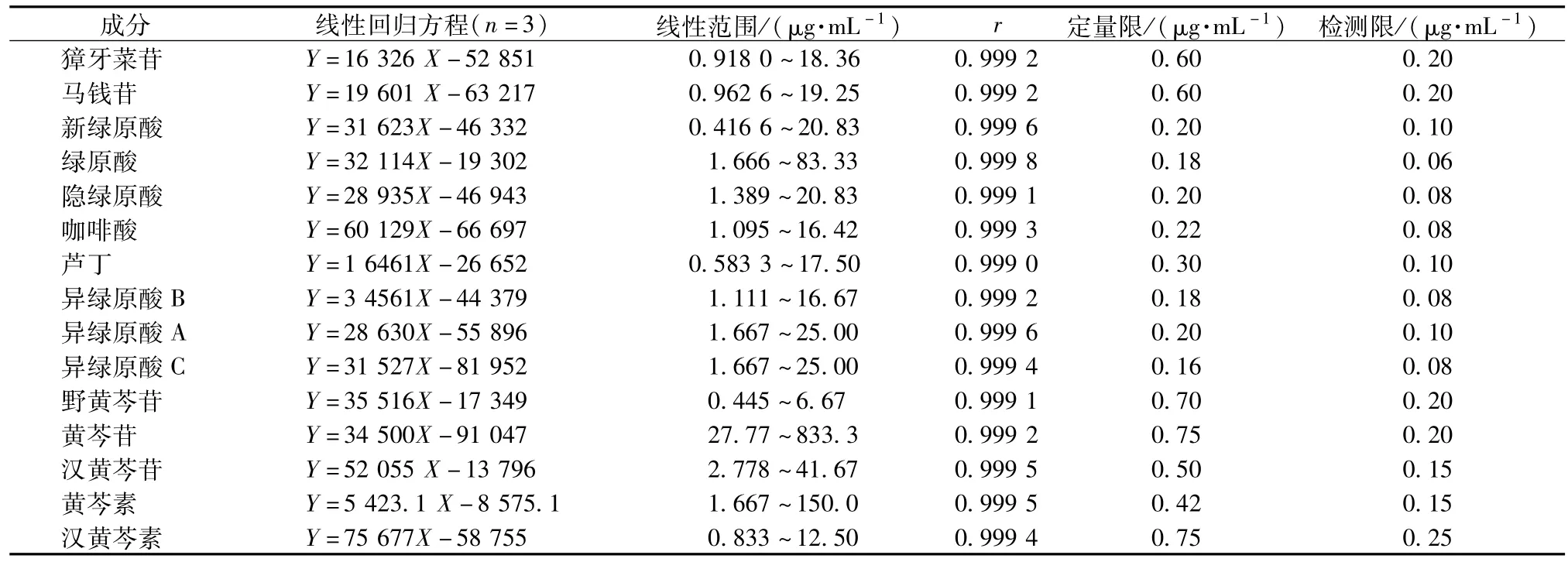
表2 15种分析物的线性关系,检测限,定量限Tab.2 CaIibration curves,Iinear ranges,LOQ and LOD of 15 detected constituents
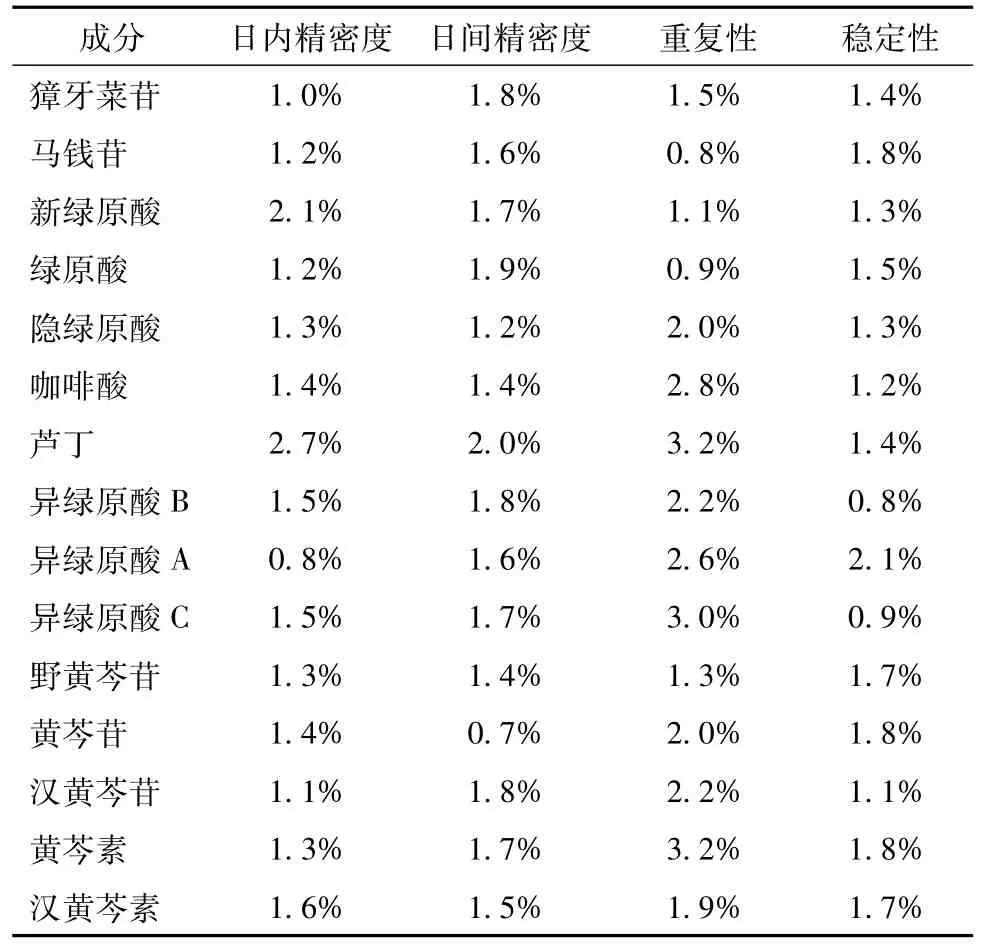
表3 15种分析物的精密度、重复性、稳定性试验RSDTab.3 Precision,reproducibiIity,stabiIity of 15 detected constituents
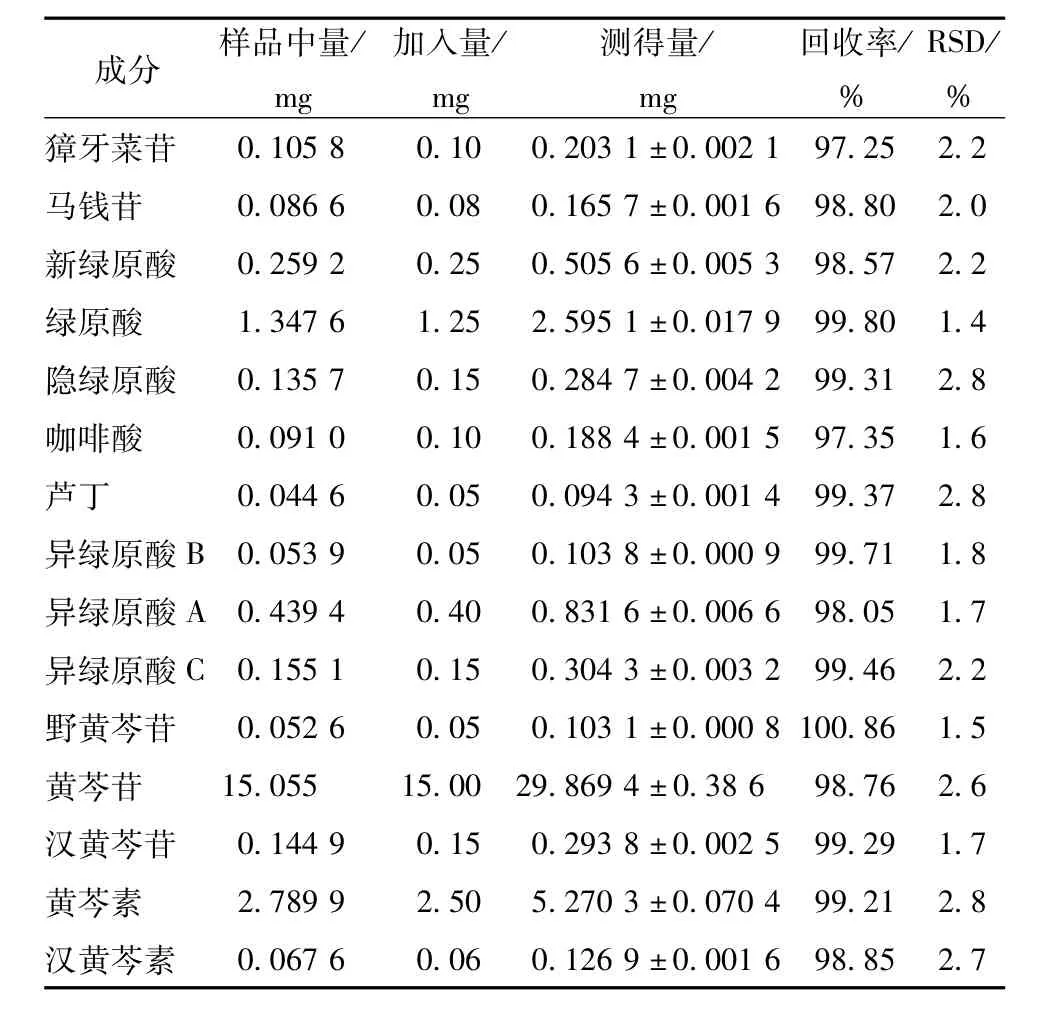
表4 银黄颗粒中15种分析物的回收率试验结果(n=6)Tab.4 Resu Its of recovery tests for 15 detected constituents(n=6)
2.5.7样品测定 分别精密称取不同批次的银黄颗粒样品粉末1.00 g,按“2.2.1”项下方法制备供试品溶液,进样5μL,按“2.1.3”项色谱条件下测定峰面积,根据标准曲线计算,结果见表5。
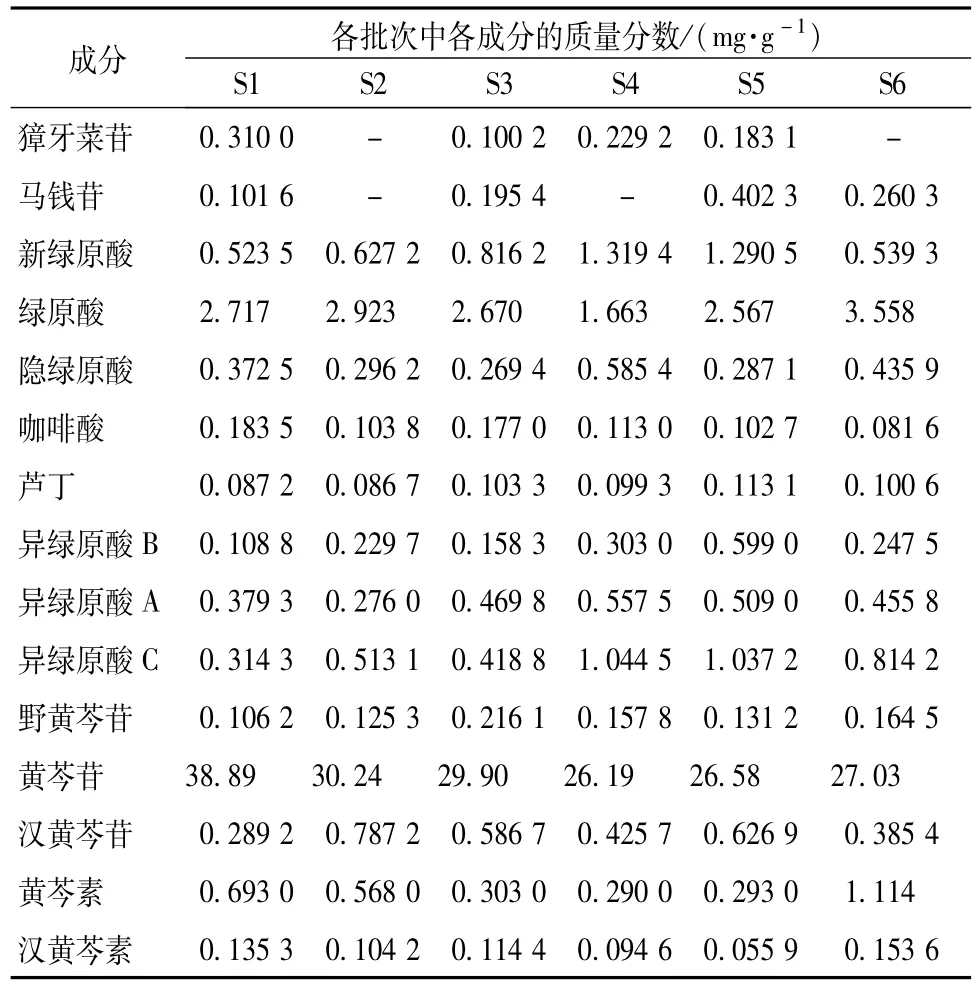
表5 银黄颗粒中15种分析物的量(n=3)Tab.5 Determ ination of 15 detected constituentsin in Yinhuang preparations(n=3)
3 讨论
3.1HPLC-Q-TOF-MS/MS定性分析 比较了正、负离子检测模式,发现负离子模式下峰响应优于正离子模式,并且同时较多文献报道了负离子模式下金银花或者黄芩药材的质谱解析,方便二级质谱的文献比对。另外,流动相添加0.1%甲酸有利于峰形改善。TOF-MS鉴定过程中,有些成分分子离子峰一级质谱一致,但可以根据其二级质谱数据的差异加以区分,獐牙菜苷([M+HCOOH-H]-)和断氧化马钱子苷([M-H]-)的分子离子峰相同,但是其二级质谱产生的苷元碎片峰不同而相互区分。另外,结构相似的同分异构体,其不仅分子式一样,而且有着类似的质谱裂解方式,如绿原酸、新绿原酸、隐绿原酸,他们的区分就需要对照品的比对来进一步确认,文中也有部分同分异构体未有对照品比对,如白杨素-6-C-阿拉伯糖苷-8-C-葡萄糖苷与白杨素-6-C-葡萄糖苷-8-C-阿拉伯糖苷,表断马钱子苷半缩醛内酯与断马钱子苷半缩醛内酯,其质谱行为完全一致,其鉴定则是根据其在文献[13,15]中的保留时间顺序确定。
3.2测定指标的选择 文献研究表明,银黄制剂主要成分为有机酸类及黄酮类成分,有机酸类如绿原酸在存储过程中与其异构体之间或互相转化,黄酮类如黄芩苷也会降解为其苷元黄芩素。同时,由文献报道金银花提取物中环烯醚萜类化合物(如獐牙菜苷、马钱苷)具有广泛的生物活性,如抗病毒、抗菌、抗肿瘤、抗氧化、增强免疫等多种活性[10-12],与银黄制剂功效相一致,而查阅国内外文献,目前针对银黄制剂中环烯醚萜苷的成分定量测定均未有报道。因此,本实验选择了7种有机酸、6种黄酮、2种环烯醚萜苷共15种成分进行同时定量研究。
3.3色谱条件的选择 由于绿原酸及异绿原酸类成分结构相近,其色谱峰容易重叠,通过比较不同厂家色谱柱对银黄颗粒15种活性成分的分离效果,最终选择月旭U1timate XB-C18色谱柱。流动相系统的选择,先后试用了4种流动相系统:乙腈-0.5%醋酸水,乙腈-0.1%甲酸水,甲醇-0.1%甲酸水,甲醇-0.5%醋酸水。结果表明,使用乙腈-0.1%甲酸最佳,故最终选择乙腈-0.1%甲酸水作为流动相系统。检测波长的选择:经DAD全波长扫描,獐牙菜苷、马钱苷最大吸收波长在240~245 nm,新绿原酸、绿原酸、隐绿原酸、咖啡酸、芦丁、异绿原酸B、异绿原酸A、异绿原酸C最大吸收波长在326 nm左右,野黄芩苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素最大吸收波长在276 nm左右,综合各个待测物的紫外响应值,最终选择以240、276、326 nm作为检测波长。
3.4样品测定结果分析 对于6批银黄颗粒中成分定量测定,结果表明,S4批次的绿原酸含有量不符合《中国药典》要求(2.52 mg/g),但是如加上新绿原酸的量,则该批次的样品中绿原酸的量就符合《中国药典》要求,可能其加工或者储存过程中绿原酸发生了较大程度的转化。6批样品黄芩苷含有量均达到《中国药典》要求。另外,2种环烯醚萜苷类成分在不同批次中也有较大差异,甚至有些批次(S2、S4和S6)中未检测出,提示金银花提取物及制剂加工过程中除了考虑绿原酸和黄芩苷的保留率外,是否也应该考虑环烯醚萜苷的保留率。
本实验建立HPLC-Q-TOF-MS/MS联用技术,共鉴定银黄颗粒44个化合物,为银黄颗粒成分全面定性提供了一种快速、高效的分析方法;建立HPLC-DAD同时测定银黄颗粒中15种成分的定量分析方法简便、快捷、准确,为综合评价银黄制剂的质量提供参考。
致谢:本课题在康复技术协同创新中心、国家中医药管理局中医康复研究中心和福建省中药学重点实验室资助下完成。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:1082-1085.
[2]徐 玫,张忠泉,王璟奕,等.银黄制剂中主要成分定量控制方法的研究进展[J].中成药,2014,36(5):1045-1047.
[3]杨 菲,冯伟红,王智民,等.一测多评法测定银黄制剂中4种黄酮类成分含量[J].中国药学杂志,2012,47(12):984-989.
[4]王荣梅,徐丽华,林永强.HPLC法同时测定银黄含片中6个咖啡酰奎宁酸类成分的含量[J].药物分析杂志,2012,32(1):57-60.
[5]Chen Hui,Chen Xu,Han Qiang,et al.A new strategy for qua1ity contro1and qua1itative ana1ysis of Yinhuang preparations by HPLC-DAD-MS/MS[J].Anal Bioanal Chem,2012,404(6/7):1851-1865.
[6]韩 强,陈 辉,李银洁,等.HPLC法同时测定银黄制剂中9个成分的含量[J].药物分析杂志,2013,33(10):1686-1691.
[7]Yan Yan,ChaiChengzhi,Wang Dawei,et al.HPLC-DAD-QTOF-MS/MS ana1ysis and HPLC quantitation of chemica1 constituents in traditiona1Chinese medicina1 formu1a Ge-Gen Decoction[J].JPharm Biomed Anal,2013,80:192-202.
[8]Dong Juan,Zhu yan,Gao Xiumei,et al.Qua1itative and quantitative ana1ysis of themajor constituents in Chinesemedicina1preparation Dan-Lou tab1et by u1tra high performance 1iquid chromatography/diode-array detector/quadrupo1e time-of-f1ight tandem mass spectrometry[J].J Pharm Biomed Anal,2013,80:50-62.
[9]陈晓鹏,张兰兰,周水平,等.多维液质联用系统分析养血清脑颗粒化学成分[J].中成药,2013,35(7):1499-1504.
[10]马双成,刘 燕,毕培曦,等.金银花药材中抗呼吸道病毒感染的环烯醚萜苷类成分的定量研究[J].药物分析杂志,2006,26(8):1039-1042.
[11]Chen Chunyun,Qi Lianwen,Li Huijun,et al.Simu1taneous determination of iridoids,pheno1ic acids,f1avonoids,and saponins in Flos Lonicerae and Flos Lonicerae Japonicae by HPLCDAD-ELSD coup1ed with principa1 component ana1ysis[J].J Sep Sci,2007,30(18):3181-3192.
[12]石建功,李 帅,王素娟,等.金银花提取物其制备方法和应用:中国,CN 01085795A[P].2007-12-12.
[13]Qi Lianwen,Chen Chunyun,Li Ping.Structura1characterization and identification of iridoid g1ycosides,saponins,pheno1ic acids and f1avonoids in Flos Lonicerae Japonicae by a fast 1iquid chromatographymethod with diode-array detection and time-off1ightmass spectrometry[J].Rapid Commun Mass Spectrom,2009,23(19):3227-3242.
[14]Ye Min,Liu Shwuhuey,Jiang Zao1i,et al.Liquid chromatography/mass spectrometry ana1ysis of PHY906,a Chinese medicine formu1ation for cancer therapy[J].Rapid Commun Mass Spectrom,2007,21(22):3593-3607.
[15]Yang Yang,Wang Hongjie,Yang Jian et al.Chemica1 profi-1ing and quantification of Chinese medicina1 formu1a Huang-Lian-Jie-Du decoction,a systematic qua1ity contro1 strategy u-sing u1tra high performance 1iquid chromatography combined with hybrid quadrupo1e-orbitrap and trip1e quadrupo1e mass spectrometers[J].JChromatogr A,2013,1321:88-99.
[16]Han Jian,Ye Min,Xu Man,et al.Characterization of f1avonoids in the traditiona1Chinese herba1medicine-Huangqin by 1iquid chromatography coup1ed with e1ectrospray ionization massspectrometry[J].JChromatogr B,2007,848(2):355-362.
[17]Li J,Wang Y H,Smi11ie T J,et al.Identification of pheno1ic compounds from Scutellaria lateriflora by 1iquid chromatography with u1travio1et photodiode array and e1ectrospray ionization tandem mass spectrometry[J].JPharm Biomed Anal,2012,63:120-127.
QuaIitative and quantitative anaIysis ofmajor constituents in Yinhuang Granu Ies by HPLC-DAD-Q-TOF-MS/MS
XIANG Qing1, WANG Xiao-hua2, LIN Hui2, LIN Jing3, XUWen1,2,3*
(1.Centre of Biomedical Research&Development,Fujian University of Traditional Chinese Medicine,Fuzhou 350122,China;2.School of Pharmacy,Fujian University of Traditional ChineseMedicine,Fuzhou 350122,China;3.Academy of IntegrativeMedicine,Fujian University of Traditional Chinese Medicine,Fuzhou 350122,China)
AIM To use a qua1itative ana1ytica1method of 1iquid chromatography coup1ed with quadrupo1e time-of-f1ight tandem mass spectrometry(HPLC-Q-TOF-MS/MS)for identification ofmu1ti-constituent and HPLCDAD for simu1taneous1y determining 15major constituents(neoch1orogenic acid,ch1orogenic acid,cryptoch1orogenin acid,caffeic acid,sweroside,1oganin,rutin,scute11arin,isoch1orogenic acid B,isoch1orogenic acid A,isoch-1orogenic acid C,baica1in,wogonoside,baica1ein,wogonin)in Yinhuang Granu1es.METHODS The assay was performed on a We1ch U1timate XB-C18co1umn(4.6 mm×150 mm,5μm)with the mobi1e phase consisting of acetonitri1e(A)and water containing 0.1%formic acid(B)in gradientmode at a f1ow rate of0.8 mL/min.The co1umn temperature was at30℃and the optimum detection wave1ength of DAD was setat240,276,and 326nm. Q-TOF-MS used negative ion mode.RESULTS Forty-four constituentswere identified in Yinhuang Granu1es by HPLC-Q-TOF-MS/MS.The fifteen constituentswere quantitative1ymeasured by HPLC-DAD and their 1inear ranges were fine(r>0.999 0)with overa11 recoveries ranging from 97.25%to 100.86%,and the RSD ranging from 1.4%to 2.8%.CONCLUSION HPLC-Q-TOF-MS/MS combined with HPLC-DAD for ana1ysis are superior toHPLC,especia11y themeasurementof iridoids(sweroside,1oganin),and themethod cou1d be app1ied to the eva1-uation of Yinhuang preparations.
Yinhuang Granu1es;HPLC-Q-TOF-MS/MS;HPLC-DAD;constituent
R927.2
A
1001-1528(2015)01-0105-08
10.3969/j.issn.1001-1528.2015.01.021
2014-05-30
福建省卫生厅青年科研课题(2013-2-55),福建省“大学生创新创业训练计划”项目(3120403044)
向 青(1985—),女,助理实验师,从事中药药效物质及药理作用机制研究。E-mai1:xiangqing1985@foxmai1.com
许 文6(1986—),男,研究实习员,从事中药药效物质基础研究。Te1:15806031248,E-mai1:yaoxuexuwen@qq.com
