COX-2在胆管癌中的表达及其选择性抑制剂对胆管癌细胞生长的影响
2015-10-19杨博马亦龙
杨博 马亦龙★
COX-2在胆管癌中的表达及其选择性抑制剂对胆管癌细胞生长的影响
杨博马亦龙★
目的 评估环氧合酶-2(COX-2)抑制剂塞来昔布对胆管癌细胞株QBC939生长和凋亡的影响。方法 通过western blot实验检测COX-2蛋白在胆管癌标本、胆管癌细胞株QBC939和肝内胆管上皮细胞HIBEpiC中的表达水平;通过WST-1实验检测塞来昔布对QBC939细胞生长的影响;通过裸鼠荷瘤模型评估塞来昔布在体内对QBC939细胞生长的影响;通过凋亡实验检测塞来昔布对QBC939细胞凋亡的影响。结果 COX-2蛋白在胆管癌组织中表达水平显著高于癌旁组织,在QBC939细胞中的表达水平显著高于HIBEpiC细胞;塞来昔布在体内和体外均可显著抑制QBC939细胞的生长;塞来昔布可诱导QBC939细胞发生凋亡。结论 COX-2抑制剂塞来昔布对胆管癌细胞的生长有显著抑制作用,该作用可能与其诱导细胞凋亡有关。
胆管癌 环氧合酶-2抑制剂 凋亡
目前胆管癌缺乏标准规范的化疗方案,众多基础实验和临床试验均证明常规化疗方案对胆管癌的疗效并不显著[1]。环氧合酶-2(COX-2)是人体合成前列腺素(PG)的限速酶,COX-2与肿瘤的关系密切,其过表达参与肿瘤的发生、发展[2];而以COX-2为靶点的COX-2抑制剂可显著抑制肿瘤的生长[3]。但目前关于COX-2与胆管癌之间的关系并未完全阐明。本研究主要检测COX-2在胆管癌组织中的表达状况,以探讨COX-2抑制剂对胆管癌细胞生长的抑制作用。
1 材料与方法
1.1材料 胆管癌细胞QBC939购自中科院上海分院细胞所细胞库;肝内胆管上皮细胞HIBEpiC购自美国ScienCell公司;BALB/C 裸鼠购自中国科学院上海实验动物中心;COX-2抑制剂塞来昔布购自美国辉瑞公司;细胞培养液购自美国Gibco公司;PCR引物由上海生物工程技术服务公司合成;凋亡试剂盒购自美国BD公司;抗COX-2单克隆抗体购买自美国圣克鲁斯生物公司;羊抗鼠二抗购买自美国KPL公司;ECL化学发光试剂盒购买自美国Pierce公司。
1.2方法 (1)病例收集:收集本院2009年1月至2014年1月行胆管癌根治术标本24例。所有标本经病理诊断证实均为胆管癌,并取相应癌旁组织作为阴性对照组。所有患者均签署手术同意书和病情告知书。(2)细胞培养: QBC939细胞和HIBEpiC细胞用含10%胎牛血清和1%青、链霉素的高糖DMEM培养于37℃、5% CO2的培养箱中。采用0.25%胰酶消化传代。(3)western blot实验:采用western blot方法检测COX-2蛋白表达。首先提取细胞浆蛋白,取30μg蛋白样品陆续完成变性、电泳、转膜(0.2μmPVDF膜)、封闭、一抗孵育(1μg/ml)、二抗孵育(0.2~0.5μg/ ml)、ECL发光、显影、定影等步骤。β-actin 蛋白作为内参照。(4)动物模型试验:21只雄性、年龄4周裸鼠饲养于SPF级环境下。将2×106个细胞注射于裸鼠的腋下。在接种2周后,可见米粒状肿块,成瘤率达90.5%(19/21)。分别予以高浓度塞来昔布[(50 mg/(kg·d)]、低浓度塞来昔布[(10mg/(kg·d)]进行灌胃。隔天灌胃,2次/d,连续灌胃28d。空白对照组采用等量等浓度生理盐水灌胃。每周测量肿瘤体积V=L×W2/2(cm3)。第28天处死裸鼠,摘除荷瘤称重(g)。(5)WST-1法检测QBC939细胞存活率:取对数生长期 QBC939细胞接种于96孔板中,每孔细胞数目约为104,然后让细胞贴壁过夜。在加入不同浓度塞来昔布(5、10、20、40、80μmol/L)处理72h后,各组细胞加入WST-1试剂,在37℃下孵育2h,然后采用酶标仪检测在450nm波长下的光密度值(OD)。细胞存活率=(实验组OD值/对照组OD值)×100%。(6)Annexin V-FITC双染法检测QBC939细胞凋亡:通过WST-1试验计算出塞来昔布的IC50值为29.97μmol/L,因而在本实验中采用该浓度进行凋亡检测。取对数生长期QBC939细胞进行试验,在加入塞来昔布处理72h后,收集细胞≥1×105个,PBS冲洗后,分别先后加入FITC-Annexin V和PI染色液,在避光条件下孵育。然后上流式细胞仪进行检测。
1.3统计学分析 采用SPSS17.0统计软件。所有数据均以表示。在三组数据组间比较时采用方差分析,两组数据组间比较时采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1COX-2在胆管癌组织和细胞中的表达COX-2蛋白在癌组织和癌旁组织中均有表达,其中COX-2蛋白在20例胆管癌标本中的表达水平显著高于相应正常组织(P<0.05)(图1A)。COX-2蛋白在QBC939细胞中的表达水平亦显著高于HIBEpiC细胞(图1B)。
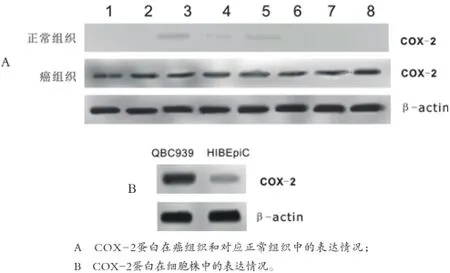
图1 COX-2蛋白在胆管癌组织和细胞株中的表达
2.2塞来昔布抑制QBC939细胞生长 不同浓度塞来昔布作用72h后,QBC939细胞生长受到不同程度的抑制。该抑制作用具有浓度依赖性,表现为药物浓度越高对QBC939细胞生长抑制作用越强(P<0.05)(图2)。计算得出半数抑制浓度(IC50值)为29.97μmol/L。
2.3塞来昔布抑制裸鼠荷瘤生长 采用塞来昔布灌胃后,在同一时间点裸鼠荷瘤体积显著小于对照组,而高浓度药物灌胃组荷瘤体积显著低于低浓度药物灌胃组(图3A)。在药物处理28d后,高浓度药物灌胃组裸鼠荷瘤重量最小,低浓度药物灌胃组裸鼠荷瘤重量次之,生理盐水灌胃组裸鼠荷瘤重量最大(图3B)。
2.4塞来昔布诱导QBC939细胞凋亡 塞来昔布作用72h后,QBC939细胞的凋亡比例显著增高,说明塞来昔布能够诱导QBC939细胞发生凋亡。见图4。
3 讨论
以肿瘤生长发展相关分子作为治疗靶点的分子靶向治疗越来越受到重视。近年来许多研究发现COX-2蛋白在多种消化道实体恶性肿瘤中如肝癌[4]、胃癌[5]、结肠癌[6]以及胰腺癌[7]中均存在表达异常升高的现象,且其高表达参与这些恶性肿瘤发生、发展的多个环节。

图2 塞来昔布抑制QBC939细胞生长

图3 塞来昔布抑制裸鼠荷瘤生长

图4 塞来昔布诱导QBC939细胞凋亡
COX-2蛋白在多数正常组织中表达微弱甚至缺失[8],当正常组织发生恶变时COX-2表达可受肿瘤发生发展过程中所产生的多种异常蛋白诱导而增高,例如炎性因子白介素-1[9]和白介素-8[10]、核因子KB (NF-KB)[11],低氧诱导因子1α(HIF-1α)[12]等。在本研究中,作者发现COX-2在胆管癌组织中表达异常升高,而在胆管正常上皮细胞中表达微弱,这与其他的研究发现基本相符。以上结果说明COX-2异常升高可能在胆管癌的发生和发展过程中起重要作用,也提示COX-2可能成为胆管癌治疗中的靶点。于是,作者在体内和体外研究中采用COX-2选择性抑制剂塞来昔布作用于COX-2高表达的QBC939细胞,并观察该细胞的生长和凋亡情况。
本资料显示塞来昔布在体内和体外均对胆管癌细胞的生长具有显著抑制作用,且这种抑制作用具有明显的浓度依赖性。通过计算得出塞来昔布对胆管癌细胞的IC50值约为29.97μmol/L。因此,在后续凋亡检测试验中选用该浓度。另外塞来昔布能够诱导胆管癌细胞发生显著凋亡。细胞凋亡是一种由机体主动调节、基因控制的程序性细胞死亡。凋亡根据信号途径和参与基因不同,可分为内源性凋亡途径和外源性凋亡途径,而参与基因根据其在凋亡过程中的作用不同可分为凋亡诱导基因和凋亡抑制基因,前者包括Fas,p53,bax等,后者包括bcl-2,bcl-xl等。研究发现,COX-2抑制剂能够促进凋亡诱导基因的表达,同时降低凋亡抑制基因的表达,最终导致凋亡[13,14]。这可能是塞来昔布导致QBC939细胞凋亡的原因。在本研究中未探讨具体分子机制,有待于后续研究。
1 Rizvi S, Gores GJ. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology,2013,145(6):1215~1229.
2 Cheng J,Fan XM.Role of cyclooxygenase-2 in gastric cancer development and progression.World J Gastroenterol,2013,19(42):7361~7368.
3 Moon CM, Kwon JH, Kim JS, et al. Nonsteroidal anti-inflammatory drugs suppress cancer stem cells via inhibiting PTGS2 (cyclooxygenase 2) and NOTCH/HES1 and activating PPARG in colorectal cancer.Int J Cancer, 2014,134(3):519~529.
4 Bae SH,Jung ES,Park YM,et al.Expression of cyclooxygenase-2 (COX-2)in hepatocellular carcinoma and growth inhibition of hepatoma cell lines by a COX-2 inhibitor,NS-398.Clin Cancer Res,2001,7(5): 1410~1408.
5 He XP, Shao Y, Li XL,et al. Downregulation of miR-101 in gastric cancer correlates with cyclooxygenase-2 overexpression and tumor growth. FEBS J,2012,279(22):4201~4212.
6 Wendum D,Masliah J,Trugnan G,et al. Cyclooxygenase-2 and its role in colorectal cancer development. Virchows Arch,2004,445(4):327~333.
7 Pomianowska E, Schjølberg AR, Clausen OP, et al. COX-2 overexpression in resected pancreatic head adenocarcinomas correlates with favourable prognosis. BMC Cancer, 2014, 14(1):458.
8 Chen WS,Wei SJ,Liu JM,et al.Tumor invasiveness and liver metastasis of colon cancer cells correlated with cyclooxygenase-2 (COX-2)expression and inhibited by a COX-2-selective inhibitor,etodolac.Int J Cancer, 2001,91(6):894~899.
9 Huang ZF,Massey JB,Via DP.Differential regulation of cyclooxygenase-2(COX-2) mRNA stability by interleukin-1 beta (IL-1 beta) and tumor necrosis factor-alpha (TNF-alpha) in human in vitro differentiated macrophages.Biochem Pharmacol,2000,59(2):187~194.
10 Manna SK1,Ramesh GT.Interleukin-8 induces nuclear transcription factor-kappaB through a TRAF6-dependent pathway.J Biol Chem,2005, 280(8):7010~7021.
11 Choi YH,Jin GY,Li GZ,et al.Cornuside suppresses lipopolysaccharide-induced inflammatory mediators by inhibiting nuclear factor-kappa B activation in RAW 264.7 macrophages.Biol Pharm Bull,2011, 34(7): 959~966.
12 He J,Wang M,Jiang Y,et al.Chronic arsenic exposure and angiogenesis in human bronchial epithelial cells via the ROS/miR-199a-5p/HIF-1α/COX-2 pathway.Environ Health Perspect,2014,122(3):255~261.
13 Yang MY, Lee HT, Chen CM, et al. Celecoxib Suppresses the Phosphorylation of STAT3 Protein and Can Enhance the Radiosensitivity of Medulloblastoma-Derived Cancer Stem-Like Cells. Int J Mol Sci, 2014,15(6):11013~11029.
14 周凯,徐建中,杨向东,等. 环氧化酶~2在婴幼儿血管瘤中的表达. 中华全科医学,2014,7:1032~1034.
Objective To evaluate the effects of Celecoxib,a selective cyclooxygenase-2 inhibitor,on the proliferation and apoptosis of QBC939 cells. Methods The expression of COX-2 in the tissue samples,QBC939 cells and HIBEpiC cells was examined using western blot assay. The in vitro inhibitory effects of Celecoxib on the proliferation of QBC939 cells were tested using WST-1 assay. The in vivo inhibitory effects of Celecoxib on the proliferation of QBC939 cells were evaluated on animal xenograft tumor models. In addition,the effects of Celecoxib on apoptosis of QBC939 cells were evaluated using Annexin V-FITC assay. Results The level of COX-2 expression in cholangiocarcinoma tissues was signifi cantly higher than that in normal tissues and its expression in QBC939 cells was also signifi cantly higher than that in HIBEpiC cells. Celecoxib signifi cantly inhibited the proliferation of QBC939 cells in vitro and in vivo. In addition,Celecoxib induced apoptosis of QBC939 cells signifi cantly. Conclusion Celecoxib can induce signifi cant apoptosis on QBC939 cells which may lead to growth inhibition of QBC939 cells in vitro and in vivo.
Cholangiocarcinoma Cyclooxygenase-2 inhibitor Apoptosis
530021 广西医科大学附属肿瘤医院介入治疗科
