食管鳞癌组织和血浆中COL14A1基因的甲基化及与临床特征的关系
2015-10-19郑燕芳李许锋蒋春雨周福有王贻诺张积仁
郑燕芳 李许锋 蒋春雨 周福有 王贻诺 张积仁★
·论著·
食管鳞癌组织和血浆中COL14A1基因的甲基化及与临床特征的关系
郑燕芳李许锋蒋春雨周福有王贻诺张积仁★
目的 对比分析食管鳞癌组织和癌旁组织,食管鳞癌患者与正常人的血浆,检测COL14A1的甲基化频率,并结合患者的临床病理特征,分析COL14A1基因甲基化与食管鳞癌的临床特征的关系。 方法 收集42例食管鳞癌组织标本和相对应的癌旁组织标本,同时收集42例食管鳞癌患者和50例正常人的血浆标本;应用甲基化特异性PCR(MSP)结合琼脂糖凝胶电泳检测COL14A1在组织和血浆中的甲基化情况。 结果 COL14A1在肿瘤组织中的甲基化频率为 45.24%,显著高于癌旁组织11.9%(P<0.001)。COL14A1在肿瘤患者血浆中的甲基化频率为30.95%,在正常对照组的血浆中未检测到甲基化。组织中的COL14A1甲基化频率在病理分期为N2组明显高于病理分期N0-N1组。血浆中的COL14A1甲基化频率在病理分期T3组明显高于病理分期T1~T2组。 结论 COL14A1在食管鳞癌组织的甲基化频率高于癌旁组织,在食管鳞癌患者血浆中的甲基化频率显著高于正常人,且临床分期越晚的甲基化频率越高。
食管鳞癌 甲基化 COL14A1基因 表观遗传学
食管癌是我国常见恶性肿瘤之一,其中河南林州为世界最高发地区。我国食管癌病理类型以鳞癌多见,>90%[1]。研究发现,早期癌变即可引起基因的甲基化异常改变,并且DNA甲基化变异可在体液和早期病变活检组织中检测到[2]。另外,DNA甲基化可通过去甲基化药物干预逆转,提示基因的甲基化异常可能作为早期发现食管癌变和治疗干预的生物靶点[3]。在前期芯片研究中,作者发现COL14A1基因启动子区甲基化在食管鳞癌和癌旁组织之间存在差异[4],为了进一步验证这一发现,本文进行了肿瘤组织样本和血液样本的验证,并且分析了COL14A1的甲基化与患者临床病理特征间的关系。报道如下。
1 临床资料
1.1一般资料 42例肿瘤组织和配对的癌旁组织于2012年6月至9月收集于河南省安阳市肿瘤医院,并与患者及家属签署知情同意书。所有标本经手术切除后,立即取肿瘤组织和癌旁组织,置于液氮中,后期-80℃低温储存,直至使用。所有标本手术前未接受过化疗、放疗等针对肿瘤的治疗,所有标本经病理科副高级以上职称病理确诊为食管鳞癌组织和正常癌旁组织。同时用EDTA抗凝管收集患者5ml血液,离心收集血浆,-80℃低温保存,直至使用。50例健康对照的血液样本来源于安阳市肿瘤医院内镜中心,内镜排除上消化道肿瘤的健康志愿者,签署知情同意书后采血,离心收集血浆,-80℃低温保存。收集标本的试验流程取得安阳市肿瘤医院伦理委员会同意。
1.2组织DNA的提取 组织DNA提取试剂盒购自QIAGEN公司,按说明书操作。取25mg组织加入80μl PBS中,用匀浆器充分搅打;加入100μl Buffer ATL,20μl 蛋白酶K,充分混匀,56℃温育至组织充分裂解。加入4μl RNase A(100 mg/ml),混匀,室温温育2min;加入200μl Buffer AL,混匀,70℃温育10min,短暂离心。加入200μl 无水乙醇,混匀15s,短暂离心,加入QIAamp I spin column中(200μl样本:200μl 无水乙醇),离心弃废液。加入500μl AW1,离心弃废液;加入500μl AW2,离心弃废液;QIAamp I spin column管离心,最高速1 min;加入30μl ddH2O于硅胶膜中央,室温孵育1min,离心洗脱DNA,为提高得率可重复一次洗脱。
1.3血浆DNA的提取 将200μl血浆加入到1.5 ml离心管里,加入20μl proteinaseK,充分混匀;加入200μl Buffer AL,充分混匀15s,56℃温育10min,短暂离心。加入200μl无水乙醇,混匀15s,短暂离心。加入QIAamp mini spin column中,200μl样本加200μl无水乙醇。离心,8000r/min,弃废液;加入500μl AW1,离心,8000r/min,弃废液;加入500μl AW2,离心,14000r/3min,弃废液;QIAamp mini spin column管离心,20000r/min 1min。加入30μl ddH2O于硅胶膜中央,室温孵育1min,离心,8,000r/min,洗脱DNA,为提高得率可重复1次洗脱。
1.4甲基化特异性PCR(MSP)反应 亚硫酸盐修饰试剂盒购自上海博升生物科技有限公司,按说明书操作。基因启动子区甲基化状态检测采用甲基化特异性PCR(MSP)法。该方法基本原理是运用亚硫酸氢钠处理DNA样本,通过化学作用,非甲基化的胞嘧啶转变为尿嘧啶,而甲基化的胞嘧啶保持不变。根据待测DNA序列,分别设计甲基化和非甲基化两套不同的引物对,在后续PCR反应中,若甲基化引物能够扩增出条带,则说明样品待测位点的CPG岛中胞嘧啶呈甲基化状态,若非甲基化引物能够扩增出条带,则说明样品待测位点的CpG岛中胞嘧啶是非甲基化的"阳性对照采用M.5551CpG甲基化酶(购自New England Biolabs公司)修饰胎盘DNA获得,同时设置双蒸水为阴性对照。COL14A1基因的甲基化PCR的引物序列见表1。

表1 COL14A1基因的甲基化PCR的引物序列
1.5电泳分析 取PCR产物进行3%琼脂糖(西班牙产,购自北京鼎国生物技术有限责任公司)凝胶电泳,EB染色后在紫外透射仪(TL一2000,TranS-1inker,Upland,USA)上观察结果,在凝胶成像系统(Imagemaster,PharmaliaBioteeh,USA)上摄片留存。1.6 统计学分析 采用SPSS13.0统计软件。统计分析方法为χ2检验,多重检验经P值校正,P<0.05为差异有统计学意义。
2 结果
2.1COL14A1在食管鳞癌和癌旁组织中甲基化差异分析 通过甲基化特异性PCR,在42对食管鳞癌组织和配对的癌旁组织中研究COL14A1的启动子区甲基化状态。甲基化PCR的结果见图1,在所有样本中均检测出了非甲基化。甲基化特异性PCR分析显示,在食管鳞癌组织和癌旁组织标本中COL14A1基因的甲基化频率分别为54.8%和9.5%,食管鳞癌组织中的甲基化频率明显高于癌旁组织(表2)。

图1 COL14A1基因甲基化特异性PCR后的电泳检测图。T:肿瘤组织,S:癌旁组织,TBP:肿瘤患者血浆,M:分子量对照(marker),P:阳性参照,N:阴性参照。
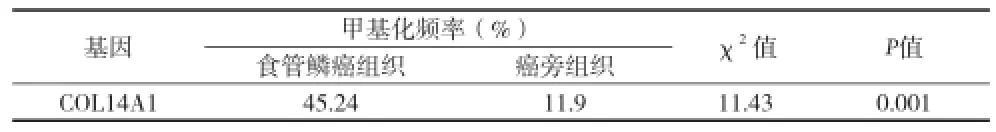
表2 COL14A1在42例肿瘤组织和对应的癌旁组织中的甲基化状态
2.2COL14A1的甲基化状态与食管鳞癌患者临床资料的关系 病理分期为N2组的GPX3基因甲基化频率,明显高于病理分期为N0~N1组,差异有显著性(P<0.001)。COL14A1的甲基化频率在性别、年龄、肿瘤家族史、肿瘤大小、病理分化程度、吸烟、饮酒之间差异无统计学意义。
2.3COL14A1在肿瘤患者血浆及健康对照血浆中的甲基化差异 检测42例肿瘤患者和50例健康志愿者血浆游离核酸中COL14A1的甲基化状态。在食管鳞癌患者的血浆中,COL14A1的甲基化频率为40.5%,在健康志愿者的血浆中未检测到COL14A1的甲基化,差异有显著性(P<0.01)。
2.4食管鳞癌患者血浆游离核酸中COL14A1甲基化状态和临床资料的关系 分析发现,病理分期T3组和病理分期T1~T2组比较,GPX3的甲基化频率较高,差异有统计学意义(P=0.015)。在不同性别、年龄、肿瘤家族史、肿瘤大小、肿瘤细胞分化程度、肿瘤病理分期、吸烟、饮酒分组中,COL14A1的甲基化频率差异均无统计学意义(P>0.05)。
3 讨论
表观遗传学是研究核苷酸序列不发生改变的情况下,基因表达发生可遗传变化的一门遗传学分支学科。表观遗传现象主要包括DNA甲基化、基因组印记、组蛋白修饰等[5]。其中DNA甲基化是最为重要,也是目前研究最为深入一种表观遗传学形式[6]。DNA甲基化是指在DNA双螺旋中,DNA甲基转移酶催化下,活性甲基被转移到特定碱基的过程[7]。在哺乳动物中,DNA甲基化主要发生在二核苷酸胞嘧啶(CpG)的第5位碳原子上,形成5`-甲基胞嘧啶。研究[8]表明,DNA甲基化在肿瘤发生发展过程中有重要作用,是肿瘤发生的早期事件之一,具有潜在的肿瘤标志物意义。
COL14A1是一种存在于细胞外基质中与胶原纤维成熟相关的大分子糖蛋白,而细胞外基质成分的改变被认为与肿瘤进展和转移有关。COL14A1与核心蛋白聚糖关系密切[9],后者是一种小分子富亮氨酸蛋白聚糖,已逐步被证明可强烈抑制多种肿瘤细胞生长,这种抑制作用可能由其核心蛋白与表皮生长因子受体和其他ErbB家族蛋白介导[10]。在肾癌细胞系和原发性肾癌中曾检测到COL14A1基因启动子区域高甲基化状态,且高甲基化与基因沉默和mRNA下调相关联[11,12]。本课题前期的芯片筛选试验中,发现食管鳞癌组织中也存在COL14A1基因启动子区域高甲基化状态。
本研究以前期高通量甲基化芯片筛选实验数据为基础,对我国食管鳞癌高发区食管鳞癌患者肿瘤组织及血浆游离DNA中COL14A1基因启动子区域甲基化状态进行检测分析,并探讨其与食管鳞癌临床特征的关系。结果显示,COL14A1在食管鳞癌组织的甲基化频率高于癌旁组织,在食管鳞癌患者血浆中的甲基化频率显著高于正常人。组织中的COL14A1甲基化频率在病理分期为N2组明显高于病理分期N0~N1组,血浆中的COL14A1甲基化频率在病理分期T3组明显高于病理分期T1~T2组。说明COL14A1基因的甲基化可能与肿瘤的浸润和转移有关。
食管鳞癌组织中COL14A1基因启动子区域存在异常高甲基化状态,这为食管鳞癌表观遗传学发病机制研究提供了新的线索。血浆游离DNA较为准确地反映了组织中COL14A1基因启动子区域甲基化状态的情况。由于血浆标本取材较为简单、基本无创,有较大的肿瘤标志物潜在价值[13,14]。相信随着更多大样本多中心研究的开展,血浆游离DNA中甲基化状态分析一定能为食管鳞癌的诊断和预后判断提供有力的帮助。
1 赫捷, 邵康. 中国食管癌流行病学现状、诊疗现状及未来对策.中国癌症杂志, 2011,21(7): 501~504.
2 Belinsky S A, Nikula K J, Palmisano W A, et al. Aberrant methylation of p16(INK4a)is an early event in lung cancer and a potential biomarker for early diagnosis. Proc Natl Acad Sci U S A, 1998,95(20): 11891~11896.
3 Esteller M. DNA methylation and cancer therapy: new developments and expectations. Curr Opin Oncol, 2005,17(1): 55~60.
4 Li X, Zhou F, Jiang C, et al. Identification of a DNA methylome profile of esophageal squamous cell carcinoma and potential plasma epigenetic biomarkers for early diagnosis . PLoS One,2014,9(7): e103162.
5 Bird A. Perceptions of epigenetics. Nature, 2007,447(7143): 396-398.
6 Jones P A, Takai D. The role of DNA methylation in mammalian epigenetics. Science, 2001,293(5532): 1068~1070.
7 Bird A P, Wolffe A P. Methylation-induced repression--belts, braces,and chromatin. Cell, 1999,99(5):451~454.
8 Jones P A, Baylin S B. The epigenomics of cancer. Cell, 2007,128(4):683~692.
9 Ehnis T, Dieterich W, Bauer M,et al. Localization of a Binding Site for the Proteoglycan Decorin on Collagen XIV(Undulin). Journal of Biological Chemistry, 1997, 272(33): 20414~20419.
10 Sofeu Feugaing DD, Gotte M, Viola M. More than matrix: the multifaceted role of decorin in cancer. Eur J Cell Biol, 2012, 92(1):1~11.
11 Ibanez de Caceres I, Dulaimi E, Hoffman Amanda M, et al. Identification of novel target genes by an epigenetic reactivation screen of renal cancer. Cancer Res, 2006, 66(10): 5021~5028.
12 Morris MR, Ricketts C, Gentle D, et al. Identification of candidate tumour suppressor genes frequently methylated in renal cell carcinoma. Oncogene, 2010, 29(14): 2104~2117.
13 Ikoma D, Ichikawa D, Ueda Y, et al. Circulating tumor cells and aberrant methylation as tumor markers in patients with esophageal cancer. Anticancer Res, 2007, 27(1B): 535~539.
14 Schwarzenbach H, Hoon DS, Pantel K. Cell-free nucleic acids as biomarkers in cancer patients. Nat Rev Cancer, 2011,11(6): 426~437.
Objective To detect COL14A1 gene methylation frequency difference between esophageal squamous cell carcinoma(ESCC)tissues and control normal tissues,between ESCC patients'plasma and healthy volenteers' plasma,and to analyze the correlation with clinicopathological parameters. Methods We collected esophageal squamous cell carcinoma tissues(n=42 cases)and adjacent surrounding normal tissues(n=42 cases),plasma of the esophageal squamous cell carcinoma(n=42 cases)and plasma of the healthy individuals(n=50 cases). We used Methylation specifi c PCR(MSP)combined with agarose gel electrophoresis to detect the methylation status of the COL14A1. We used SPSS 13.0 software for statistical analysis by χ2test and Fisher's exact test. Results GPX3 frequency of methylation in tumor tissue was 54.8%,signifi cantly higher than the adjacent tissues which was 9.5%,the difference was statistically signifi cant(χ2=28.873,P<0.001,n=84). In the plasma of cancer patients GPX3 methylation frequency was 40.5%,while the methylation of COL14A1 in the plasma of healthy volunteers was not detected. Methylation of GPX3 in tissue was more frequently seen in patients with T3 or N2 than in patients with T1-2 or N0-1. Conclusion The methylation frequency of COL14A1 is higher in ESCC tissus than in control normal tissues,and higer in plasma of ESCC patients than in healthy volunteers. GPX3 methylation was more frequently seen in patients with more advanced disease.
Esophageal squamous cell carcinoma GPX3 gene DNA methylation Epigenetics
国家自然科学基金青年项目(81202073)
510282 南方医科大学珠江医院肿瘤中心(郑燕芳 李许锋 张积仁)455000 河南省安阳市肿瘤医院放疗科(蒋春雨 周福有)200433 上海分子靶向研究所(王贻锘)*通讯作者
