血液中循环肿瘤细胞捕获与释放方法研究进展
2015-10-18陆宁宁程世博吕松伟黄卫华
陆宁宁, 谢 敏, 程世博, 吕松伟, 黄卫华
(生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉 430072)
1 引言
癌症是目前威胁人类健康最严重的疾病之一,肿瘤转移则是癌症高死亡率的主要原因[1]。在癌细胞转移过程中,有些细胞从原位肿瘤病灶脱离进入人体外周血循环系统,并随着血液循环进入其它组织和器官,生长成新的肿瘤组织。这种存在于循环血液中的癌细胞被称为循环肿瘤细胞(Circulating Tumor Cells,CTCs)[2]。2014年Alix-Panabières 等人[3]指出CTCs检测可用来解释肿瘤转移行为、反映肿瘤侵袭性,对于癌症治疗效果判断及肿瘤预测具有十分重要的意义。
虽然CTCs分选对癌症临床治疗具有很大的指导价值,但其检测却面临诸多困难与挑战[3]。首先CTCs数量十分稀少,每mL血中血细胞数量超过109个,而CTCs却只有几个到几百个[2],这便要求所用检测方法能高效准确地从大量非目标细胞中检测出极少的目标细胞;其次,CTCs的抗原表达存在异质性,同一类型的癌细胞其抗原表达往往具有差异,甚至同一个病人中的癌细胞抗原表达也不完全相同[4]。因此需发展高灵敏、高特异性方法,以实现血液中CTCs的分选及检测。
2 CTCs分选策略
近年来,随着人们对肿瘤转移机制的深入研究及检测技术的不断改进,多种CTCs富集、分离及检测方法得以涌现(图1)。按照分离原理,这些方法主要可分为基于物理性质分离及基于亲和识别分离两类[2]。其中,基于物理性质分离主要利用癌细胞与正常血细胞在尺寸[5,6]、密度[7,8]、变形性[9]及黏附性[10]等方面的差异对癌细胞进行分离;而基于亲和识别分离则是采用抗体[11 - 13]、核酸适配体[14,15]或E选择素[16,17]等物质识别癌细胞表面特定抗原,从而实现CTCs特异性识别及分离。
一般情况下,癌细胞在尺寸上大于血液中白细胞、红细胞及血小板等其它成分,因此可根据细胞大小不同,采用过滤方式分选CTCs。基于肿瘤细胞与血细胞间的尺寸以及变形性差异,Hosokawa等人[5]设计了具有尺寸选择性(8~9 μm) 的微腔阵列微流体装置,用于全血中癌细胞的快速分离。对于添加10~100个肺癌NCI-H358细胞的1 mL血液样品,该装置的分离效率可达97%,且回收细胞的活力约为98%。虽然依靠细胞尺寸的CTCs分选方法操作简单,对细胞无损伤且利于后续检测,但容易遗漏该尺寸范围以外的CTCs,特异性较低。
此外,也可利用CTCs与血细胞密度的差异对CTCs进行分选[7,8]。由于不同种类细胞密度不同,可通过离心方式分选细胞。但由于CTCs尺寸与部分血细胞尺寸交叉,分选的CTCs可能会与白细胞或红细胞等共沉积,导致灵敏度降低。为改进这一问题,Park等人[8]通过在微珠表面修饰EpCAM抗体,特异性识别CTCs增加细胞密度,大大提高了CTCs离心分选效果。
总体说来,基于物理性质的CTCs分离方法较为简单,能较大程度保持细胞完整性及活性,且对不同种类的CTCs均可分离,但此类方法缺乏特异性,易遗失相应尺寸及密度以外的肿瘤细胞。相比之下,基于免疫识别分离的方法可针对性分离表达特定抗原的细胞,具有更高的特异性。由于CTCs膜表面特异表达角蛋白(CK)[18]、上皮细胞黏附分子(EpCAM)[19]以及组织有关标志物如表皮生长因子受体(EGFR)[20]、前列腺抗原(PSA)[21]、癌胚抗原(CEA)[22]等物质,若将识别上述抗原的抗体或核酸适配体固定在固相基质上,则可实现CTCs特异性分离[23]。
免疫识别分离方法一般以磁性纳米颗粒、微纳米基质或微流控芯片为载体。磁性纳米颗粒良好的磁导向性为CTCs的可控分离提供了便利;而微纳米基质具有高比表面积和特殊形貌,可增加基质表面的抗体负载量,并通过三维拓扑相互作用增加细胞在基底上的黏附力,提高捕获效率[23];微流控芯片技术将采样、预处理、反应、分离、检测等功能集成在微芯片上,不但可以省去样品的前处理步骤,还可通过流体冲洗提高分离纯度。在此基础上将多种策略结合用于CTCs检测,不但可以保留各自优势,还能发挥不同基质间的协同作用,进一步提高捕获效率及纯度。
2.1 磁分离技术
纳米材料近年来受到了研究者的广泛关注。磁性纳米颗粒作为纳米材料的一种,除具备纳米材料的特性外,还具有良好的磁导向性和可操控性,被广泛应用于生物医学领域。目前唯一通过美国FDA认证的CTCs检测技术CellSearch系统,就是利用免疫磁珠富集技术实现对转移性乳腺癌、结直肠癌或前列腺癌CTCs的半自动化检测,具有较高的准确性和可重复性[24]。
磁性纳米颗粒表面经修饰改性后,可偶联抗体、酶、DNA或RNA等多种生物活性物质[25,26],通过这些生物分子与细胞表面的特异性受体结合,实现细胞的分离与检测[18]。由于磁性纳米颗粒具有优良的磁富集功能,可大大缩短分离时间,增强方法灵敏度。此外,修饰了生物活性分子的磁性纳米颗粒还可与其它纳米颗粒如量子点、金纳米颗粒等结合,构成多功能纳米探针,更加快速方便地用于生物体系中特定组分的捕获和分离[19,27]。我们课题组[19]通过层层组装的方式,在聚苯乙烯/丙烯酰胺共聚纳米球表面组装γ-Fe2O3及水溶性CdTe量子点,并连接anti-EpCAM抗体,构建了具备荧光-磁性-生物靶向多个功能的纳米探针,并成功用于乳腺癌细胞SK-BR-3的分离。
2.2 基于微纳米基质分离
纳米基质因包含纳米尺度级别的拓扑结构,被广泛用于组织工程学及再生医学等领域[28]。纳米结构可促进细胞与基质的相互作用,有利于细胞黏附、迁移、增殖分化及天然细胞外基质形成[29],这一特征对少量细胞的分离分析非常有利。尽管与基于物理性质的分离方法相比,基于亲和反应的CTCs检测方法可获得更高的捕获效率及特异性,但仍较难实现高纯度、高活力的CTCs分离。若将亲和识别分离与仿生纳米基质结合,不但能提高抗体在基质表面的负载量[30],同时可减缓细胞在通道中的运行速度,增大与基质界面的碰撞几率,因而可进一步改善CTCs分离效果。研究表明纳米结构可与细胞表面的微观结构发生相互作用,在无捕获试剂的情况下也可实现对癌细胞的捕获及分离[31]。因此微纳米基质为探索制备高效CTCs分离器件提供了新思路。
2.2.1纳米柱、纳米线及纳米纤维在CTCs捕获装置中,纳米柱、纳米线及纳米纤维基质均可通过多种方式获得。如利用湿法刻蚀或化学气相沉积法可制备纳米柱或纳米线基质[32 - 35]。Wang等人[32]通过湿法刻蚀在硅片表面制备硅纳米柱阵列,并在纳米柱表面固定anti-EpCAM抗体,用于乳腺癌细胞MCF-7的分离(图2A)。实验结果表明,硅纳米柱基质对细胞的捕获效率(45%~65%) 几乎为硅平面基质的(4%~14%) 的10倍,并且该装置对MCF-7细胞的捕获效率随着硅纳米柱长度增加而提高。Lee等人[35]也构建了以石英纳米线阵列为基质的CTCs分离装置并用于肺癌细胞A549的高效分离(图2B)。这些结果表明三维拓扑作用在细胞分离中扮演着十分重要的角色。
与纳米柱、纳米线的制备方式不同,纳米纤维一般通过静电纺丝技术制备而成[36 - 38]。Zhang等人[38]以钛酸四丁酯和聚乙烯吡咯烷酮(PVP)为前体,在硅片表面通过静电纺丝制备PVP及TiO2的复合纳米纤维,通过煅烧除去聚合物模板,最终形成直径为100 nm~300 nm 的TiO2纳米纤维。对TiO2纳米纤维进行硅烷化及抗体修饰后,用于癌症病人血样中CTCs捕获(图2C)。
2.2.2纳米粗糙表面由于CTCs的黏附性较血液中其它细胞强,所以粗糙界面的构建为CTCs高效分离提供了另外一种选择[31]。与纳米柱、纳米线及纳米纤维相类似,纳米粗糙表面因比表面积增加,大大提高细胞与基质表面的接触几率,促进了CTCs分离。如Sekine等人[30]构建的基于导电聚合物聚乙烯二氧噻吩(PEDOT) 的纳米粗糙表面可提高细胞分离效率(图2D)。他们通过电聚合方法在氧化铟锡(ITO) 表面形成纳米尺寸范围的PEDOT-COOH 纳米点,修饰EpCAM抗体后用于癌细胞分离。实验结果表明,由于配体-受体、基质纳米结构-细胞微观结构的协同相互作用,具有纳米点的粗糙界面对癌细胞的捕获效率为无纳米点基质的4~5倍。
2.2.3碳纳米材料以碳纳米管、石墨烯为代表的碳纳米材料因具有高比表面积、优良的导电性能和良好的生物相容性等特点,成为了生物传感器、储能材料、药物载体以及高分子等领域中的常用材料[23]。
利用碳纳米管、氧化石墨烯优良的导电性能可构建CTCs电化学传感器[39,40]。Wu等人[40]以氧化石墨烯为基础,构建了以癌细胞为对象的电化学检测装置(图2E)。他们在经过预处理的玻碳电极表面沉积氧化石墨烯并进行电化学还原,连接抗体后与细胞孵育;在此基础上,将修饰有量子点的二氧化硅纳米颗粒耦联抗体,并与固定于电极上的细胞形成免疫夹心结构,通过方波伏安及荧光成像实现了癌细胞的定量测定。
2.2.4仿生材料自然粒子如哺乳动物细胞和花粉,因具有独特的拓扑结构而呈现众多优良性能。以这些复杂结构的自然粒子为模板,可制备具有相应结构的仿生材料[41 - 43]。
利用仿生材料的拓扑特征可增强材料与细胞丝状伪足间的相互作用,从而提高分离效率。Huang等人[44]以胞吞磁性纳米粒子后的巨噬细胞为模板,在细胞表面进行硅化处理并高温煅烧,在硅材料表面保持了细胞形貌。通过在其表面修饰抗体,可获得具有拓扑结构、磁性、生物靶向多功能的微米探针并用于癌细胞分离(图2F)。尽管仿生材料在CTCs分离中的应用还较少,但由于其尺寸、形貌与细胞表面微观物质更为匹配,在细胞捕获及分离中具有更明显的增强效应。因此,发展新型仿生材料,构建更智能化的CTCs传感器将成为CTCs研究领域的一个重要研究方向。

图2 微纳米基质在CTCs 捕获中的应用.(A) 3D 纳米基质[32];(B) 石英纳米线[35];(C) 静电纺丝形成的TiO2纳米纤维[38];(D) PEDOT纳米点[30];(E) 基于石墨烯的电化学传感器[40];(F) 通过“细胞模板”制备的多功能颗粒[44]
综上所述,纳米材料因具有高比表面积,可显著改善基于物理性质分离方法中捕获效率及纯度不够高等问题。但纳米柱、纳米线、纳米纤维、纳米粗糙表面及仿生材料等纳米基质均要通过一系列微加工技术才能获得,因此制备过程较为繁琐、耗时,不适合大规模推广应用。
2.3 基于微流控芯片的CTCs分离
近年来,微流控芯片装置因其尺寸小、比表面高、流体可控及高度集成化等特点,已逐渐成为生物医学分析的重要平台,并广泛用于细胞培养、分选及检测等过程[45]。
最早用于制作微流控芯片的材料主要有石英、玻璃及单晶硅片,然而由于具备成本低廉、制备过程简单等特点,一系列有机聚合物如聚甲基丙烯酸甲酯(PMMA)、聚二甲基硅氧烷(PDMS) 和聚碳酸酯(PC) 等也逐渐发展成为芯片制作的常用材料[46]。
基于微流控芯片的CTCs分离方法通过在芯片通道内部修饰可识别细胞表面抗原的抗体或核酸适配体,当通入含CTCs的样本时,CTCs与通道表面捕获试剂结合,实现特异性分离。该法所需样品量小,无需对血液样品进行前处理,且流动的流体环境有利于去除非特异性吸附的其它细胞,从而提高分离纯度。
2.3.1基于硅材料的微流控芯片硅材料亲水性表面可促进细胞黏附,另外采用微加工技术可制作具有复杂及高精度结构的芯片。Nagrath等人[12]通过刻蚀法在硅片表面制备了78000个呈等边三角形排列的圆形微柱,并在微柱表面修饰anti-EpCAM抗体,将其用于病人血样中CTCs分离(图3A)。当流速为1~2 mL/h时,该装置能从116个癌症病人血样中检测出115个含CTCs的样本,分离纯度为50%,表明了该装置的灵敏性、特异性及有效性。另外,Gleghorn等人[47]在硅片表面构建八边形微柱阵列,并通过化学修饰方法连接抗体用于前列腺癌细胞的分离(图3B)。八边形结构设计可进一步增大细胞与微柱间的接触频率,从而提高分离效率及纯度。
虽然硅芯片在CTCs分离中有所应用,但却存在光学不透明性这一缺点。在芯片中引入玻璃材料,不但能保留硅片易于微加工的特点,还可以解决基质不透明的困难。基于此背景,Kim等人[48]构建了可对CTCs进行过滤分离的微流控芯片装置。首先将硅片与玻璃基底键合,并对硅片进行化学机械抛光及反应离子刻蚀等操作形成微腔阵列,在硅片顶部再次键合玻璃形成CTCs过滤装置。然后采用修饰抗体的微珠捕获靶细胞并放大细胞尺寸,便于血样流经芯片时拦截被捕获的细胞,而白细胞及红细胞由于尺寸较小随流体流动而被除去,该法回收率可达89.7%。由于芯片顶部及底部的玻璃具有良好透光性,分离后的细胞可进一步成像观察。由此可见,玻璃基质材料的引入扩大了基于硅材料的微流控芯片在CTCs分选中的应用范围。
2.3.2基于PDMS/玻璃的微流控芯片聚二甲基硅氧烷(PDMS)因具有光透明、化学惰性、无毒廉价、易使用、高弹性等特点,被广泛应用于微流控芯片领域[45]。而玻璃因具有良好透光性,常作为基底与透气的聚合物键合用于细胞实验,在细胞分离分析过程中可获得清晰的明场及荧光图片。
利用PDMS及玻璃作为芯片材料的优越性,Stott等人[49]设计了含鱼骨结构的8通道PDMS芯片,并将之与玻璃基底键合,在通道内部修饰抗体形成细胞分离装置(图3C)。将含靶细胞的血液样品通入芯片时,鱼骨结构大大增加细胞与基质表面的碰撞几率,进一步提高了捕获效率。借助免疫荧光染色方法及成像设备可对捕获到的细胞进行定性及定量分析。对于血样中掺杂的前列腺癌细胞,该装置可以实现91.8%的捕获效率,纯度为14%。除此之外,该芯片还能成功从癌症病人血样中分离出CTCs簇,这为追踪临床治疗效果提供了重要依据。在此基础上,Sheng等人[50]对芯片中的鱼骨结构进行优化,他们将鱼骨结构中的凹槽宽度由50 μm增加至120 μm时,分离后的细胞纯度可由61%提高到84%,显示出了该技术在临床应用中的潜力。
2.3.3基于热聚物的微流控芯片聚甲基丙烯酸甲酯(PMMA) 是一种高度透明的热塑性聚合物,具有质轻、价廉及易于成型等优点,可作为微流体装置的另一理想基质。利用含特定结构的金属模板作为掩膜,通过对PMMA进行紫外照射,可在其表面获得含丰富羧基官能团的图案化区域(图3D),并且可通过增加紫外光照射强度获得更粗糙的表面,进而提高表面功能化的有效面积。PMMA基质表面存在大量羧基官能团为抗体连接提供了有力条件,使基于该物质的微流控芯片应用于癌细胞的分离分析成为可能[51,52]。环烯烃共聚物(COC) 具有与PMMA相似的优点,但在紫外照射条件下可产生更多羧基,因此可在其表面连接更多数量的抗体,进一步提高捕获效率及分离纯度[53]。
与单独使用免疫磁富集的方法相比,微流控芯片用于CTCs的分选具有如下优点:首先可在芯片内部设计多种结构,通道内部结构与细胞表面微观结构的三维相互作用有利于提高捕获效率;其次在反应装置中可以进行洗涤,有利于提高分离纯度。但由于此类芯片往往对设计及结构要求较高,因此芯片制备过程较为繁琐。

图3 基于微流控芯片的CTCs分离.(A) 基于硅材料的CTC芯片[12];(B) 含八边形微柱阵列的微装置[47];(C) 鱼骨形芯片[49];(D)紫外照射后PMMA的表面修饰[51]
2.4 基于微流控芯片平台的磁分离技术
基于微流控芯片的免疫磁分离体系一般以芯片为载体,将表面连接抗体的磁性纳米颗粒及含靶细胞的悬浮液共同通入芯片中,在芯片内部实现混合、捕获、磁分离及洗涤等步骤。这种微流控芯片及免疫磁分离结合的方法除了具备免疫识别及磁分离功能外,还可进一步提高反应通量及分离纯度[54 - 56]。
基于上述原理,Toner等人设计了CTCs捕获平台“CTC-iChip”[54,57]。该芯片可分为两个部分:首先利用覆盖有可识别白细胞表面抗原的磁珠对白细胞进行标记,当血样流经微流体腔室第一部分时,在微流体作用下根据体积大小除去红细胞、血浆及多余磁珠;在芯片第二部分,通过惯性聚焦和磁分离技术将CTCs和白细胞分离。这一装置可使用阳性富集方式将EpCAM阳性表达的CTCs从病人血中分离,还可采用阴性富集方法将EpCAM表达较弱或不表达的CTCs分离。该法分离纯度较高,且对CTCs活性基本无影响,分离后的CTCs可进行培养、增殖及后续基因分析,适用于各种类型CTCs的检测。
2.5 基于微流控芯片平台的微纳米基质分离技术
微流控芯片的集成化优势为CTCs分离获得更高灵敏度、分离效率及纯度这一目标提供了广阔前景,但仍需发展新兴技术进一步提高上述指标,从而获得数量更多、纯度更高、活性更好的细胞目标群体用于后续分析。而微纳米基质可提供高比表面积以促进细胞黏附,有利于少量细胞的分离分析。近年来,将微纳米基质与微流控芯片结合用于CTCs检测得到了迅速发展。
如上文所述,Wang等人[32]构建了硅纳米柱阵列并成功用于MCF-7细胞分离,证明了三维拓扑相互作用在细胞分离中的重要作用。在此基础上,他们又对这装置进行了优化,通过在硅纳米柱基质顶部键合具有鱼骨结构设计的PDMS芯片,制备了NanoVelcro装置(图 4A),进一步增强细胞与基质的混合作用,提高对细胞的分离效果。这一装置已成功用于癌症病人血样的分析[11]。
另外,由于碳纳米管、氧化石墨烯比表面积较大,能较大程度提高分子吸附量,因而也有效用于细胞或生物分子检测。Chen等人[58]以碳纳米管为基础,结合微流控技术构建了细胞分离装置(图 4B)。由于碳纳米管间存在缝隙,流体可进入微柱内部,增加细胞与捕获基质的有效碰撞,同时还可以减少流体阻力,降低对细胞的损伤。Yu等人[59]将Fe3O4磁性纳米颗粒与氧化石墨烯混合,制备了Fe3O4-氧化石墨烯复合物并连接anti-EpCAM抗体(图 4C)。在磁场控制下,修饰有抗体的Fe3O4-氧化石墨烯复合物被固定于含镍柱阵列的微流控芯片中,当含靶细胞的细胞悬浮通入芯片时,该装置能对靶细胞进行分离。磁场撤除后,被分离的细胞可回收。
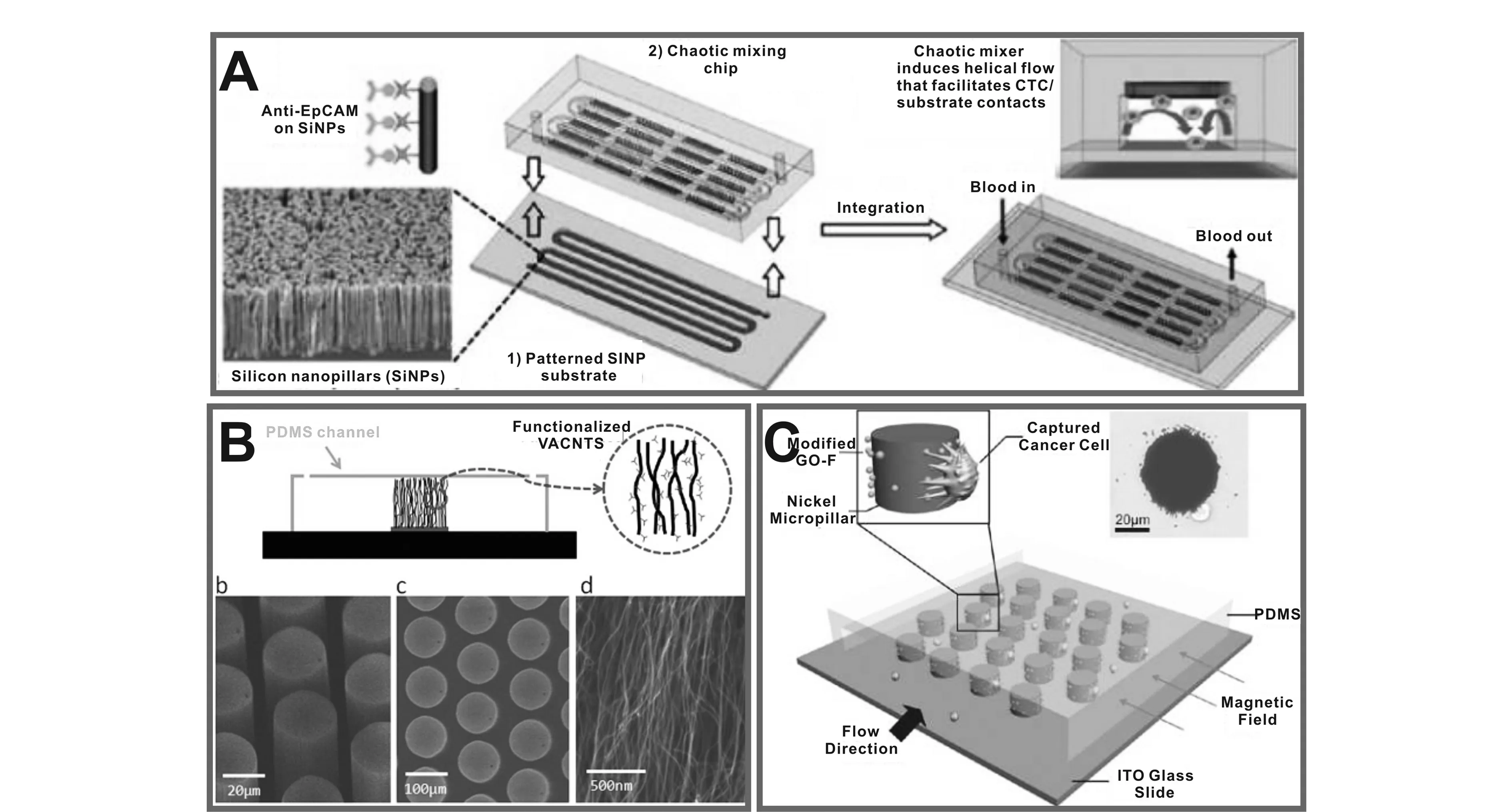
图4 纳米基质结合微流控芯片用于CTCs检测.(A)硅纳米柱基质与微流控芯片的集成[11];(B) PDMS芯片中垂直排列的碳纳米管基质[58];(C) 修饰氧化石墨烯-Fe3O4复合物的微柱装置[59]
将微流控芯片与纳米材料相结合,发挥两种技术在CTCs检测中的优势,有利于快速、高效捕获血液样品中少量CTCs。因此,基于微流控芯片和纳米技术的CTCs联合检测平台有望满足临床诊断中样品量少、检测通量高、实时快速等检测需求,在生物医学研究领域具有广阔的应用前景。
3 CTCs释放方法研究进展
采用上述系列CTCs分选技术,可将淹没于大量血细胞中的少量癌细胞富集,从而获得较高纯度的目标细胞群体。但分选后的细胞若继续保留于基质上,将不利于后续操作如细胞培养、PCR分析等的展开。Yu等人[57]于2014年发表在《Science》上的研究成果表明,若能将CTCs从捕获基质有效解离并对其进行体外培养,结合基因测序与体外药敏实验,将有助于建立基于CTCs的肿瘤个性化诊断技术。因此,发展有效的技术手段,满足CTCs高效捕获的同时实现CTCs无损伤释放,获取具有高生物活力的CTCs,是当前CTCs研究的另一热点。目前发展的CTCs释放方法主要基于酶解[34,60,61]、温控释放[33,62,63]、光化学断键[64,65]、化学竞争性结合[66,67]及电化学解析[68,69]等原理实现对捕获细胞的解离。
3.1 酶解释放
利用酶解原理实现细胞与捕获基质的解离较为简单,一般采用胰酶处理[60]或酶切[34,61]等方式。前者通过在捕获了细胞的基质中加入胰酶并结合流体作用力对细胞进行洗脱;后者则较多用于使用核酸适配体的体系,在核酸适配体特异性识别作用下,靶细胞可被基质捕获,而限制性内切酶或核酸酶的加入可切断捕获试剂与基质的连接,从而实现细胞释放。例如Shen等人[34]将生物素化的核酸适配体引入修饰有亲和素的纳米搭扣芯片中,实现靶细胞的特异性捕获,当往芯片内通入核酸内切酶时,>90%的细胞可从基质表面解离,释放后约80%的细胞保持良好活力(图 5A)。
3.2 温控释放
温控释放一般通过在基质中引入具有温敏性能的材料,利用外界温度变化调节细胞的黏附与分离。最常用的材料是聚N-异丙基丙烯酰胺(PNIPAAm)水凝胶,由于其大分子链上同时具有亲水基团(酰胺基) 和疏水基团(异丙基),因而具有良好的温敏性能。PNIPAAm水凝胶通常是在32 ℃发生体积相变,即其最低临界溶解温度(LCST) 一般为32 ℃。当温度低于LCST时,凝胶网络中高分子链上的亲水集团通过氢键与水分子结合,水凝胶高度溶胀。当温度高于LCST时,高分子链中疏水基团间的相互作用起主导作用,凝胶失水收缩[70,71]。随着亲水单体含量增加,水凝胶的LCST也将逐渐提高[72]。基于这一原理,Li等人[62]构建了含PNIPAAm水凝胶的细胞捕获及释放平台,通过增加亲水单体的含量将PNIPAAm的LCST提高至39 ℃。运用生物黏附分子RGD捕获细胞,当温度由37 ℃升至41 ℃时,水凝胶由亲水膨胀状态变为疏水收缩状态,在收缩过程中黏附在水凝胶表面的细胞随着溶液排出而被释放。此外,Tseng课题组也将pNIPAAm水凝胶用于细胞捕获与释放系统中(图5B),并获得了良好的细胞释放效果[33,63]。
3.3 光控释放
近年来,光响应释放体系也吸引了研究者的广泛关注。相比温度、pH等内在刺激源而言,光作为外在刺激能被精确调控,有利于实现细胞的“定时、定点”释放。
在CTCs释放体系中,光控释放一般通过在基质及捕获试剂之间连接光敏感性物质,在紫外或近红外光照射下光敏分子发生断裂,细胞被释放[64,65]。Lee等人[64]在微珠表面连接光敏分子后修饰抗体,将之用于癌细胞的捕获及释放,并获得了良好的分离效果(图5C)。
光致断裂的光敏基团主要有芘、硝基苄基类和香豆素类等,其中后两者更为常用。对硝基苄基类而言,紫外光和近红外光都可造成光解反应。而香豆素类基团由于对近红外光具有更高效的双光子吸收,在生物医学领域具有更广阔的应用前景[73]。虽然紫外光响应性体系能被精确调控,可远程控制细胞“定时、定点”释放,但存在穿透性差、对细胞杀伤性强等缺点。而近红外光(650~900 nm) 穿透力更强,且对组织体无害,因而更适用于构建CTCs光控释放体系。
3.4 竞争性结合引发释放
物质的相互竞争作用也能用来调控细胞的捕获与释放,竞争性结合试剂的添加往往能破坏原本稳定的细胞捕获体系,因而可实现细胞从基质中的解离。例如Liu等人[66]通过在硅纳米线上接枝3-丙烯酰胺基苯硼酸聚合物(polyAAPBA),制备了pH和葡萄糖双响应界面(图5D)。利用polyAAPBA/唾液酸和polyAAPBA/葡萄糖之间的竞争结合作用,通过控制pH和葡萄糖浓度,可对癌细胞进行可逆的捕获与释放。苯硼酸与唾液酸在相对较低的pH值条件下能形成稳定的络合物,当pH为6.8时polyAAPBA与细胞膜表面上的唾液酸结合,细胞被捕获;当pH升至7.8时,polyAAPBA中的部分3-丙烯酰胺基苯硼酸基团以四面体阴离子形式存在,在外加葡萄糖的条件下,以四面体阴离子形式存在的polyAAPBA与葡萄糖形成的稳定复合物,替代了polyAAPBA/唾液酸的作用从而将细胞释放;当pH恢复至6.8且没有葡萄糖时,四面体阴离子形式存在的polyAAPBA脱去羟基并重新与唾液酸结合,再次恢复细胞捕获功能。
3.5 电化学解析
电化学释放主要利用电化学活性物质在氧化还原过程中引起的键断裂(如Au-S)[68]或体积变化[69]等过程,将细胞从电化学传感器件表面解离。例如Jeon等人[69]利用氧化还原过程中电化学活性物质电荷转移引起的体积变化,设计了癌细胞捕获及释放体系(图 5E)。他们通过电化学方法在ITO表面沉积生物素-聚吡咯复合物,利用生物素与亲和素的相互作用将抗体固定至电极表面,实现细胞捕获。在外加电场刺激下,氧化还原反应发生并伴随电化学活性物质的电荷转移,引起可逆的体积变化,从而改变聚吡咯骨架与生物素之间的反应强度,使连接抗体的生物素从聚吡咯骨架上分离,实现细胞释放。

图5 释放被捕获CTCs 的不同策略.(A) 修饰有核酸适配体的纳米搭扣装置[34];(B) 具有温敏性质的纳米搭扣装置[63];(C) 可分解的微珠及过滤设备[64];(D) pH和葡萄糖双响应界面[66];(E) 掺杂生物素并修饰anti-EpCAM 抗体的聚吡咯电化学活性装置[69]
总之,上述释放方式因各有优势得到了充分发展,但也都存在缺陷及不足。采用胰酶释放细胞的方法虽然简单、容易操作,但效率低,选择性也较差,不易于获得高纯度CTCs。通过温控、光控释放及电化学解析虽能对释放过程进行精确调控,达到定时或定点释放效果,但却对材料要求较为严格。此外,限制性内切酶及化学竞争结合也只能分别适用于含核酸适配体或存在物质竞争作用的体系,这都极大限制了CTCs释放体系的快速发展。除此之外,上述方法在释放过程中都对细胞造成一定损伤,因此需要迫切发展更温和、灵敏且选择性好的CTCs释放方法。
4 结论与展望
综上所述,血液中CTCs因含量稀少且存在异质性,给CTCs分离分析带来了巨大挑战。尽管以纳米技术、微流控芯片、控制释放为基础的CTCs分离纯化体系已取得了重要进展,但要发展能真正用于癌症病人血液样本检测方法,实现CTCs的快速灵敏捕获、高效无损释放以及后续基因分析,当前依然面临严峻挑战。
首先,CTCs的分离纯度仍有待提高。研究表明,使用磁性纳米颗粒、微纳米基质或含特定结构设计的微流控芯片可获得理想的分离效率,但CTCs目前的分离纯度普遍较低[49,74]。因此通过发明新材料或发展新方法,保证CTCs高效捕获的同时,采取有效手段提高CTCs的分离纯度是当前的一个重要研究方向。其次,CTCs的无损释放及后续基因分析也是一个重要研究课题。当前,已有部分CTCs可逆释放体系取得了可喜进展,但释放过程中存在细胞损伤及释放效率较低等问题。因此必须建立温和的CTCs释放体系,获取纯度高、活力好的CTCs,方便对其进行后续培养及再分析。此外CTCs的研究应进一步深入,将释放后的CTCs体外培养,研究肿瘤转移机制并与体外药敏实验结合,将有助于建立基于CTCs的肿瘤个性化治疗技术。
