半整数生成函数法测定炔丙基半胱氨酸的有关常数
2015-10-18包行飞
包行飞, 张 云
(同济大学化学系,上海 200092)

图1 半胱氨酸(左)和炔丙基半胱氨酸(右)结构图
炔丙基半胱氨酸(S-propargyl-cysteine,SPRC)是半胱氨酸(Cysteine)的衍生物(半胱氨酸和炔丙基半胱氨酸的结构见图1),其酸碱性质及其与金属离子配合的性质类似于半胱氨酸及其他中性氨基酸。此外,与大蒜的主要活性成分烯丙基半胱氨酸(S-allyl-cysteine,SAC)一样,炔丙基半胱氨酸也具有显著的心血管药理活性和潜在的药用价值[1]。药物的离解常数、等电点及其与金属离子形成的配合物的稳定常数是其重要参数,也是新药报批、构效研究、结构修饰及质量控制的重要依据,对这些参数的测定具有重要的意义。生成函数法是测定酸离解常数或配合物稳定常数的常用方法。在酸碱反应中,已经与酸根结合的质子的浓度(或物质的量)与酸根的总浓度(或物质的量)之比,称作酸的质子化生成函数;在配位反应中,已经与金属离子配合的配位剂的浓度(或物质的量)与金属离子的总浓度(或物质的量)之比,称作配合物的生成函数。利用生成函数测定酸离解常数或配合物稳定常数的方法称作生成函数法;特别地,利用半整数时的生成函数测定酸离解常数或配合物稳定常数的方法称作半整数生成函数法[2]。本文以NaOH(或HCl)溶液作滴定剂,氢离子选择性电极作指示电极,半整数生成函数法作数据处理方法,对炔丙基半胱氨酸的离解常数、等电点及其与Cu2+和Zn2+形成的配合物的稳定常数进行了测定。
1 原理部分
1.1 半整数生成函数法的测定原理

lgKHA,j=-lg[H+]
(1)
或
lgKj=-lg[A-]
(2)

1.2 炔丙基半胱氨酸离解常数及等电点的测定
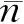
(3)
或
(4)
式(3)(或式(4))中,Vo和cHA是炔丙基半胱氨酸溶液的初始体积和浓度;VNaOH和cNaOH(或VHCl和cHCl)是滴定加入的NaOH(或HCl)溶液的体积和浓度;[H+]是H+的浓度;KW是水的质子自递常数。
在测出Ka1和Ka2的基础上,利用两性物质溶液pH的近似计算式[2]:
(5)
求出炔丙基半胱氨酸偶极离子溶液的pH,即炔丙基半胱氨酸的等电点pI。
1.3 炔丙基半胱氨酸-金属离子配合物稳定常数的测定

(6)
和
(7)
式(6)和式(7)中,Vo是炔丙基半胱氨酸与金属离子构成的混合溶液的初始体积;cM是金属离子的初始浓度;Ka是炔丙基半胱氨酸偶极离子的离解常数;其余物理量的含义同式(3)。

2 实验部分
2.1 仪器和试剂
798MPT自动电位滴定仪,氢离子选择性复合电极(瑞士,万通公司)。
0.09203 mol/L NaOH溶液,用基准邻苯二甲酸氢钾标定;0.09729 mol/L HCl溶液,用NaOH溶液标定;0.1000 mol/L 炔丙基半胱氨酸溶液;0.01974 mol/L CuSO4溶液,0.01960 mol/L Zn(NO3)2溶液,均用EDTA标准溶液测定准确浓度;pH为4.00、6.88及9.23(20 ℃)的成套标准缓冲溶液;1 mol/L KNO3离子强度调节剂。
2.2 实验步骤
2.2.1电极的校正见文献[3]。
2.2.2离解常数的测定吸取5 mL炔丙基半胱氨酸溶液,5 mL KNO3溶液及40 mL水,混合均匀。分别用NaOH溶液和HCl溶液等步长(0.10 mL)滴定上述溶液,测出m组滴定数据Vi和[H+]i(i=1,2,…,m);按上述原理,求出炔丙基半胱氨酸正离子的各级离解常数Ka,j。
2.2.3稳定常数的测定吸取5 mL炔丙基半胱氨酸溶液,5 mL CuSO4(或Zn(NO3)2)溶液,5 mL KNO3溶液及35 mL水,混合均匀。用NaOH溶液等步长(0.10 mL)滴定上述溶液,测出m组滴定数据Vi和[H+]i(i=1,2,…,m);按上述原理,求出炔丙基半胱氨酸-金属离子配合物的各级稳定常数Kj。
3 结果和讨论
3.1 测定结果
根据上述原理测得的实验结果见表1和表2。其中,实验温度20 ℃;式(3)和式(4)的KW用20 ℃的文献值(6.8×10-15);式(7)的Ka用本文测定值(表1)。
表1 炔丙基半胱氨酸正离子的两级离解常数及等电点的测定结果(n=3)

表2 炔丙基半胱氨酸-铜离子(或锌离子)配合物稳定常数的测定结果(n=3)
3.2 关于炔丙基半胱氨酸离解常数的讨论
首先,炔丙基半胱氨酸作为一种新型药物成分,其离解常数及等电点等数据并无相关文献可以比对,但其等电点的测定值(5.40)(表1)与其结构类似物烯丙基半胱氨酸等电点的文献值(5.60)[5]及半胱氨酸等电点的文献值(5.02)[2]非常接近温度。20 ℃时,炔丙基半胱氨酸水溶液(0.01000 mol/L)pH的测定值(5.43)也与其等电点的测定结果(5.40)(按式(5)求得的测定结果,表1)吻合。其次,实验测得的炔丙基半胱氨酸正离子的两级离解常数(10-2.08,10-8.72)(表1)介于半胱氨酸的离解常数[2](10-1.71,10-8.33)及烯丙基半胱氨酸的离解常数[5](10-2.20,10-9.10)之间。(1)根据电子效应,半胱氨酸上增加烃基,推电子效应将导致化合物酸性降低,所以烯丙基半胱氨酸和炔丙基半胱氨酸的酸性均应该小于半胱氨酸;(2)炔基的sp结构与烯基的sp2结构相比,电负性更大,吸电子能力更强,所以炔丙基半胱氨酸的酸性应该大于烯丙基半胱氨酸。因此,上述三种物质的酸性大小顺序应该为:半胱氨酸>炔丙基半胱氨酸>烯丙基半胱氨酸。这与炔丙基半胱氨酸离解常数的测定结果是相符的。
3.3 炔丙基半胱氨酸与金属离子配合的化学计量比


图2 0.09203 mol/L NaOH溶液滴定50 mL 由SPRC-Cu2+混合溶液的曲线 curve of 50 mL mixture of SPRC-Cu2+ titrated with 0.09203 mol/L NaOH
3.4 Cu2+和炔丙基半胱氨酸含量的测定

4 结论
半整数生成函数法是测定炔丙基半胱氨酸的离解常数,等电点及其与金属离子形成的配合物的稳定常数的有效方法。本文方法对与炔丙基半胱氨酸具有类似性质物质的有关常数的测定,有一定的借鉴作用。
致谢:本文实验所用炔丙基半胱氨酸试样,由复旦大学药学院马国博士提供,谨此致谢!
