跑台运动训练与按摩联合作用对大鼠骨骼肌急性损伤修复过程中炎症的发展及肌卫星细胞增殖的影响
2015-10-18唐成林唐念珍
杨 辉,常 青,唐成林,唐念珍,田 源,张 毅
骨骼肌损伤是运动中最为常见的软组织损伤,在肌肉损伤中所占比例最大[26]。在所有肌肉骨骼系统损伤中,钝器伤是最常见的损伤类型之一[23]。如此高的发病率让科研工作者一直致力于有关骨骼肌损伤修复机制的相关研究,现有研究观察了药物、康复理疗等干预因素对损伤动物模型愈合的促进作用。张建、陈世益、李云霞等[12]发现,在急性骨骼肌钝挫伤修复过程中,黄芪皂甙、丹参酮ⅡA注射液能减少损伤区域纤维疤痕组织形成,对损伤部位骨骼肌纤维直径无明显影响。葛新发、潘卫东、董贵俊等[3]发现,磁纳米化的bFGF比直接注射bFGF能明显改善大鼠急性骨骼肌钝挫伤后肌肉收缩应力和恢复应力衰减。罗丽、张林、董宇等[9]发现,低功率激光能增强急性骨骼肌钝挫伤大鼠肌卫星细胞增殖活性,从而加速骨骼肌的再生,促进损伤修复;Kasemkijwattana、Channarong MD 等[24]通过在损伤骨骼肌中注射生长因子,提高骨骼肌损伤后修复。但是,有关运动训练促进骨骼肌损伤修复的文献却很少。
N复合体I,即NADH-泛醌还原酶,是细胞能量代谢所必需的辅酶,是线粒体中能量产生链中的控制标志物,在维持细胞生长、分化和能量代谢以及细胞保护方面起着重要作用[1,14,19]。肌卫星细胞是位于肌膜和基底膜之间的梭形单核干细胞,一般情况下处于静止状态,当受到损伤或刺激时即被激活并增殖,然后,与原有骨骼肌细胞相互融合,形成新的肌纤维细胞,动物出生后,在肌肉组织的生长和肌肉损伤的修复过程中起着重要作用[30]。而NO/HGF/c-Met作为肌卫星细胞激活主要信号通路之一[2],在肌卫星细胞的激活增殖中发挥了重要作用。
随着国家大力发力发展竞技体育与全民健身运动,运动损伤也大量出现,科学的防治运动损伤是现今科研工作者面临的一大难题。本研究结合现状,紧接前期研究[5-8],探讨跑台运动训练与按摩联合作用对大鼠骨骼肌急性损伤修复过程中NADH还原酶及NO/HGF/c-Met通路的影响,研究跑台运动训练与按摩联合作用对炎症的发展及肌卫星细胞增殖的分子机制,为临床按摩与跑台运动训练联合治疗骨骼肌损伤提供一定的实验理论依据;也为运动员肌肉损伤的治疗方法与康复手段的发展提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
本研究共选取12周健康成年雄性SD大鼠76只,体质量200~230g/只,均由重庆医科大学实验动物中心提供(医学动物合格证SCXK渝在20070002)。常规分笼饲养,每笼1只,室温(21±2℃),相对湿度为65%~75%,自然光照,每日正常饮水,喂食标准饲料。
1.1.2 主要试剂及仪器
主要试剂:1)NDUFA1Antibody(G-13)试剂,编号 :sc-131623,购自Santa Cruz生物科技公司;2)RNA逆转录(Perfect Real Time)试剂盒,RNAiso Plus试剂,荧光定量SYBR○RPremix Ex TaqTM II(Tli RNaseH Plus)试 剂 盒,DEPC水,均购自日本TAKARA生物公司。2×Taq MasterMix(含染料)酶 :购自北京天根生化有限公司;3)8%硫化钠脱毛剂。
主要仪器:小动物跑台,6跑道,型号:M9W-315587,购自北京中西远大科技有限公司,低温离心机购自德国LEICA生物科技公司,荧光定量PCR仪购自美国ABI生物科技公司 ,PCR仪购自美国MJR生物科技公司。自制软组织打击器、AFY—10型按摩器(天津产)。生物显微镜、图像采集系统等设备由重庆医科大学生命科学研究院提供。
1.2 实验方法
1.2.1 动物造模
自制打击器参照了KATSUYA KAMI[25]的模型。在造模的前一天用8%硫化钠脱毛剂除去B、C、D、E各实验组大鼠右侧小腿腓肠肌被毛,用10g/L水合氯醛腹腔麻痹后,重物下落导致一次性打击伤,打击部位为大鼠右侧小腿内侧面(其皮下为腓肠肌中段),打击器为一打击面平坦的空心铝制圆柱体(直径1cm,长20cm,质量20g),底面与木制圆柱体相接(直径1cm,长2cm,质量2g),木制打击面与打击部位直接接触,自制重力锤640g,从25cm高处落下,重力6.27N,产生1.57J的动能打击力,造成腓肠肌急性中度挫伤模型。造模后即刻麻醉解剖,通过病理、功能检查,观察损伤部位肌组织断裂程度、是否骨折,证实腓肠肌有一定的收缩功能障碍,无骨折,属急性中度腓肠肌挫伤模型。重力锤的投放和大鼠的固定均由一人操作,保证打击力和损伤部位及程度的一致性。
1.2.2 分组处理
所有实验SD大鼠经过适应性喂养1周后,随机分成5组。分别为正常对照组(A组,n=4)、自然恢复组(B组,n=24)、按摩组(C组,n=16)、跑台组(D组,n=16)、混合组(E组,n=16)。各组又根据造模后时间观察点不同,B组又分为造模后1d、3d、7d、14d、21d、28d6个亚组(每个亚组4只),C、D、E组分为造模后7d、14d、21d、28d4个亚组(每个亚组4只)。A组为空白对照组,不做任何处理;B、C、D、E组SD大鼠用自制打击器造大鼠右后肢腓肠肌损伤模型。B组不给予按摩,C组于造模后第3天开始给予按摩,D组于造模后第3天开始给予跑台运动训练,E组造模后第3天开始给予按摩加跑台运动训练。正常对照组于造模前一天取标本;自然恢复组1d、3d、7d、14d、21d、28d处死大鼠取标本;C、D、E组分别造模后7d、14 d、21d、28d处死大鼠取标本。提取大鼠右侧腓肠肌损伤最严重区域的肌肉,一部分用PBS缓冲液冲洗干净后,放入事前标记好的1.5ml离心管,于液氮冻存0.5h,然后转移到-80℃冰箱,待Western Blot检测肌组织NADH还原酶蛋白量,待实时荧光PCR检测nNOS、HGF mRNA转录水平;另一部分用生理盐水清洗干净后,用4%多聚甲醛固定,备以石蜡切片及HE染色。
1.3 跑台运动训练干预方案
造模后第3天,跑台组、混合组实验大鼠介入跑台运动训练。在动物的暗周期进行训练,每周训练5d,每天训练1次。跑台运动恢复训练参照Bedford[16]训练方案进行(表1)。
1.4 按摩干预方案
造模后第3天,按摩组、混合组实验大鼠介入震动按摩治疗。实验大鼠震动按摩干预操作步骤:1)实验大鼠按1ml/kg体质量用10g/L水合氯醛进行腹腔麻痹;2)麻醉后将实验大鼠以侧卧位的方式固定,损伤侧位于健侧腿之上;3)将天津产AFY-10型小动物按摩器按摩头固定于大鼠受损腓肠肌中部及邻近肌组织下;4)让按摩头对受损组织进行按摩干预,设置按摩头转速为2600r/min,按摩时间为15min,每天1次[10]。

表1 本研究大鼠跑台运动训练方案一览表Table 1 Proposal of Treadmill Running Exercise
1.5 实时荧光定量PT-PCR检测大鼠骨骼肌nNOS、HGF mRNA转录水平
1.5.1 引物设计与合成
检索美国国立生物技术信息中心NCBI数据库(Gene Bank)中nNOS、HGF mRNA序列,用Primer P remier5.0软件设计出nNOS、HGF基因以及内参GAPDH基因的上下游引物序列(表2),均由TAKARA生物工程(大连)有限公司合成。

表2 nNOS、HGF和GAPDH基因引物序列一览表Table 2 Sequences and Detalls of Target Genes
1.5.2 总RNA提取与鉴别
选取冻存于-80℃冰箱中离心管的样本,加入液氮预冷的研钵中,用研杵研磨组织,其间不断加入液氮,直至研磨成粉末状,按照RNAiso Plus试剂盒说明书提取RNA。用TE Buffer稀释RNA后测定吸光度,使用紫外分光光度计检测,OD260/OD280比值在1.7~2.1为好。
1.5.3 RNA逆转录反应
取1μg的总RNA,按照逆转录试剂盒(TAKARA)配配制PT反应液(总体积10μl),逆转录后得cDNA模板。
1.5.4 实时荧光定量PCR(Real-Time PCR)
Realtime PCR反应体系为20μl,其中,SYBR○RGreen PCR Master Mix(TOYOBO)10μl,前向、反向引物各1μl,dH206μl,cDNA 模 板 2μl。 反 应 条 件,tep 1:预 变 性(95℃,30s);Step 2:(95℃,15s;55℃/56℃,30s;65℃,30s)×40个循环;Step3:扩增建立PCR产物的熔解曲线,再变性 (95℃,15s),退 火 (55℃/56℃,35s),然 后,从55℃/56℃缓慢加热到(95℃,15s);每1℃收集荧光一次。经仪器自动分析,各基因融解曲线(Melt Curve)均为单峰,表明扩增产物特异性较高。反应结束后,PCR仪给出各反应孔的Ct值,以GAPDH基因为内参,根据公式2-△Ct(△CT=CT-target-CTGAPDH)计算出样品目的基因的相对表达量。
1.6 Western Blot检测肌组织NADH还原酶蛋白量
1)灌制聚丙烯凌胶,10%分离胶,4%浓缩胶;2)上样量50μg,每样至少上2块平行胶;3)电泳电压浓缩胶90 V,分离胶160V,电泳液为甘氨酸缓冲液;4)电泳结束后,取出凝胶,和相同大小的PVDF(先用95%乙醇固定)置于3层滤纸中间,放入转移槽中,加满转移液,300mA约90 min;5)取出PVDF膜,自然晾干后,置于95%乙醇中固定;自然晾干;6)0.01MPBST洗5min;7)放入5%脱脂奶粉中封闭非特异性蛋白,37℃恒温摇床下约4h;8)加I抗体(1∶1000用0.01MPBT配制),37℃恒温摇床下3~4h;9)0.01MPBST洗15min×3次;10)加 HRP标记的二抗(1∶1000用0.01MPBST配制),室温下1~2h;11)0.01M PBST洗15min×3次;12)将PVDF置于NEN化学发光试剂中增强反应1~3min;13)在暗室中使X光片爆光,常规方法显影,定影,并扫入凝胶成象系统进行图象分析,计算光密度值(OD值),重复3次。
1.7 组织学观察
取出固定于4%多聚甲醛的各实验大鼠受损腓肠肌标本,常规乙醇梯度脱水、二甲苯透明、石蜡包埋、然后切片5μm/片,HE染色后置于生物显微镜下观察受损组织病理学改变,在图像采集系统下获取图片。
1.8 数据处理
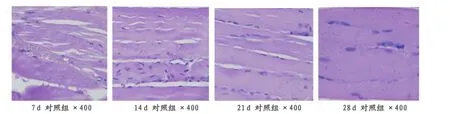
图2 本研究自然对照组大鼠小腿腓肠肌组织学观察图(HE,400×)Figure 2.The Histological Observation of the Gastrocnemius in Control Group(HE,400×)
2 实验结果
2.1 造模前、后实验各组大鼠骨骼肌组织变化
正常对照组大鼠骨骼肌肌节结构完整,肌丝排列整齐,肌细胞正常(图1A)。自然恢复组大鼠肌纤维断裂、碎解,炎症细胞浸润,吞噬碎片,肌节结构紊乱(图1B)。
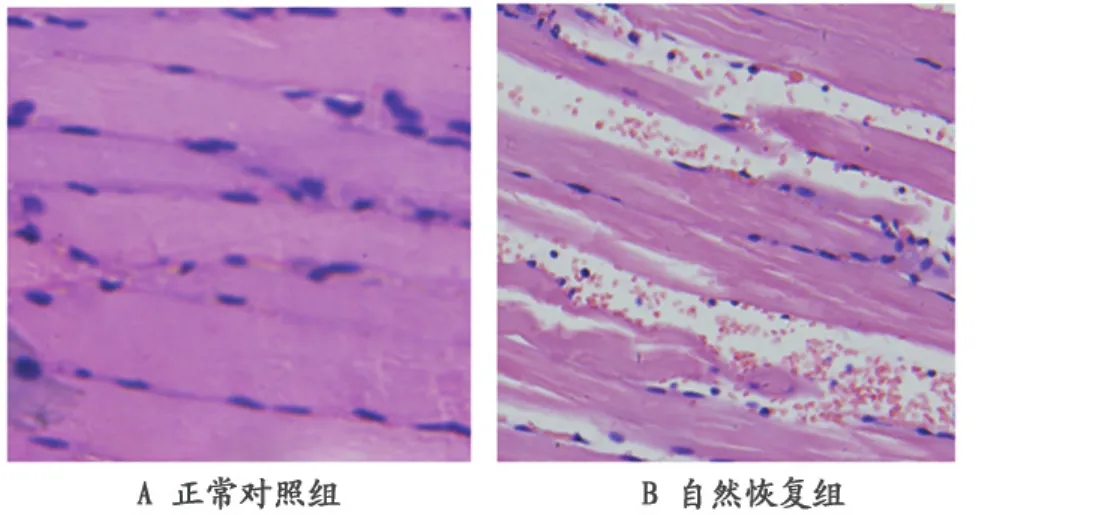
图1 本研究大鼠小腿腓肠肌组织学观察图(HE,400×)Figure 1.The Histological Observation of the Gastrocnemius in Rats(HE,400×)
自然恢复组7天后可见少量成肌细胞,炎症细胞减少,线粒体较少;14天后出现肌管自然恢复组出现在肌管,成肌细胞核出现,周围有新生肌纤维;21天后肌管融合,损伤部位出现疤痕组织;28天后,损伤部位基本愈合,但是疤痕组织明显(图2)。
按摩组7天后炎症细胞减少明显,出现少量线粒体、大量成肌细胞,并有一定量成肌细胞核出现,周围有大量新生肌纤维,肌卫星细胞增殖明显;14天后大量肌管出现,肌卫星细胞增殖更加明显,肌纤维排列有序;21天后肌管融合,肌纤维排位整齐,损伤部位基本愈合:28天后损伤部位完全愈合,疤痕组织微小(图3)。
跑台组7天后炎症细胞减少亦明显,出现大量线粒体,大量成肌细胞:14天后出现大量肌管,并融合成肌纤维,肌卫星细胞增殖明显;21天后,肌纤维排列整齐,损伤部位基本愈合;28天后损伤部位完全愈合,肌组织排列整齐,少量疤痕组织,与正常对照组无异(图4)。
混合组7天后炎症细胞基本消失,出现大量线粒体,肌卫星细胞增殖明显,出现大量肌纤维;14天后,肌卫星细胞增殖更加明显,新生肌纤维相互融合,排列整齐;21天后,损伤肌组织已基本痊愈,新生肌纤维排列整齐,并伴有大量成肌细胞核:28天后,损伤部位痊愈,基本无疤痕组织,与正常对照组肌组织相比,混合组有更多成肌细胞 核、线粒体,肌组织排列更加紧凑(图5)。

图3 本研究按摩组大鼠小腿腓肠肌组织学观察图(HE,400×)Figure 3.The Histological Observation of the Gastrocnemius in Massage Group(HE,400×)
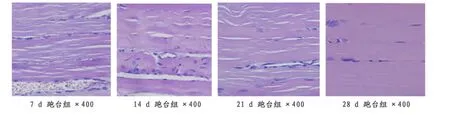
图4 本研究跑台组大鼠小腿腓肠肌组织学观察图(HE,400×)Figure 4.The Histological Observation of the Gastrocnemius in Treadmill Exercise Group(HE,400×)
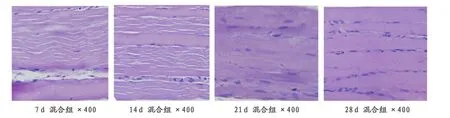
图5 本研究混合组大鼠小腿腓肠肌组织学观察图(HE,400×)Figure 5.The Histological Observation of the Gastrocnemius in Mixed Group(HE,400×)
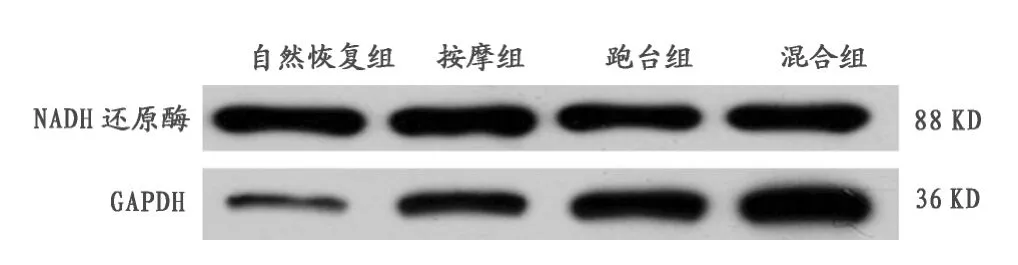
图6 本研究各组大鼠骨骼肌中NADH还原酶蛋白量比较图Figure 6.NADH Reductase Protein in Each Group
2.2 Western Blot检测实验各组肌组织NADH还原酶蛋白量结果
表3显示,C、D、E组与B组比较,肌组织NADH还原酶蛋白量明显增高,且具有极显著性差异(P=0<0.01),说明干预组比自然恢复组能量代谢更好;E组与C、D组比较,肌组织NADH还原酶蛋白量明显增高,且具有极显著差异(P=0<0.01),混合组增加肌细胞NADH还原酶蛋白量效果最明显;D组与C组比较,肌组织NADH还原酶蛋白量明显增高,且具有极显著差异(P=0.006<0.01),在提高肌组织NADH还原酶蛋白量上,跑台组比按摩组明显。
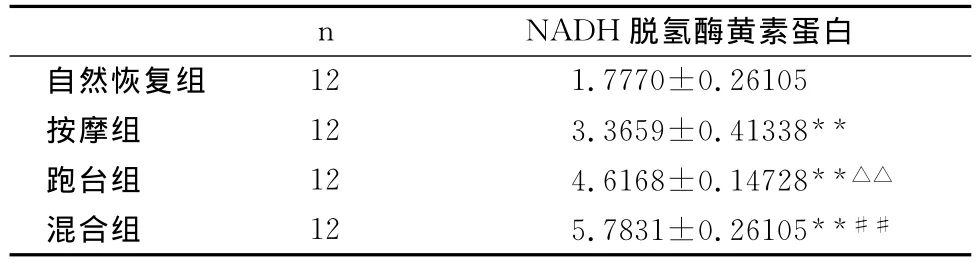
表3 本研究各组大鼠骨骼肌中NADH还原酶蛋白量的比较一览表Table 3 NADH Reductase Protein in Each Group
2.3 实验各组骨骼肌肌卫星细胞中nNOS、HGF mRNA整体转录水平实时荧光定量PCR检测结果
表4显示,C、D、E组与B组比较,骨骼肌肌卫星细胞中nNOS、HGF mRNA整体转录水平明显增高,且具有极显著差异(P=0<0.01);E组与C、D组比较,骨骼肌肌卫星细胞中nNOS、HGF mRNA整体转录水平明显增高,且具有极显著差异(P=0<0.01)。

表4 本研究大鼠骨骼肌中nNOS、HGF mRNA转录水平一览表Table 4 nNOS,HGF mRNA Transcription in Each Group
2.4 实验各组骨骼肌NADH还原酶,nNOS、HGF mRNA转录水平治疗前后对比
通过跑台运动训练与按摩的联合作用,控制组各组骨骼肌损伤区域NADH还原酶,nNOS、HGF mRNA转录水平明显高于自然恢复组,这说明跑台运动训练与按摩能明显改善骨骼肌损伤的修复,在修复效果上,联合干预好于单独干预,跑台运动训练效果好于按摩。
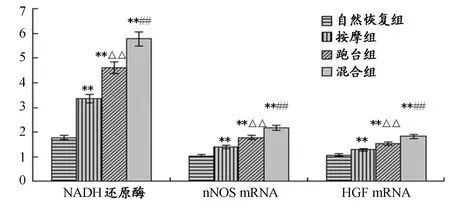
图6 本研究各实验大鼠治疗前、后骨骼肌中NADH还原酶、nNOS、HGF mRNA转录水平图Figure 6.Comparison of NADH Reductase、nNOS,HGF mRNA Transcription of the Control and the Model
3 讨论
骨骼肌损伤修复过程的极其复杂性,使骨骼肌损伤一直成为现在研究的热点和难点。骨骼肌急性损伤后,肌纤维膜受损,细胞内Ca2+外溢,导致局部Ca2+浓度升高,激活Ca2+依赖的蛋白酶,抑制正常线粒体呼吸,激活补体,募集炎症细胞,引起局部坏死。随后,炎症因子会释放一些成肌细胞趋化因子和促分裂因子[20,28],紧接着血管化随着吞噬作用而发现,并释放一些血管源性因子,如IGF、FGF等[28]。肌成肌细胞趋化因子和促分裂因子激活肌卫星细胞与纤维母细胞参与修复,它们增殖、增生、分化、融合,形成新肌管,在这个过程中,新生的肌纤维通常从未受伤部分开始,向受损区域延伸,数个新形成的肌管向幸存的肌纤维融合[22,29]。如果成纤维细胞过程增殖则会形成疤痕组织,导致不完全的恢复,影响肢体正常功能。
在这个复杂的动态修复过程中,炎症的发展以及肌卫星细胞的激活增殖对骨骼肌损伤的修复都具有十分重要的作用。炎症反应学说提出钙离子在骨骼肌损伤中起触发作用,当肌组织受到损伤,肌膜上K+-Na+-ATPase异常,影响肌细胞K+-Na+交换、Ca2+超载,导致线粒体结构受损,三羧酸循环发生困难,氧化磷酸化过程中的能量转换异常,活性氧类物质逐渐累积,进一步造成肌膜、线粒体膜的破坏,导致能量代谢障碍以至细胞死亡[4,31]。能量的代谢对于骨骼肌损伤后炎症的发展起着决定性的作用。NADH还原酶简称复合体Ⅰ(complexⅠ),作为线粒体呼吸链上的重要限速酶,在生物氧化过程中起着电子传递的作用,是细胞能量代谢所必需的辅酶。NADH还原酶的活性和蛋白量直接影响细胞能量的代谢,它通过影响肌膜K+-Na+-ATPase的活性来影响 K+-Na+交换、Ca2+代谢。当损伤肌组织炎症持续发展,NADH还原酶活性被抑制,直接导致肌膜K+-Na+-ATPase的活性下降,K+-Na+交换、Ca2+代谢障碍,Ca2+超载,更多的线粒体结构、肌浆网受损,进而引起局部组织结构损伤的加重和肌肉内部的损伤,出现肌原纤维断裂,线粒体膜、肌膜的破坏等现象,最终导致细胞坏死。而受损、坏死的细胞吸引炎症细胞聚集,分泌更多的炎症因子,抑制了肌成肌细胞趋化因子和促分裂因子分泌,影响了肌卫星细胞的激活、增生、分化、融合形成肌管的再生修复过程。可见,NADH还原酶的活性与骨骼肌损伤的修复也密切相关。
一般情况下,骨骼肌肌卫星细胞处于静息状态,当受到外界刺激时,如损伤、牵拉或肌肉萎缩引起的病变时,卫星细胞能够被激活[17]。Angelis[18]在有关损伤区域肌卫星细胞作用的研究中认为,肌肉损伤区肌卫星细胞的增殖和分化,是达到损伤修复目的的主要途径。有研究表明,NO/HGF/c-Met信号通路对肌卫星细胞的激活起着关键作用。骨骼肌细胞在受到刺激后可通过相应机制增加一氧化氮合酶数量或活性,然后,合成并释放NO,成为肌卫星细胞激活的起始信号;NO介导HGF及c-MET在肌卫星细胞的共同定位作用[32];HGF一方面与其受体c-MET结合,引发磷脂酰肌醇3-激酶(PI3K)和丝裂原活化蛋白激酶等相关基因转录和细胞分裂的多个信号通路;另一方面,下调肌肉生长抑制素水平以保持肌卫星细胞静息状态,从而激活肌卫星细胞[28]。肌卫星细胞增殖、增生、分化、融合,最终形成新肌管,完成修复。nNOS、HGF mRNA表达的量决定了NOS、HGF蛋白的量,NOS介导NO的合成,间接影响NO介导的NO/HGF/c-Met信号通路,影响肌卫星细胞的激活、增生、分化以及融合形成肌管。
前期研究已发现,骨骼肌损伤修复的生理生化机制。按摩可以增强SDH和K+-Na+-ATPase酶活性的。按摩可以抑制兔钝挫伤骨骼肌瘢痕的形成,兔骨骼肌钝挫伤恢复过程中碱性成纤维细胞生长因子有干预作用以及有促进骨骼肌损伤后肌纤维再生[11]等。查阅国内、外最新研究报道,却没有发现有关跑台运动训练与按摩联合作用对骨骼肌急性损伤修复过程中线粒体呼吸链关键酶NADH还原酶及肌卫星细胞NO/HGF/c-Met通路的研究。本研究采用跑台运动训练结合按摩联合干预的方法,探讨联合疗法对骨骼肌急性损伤修复的影响。
临床上将骨骼肌损伤程度分为 3度[15,23]:轻度(1°):少量肌纤维损伤并伴有轻微肿胀,没有或仅有轻微的力量和活动受限;中度(2°):绝大部分肌纤维损伤,肌力明显下降:重度(3°):损伤范围涉及整块肌肉横截面,波及临近肌肉组织,损伤后肌肉功能完全丧失。损伤程度直接影响炎症反应、肌纤维再生和肌纤维化程度[13]。轻度损伤一般可以自动痊愈,中度和重度损伤伴随着肌纤维和脉管系统的破裂,最终出现瘢痕修复。本研究以大鼠骨骼肌急性中度损伤模型为研究对象,突出动物自身的运动修复,在修复中恢复损伤部位的正常功能,主要包括肌力和关节度的恢复。本研究运用HE染色,Western Blot检测肌组织NADH还原酶蛋白量,实时荧光PCR检测肌卫星细胞中nNOS、HGF mRNA表达量,研究了跑台运动训练与按摩联合干预对骨骼肌急性损伤修复过程NADH还原酶,及肌卫星细胞NO/HGF/c-Met通路的影响。本实验发现,经过4周的跑台运动训练和按摩介入治疗,按摩组C组、跑台组D组、混合组E组,骨骼肌肌卫星细胞中nNOS、HGF mRNA表达量,肌组织NADH还原酶蛋白量均比自然恢复组B组高,且具有极显著性差异(P<0.01);混合组与按摩组、跑台组比较,骨骼肌肌卫星细胞中nNOS、HGF mRNA表达量、肌组织NADH还原酶蛋白量更高,且具有极显著差异(P<0.01);跑台组与按摩组比较,骨骼肌肌卫星细胞中nNOS、HGF mRNA表达量更高,且具有极显著差异(P<0.01),肌组织NADH还原酶蛋白量也比按摩组高,且具有显著差异(P<0.05)。这说明,联合治疗更能有效地提高肌组织中nNOS、HGF mRNA表达量、肌组织NADH还原酶,通过提高肌组织NADH还原酶的量,增强线粒体的呼吸作用,产生更多的ATP,改善肌膜K+-Na+-ATPase的活性,调节NA+-K+的交换,Ca2+的转运,减轻Ca2+超载,减少活性氧类物质累积,减轻线粒体结构的破坏以及线粒体膜、肌膜的损伤,减少炎症细胞的聚集,减少炎症因子的分泌,增加成肌细胞趋化因子和促分裂因子的分泌,从而阻止了炎症的发展、减少了细胞的损伤、死亡,促进了肌前体细胞的激活、增生、分化的再生修复过程;另一方面,联合治疗可以明显提高nNOS、HGF mRNA表达量,提高了肌组织内NOS的产生,促进肌细胞产生更多的NO,通过NO介导的NO/HGF/c-Met信号通路,激活更多肌卫星细胞,进而有更多的肌卫星细胞增殖、增生、分化、融合成肌管,形成更多肌纤维,增加修复的速度。联合干预比单一手段干预能更好地阻止炎症的发展及促进后期骨骼肌损伤的修复速度,在骨骼肌损伤修复的整个过程中都发挥着重要作用。跑台运动训练与按摩相比,前者在阻止炎症的发展及促进后期骨骼肌损伤的修复速度的效果上好于后者。总之,联合治疗能有效阻止骨骼肌急性损伤后早期炎症的发展,促进和提高骨骼肌损伤后肌卫星细胞的再生修复过程。
4 结论
在骨骼肌急性损伤修复过程中,跑台运动训练与按摩联合作用比单独的跑台运动训练或按摩干预能更有效地提高骨骼肌中NADH还原酶蛋白量及NOS、HGF mRNA表达量,能提高机体能量代谢水平,有效阻止骨骼肌急性损伤后早期炎症的发展,促进和提高骨骼肌损伤后肌卫星细胞的再生修复过程,在骨骼肌损伤修复的整个过程中发挥着重要作用。
本研究进一步完善了按摩对骨骼肌损伤修复过程中细胞内修复相关因子的作用机制的证据链,为临床上进行跑台运动训练与按摩联合干预治疗骨骼肌急性损伤提供了一定的依据。
5 研究展望
最新的研究发现,在骨骼肌损伤中,超早期介入按摩比晚期介入按摩更有利于恢复肌肉功能和调节炎症细胞浸润[21]。在未来的研究中,本研究团队将围绕超早期介入按摩对骨骼肌急性损伤修复过程中细胞膜修复的影响机制展开研究,进一步完善按摩对于骨骼肌损伤修复的作用机制。
[1]查锡良,周春燕.生物化学(第7版)[M].北京:人民卫生出版社,2008:160-178.
[2]冯振伟,江黎明,陈孝文,等.IL-13对大鼠急性肾缺血再灌注时IL-1β表达的影响[J].中国病理生理学杂志,2003,19(3):930-934.
[3]葛新发,潘卫东,董贵俊,等.利用碱性成纤维细胞生长因子包裹的磁性纳米粒对大鼠急性骨骼肌钝挫伤后肌肉收缩力与松弛特性恢复的影响研究[J].中国运动医学杂志,2010,29(5):538-541.
[4]邝勇,黄跃生.微管损伤与缺氧心肌细胞线粒体损害的关系研究[J].第三军医大学学报,2006,28(15):1547-1549.
[5]侯懿烜,柳满然,张萍,等.骨骼肌损伤修复的生理生化机制研究[J].激光生理学报,2011,20(5):662-667.
[6]侯懿烜,郑元义,张萍,等.按摩增强SDH和钾钠-ATPase酶活性促进兔股四头肌的损伤修复[J].第三军医大学学报.2011,33(19):2012-1015.
[7]刘仁建,唐成林.兔骨骼肌钝挫伤恢复过程中碱性成纤维细胞生长因子的变化及按摩的干预作用[J].重庆医科大学学报,2013,38(11):1303-1307.
[8]刘仁建,唐成林,邹敏,等.按摩抑制兔钝挫伤骨骼肌瘢痕形成的机制研究[J].中华物理与康复杂志,2012,34(10):742-746.
[9]罗丽,张林,董宇.低功率激光对急性骨骼肌钝挫伤大鼠肌卫星细胞增殖活性的影响[J].体育科学,2007,27(7):55-58.
[10]石葛明,王学理,李佳桐,等.按摩对肌肉损伤修复作用的形态学研究[J].中国运动医学杂志,1991,10(4):201-204.
[11]谢辉,唐成林,陈晓玲,等.按摩促进骨骼肌损伤后肌纤维再生机理的研究[J].重庆医科大学学报,2013:190-194.
[12]张建,陈世益,李云霞,等.黄芪皂甙、丹参酮ⅡA注射液对大鼠骨骼肌急性钝挫伤后骨骼肌组织形态的影响[J].中国运动医学杂志,2011,30(3):270-274.
[13]AMERCIAN ACADEMY OF ORTHOPAEDIC SUIGEONS.The Burden of Musculoskeletal Disease in the United States[EB/OL].Http://www.bineandjointburden.org,2012-01-20.
[14]BAKER M A,LAW EN A.Plasma membrane NADH oxidoreductase system:a critical review of the structural and functional data[J].Anti Red Sign,2000,2(2):197-212.
[15]BLANKENBAKER D G,TUITE M J.Temporal changes of muscle injury[J].Semin Musculoskelet Radiol,2010:14(2):176-193.
[16]BEDFORD T G,TIPTON C M,WILSON N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Phys:Respirat,Environ Exe Phys,1980,47(6):1278-1283.
[17]CHARGE S B,RUDNICKI M A.Cellular and molecular regulation of muscle regeneration[J].Phys Rev,2004,(84):209-238.
[18]DE ANGELIS L,BERGHELLA L,COLETTA M,et al.Skeletal myogenic progenitors originating from embryonic dorsal aorta coexpress endothelial and myogenic markers and contribute to postnatal muscle growth and regeneration[J].J Cell Biology,1999,174(4):695-698
[19]FERNANDES M A,GERALDES C F,OLIVEIRA C R,et al.Effects of NADH and H2O2on chromate induced human erythrocytes hemoglobin oxidation and peroxidation[J].Ecotoxicol Environ Saf,2000,47(1):39-42.
[20]GROUNDS M D.Towards understanding skeletal muscle re-generation[J].Path Res Pract,1991,(187):1-22.
[21]HAAS C,BUTTERFIELD T A,ABSHIRE S,et al.Massage timing affects postexercise muscle recovery and inflammation in a rabbit model[J].Med Sci Sports Exe,2013,45(6):1105-1112.
[22]HURME T,KALIMO H.Activation of myogenic precuisor cells after muscle injury[J].Med Sci Sports Exe,1992,24:197-205.
[23]JARVINEN T A,JARVINEN T L,KAARIAINEN M.Muscle injures:biology and treatment[J].Am J Sports Med,2005,33(5):745-764.
[24]KASEMKIJWATTANA C,MENETREY J,BOSCH P,et al.Use of growth factors to improve muscle healing after strain injury[J].Clin Orthop Relat Res,2000,(370):272-285.
[25]KATSUYA KAMI,MITSUHIKO MASUHARA,HITOSHI KASAHIBA,et al.Changes of vinculin and extracelluar matrix components following blunt treuma to rat skeletal muscle[J].Med Sci Sports Exe,1993,25,(7):832-840.
[26]LOCKHART N C,BROOKS S V.Protection fnom contraction-induced injury provided to skeletal muscles of young and old mice by passive stretch is not due to a decrease in initial mechanical damage[J].J Gerontol A Biol Sci Med Sci,2006,61(6):527-533.
[27]MCCROSKERY S,TJOMAS M,PLAAT L,et al.Improved muscle healing through enhanced regeneration and reduced fibrosis in myostatin-null mice[J].J Cell Sci,2005,118(Pt 15):3531-3541.
[28]RABERTSON T A,MALEY M A,GROUNDS M D,et al.The role of macrophages in skeletal muscle regeneration with particular reference to chemotaxis[J].Exp Cell Res,1993,(207):321-331.
[29]ROBERTSON T A,PAPADIMITRION J M,GROUNDS M D,et al.Fusion of myogenic cells to the newly sealed region of damaged myofibres in skeletal muscle regeneration[J].Neuropathol Appl Neurobiol,1993,(19):350-358.
[30]SHEFER G,VAN DE MARK D P,RICHARDSON J B,et al.Satellitecell pool size does matter:defining the myogenic potency of aging skeletal muscle[J].Dev Biol,2006,294(1):50-66.
[31]SHU B,SHEN Y,WANG A M,et al.Histological,enzymohistochemical and biomechanical observation of skeletal muscle injury in rabbits[J].Chin J Traumatol,2007,10(3):150-153.
[32]TATSUMI R,WUOLLET A L,TABATA K,et al.A role for calcium-calmodulin in regulating nitricoxide production during skeletal muscle satellite cell activation[J].Am J Physiol Cell Physiol,2009,296(4):C922-C929.
