低氧和运动训练对大鼠学习记忆能力的影响及其与海马突触可塑性的关系
2015-10-18金其贯吴尚琳王云峰金爱娜胡要娟
金其贯,吴尚琳,王云峰,金爱娜,胡要娟
学习记忆是大脑的高级神经功能之一,学习主要是指人或动物通过神经系统接受外界环境信息而影响自身行为的过程,记忆是指获得的信息或经验在脑内储存和提取(再现)的神经活动过程,两者密切相关[7]。而海马是大脑中负责学习和记忆的最主要的部位,海马的突触可塑性是学习和记忆的神经基础。研究证实,神经生长相关蛋白-43(neuronal growth-associated protein,GAP-43)、突 触 素(synaptophysin,SYP)和神经细胞粘附因子(neural cell adhesion molecule,NCAM)与海马突触可塑性的形成有着密切的关系,是反映突触可塑性的重要分子标志[5]。有研究表明,长期的高原缺氧环境可以影响海马神经元的结构和功能,抑制大鼠的学习记忆能力[14,28],而长期适量的运动训练可以增加海马突触的可塑性来提高学习记忆能力[29-30]。虽有研究发现,间歇性低氧训练结合体育锻炼可以扩大运动改善老年人的认知能力和生活质量的积极效应[26],但高原训练对学习记忆能力的影响及其与海马突触可塑性的关系目前尚未见到报道。本研究通过交互设计的实验方案,分别对大鼠进行8周的低氧暴露或/和有氧运动训练,在测定大鼠学习记忆能力的同时,观察了大鼠海马的超微结构,测定海马组织中GAP-43、SYP、NCAM mRNA的表达量,来探讨低氧和运动训练对大鼠学习记忆的作用和交互作用及其与海马突触可塑性之间的关系,为进一步研究在高原训练中机体学习记忆能力的变化及其机制提供实验依据。
1 材料与方法
1.1 动物分组与饲养
6周龄雄性Sprague-Dawley(SD)大鼠40只,体重160~180g,购于南京市江宁区青龙山动物繁殖场,分笼饲养,每笼5只,饲养室温20±2℃,自然光照,每天定时更换垫料。采用国家标准啮齿类动物饲料喂养,自由饮水进食。大鼠适应饲养3天后随机分成常氧对照组(Normoxic control group,NC)、低 氧 对 照 组 (hypoxia control group,HC)、常氧运动组(Normoxic exercise group,NE)和低氧+运动训练组(hypoxia exercise group,HE)4组,每组10只。
1.2 实验方案
运动训练采用无负重游泳运动,每天下午训练1次,每周训练6天。第1周进行适应性训练,在1周内运动时间逐渐增加到60min,共训练8周。游泳池为120cm×80 cm×70cm的长方体塑料水桶,内壁光滑,水深50cm,水温30~33℃。游泳时注意观察大鼠状态,预防溺水死亡,并及时捞出大鼠粪便,保持池水清洁。前2周内将低氧舱模拟海拔高度由1600m逐渐增加到3000m高度,最终氧浓度为14.2%。在取材时NC组1只大鼠用做海马定位实验,训练中HC组、NE组各有2只大鼠、HE组有3只大鼠溺亡。
实验第8周时,在Morris水迷宫中进行定位航行试验的训练,共5天。从第1天开始,每天上午8:00—11:00定时训练,每天3次,每次训练间隔60s。训练时从第一、第二、第四象限依次(平台设在第三象限)进行,并将大鼠面向池壁放入水中,记录120s内寻找并爬上平台的路线图及所需要的时间(即潜伏期),允许在平台上停留10s,加强记忆效果。如果大鼠在规定的试验时间120s内未找到平台,须将其引导至平台,同样允许在平台上停留10s。第6天进行定位航行测验,取3次潜伏期平均值作为其每一个训练时间段的潜伏期;在第6天下午进行空间探索测验,即移去平台,从同一个入水点将大鼠面向池壁放入水中,测定大鼠在120s内游过的轨迹以及跨过平台相应位置的次数。
1.3 取材
大鼠在 Morris水迷宫测验完毕后,禁食12h,按50 mg/kg剂量腹腔注射2%戊巴比妥钠溶液进行麻醉,用剪刀断髓处死后,小心剪开颅骨,取出右侧海马组织,放入2.5%戊二醛溶液中固定,备作电镜制样。取左侧海马组织,用锡箔纸包裹后立即置于液氮中,再转入-80℃保存,以备提取总RNA,测定海马组织中GAP-43、SYP、NCAM mRNA的表达量。
1.4 指标测试
从戊二醛溶液中取出海马组织,常规包埋、制片,用Tecnai 12型透射电镜观察海马组织的超微结构,摄片并存档。透射电镜切片的制备和观察均在扬州大学测试中心进行。GAP-43、SYP、NCAM mRNA采用RT-PCR测定,先用Trizol(购自Life technologies)法从海马组织中提取总RNA后,采用NanoDrop ND-3300微量分光光度计检测260/280吸光度比值,判断RNA纯度和浓度。按照cDNA合成试剂盒(购自上海东洋纺生物科技有限公司)中说明书上的操作步骤,使用2720Thermal Cycler梯度PCR仪(美国)进行cDNA合成,反应结束后,在-20℃条件下保存。然后,使用SYBR Green Master(ROX)试剂盒(购自Roche Diagnostics),以cDNA 为 模 板,GAPDH 为 内 参,用 ABI 7500RT-PCR仪进行基因扩增。扩增程序为:50℃预处理2min,95℃预变性10min,95℃变性15s,60℃退火60s共进行40个循环。程序运行结束后,将目的基因的Ct值与内参GAPDH进行标准化,计算出目的基因的相对表达量。GAP-43、SYP、NCAM和GAPDH的引物均由上海生物工程有限公司设计并合成(表1)。

表1 本研究目的基因的引物序列一览表Table 1 Primer Sequences for Target Genes
1.5 统计处理
2 研究结果
2.1 各组大鼠潜伏期的变化和穿越平台次数的变化
通过对NC、HC、NE和 HE 4组进行双因素方差分析可知,长期的低氧暴露可使大鼠的潜伏期显著增加(P<0.05),穿越平台的次数显著减少(P<0.05),运动训练能使大鼠的潜伏期显著缩短(P<0.05),穿越平台的次数显著增加(P<0.05),低氧联合运动训练对缩短大鼠潜伏期、提高大鼠穿越平台次数均没有显著的交互作用(P>0.05,表2)。
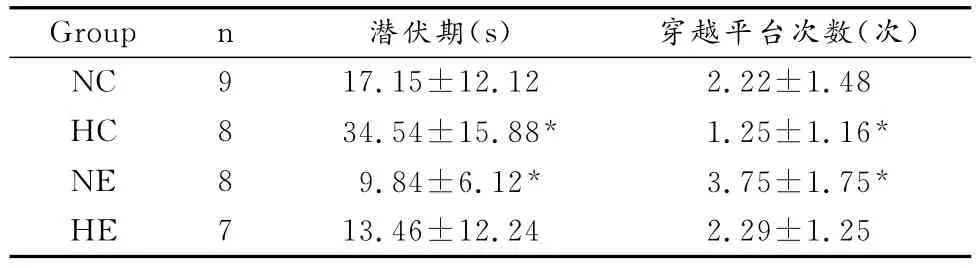
表2 本研究各组大鼠潜伏期和穿越平台次数的变化一览表Table 2 The Changes of Llatency and Times of Cross Platform in Each Group of Rats
2.2 各组大鼠海马超微结构的变化

图1 本研究各组大鼠海马超微结构的变化Figure 1 The Changes of Hippocampal Ultrastructure in Each Group of Rats
如图1所示,NC组大鼠海马突触间隙清晰,突触后膜致密物质(PSD)厚度大,突触前膜内聚集有突触小泡,线粒体数量多,结构清晰;HC组大鼠海马突触数量少,突触间隙模糊不清,突触的界面较小,线粒体变形且结构模糊。NE组大鼠海马突触数量多,突触间隙清晰,突触的界面曲度大,PSD厚度增大而明显,突触前膜内聚集丰富的突触小泡,线粒体数量增加,且结构清晰。与NE组相比,HE组大鼠海马内突触数量以及突触小泡数量有所减少,PSD厚度减小,线粒体数量少,且结构模糊不清。
2.3 各组大鼠海马GAP-43、SYP、NCAM mRNA表达的变化
对NC、HC、NE、HE 4组进行单因素方差分析可知,长期运动训练可使大鼠海马区GAP-43、SYP、NCAM mRNA表达显著增加(P<0.05,P<0.01),低氧暴露可使大鼠海马区 GAP-43、NCAM mRNA表达显著降低(P<0.05),SYP mRNA表达下降,但无显著性差异(P>0.05),低氧联合运动训练对提高GAP-43、SYP、NCAM mRNA的表达没有显著的交互作用(P>0.05,表3)。
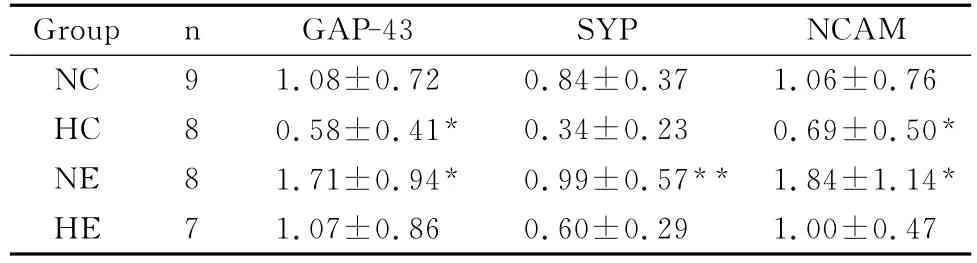
表3 本研究各组大鼠海马GAP-43、SYP、NCAM、mRNA表达一览表Table 3 Expression of Hippocampal GAP-43、SYP NCAM、mRNA in Each Group of Rats
3 分析与讨论
3.1 低氧和运动对大鼠学习记忆能力的影响
有研究表明,高原缺氧可使机体的学习记忆能力下降,并导致机体的认知功能障碍,且随着海拔高度和缺氧程度的增加,其抑制能力增加[9]。而适量、规律的运动锻炼会显著提高机体的学习记忆能力[13,20],过度负荷的运动阻碍大鼠学习记忆能力的形成和保持[4]。关于高原训练影响学习记忆能力的研究甚少,魏星研究发现,低氧和运动的双重刺激,对大鼠的空间学习能力具有抑制作用,而对大鼠的空间记忆能力却具有促进作用[6]。为了进一步探讨高原训练中低氧和运动两个因素对学习记忆能力的作用和交互作用,本研究采用交互设计的实验方案对大鼠进行8周氧浓度为14.2%的低氧暴露或/和60min的无负重游泳训练,通过Morris水迷宫检测各组大鼠的学习和记忆能力。结果发现,长期的低氧暴露可使大鼠的潜伏期显著延长(P<0.05),穿越平台的次数显著减少(P<0.05),运动训练能使大鼠的潜伏期显著缩短(P<0.05),穿越平台的次数显著增加(P<0.05),低氧联合运动训练(模拟高原训练)对缩短大鼠潜伏期、提高大鼠穿越平台的次数没有显著的交互作用(P>0.05)。由此进一步说明,长期的低氧暴露可以抑制机体的学习记忆能力,而适量的运动训练可以提高机体的学习记忆能力,虽然运动训练在一定程度上可以减轻低氧暴露所引起的学习记忆能力的抑制,但是运动训练并不能完全逆转低氧暴露所造成的学习能力下降的现象。因此,长期居住在高原缺氧环境下的人们通过适当的运动锻炼可减轻低氧环境对学习记忆能力的影响,对改善低氧环境下机体的认知功能可能具有非常重要的作用。
3.2 低氧和运动训练对大鼠海马超微结构的影响
突触可塑性是指突触在一定条件下调整功能、改变形态和增减数目的能力,包括突触形态结构的改变和突触传递效应的变化。有研究发现,海拔6000m的低氧环境可使大鼠海马CA1区神经元PSD厚度明显降低,PSD长度缩短,突触间隙相应地增加[3]。2周的间歇性低氧暴露,可使大鼠海马神经元核膜轻度破坏和线粒体轻微肿胀,而4周的间歇性低氧暴露,可使大鼠海马神经元核膜严重破坏、细胞肿胀和溶解[16]。运动训练可使大鼠海马齿状回的突触数量以及线粒体数量明显增加,促进突触结构可塑性改变[15]。低氧和运动的双重刺激可抑制大鼠海马齿状回新生细胞的发生,氧浓度越低抑制作用越大[6],但洪平(2005)研究6周不同形式的低氧训练对大鼠海马神经元的影响发现,低住低练、高住低练和低住高练组的大鼠海马神经元形态正常,只有高住高练组海马神经元受到轻度损伤,并认为这是在持续性低氧的基础上进行运动训练加重了脑组织的缺氧所致[1]。
为了进一步探讨模拟高原训练对大鼠海马突触结构可塑性的影响,本实验通过让大鼠模拟高原训练8周,观察大鼠海马超微结构的变化。结果发现,与NC组相比,HC组大鼠海马区突触数量减少,突触的界面变小,突触间隙与线粒体变形且结构模糊;NE组大鼠海马区突触数量增多,突触的界面曲度增大,突触间隙清晰,PSD厚度明显增厚,突触前膜内突触小泡数量增多,线粒体数量增加,且结构清晰;与NE组相比,HE组大鼠海马内突触数量以及突触小泡数量有所减少,PSD厚度减小,线粒体数量少,且结构模糊。从而进一步说明,长期的低氧暴露可以降低海马区突触结构的可塑性,适量的运动训练可以增加海马区突触结构的可塑性,运动训练虽然对低氧暴露大鼠海马突触的超微结构的损伤有一定的保护作用,但并不能完全逆转低氧暴露对大鼠海马突触结构带来的损伤。
3.3 低氧和运动训练对海马GAP-43、SYP、NCAM表达的影响
研究证实,GAP-43是神经元发育、神经生长及再生、突触形成和重建的标志性物质,在神经系统的可塑性中起重要作用[25];SYP是突触小泡蛋白,并可作为突触传递的标志物参与神经元的传输[24];而NCAM与突触结构维持、模式重建有密切关系[23]。因此,GAP-43、SYP、NCAM 是反映海马突触可塑性的重要分子标志物。
中枢神经系统对氧极为敏感,很容易发生缺氧性损伤,而GAP-43、NCAM可能是神经系统损伤后自我修复再生的重要因子[18,22]。有研究证实,慢性间歇缺氧引起脑损伤时GAP-43的表达瞬时升高,这种瞬时升高可能是由于缺氧刺激未受损的脑神经元代偿性地增加GAP-43的合成,促进脑损伤后神经元再生与修复(注:以前人们一直认为脑发育成熟后其神经元失去再生能力,但最近Nagavi等科学家们证实了多种生物的脑组织内,甚至在具有高级神经功能的新皮质中有神经元再生现象);但随着缺氧的进行,海马神经元损伤加重,抑制了海马神经元GAP-43的合成,导致GAP-43的表达逐渐降低[18]。慢性间歇性缺氧可使大鼠海马区SYP的表达显著降低[11],缺氧缺血性脑损伤大鼠海马神经元SYP蛋白含量及mRNA表达均下降[19],而SYP的表达直接引起突触量化的改变,进而改变突触可塑性。但是,长期的运动训练对海马GAP-43、SYP、NCAM的影响,由于实验对象的不同,实验结果不完全相同。长期、适量的运动训练不仅可以促进正常大鼠海马内GAP-43、SYP和NCAM蛋白表达上调,而且可以促进衰老小鼠海马GAP-43以及衰老大鼠海马NCAM是mRNA和蛋白的表达增加,促进了空间学习记忆的形成和保持[4,8-10,17]。在对脑损伤的小鼠进行神经干细胞/祖细胞移植的同时,进行适当的跑台运动可以增加脑神经生长因子和GAP-43mRNA的表达,使移植细胞分化成神经元显著增多[21],且适当的运动训练也可以增加脑缺血大鼠海马区SYP含量或mRNA的表达[2,27],从而促进神经功能的恢复,改善大鼠的空间学习记忆能力。另有研究发现,适当的有氧运动锻炼能够通过增加睡眠剥夺大鼠海马GAP-43蛋白的表达来显著改善长时间睡眠剥夺引起的记忆障碍,但是睡眠剥夺和有氧运动锻炼均不能改变突触蛋白1、SYP和PSD-95蛋白的表达[20]。然而,低氧联合运动训练对海马GAP-43、SYP、NCAM表达的作用和交互作用目前尚未见到研究报道。
本研究采用交互设计的实验方案对大鼠进行8周14.2%的低氧暴露或/和60min的无负重游泳训练后,检测了大鼠海马区 GAP-43、SYP、NCAM mRNA表达。对NC、HC、NE、HE 4组进行双因素方差分析后发现,长期的低氧暴露可使大鼠海马区GAP-43、NCAM mRNA表达显著降低(P<0.05),SYP mRNA表达下降,但无显著性差异(P>0.05),长期运动训练可使大鼠海马区 GAP-43、SYP和 NCAM mRNA表达显著增加(P<0.05,P<0.01),在低氧条件下进行运动训练对于提高GAP-43、SYP、NCAM mRNA表达没有显著的交互作用(P>0.05)。由此可见,长期的低氧暴露或运动训练时大鼠海马区GAP-43、SYP、NCAM mRNA表达变化与突触超微结构的变化以及学习记忆能力变化相一致。说明长期的低氧暴露或运动训练通过引起海马GAP-43、SYP和NCAM mRNA表达的下调或上调,抑制或增强海马突触结构的可塑性,可能是影响学习记忆能力的重要机制。
4 结论
1.长期的低氧暴露可抑制学习记忆能力,而运动训练能够增加学习记忆能力,虽然运动训练在一定程度上可以改善低氧暴露大鼠的学习记忆能力,但并不能完全逆转低氧暴露所造成的学习能力下降。
2.长期的低氧暴露或运动训练时大鼠海马区GAP-43、SYP、NCAM mRNA表达变化与突触超微结构的变化以及学习记忆能力变化相一致。长期的低氧暴露或运动训练通过下调或上调海马GAP-43、SYP和NCAM mRNA的表达,抑制或增强海马突触结构的可塑性,可能是影响学习记忆能力的重要机制。
[1]洪平.低氧训练对大鼠海马神经元的影响及其机制研究[D].北京:北京体育大学,2005.
[2]李雨峰,吴莹,程明,等.康复训练对脑梗死大鼠认知功能、海马内突触素和神经颗粒素表达的影响[J].中国康复理论与实践,2012,18(1):15-18.
[3]隋建峰.模拟高原缺氧条件下大鼠记忆行为变化及其突触机制[J].中国行为医学科学,2002,11(2):125-126.
[4]王富鸿.长期不同负荷运动对大鼠学习记忆能力及海马GAP-43基因表达的影响[D].成都:成都体育学院,2010.
[5]王晓英,张均田.突触可塑性与相关蛋白研究进展[J].中国药理学通报,2001,17(4):369-372.
[6]魏星.低氧训练对大鼠空间学习记忆和海马齿状回新生细胞数量的影响[D].上海:上海体育学院,2011.
[7]吴冰洁,刘艳萍,卢宝金.不同运动方式对快速老化小鼠学习记忆能力的影响[J].中国康复医学杂志,2010,25(5):430-434.
[8]袁琼嘉,李垂坤,李雪,等.长期中等负荷运动对大鼠空间学习记忆及海马神经粘附分子的影响[J].中国运动医学杂志,2012,31(12):1075-1080.
[9]袁琼嘉,张金梅,邓文骞,等.衰老过程中的运动干预对大鼠学习记忆能力及海马神经粘附分子表达的影响[J].体育科学,2014,34(8):85-90.
[10]苑振云,姜向明,王铭维,等.自愿运动对快速老化小鼠学习记忆能力和海马生长相关蛋白43的影响[J].第二军医大学学报,2012,33(1):48-52.
[11]张峰.慢性间歇性缺氧对大鼠学习记忆功能的影响[D].重庆:重庆医科大学,2008.
[12]张宽,朱玲玲,范明.高原环境对人认知功能的影响[J].军事医学,2011,35(9):706-709.
[13]ANG E T,DAWE G S,WONG P T,et al.Alterations in spatial learning and memory after forced exercise[J].Brain Res,2006,1113(1):186-193.
[14]BAITHARU I,JAIN V,DEEP S N,et al.Withania somnifera root extract ameliorates hypobaric hypoxia induced memory impairment in rats[J].J Ethnopharmacol,2013,145(2):431-441.
[15]BRIONES T L,SUH E,JOZSA L,et al.Changes in number of synapses and mitochondria in presynaptic terminals in the dentate gyrus following cerebral ischemia and rehabilitation training[J].Brain Res,2005,1033(1):51-57.
[16]CAI X H,ZHOU Y H,ZHANG C X,et al.Chronic intermittent hypoxia exposure induces memory impairment in growing rats[J].Acta Neurobiol Exp(Wars),2010,70(3):279-287.
[17]CASSILHAS R C,LEE K S,FERNANDES J,et al.Spatial memory is improved by aerobic and resistance exercise through divergent molecular mechanisms[J].Neuroscience,2012,202:309-317.
[18]CHEN Y,ZHAO C L,ZHANG C L,et al.Influence of chronic intermittent hypoxia on growth associated protein 43expression in the hippocampus of young rats[J].Neural Regen Res,2012,7(16):1241-1246.
[19]DING J Y,KREIPKE C W,SCHAFER P,et al.Synapse loss regulated by matrix metalloproteinases in traumatic brain injury is associated with hypoxia inducible factor-1alpha expression[J].Brain Res,2009,1268:125-134.
[20]FERNANDES J,BALIEGO L G,PEIXINHO-PENA L F,et al.Aerobic exercise attenuates inhibitory avoidance memory deficit induced by paradoxical sleep deprivation in rats[J].Brain Res,2013,1529:66-73.
[21]IMURA T,MATSUMOTO M,FUKAZAWA T,et al.Interactive effects of cell therapy and rehabilitation realize the full potential of neurogenesis in brain injury model[J].Neurosci Lett,2013,555:73-78.
[22]IWAI M,HAYASHI T,ZHANG W R,et al.Induction of highly polysialylated neural cell adhesion molecule(PSA-NCAM)in postischemic gerbil hippocampus mainly dissociated with neural stem cell proliferation[J].Brain Res,2001,902(2):288-293.
[23]JOHNSON C P,FUJIMOTO I,RUTISHAUSER U,et al.Direct evidence that neural cel1adhesion molecule(NCAM)polysialylation increases intermembrane repulsion and abrogates adhesion[J].J Biol Chem,2005,280(1):137-145.
[24]KOO J W,PARK C H,CHOI S H,et al.The postnatal environment can counteract prenatal effects on cognitive ability,cell proliferation,and synaptic protein expression[J].FASEB J,2003,17(11):1156-1558.
[25]KRUEGER D D,NAIRN A C.Expression of PKC substrate proteins,GAP-43and nenrogranin,is downregulated by cAMP signaling and alterations in synaptic activity[J].Enr J Neurosci,2007,26(11):3043-3053.
[26]SCHEGA L,PETER B,TÖRPEL A,et al.Effects of intermittent hypoxia on cognitive performance and quality of life in elderly adults:apilot study[J].Gerontol,2013,59(4):316-323.
[27]SEO H G,KIM D Y,PARK H W,et al.Early motor balance and coordination training increased synaptophysin in subcortical regions of the ischemic rat brain[J].J Kor Med Sci,2010,25(11):1638-1645.
[28]TITUS A D,SHANKARANARAYANA RAO B S,HARSHA H N,et al.Hypobaric hypoxia-induced dendritic atrophy of hippocampal neurons is associated with cognitive impairment in adult rats[J].Neuroscience,2007,145(1):265-278.
[29]UYSAL N,TUGYAN K,KAYATEKIN B M,et al.The effects of regular aerobic exercise in adolescent period on hippocampal neuron density,apoptosis and spatial memory [J].Neurosci Lett,2005,383(3):241-245.
[30]VAYNMAN S,YING Z,GOMEZ-PINILLA F.Interplay between brain-derived neurotrophic factor and signal transduction modulators in the regulation of the effects of exercise on synaptic-plasticity[J].Neuroscience,2003,122(3):647-657.
