固相萃取-高效液相色谱-串联质谱法测定坚果中62种农药残留
2015-10-17粟有志骆灵静李艳美刘绪斌
杨 巍, 粟有志, 李 芳, 骆灵静, 李艳美, 刘绪斌
(1.伊犁职业技术学院,新疆伊宁 835000;2.石河子大学食品学院,新疆石河子 832000;3.伊犁出入境检验检疫局综合技术服务中心,新疆伊宁 835000)
坚果又称壳果、干果,其果实外部被坚硬果壳包围,食用部分多为果核内的种仁子叶或胚乳。坚果含有丰富的营养物质,具有健胃、补脑、预防疾病等多种功效,常被人们当作保健食品食用[1]。近年来,随着食品安全事件的频发,农药残留成为食品安全问题关注的焦点之一。欧盟规定了430余种农药在各类坚果中的最大残留限量(MRLs),同时国际食品法典委员会(CAC)、美国、日本等国家或组织均对坚果中的农药残留设定了严格的MRLs[2]。目前,坚果中农药残留的检测主要采用气相色谱法[3]、液相色谱法[4]、气相色谱-质谱法[5,6]、气相色谱-串联质谱法[7,8]、液相色谱-串联质谱法[9 - 12]。其中气相色谱法和液相色谱法均为半定性分析,不能对农药进行确证,易产生假阳性;气相色谱-质谱法的目标分析物碎片离子易受基质的干扰,定性方面存在不足。李南等[7]建立了气相色谱-串联质谱法同时分析坚果中185种农药残留的方法,弥补了气相色谱和气相色谱-质谱法在确证方面的不足,但该方法仪器分析时间较长,单个样品的分析时间在40 min以上。宋欢等[9]建立了超高效液相色谱-电喷雾串联质谱法同时测定坚果中18种氨基甲酸酯类农药残留的方法,但该方法不能满足几十种农药残留同时监测的需要。
本文选择有限量要求的62种农药为研究对象,采用固相萃取(SPE)净化样品,建立了同时分析坚果干中62种农药残留的高效液相色谱-串联质谱(HPLC-MS/MS)方法。
1 实验部分
1.1 仪器与试剂
Agilent 1260-6460A液相色谱-串联质谱仪(Agilent公司),配有电喷雾离子源(ESI);Sigma 3-18K台式冷冻离心机(Sigma公司);EYELA MMV-1000W振荡器(东京理化公司);GM200刀式混合研磨仪(Retsch公司);N-EVAP-112水浴氮吹仪(Organomation公司);Milli-Q Advangtage A10 超纯水系统(Millipore公司);MS3型涡旋振荡器(IKA公司)。Carbon/PSA、Carbon/NH2、TPH、TPT固相萃取柱(规格均为1 g,6 mL),购于Agela公司。
62种农药标准品均购自德国Dr.Ehrenstorfer GmbH 公司。乙腈、甲苯、正己烷、丙酮、甲酸、乙酸均为色谱纯。其他试剂为分析纯;实验用水均为经Milli-Q超纯水器纯化的超纯水。
分析样品均为实验室送检样品。
1.2 标准溶液的配制
1.2.1标准储备溶液精密称取各农药标准品10 mg(精确至0.01 mg)于10 mL容量瓶中,用甲醇溶解并定容至刻度,配成质量浓度为1 000 mg/L的标准储备液,储存于-18 ℃冰箱中,备用。
1.2.2中间混合标准溶液根据每种农药在仪器上的响应灵敏度,确定其在混合标准溶液中的浓度,用甲醇稀释农药标准储备溶液至中间混合标准溶液中各农药的最终浓度为其检出限的500倍。
1.2.3基质混合标准工作溶液用不含待测农药残留的空白试样,按照1.3节处理样品,制备空白样品提取液。根据需要用空白样品提取溶液和中间混合标准溶液稀释成合适浓度的基质混合标准工作溶液,制备质量浓度为1、2、5、10、20、50倍定量限的基质匹配混合标准曲线溶液,基质混合标准工作溶液现配现用。
1.3 样品前处理
取代表性样品500 g,去除外壳,经混合研磨仪粉碎充分匀浆,密封,储存于-18 ℃冰箱中备用。称取5 g试样(精确至0.01 g)于50 mL离心管中,加入10 mL水,放置30 min后,加入2 g NaCl和20 mL乙腈,水平振荡15 min,6 000 r/min离心3 min,将上层乙腈层转移至100 mL鸡心瓶中,剩余部分用20 mL乙腈按照上述步骤重复提取一次,合并两次乙腈层于鸡心瓶中,向鸡心瓶中加入乙腈饱和的正己烷20 mL,涡旋30 s,静止5 min,弃去正己烷层,用20 mL乙腈饱和的正己烷重复操作一次,于40 ℃水浴中旋转蒸发浓缩至约1 mL,待固相萃取柱净化。
在TPH固相萃取柱内加入约2 cm高无水Na2SO4,固定于支架上,6 mL乙腈-甲苯(3∶1,V/V)预淋洗,当预淋洗液液面到达无水Na2SO4的顶部时,迅速将上述样品的浓缩液转移至柱中,并用鸡心瓶接收。再用2 mL乙腈-甲苯洗涤样液瓶两次,并将洗涤液转移至柱中。在柱上连接50 mL储液器,用20 mL乙腈-甲苯溶液洗脱农药,合并于鸡心瓶,于40 ℃水浴中旋转浓缩至约0.5 mL。将浓缩液置于氮吹仪上吹干,用1 mL乙腈-水溶液(3∶7,V/V)溶解残渣,超声溶解30 s,充分涡旋30 s,过0.22 μm滤膜,供HPLC-MS/MS测定和确证。
1.4 HPLC-MS/MS条件
1.4.1色谱条件色谱柱:Zorbax Eclipse Plus C18柱(100×3.0 mm,1.8 μm);流动相:A相为0.1%甲酸溶液,B相为乙腈,梯度洗脱程序如下:0~8.0 min,10%~75%B;8.0~15.0 min,75%~90%B;15.0~18.0 min,90%B;18.01~23.0 min,10%B;柱温:30 ℃;进样量:10.0 μL。
1.4.2质谱条件电离模式:电喷雾正离子源模式;多重反应监测(MRM);雾化气、干燥气、鞘气均为高纯氮气;干燥气温度:350 ℃;干燥气流量:9.0 L/min;鞘气温度:250 ℃;鞘气流速:11.0 L/min,毛细管电压:4 kV;监测离子对、碰撞能力、碎裂电压等参见表1。

表1 62种农药的保留时间、监测离子对、碰撞能量、碎裂电压、基质标准曲线范围、相关系数
(续表1)
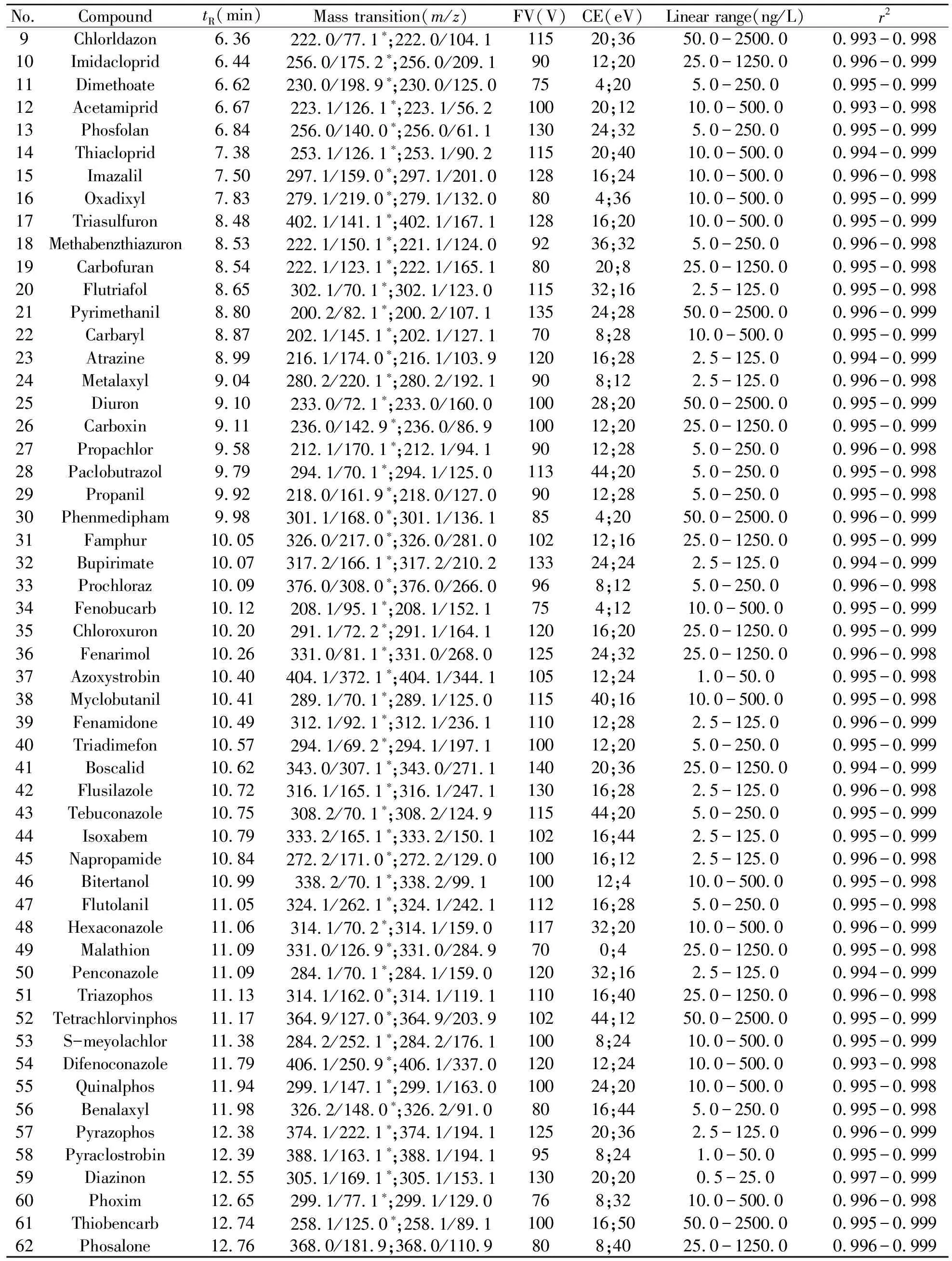
No.CompoundtR(min) Mass transition(m/z)FV(V)CE(eV)Linear range(ng/L)r29Chlorldazon6.36222.0/77.1∗;222.0/104.111520;3650.0-2500.00.993-0.99810Imidacloprid6.44256.0/175.2∗;256.0/209.19012;2025.0-1250.00.996-0.99911Dimethoate6.62230.0/198.9∗;230.0/125.0754;205.0-250.00.995-0.99912Acetamiprid6.67223.1/126.1∗;223.1/56.210020;1210.0-500.00.993-0.99813Phosfolan6.84256.0/140.0∗;256.0/61.113024;325.0-250.00.995-0.99914Thiacloprid7.38253.1/126.1∗;253.1/90.211520;4010.0-500.00.994-0.99915Imazalil7.50297.1/159.0∗;297.1/201.012816;2410.0-500.00.996-0.99816Oxadixyl7.83279.1/219.0∗;279.1/132.0804;3610.0-500.00.995-0.99917Triasulfuron8.48402.1/141.1∗;402.1/167.112816;2010.0-500.00.995-0.99918Methabenzthiazuron8.53222.1/150.1∗;221.1/124.09236;325.0-250.00.996-0.99819Carbofuran8.54222.1/123.1∗;222.1/165.18020;825.0-1250.00.995-0.99820Flutriafol8.65302.1/70.1∗;302.1/123.011532;162.5-125.00.995-0.99821Pyrimethanil8.80200.2/82.1∗;200.2/107.113524;2850.0-2500.00.996-0.99922Carbaryl8.87202.1/145.1∗;202.1/127.1708;2810.0-500.00.995-0.99923Atrazine8.99216.1/174.0∗;216.1/103.912016;282.5-125.00.994-0.99924Metalaxyl9.04280.2/220.1∗;280.2/192.1908;122.5-125.00.996-0.99825Diuron9.10233.0/72.1∗;233.0/160.010028;2050.0-2500.00.995-0.99926Carboxin9.11236.0/142.9∗;236.0/86.910012;2025.0-1250.00.995-0.99927Propachlor9.58212.1/170.1∗;212.1/94.19012;285.0-250.00.996-0.99828Paclobutrazol9.79294.1/70.1∗;294.1/125.011344;205.0-250.00.995-0.99829Propanil9.92218.0/161.9∗;218.0/127.09012;285.0-250.00.995-0.99830Phenmedipham9.98301.1/168.0∗;301.1/136.1854;2050.0-2500.00.996-0.99931Famphur10.05326.0/217.0∗;326.0/281.010212;1625.0-1250.00.995-0.99932Bupirimate10.07317.2/166.1∗;317.2/210.213324;242.5-125.00.994-0.99933Prochloraz10.09376.0/308.0∗;376.0/266.0968;125.0-250.00.996-0.99834Fenobucarb10.12208.1/95.1∗;208.1/152.1754;1210.0-500.00.995-0.99935Chloroxuron10.20291.1/72.2∗;291.1/164.112016;2025.0-1250.00.995-0.99936Fenarimol10.26331.0/81.1∗;331.0/268.012524;3225.0-1250.00.996-0.99837Azoxystrobin10.40404.1/372.1∗;404.1/344.110512;241.0-50.00.995-0.99838Myclobutanil10.41289.1/70.1∗;289.1/125.011540;1610.0-500.00.995-0.99839Fenamidone10.49312.1/92.1∗;312.1/236.111012;282.5-125.00.996-0.99940Triadimefon10.57294.1/69.2∗;294.1/197.110012;205.0-250.00.995-0.99941Boscalid10.62343.0/307.1∗;343.0/271.114020;3625.0-1250.00.994-0.99942Flusilazole10.72316.1/165.1∗;316.1/247.113016;282.5-125.00.996-0.99843Tebuconazole10.75308.2/70.1∗;308.2/124.911544;205.0-250.00.995-0.99944Isoxabem10.79333.2/165.1∗;333.2/150.110216;442.5-125.00.995-0.99945Napropamide10.84272.2/171.0∗;272.2/129.010016;122.5-125.00.996-0.99846Bitertanol10.99338.2/70.1∗;338.2/99.110012;410.0-500.00.995-0.99847Flutolanil11.05324.1/262.1∗;324.1/242.111216;285.0-250.00.995-0.99848Hexaconazole11.06314.1/70.2∗;314.1/159.011732;2010.0-500.00.996-0.99949Malathion11.09331.0/126.9∗;331.0/284.9700;425.0-1250.00.995-0.99850Penconazole11.09284.1/70.1∗;284.1/159.012032;162.5-125.00.994-0.99951Triazophos11.13314.1/162.0∗;314.1/119.111016;4025.0-1250.00.996-0.99852Tetrachlorvinphos11.17364.9/127.0∗;364.9/203.910244;1250.0-2500.00.995-0.99953S-meyolachlor11.38284.2/252.1∗;284.2/176.11008;2410.0-500.00.995-0.99954Difenoconazole11.79406.1/250.9∗;406.1/337.012012;2410.0-500.00.993-0.99855Quinalphos11.94299.1/147.1∗;299.1/163.010024;2010.0-500.00.995-0.99856Benalaxyl11.98326.2/148.0∗;326.2/91.08016;445.0-250.00.995-0.99857Pyrazophos 12.38374.1/222.1∗;374.1/194.112520;362.5-125.00.996-0.99958Pyraclostrobin 12.39388.1/163.1∗;388.1/194.1958;241.0-50.00.995-0.99959Diazinon12.55305.1/169.1∗;305.1/153.113020;200.5-25.00.997-0.99960Phoxim12.65299.1/77.1∗;299.1/129.0768;3210.0-500.00.996-0.99861Thiobencarb12.74258.1/125.0∗;258.1/89.110016;5050.0-2500.00.995-0.99962Phosalone12.76368.0/181.9;368.0/110.9808;4025.0-1250.00.996-0.999
*quantitative transition;FV:fragmentor voltage;CE:collision energy.
2 结果与讨论
2.1 提取溶剂的选择
本文考察了正己烷-丙酮(1∶1,V/V)[13]、纯乙腈[14]和乙腈(含1%乙酸)[15]三种提取溶剂对62种农药的提取效果。结果表明,正己烷-丙酮、乙腈和乙腈(含1%乙酸)作为提取溶剂时,回收率在70%~120%范围内的农药比例分别为83.8%、100.0%和91.9%;采用乙腈(含1%乙酸)提取时,部分碱性农药如呋虫胺、嘧霉胺、噻虫胺、敌稗的提取回收率较差。因此选择乙腈作为提取溶剂。同时本文尝试样品提取后用乙腈饱和的正己烷进行脱脂,结果发现脱脂前后,62种农药的回收率没有明显的差异,约2/5的农药基质效应有所改善。故本文最终选择乙腈作为提取液,样品提取液经乙腈饱和的正己烷脱脂后,再进行固相萃取(SPE)柱净化。
2.2 净化条件的选择
2.2.1SPE柱的选择由于62种农药化学性质差异较大,选择单一填料的SPE柱难以满足样品净化的需要。本文比较Carb/PSA、Carb/NH2、TPT、TPH四种混合填料SPE柱对样品的净化效果,结果发现,回收率在70%~120%的农药数分别为60、58、62和62个。使用TPT、TPH柱时的回收率均较高;但TPT柱净化时样品基质干扰相对较大,某些农药的峰形变差,个别农药监测离子的背景信号较大,方法检出限较高。故本文选择TPH柱净化样品。
2.2.2洗脱溶剂的选择选择TPH SPE柱净化样品,对比乙腈-甲苯(3∶1,V/V)、乙腈、正己烷-丙酮(6∶4,V/V)三种洗脱溶剂的洗脱效果。结果表明,乙腈洗脱时部分农药的回收率达不到检测要求;正己烷-丙酮和乙腈-甲苯洗脱时,62种农药的回收率均较好;但正己烷-丙酮洗脱时约3/4农药的基质效应高于乙腈-甲苯洗脱时的基质效应。所以本文选择乙腈-甲苯(3∶1,V/V)为洗脱剂。
2.2.3洗脱体积的选择进一步优化洗脱溶剂的体积,在空白核桃仁中添加62种农药混合标准溶液进行回收率实验,按照1.3进行前处理,在储液器中加入40 mL洗脱溶剂,每5 mL收集一次流出液,共收集9次,并计算各次流出液中农药的累计回收率。结果表明,洗脱液体积超过20 mL后62种农药的回收率无明显提高,故本文选择洗脱剂乙腈-甲苯(3∶1,V/V)体积为20 mL。
2.3 仪器条件的选择
配制62种农药的单一标准溶液,分别采用电喷雾正、负离子模式进行母离子全扫描。结果发现待测农药的[M+H]+峰均高于[M-H]-峰。以[M+H]+为母离子,进一步对62种农药的子离子、碎裂电压、碰撞能量等参数进行优化,获得最佳的仪器条件。基于优化结果建立的多重反应监测(MRM)质谱分析参数见表1。
液相色谱-串联质谱分析样品时,流动相体系中有机相一般以乙腈、甲醇为主,水相中适当添加一定量的缓冲物质。本文比较不同浓度的甲酸水溶液和乙酸铵水溶液、乙腈及甲醇组成流动相的分离效果。结果表明,乙腈-0.1%甲酸水溶液为流动相时,各农药的响应值较高。通过优化梯度洗脱程序,62种农药均能得到较好的分离度和色谱峰形。核桃阴性样品和阴性样品中添加1×LOQ浓度的62种农药提取总离子流图如图1。
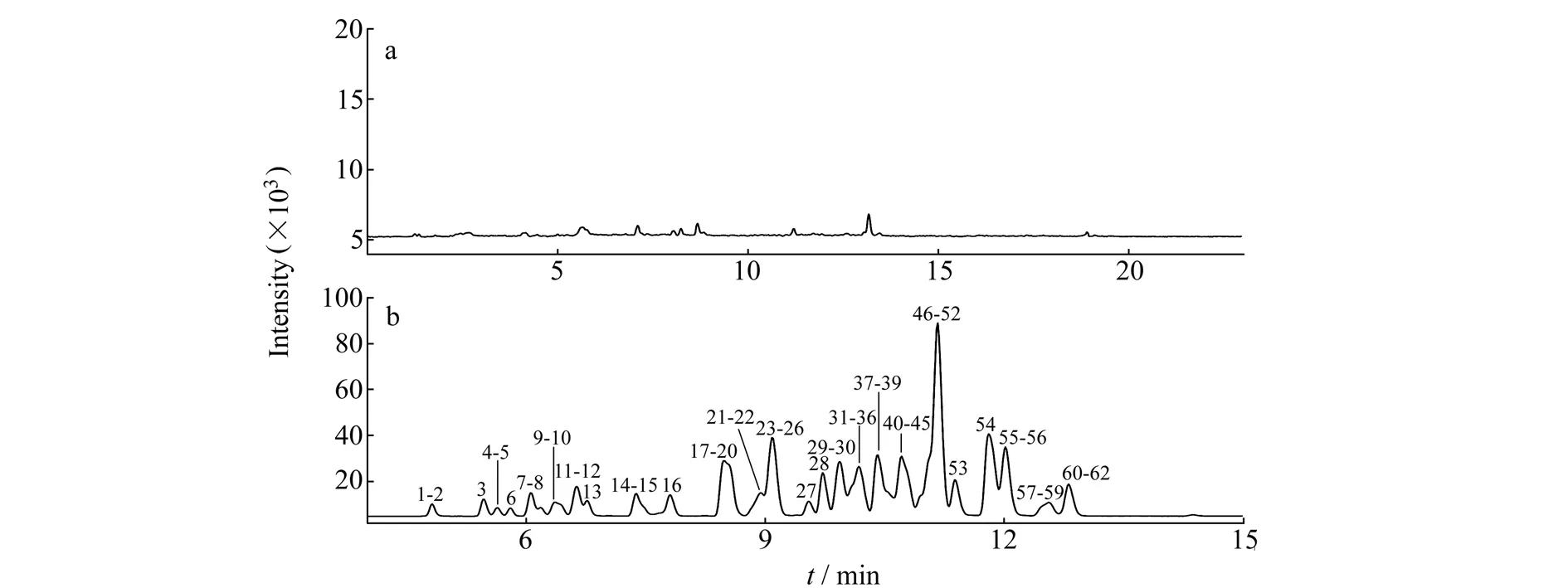
图1 核桃阴性样品(a)和阴性样品中添加1×LOQ浓度(b)的62种农药提取总离子流色谱图 Fig.1 Total ion chromatograms of a negative walnut sample(a) and a negative walnut sample spiked with 62 pesticides at LOQ concentration(b) number of 1-62 are the same as table 1.
2.4 方法的线性关系和定量限
实验发现,样品基质对大部分的农药有一定的抑制作用,采用基质匹配标准曲线可有效地消除样品基质效应。空白样品按照1.3节前处理样品,制备质量浓度为1、2、5、10、20、50倍LOQ的基质匹配混合标准系列溶液,以峰面积对农药的质量浓度作线性回归,绘制标准曲线;62种农药在核桃、杏仁、花生基质中的相关系数均大于0.993。基质匹配标准曲线线性范围和相关系数(r2)见表1。以信噪比(S/N) ≥3 确定方法的检出限(LOD),其范围为0.03~3.0 μg/kg;以S/N≥10 确定方法的定量限(LOQ),其范围为0.1~10.0 μg/kg。所有农药的定量限均小于或等于10.0 μg/kg,符合国内外法规残留限量要求。62种农药的检出限和定量限见表2。
2.5 方法的准确度和精密度
选择核桃仁、杏仁和花生仁三种阴性样品,以1、2、4 倍LOQ为加标水平进行回收率实验。添加了农药混合标准溶液的样品,静置30 min,待农药被样品充分吸收后,按照1.3节和1.4节进行前处理和测定,每个水平重复6次。回收率和相对标准偏差(RSD)见表2。从表2可见,62种农药回收率在71.2%~112.7%范围,RSD小于5.8%~14.1%,表明该方法的准确度高,通用性好。

表2 62种农药在核桃、杏仁、花生三种基质中的检出限、定量限、添加回收率和精密度(n=6)
(续表2)

No.CompoundLOD(μg/kg)LOQ(μg/kg)Spiked 1×LOQSpiked 2×LOQSpiked 4×LOQRecovery(%)RSD(%)Recovery(%)RSD(%)Recovery(%)RSD(%)38Myclobutanil0.62.079.09.784.56.790.19.539Fenamidone0.150.581.79.482.012.181.713.340Triadimefon0.31.0101.310.982.913.785.06.841Boscalid1.55.085.712.886.29.586.78.442Flusilazole0.150.579.66.581.29.483.110.643Tebuconazole0.31.071.88.382.110.683.110.944Isoxabem0.150.582.610.396.08.7103.46.745Napropamide0.150.576.98.685.97.771.29.546Bitertanol0.62.082.711.383.27.574.07.847Flutolanil0.31.081.913.482.712.575.29.548Hexaconazole0.62.0104.89.881.211.794.812.949Malathion1.55.071.58.796.89.781.910.050Penconazole0.150.576.710.986.09.790.29.551Triazophos1.55.083.18.578.911.490.212.652Tetrachlorvinphos3.010.087.911.782.210.779.711.053S-meyolachlor0.62.0112.714.178.97.993.08.254Difenoconazole0.62.092.49.582.27.879.79.555Quinalphos0.62.075.99.176.512.974.813.256Benalaxyl0.31.094.711.581.011.785.29.557Pyrazophos0.150.586.08.473.29.979.911.158Pyraclostrobin0.060.294.812.181.110.183.910.459Diazinon0.030.185.910.677.511.877.89.560Phoxim0.62.074.58.586.012.799.813.961Thiobencarb3.010.082.09.586.58.181.98.462Phosalone1.55.076.911.191.98.783.19.0
3 结论
本文建立了以乙腈为提取剂,经正己烷脱脂和TPH固相萃取小柱净化,液相色谱-串联质谱法测定坚果中62种农药残留的检测方法。该方法的定量限、回收率和精密度均满足痕量分析的要求,适用于坚果中农药残留的分析检测。
