硫代杯[4]冠-4在硝酸体系中对Sr2+的萃取
2015-10-17李洁周丽娟张东翔刘聪TarasovV
李洁,周丽娟,张东翔,刘聪,TarasovV. V.
硫代杯[4]冠-4在硝酸体系中对Sr2+的萃取
李洁1,周丽娟1,张东翔1,刘聪1,TarasovV. V.2
(1北京理工大学化工与环境学院,北京100081;2俄罗斯门捷列夫化工大学,莫斯科 125190)
乏燃料后处理的高放废液分离过程中,发展新型分离材料实现对锶的高效萃取至关重要。合成了1,2交替构象的硫代杯[4]冠-4(TCACE),利用FT-IR、1H NMR和MS对目标产物进行了表征。研究不同稀释剂对萃取的影响,优化得出CH2Cl2为稀释剂,在硝酸浓度为3mol·L-1,有机相中硫代杯[4]冠-4浓度为1×10-3mol·L-1,水相中Sr2+浓度为5×10-4mol·L-1,萃取温度为25℃,萃取80 min条件下,平均传质系数为1.36×10-5 m·s-1,Sr2+的分配比为0.69。分析了不同条件对硫代杯[4]冠-4对Sr2+的萃取影响,研究了萃取计量方程式,实验结果表明萃合物为{Sr(NO3)2}·{TCACE}。研究了TCACE对其他金属离子Mo6+、Ni2+、Ag+、Sn4+等的萃取效果,表明对Sr2+具有较好的选择性。
硫代杯[4]冠-4;合成;Sr2+;萃取;分离
引 言
杯芳烃是一类具有特殊环腔结构的环状聚合物,通常是由对烷基酚和甲醛在一定条件下反应得到的缩合产物,其具有空腔可调节、构象可变化和结构易修饰等优点,对很多金属离子具有很高的选择性和亲和性[1]。1997年,Kumagai等[2]报道的对叔丁基硫代杯[4]芳烃的一步合成方法,为硫代杯芳烃的研究发展提供了基础。硫代杯[4]芳烃衍生物广泛用于对碱金属[3]、碱土金属[4]、过渡金属[5]和镧锕系[6]等金属离子的识别研究,也可以通过它的空穴和晶格对中性分子的包合来实现对中性分子的识别[7]。目前已经有对硫代杯[4]芳烃的上、下缘进行选择性修饰的报道[8],对金属离子的萃取提供了很大帮助。
90Sr是高释放热核素,比放射性活度大,给高放废液的最终处理带来了较大困难[9]。目前萃取锶的方法有SREX[10]、UNEX[11]和TRUEX[12],但是在这些流程中萃取剂如18-冠醚-6[13]等合成困难而且其化学稳定性较差,对锶的萃取效果不佳,因此合成新型的萃取剂并对高放废液中的锶进行有效分离是非常有必要的。
利用5,11,17,23,29,35-六苄氧基-37,38,39,40,41,42-六羟基-杯[6]芳烃[14]、二叔丁基-辛基苯冠-6-杯[4]芳烃等[15]对Sr2+进行萃取分离,表明它们对锶都有良好的萃取热力学性能。Sr2+的络合取决于受体的结构属性,如氢结合能力、稳定性和质子化作用的能力[16],因此萃取剂的分子结构选择至关重要。本文合成了硫代杯[4]冠-4(TCACE),研究了其对Sr2+的萃取性能。
1 TCACE的合成和表征
1.1 仪器与试剂
iS10型FT-IR光谱仪,Nicolet公司;Bruker dpx-400型超导核磁共振仪,德国Bruker公司;Varian-400质谱仪,美国Varian公司;MP-AES型原子发射光谱仪,美国Agilent 公司。
锶元素溶液标准物质,光谱纯,中国计量科学研究院;硝酸、二氯甲烷、甲苯、氯仿、NaOH、AlCl3和K2CO3等均为分析纯,北京化工厂;对叔丁基苯酚,对甲苯磺酰氯,二苯醚等为化学纯,国药集团化学试剂有限公司。
1.2 TCACE的合成
将13 g碳酸铯、7.2 g对叔丁基硫代杯[4]母体、8.24 g三乙二醇二甲苯磺酸酯加入圆底烧瓶中,然后加入乙腈溶剂500 ml,加热至81.1℃,并回流保持6 h,TLC检测。反应结束降至室温,将溶剂旋蒸后,加入二氯甲烷,溶解过滤除掉杂质,加入10%的HCl洗两次,再加水洗一次,干燥以后得到粗产品。用甲醇溶解,热过滤以后,加入丙酮重结晶,干燥后得到最终产品[17]。
图1为TCACE的合成路线图,其中化合物1为自制的对叔丁基硫代杯[4]母体,将13.75 g (0.43 mol) 升华硫,32.25 g (0.215 mol) 对叔丁基苯酚,4.43 g (0.11 mol) NaOH和30 ml二苯醚加入圆底烧瓶中,在N2气氛下磁力加热搅拌,4 h内逐步加热到230℃。在此温度下保持回流4 h,冷却至室温,反应混合物用20 ml甲苯稀释。接着依次用0.5 mol·L-1的硫酸溶液及蒸馏水洗涤,分出灰黄色悬浮液,加入50 ml乙醇,使产物析出,静置2 h,用95%乙醇洗涤,在50℃下干燥4 h,得粗产品白色固体。将烘干后的固体用氯仿-乙醇进行重结晶,得到白色的对叔丁基硫代杯[4]母体[2],产率为53%。化合物2为自制的三乙二醇二甲苯磺酸酯,制备方法为将1.416 g三乙二醇、4.492 g对甲苯磺酰氯、1.132 g氢氧化钠置于干燥的蒸发皿中,研磨10~12 min,水洗过滤得到粗产品,乙醇重结晶后得到三乙二醇二甲苯磺酸酯,产率为93%。化合物3为TCACE。
1.3 合成产物TCACE的结构表征
合成产物TCACE的FT-IR谱图见图2。图2中,2962、1364、1395 cm-1处的吸收峰是杯芳烃上缘叔丁基上甲基和亚甲基上C—H键的不对称和对称伸缩振动;1571、1461 cm-1处的吸收峰是苯环的骨架振动峰;1241 cm-1处的吸收峰是酚羟基上的C—O的伸缩振动峰。
合成产物TCACE的1H NMR谱图见图3。图中,1.28处的单峰为杯芳烃上缘叔丁基上的质子,4.06处的多重峰为与酚氧原子相连的亚甲基上的质子,3.85处的多重峰为—C—O所连接的质子,7.77处的单峰为苯环上的质子峰。
合成产物TCACE的MS谱图见图4。图4中,TCACE在质谱(MS-ESI)的阳离子模式下得到荷质比(/)为971.7 (M+Na+),这与硫代杯[4]冠-4的相对分子质量一致。
2 TCACE对Sr2+的萃取实验
2.1 萃取实验方法
在萃取体系中,水相为含Sr2+的硝酸溶液,其中Sr2+的浓度为5´10-4mol·L-1,硝酸浓度为3 mol·L-1。有机相为TCACE浓度为1´10-3mol·L-1的二氯甲烷溶液。分别置等体积的水相和有机相于50 ml锥形瓶中,在恒温水浴振荡箱中振荡120 min,操作温度为25℃。静置分层后,用原子发射光谱仪检测水相中Sr2+浓度,以差减法得到有机相金属离子浓度。
按式(1)计算对Sr2+的萃取率
式中,w和o分别为不同萃取时间下Sr2+在水相中与有机相中的浓度。
按式(2)计算对Sr2+的分配比
按式(3)与式(4)分别计算微分传质系数t和平均传质系数p[18]。
式中,p为平衡时有机相金属离子的浓度,C为有机相在不同萃取时间时金属离子的浓度;为相接触面积,=0.00196 m2;为有机相体积,为5 ml。
2.2 稀释剂的选择
为了选择合适的稀释剂,本实验初步研究了丙酮、正辛醇、甲苯、己烷、石油醚、二氯甲烷对萃取效果的影响。
在萃取体系中,水相为5.0×10-4mol·L-1Sr(NO3)2,有机相为1.0×10-3mol·L-1的TCACE溶液。分别置5 ml的水相和有机相于50 ml锥形瓶中,在恒温水浴振荡箱中振荡120 min,操作温度为25℃,然后静置分层。以原子发射光谱仪检测水相中金属离子的浓度和原始浓度,以差减法得到有机相金属离子浓度,并按式(1)计算在不同稀释剂中TCACE对锶的萃取率。
由图5可知,二氯甲烷作为稀释剂时对Sr2+的萃取效果最好,所以本实验选择二氯甲烷作为稀释剂进行其他因素的研究。
3 结果与讨论
3.1 硝酸浓度对萃取的影响
改变硝酸浓度,保持其他实验因素不变,Sr2+萃取率随硝酸浓度的变化如图6所示。可以看出随着硝酸浓度的升高,萃取率呈先升高后降低的趋势,这与Zhang等[19]利用修饰的杯[4]芳烃分离Sr2+的结果相似。在本实验条件下,利用TCACE萃取分离Sr2+与Chen等[20]报道的利用DtBuCH18C6对Sr2+的分离相似,可以用式(5)和式(6)表示
上述两个反应为竞争反应,当HNO3浓度小于3 mol·L-1时,由于硝酸浓度的增大,TCACE为Sr2+提供了合适的结合位点,增加了Sr2+同TCACE的络合,从而使萃取率升高;当HNO3浓度大于3 mol·L-1时,由式(6)可知,HNO3与TCACE络合,氢键对萃取过程起到了主导作用,从而减少了Sr2+同TCACE的络合,使萃取率降低。
3.2 TCACE浓度对萃取的影响
为了研究有机相中TCACE浓度对萃取的影响以及萃合物的组成,保持其他实验因素不变,进行不同TCACE浓度的实验。因为在有机相中Sr2+浓度远远小于TCACE的初始浓度,所以TCACE的平衡浓度与它的初始浓度可以看成是不变的。为了探讨萃合物的组成,本节以分配比的变换形式ln来表示萃取性能。
根据计量方程式(5),可知反应平衡常数ex为
同时,式(2)可以转化为
结合式(7)和式(8)
ln对ln [] 的关系如图7所示,可以看出萃取率随着TCACE浓度的升高而增大。图中斜率约为1,则值为1,说明一个TCACE分子能够络合一个Sr2+。lnex值计算为4.34,说明对Sr2+的萃取是比较高效的。
根据式(9),该萃取反应的D为-10.75 kJ·mol-1,说明TCACE萃取锶的过程是自发的。
DRTlnex(10)
3.3 Sr2+初始浓度对萃取的影响
改变Sr2+初始浓度,保持其他实验因素不变,Sr2+萃取率随Sr2+初始浓度的变化如图8所示。在本实验条件下,可以观察到,萃取率随着Sr2+初始浓度的升高而增大。由式(6)可知,在硝酸浓度不变的情况下,萃取反应中氢键的作用被限定,而Sr2+初始浓度的升高,使得式(5)的平衡向正反应方向进行,促进了TCACE与Sr2+的络合,从而提高了萃取率。
3.4 萃取时间对萃取的影响
改变萃取时间,保持其他实验因素不变,Sr2+萃取率随硝酸浓度的变化如图9所示。结果表明,当萃取进行到约80 min时,萃取率基本不再变化,说明在本实验条件下,反应进行80 min体系能够达到平衡状态。
根据式(3),拟合出微分传质系数t随时间的变化关系如图10所示,进而根据式(4),计算出本反应体系在80 min内的平均传质系数p为1.36×10-5 m·s-1。
4 TCACE对其他金属离子的萃取效果
研究了TCACE对Sr2+的萃取选择性,及其对La3+、Ce3+、Sm3+、Mo6+、Ni2+、Ag+、Sn4+等离子的萃取效果。
在萃取体系中,水相为含金属离子的硝酸溶液,其中金属离子浓度为5×10-4mol·L-1,硝酸浓度为3 mol·L-1。有机相为1×10-3mol·L-1TCACE的二氯甲烷溶液。分别置5 ml的水相和有机相于50 ml锥形瓶中,在恒温水浴振荡箱中振荡120 min,操作温度为25℃。静置分层后,用原子发射光谱仪检测水相中金属离子的浓度。按式(11)计算理论分离系数
式中,Sr、M分别为TCACE对Sr2+的分配比及对其他离子的分配比。
TCACE对不同金属离子的萃取率、分配比以及分离系数列于表1。从分离系数得知TCACE对Sr2+具有较好的分离效果;相对于Mo6+、Ni2+、Ag+、Sn4+、La3+等金属离子,TCACE对Sr2+分离过程具有较好的选择性。
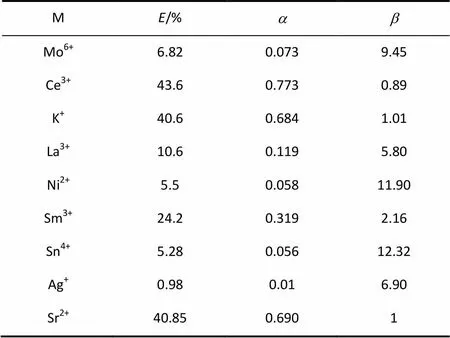
表1 TCACE对各种金属离子的萃取率和分配比Table 1 Extraction rate and distribution ratio of other metal ions with TCACE
5 结 论
(1)以对叔丁基硫代杯[4]为母体,与2,2′-(乙烯二氧)二乙基二甲苯磺酸酯发生取代反应,合成了硫代杯[4]冠-4。以硫代杯[4]冠-4作为萃取剂研究了其对Sr2+的萃取影响。
(2)本实验优化出二氯甲烷为稀释剂;Sr2+萃取率随硝酸浓度的升高呈先增大后减小的趋势,在硝酸浓度为3 mol·L-1时萃取率最高;Sr2+萃取率随着TCACE浓度及Sr2+初始浓度的升高而增大。
(3)萃取反应时间到80 min时,反应接近平衡状态;本反应体系在80 min内的平均传质系数p为1.36×10-5 m·s-1。
(4)萃取过程中形成的萃合物为{Sr(NO3)2}•{TCACE},即一个TCACE分子能够络合一个Sr2+,萃取计量方程式为。
(5)相对于Mo6+、Ni2+、Ag+、Sn4+、La3+等金属离子,TCACE对Sr2+分离过程具有较好的选择性。
符 号 说 明

Ct, Cp——分别为有机相在不同萃取时间和平衡时金属离子的浓度,mol·L-1 Cw, Co——分别为不同萃取时间下Sr2+在水相中与有机相中的浓度,mol·L-1 ——分别为体系平衡时Sr2+在水相中与有机相中的浓度,mol·L-1 E——TCACE对Sr2+的萃取率,% Kex——反应平衡常数 kp——平均传质系数 kt——微分传质系数 s——相接触面积,m2 v——有机相体积,ml a——分配比 b——分离系数 下角标 o——有机相 t——时间 w——水相
References
[1] Wanda S, Tomasz G. Calixarene complexes with metal ions [J]., 2010, 66: 15-41
[2] Kumagai H, Hasegawa M, Miyanari S, Sugawa Y, Sato Y, Hori T, Ueda S, Kamiyama H, Miyano S. Facile synthesis of--butylthiacalix[4]arene by the reaction of--butylphenol with elemental sulfur in the presence of a base [J]., 1997, 38(22): 3971-3972
[3] Choi Y, Kim H, Lee J K, Seong Ho Lee, Heung Bin Limc, Jong Seung Kim. Cesium ion-selective electrodes based on 1, 3-alternate thiacalix[4]biscrown-6,6 [J]., 2004, 64: 975-980
[4] Herschbach H, Brisach F, Haddaoui J. Lanthanide complexation with CMPO and CMPO-calix[4]arenes in solution: spectrop hotometric and electrospray mass spectrometric approaches [J]., 2007, 74(1): 31-39
[5] Matsumiya H, Masai H, Terazono Y, Terazono Y, Iki N, Miyano S. Chelating adsorbent for heavy metal ions prepared by loading anion-exchange resin with thiaealix[4]arenetetrasulfonate [J]., 2003, 76: 133-136
[6] Mustafina A, Elistratova J, Burilov A. Cloud point extraction of lanthanide(Ⅲ) ionsuse of Triton X-100 without and with water-soluble calixarenes as added chelating agents [J]., 2006, 68(3): 863-868
[7] Mostovaya O A, Agafonova M N, Galukhin A V, Khayrutdinovb B I, Islamova D, Kataevaa O N, Antipina I S, Konovalova A I, Stoikov I I. Phosphorylated amino derivatives of thiacalix[4]arene as membrane carriers: synthesis and host-guest molecular recognition of amino, hydroxy and dicarboxylic acids [J]., 2014, 27(1):57-65
[8] Reddy P A, Gutsche C D. Calixarenes. 32. Reactions of calix[4]quinines [J]., 1993, 58(12):3245–3251
[9] Raut D R, Mohapatra P K. Simultaneous extraction of Cs and Sr from synthetic high level waste solutions using a solvent containing chlorinated dicarbollide and PEG-400 in PTMS [J]., 2014, 299: 75-80
[10] Wood D J, Law J D. Evaluation of the SREX solvent extraction process for the removal of90Sr and hazardous metals from acidic nuclear waste solutions containing high concentrations of interfering alkali metal ions [J]., 1997, 32: 241-253
[11] Law J D, Herbst R S, Todd T A, Romanovskiy V N, Babain V A, Esimantovskiy V M, Smirnov I V, Zaitsev B N. The universal solvent extraction (UNEX) process(Ⅱ): Flowsheet development and demonstration of the UNEX process for the separation of cesium, strontium, and actinides from actual acidic radioactive waste [J]., 2001, 19: 23-36
[12] Manchanda V K, Pathak P N. Amides and diamides as promising extractants in the back end of the nuclear fuel cycle: an overview [J]., 2004, 35: 85-103
[13] Visser A E, Swatloski R P, Reichert W M, Griffin S T, Rogers R D. Traditional extractants in nontraditional solvents: groups 1 and 2 extraction by crown ethers in room-temperature ionic liquids [J]., 2000, 39: 3596-3604
[14] Casnati A, Barboso S, Rouquette H, Marie-Jose Schwing-Weill, Francüoise Arnaud-Neu, Jean-Francüois Dozol, Rocco Ungaro. New efficient calixarene amide ionophores for the selective removal of strontium ion from nuclear waste: synthesis, complexation, and extraction properties [J]., 2001, 123: 12182-12190
[15] Riddle C L, Baker J D, Law J D, McGrath C A, Meikrantz D H, Mincher B J, Peterman D R, Todd T A. Fission product extraction (FPEX): development of a novel solvent for the simultaneous separation of strontium and cesium from acidic solutions [J]., 2005, 23: 449-461
[16] Ezgi Akceylan, Aydan Yilmaz, Mustafa Yilmaz. Synthesis and properties of calix[4]arene polymers containing amide groups: exploration of their extraction properties towards dichromate and nitrite anions[J]., 2013, 21(10): 1091-1096
[17] Fijs W B van Leeuwen, Hans Beijleveld, Huub Kooijman, Anthony L Spek, Willem Verbooma, David N Reinhoudt. Cation control on the synthesis of--butylthiacalix[4](bis)crown ethers [J]., 2002: 9675-9678
[18] Zhang Dongxiang(张东翔), Xue Rongshu(薛荣书), Tan Shiyu(谭世语). Mass transfer characteristics of interfacial layer mechanically activated in liquid -liquid system[J].()(化工学报), 2000, 51(1):108-114
[19] Zhang Anyun, Li Jinying, Dai Ying, Xu Lei. Development of a new simultaneous separation of cesium and strontium by extraction chromatograph utilization of a hybridized macroporous silica-based functional material [J]., 2014, 127:39-45
[20] Chen Z, Wu Y, Wei Y Z. Adsorption characteristics and radiation stability of a silica-based DtBuCH18C6adsorbent for Sr(Ⅱ) separation in HNO3medium [J]., 2014, 299: 485-491
Extraction of Sr2+with thiacalix[4]arene-biscrowns 4 in HNO3solution
LI Jie1, ZHOU Lijuan1, ZHANG Dongxiang1, LIU Cong1, Tarasov V. V.2
(School of Chemical Engineering and EnvironmentBeijing Institute of TechnologyBeijingChina;Mendeleev University of Chemical TechnologyMoscowRussia
Inthehigh-level radioactive waste liquid separation process of spent fuel reprocessing, new separation materials are of great significance for the efficient extraction of strontium. In the paper, 1, 2-alternate thiacalix[4]biscrowns 4 (TCACE) was synthesized by using calix[4]arene and triethylene glycol di(-toluenesulfonate). TCACE was characterized by FT-IR,1H NMR and MS. The influence of different diluents on extraction rate was studied, and CH2Cl2was chosen as diluent by optimization. Extraction rate of Sr2+was excellent and average mass transfer coefficient was 1.36×10-5 m·s-1under the conditions of CH2Cl2as organic solvent, nitrate acid concentration was 3 mol·L-1, TCACE concentration was 1×10-3mol·L-1, Sr2+concentration was 5×10-4mol·L-1, extraction was conducted for 80 min and at 25℃. Different technological conditions on extraction for Sr2+were studied. Furthermore, the extraction measurement equation was also studied. The extraction complex was {Sr(NO3)2}·{TCACE} as shown by experiment. The extraction effects for other metal ions Mo6+, Ni2+, Ag+, Sn4+with TCACE were also studied. It was found that TCACE showed excellent selectivity for Sr2+.
thiacalix[4]arene-biscrowns 4;synthesis;Sr2+;extraction;separation
2014-07-25.
Dr. ZHANG Dongxiang, boris@bit.edu.cn
10.11949/j.issn.0438-1157.20141122
O 625
A
0438—1157(2015)03—1035—07
国家高技术研究发展计划项目(2013AA051401)
2014-07-25收到初稿,2014-12-02收到修改稿。
联系人:张东翔。第一作者:李洁(1988—),女,硕士研究生。
supported by the National High Technology Research and Development Program of China (2013AA051401).
