难溶电解质的计算溶解度小于实测溶解度的原因分析
2015-10-15孟凡盛
孟凡盛
摘要:由人教版化学教材选修4表3-5中的Ksp计算某些难溶电解质的溶解度,发现其计算值小于实测值。从溶液中的“离子对”、电离、水解、配位反应等角度,分析了难溶电解质由Ksp计算溶解度小于实测溶解度的原因;指出了Ksp与计算溶解度之间存在的相互换算关系。
关键词:难溶电解质;Ksp;溶解度;离子对;配位反应
文章编号:1005–6629(2015)8–0087–04 中图分类号:G633.8 文献标识码:B
课堂上笔者以AgCl、BaSO4这两种难溶电解质为例,通过计算揭示了难溶电解质溶度积与溶解度之间存在相互换算关系后,进一步分析:“2014年高考新课标卷第11题考查了利用溴酸银的溶解度计算其溶度积,就是把难溶电解质的饱和溶液中,溶解度(S)、离子的平衡浓度(c)、溶度积(Ksp)这三个重要物理量综合起来设计试题;今后的考试,很有可能把该知识点设计成主观试题,进一步考查同学们对这三个重要概念及其换算关系的掌握情况”。话音刚落,不少学生露出了“钦佩”的目光,笔者心里不禁暗自得意。不料,第二天三名学生拿着写有计算过程的作业本找到笔者说:“我们用教材上硫酸钙的溶度积计算其溶解度,发现硫酸钙的计算溶解度与教材上提供的实测溶解度相差较大,是什么原因呢?”笔者闻之立即进行了验算,结果可想而之,面对硫酸钙的计算溶解度小于其实测溶解度,一时语塞,尴尬万分。随后笔者带领学生探究,“发现”了难溶电解质的计算溶解度小于其实测溶解度的“奥秘”,希望能对高中化学教师的教学有一些启迪和参考作用。
1 发现问题
1.1 溶度积和溶解度的相互换算
讲完溶度积的概念后,笔者对学生说:“现在学习的溶度积和初中学习的溶解度,都可以用来表示难溶电解质的溶解性,二者之间能否相互换算呢?”学生讨论后认为:难溶电解质的饱和溶液是极稀的溶液,将溶液的密度近似看作1 g/cm3,就能依据溶解度(或溶度积)计算出饱和溶液中各离子的物质的量浓度,进而得出溶度积(或溶解度)。然后,学生分为甲、乙两组进行计算、展示、交流。
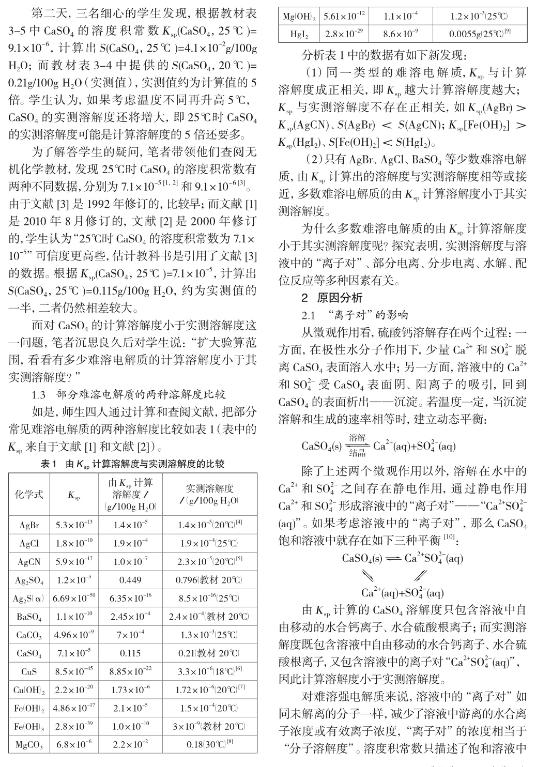


3 教学建议
溶度积和溶解度这两个物理量都可以用来表示难溶电解质的溶解性,教学过程中,既要讲清二者的联系,又要讲清二者的区别。
溶度积和溶解度之间的联系,主要是指溶度积与计算溶解度之间存在相互换算关系。对于多数难溶电解质而言,溶度积与实测溶解度之间不存在类似的相互换算关系。其次,对同一类型的难溶电解质而言,溶度积与计算溶解度成正相关,即溶度积越大计算溶解度越大;溶度积与实测溶解度不存在正相关。
溶度积和溶解度之间的区别,是指影响溶度积的因素与影响实测溶解度的因素不同。由于溶度积只描述饱和溶液中未溶解的固体与溶液中的离子之间的平衡,所以影响溶度积的因素只有温度(即计算溶解度只与温度有关)。影响实测溶解度的因素除了温度以外,还与难溶电解质的饱和溶液中可能同时存在的“离子对”、部分电离、分步电离、水解、配位反应等多种平衡有关,因此,计算溶解度往往小于实测溶解度。
古人云:“学起于思,思源于疑。”教学过程中,教师要鼓励学生质疑,须正确地对待学生的质疑。对于教师一时也无法解答的问题不要敷衍搪塞、轻易放过,要能够带领学生一起积极探究,把思维的触角伸向课外。这样既能更好地为学生释疑解惑,又能把师生互动引向深层次,真正起到教学相长的作用。
参考文献:
[1]张祖德编著.无机化学[M].合肥:中国科技大学出版社,2008:596.
[2][10]大连理工大学无机化学教研室编.无机化学(第4版)[M].北京:高等教育出版社,2001:657.
[3]武汉大学等校编.无机化学(上册,第3版)[M].北京:高等教育出版社,1994:493.
[4] http://zh.wikipedia.org/wiki/溴化銀.
[5] http://zh.wikipedia.org/wiki/氰化银.
[6]实用化学手册编写组编.实用化学手册[M].北京:科学出版社,2001:158.
[7] http://zh.wikipedia.org/wiki/溶解度表.
[8][9]宋天佑等编.无机化学(下册)[M].北京:高等教育出版社,2010:823;818.
