PFC体内递增诱导建立S180肿瘤多药耐药模型及其稳定性观察
2015-10-15顾云浩曹晨洁胡碧原韩东冬许爱华
顾云浩, 曹晨洁, 胡碧原, 王 俊, 韩东冬, 许爱华
(扬州大学医学院, 扬州 225001)
PFC体内递增诱导建立S180肿瘤多药耐药模型及其稳定性观察
顾云浩, 曹晨洁, 胡碧原, 王俊, 韩东冬, 许爱华
(扬州大学医学院, 扬州225001)
目的小鼠体内诱导建立获得性S180多药耐药(multi-drug resistance, MDR)模型及其稳定性观察。方法模拟临床顺铂+氟尿嘧啶+环磷酰胺(PFC)化疗方案给药, 分三个阶段剂量递增法诱导S180腹水瘤小鼠, 建立获得性S180MDR实验模型。采用噻唑蓝(MTT)法、流式细胞术动态检测各阶段所诱导细胞对化疗药物的耐药倍数、细胞内药物积累量及细胞膜P-糖蛋白(P-glycoprotein, P-gp)功能活性,并通过检测以上指标观察各阶段所诱导细胞停药后的耐药稳定性; 采用实时荧光定量PCR(RT-qPCR)法检测各阶段所诱导细胞MDR-1 mRNA、多药耐药相关蛋白-1(multidrug resistance-associated protein 1,MRP-1) mRNA的表达量。结果与亲本细胞对照组比较,各阶段所诱导S180细胞对化疗药物的耐药倍数随着诱导时间延长和剂量增高而逐渐增大, 细胞内阿霉素(adriamycin, ADR)积累量逐渐减少, 细胞P-gp功能活性逐渐增强; 各阶段所诱导S180细胞MDR-1 mRNA、MRP-1 mRNA的表达量也与诱导时间和给药剂量呈正相关; 第一、二和三阶段所诱导细胞的稳定耐药时间分别为1周、2周和3周左右。结论模拟临床PFC化疗方案给药,采用分阶段剂量递增小鼠体内诱导法可建立耐药强度高、稳定时间长的获得性S180MDR实验模型。
顺铂+氟尿嘧啶+环磷酰胺(PFC); 多药耐药(MDR); S180细胞株; 体内;细胞膜P-糖蛋白(P-gp); MDR-1 mRNA; 多药耐药相关蛋白-1(MRP-1) mRNA
肿瘤细胞多药耐药性(multi-drug resistance,MDR)是指肿瘤细胞对一种抗肿瘤药物产生抗药性的同时,对结构和作用机制不同的抗肿瘤药物产生交叉耐药性,使抗肿瘤化学治疗达不到预期的临床效果。如果在进行多个疗程化疗的同时合用有效的MDR逆转剂,将有利于提高抗肿瘤化疗疗效。目前,虽然有很多研究文献显示,一些药物在体外试验具有很好的MDR逆转作用[1,2],但真正可用于临床的逆转剂却很少,其主要原因之一是逆转剂的药效学研究大多采用体外给药方法诱导的MDR细胞株[3-6]及其动物模型[7],而癌症患者MDR的形成过程是受机体各种内环境影响的。因此, 建立接近于临床的MDR实验模型是寻找有效MDR逆转剂的重要基础。本研究模拟临床常用联合化疗顺铂+氟尿嘧啶+环磷酰胺(PFC)方案,体内给药, 采用分阶段剂量递增法诱导S180腹水瘤小鼠, 建立了获得性S180MDR细胞株及其动物模型, 并观察其稳定性。
1 材料与方法
1.1动物与细胞
6~8周龄SPF级ICR小鼠, 雌雄兼用, 体质量20±2 g, 由扬州大学比较医学中心提供[SCXK(苏)2012-0004]; 小鼠S180肉瘤细胞株购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,体外培养扩增后接种于ICR小鼠腹腔内,7~8 d传代1次。
1.2试剂
顺铂注射液(DDP,江苏豪森制药股份有限公司,批号: 130603),氟尿嘧啶注射液(FU,天津金耀氨基酸有限公司,批号: H12020959),注射用环磷酰胺(CPA, 江苏恒瑞医药股份有限公司, 批号:13022625), 注射用盐酸阿霉素(ADR, 浙江海正药业股份有限公司, 批号: 120701), 罗丹明123(Rho123,Sigma,批号: MKBC2653V),新生牛血清(杭州四季青生物工程材料公司),青霉素(重庆市先锋动物药业有限公司), 链霉素(江西省和光药业有限公司),RPMI1640培养基(Gibco),Trizol试剂盒、引物(生工生物工程上海有限公司)、逆转录试剂盒、PCR试剂盒(TaKaRa公司)。
1.3主要仪器
超净工作台(苏州净化设备有限公司),COIC XSZ-D2倒置显微镜(中国重庆光子仪器厂产品),ELx800型酶联免疫检测仪(BIO-TEK, 美国), CO2培养箱(Thermo), 分析型流式细胞仪(BD FACSCalibur),核酸蛋白测定仪(德国Eppendorf公司),PCR仪、实时定量PCR仪(ABI公司)。
1.4小鼠体内S180MDR模型的建立
取S180腹水瘤小鼠,无菌条件下抽取腹水,用无菌生理盐水稀释制成肿瘤细胞悬液,计数并调整细胞浓度至1×106个/mL。分别取0.2 mL细胞悬液从右下腹部注入小鼠腹腔内,24 h后,模拟临床常用的PFC联合化疗方案给药,采用分阶段剂量递增诱导法。DDP, ip, 每周一次; FU, ig, 每日一次; CPA,ig, 每日一次。不同阶段的给药剂量具体如下, 第一阶段: DDP 3.0 mg/kg+FU 3.0 mg/kg+CPA 3.0 mg/kg, 诱导时间为第一代和第二代; 第二阶段:DDP 4.0 mg/kg+FU 6.0 mg/kg+CPA 6.0 mg/kg, 诱导时间为第三代和第四代; 第三阶段: DDP 5.0 mg/kg +FU 12.0 mg/kg+CPA 12.0 mg/kg, 诱导时间为第五代和第六代。根据腹水生长的速度确定传代时间。
1.5S180MDR模型的验证
1.5.1噻唑蓝(MTT)法测定各化疗药物的耐药倍数取亲本S180细胞和各阶段诱导的S180细胞悬液, 均以1×l05/mL浓度接种于96孔培养板, 100 μL/孔。然后分别给予ADR、DDP和FU 6个不同浓度,每个浓度设6个复孔。实验设空白对照组、亲本细胞对照组、诱导细胞组及各浓度给药组。37℃、5%CO2恒温箱培养44 h后,吸取上清100 μL弃之,每孔加5 mg/mL MTT 溶液10 μL,继续孵育4 h后,每孔加盐酸异丙醇100 μL,振荡10 min,吹打均匀后震荡器上充分混匀, 于自动酶标仪490 nm波长下测定吸光度值,计算细胞生长抑制率、半数抑制浓度(IC50)和耐药倍数。细胞生长抑制率= (1-实验组吸光度/对照组吸光度) ×100%; 耐药倍数=诱导细胞IC50/亲本细胞IC50。
1.5.2流式细胞术测定细胞内ADR积累量收集亲本S180细胞和各阶段所诱导的S180细胞,用含5 μg/mL ADR的 RPMI 1640 完全培养基调整细胞至细胞数 1×106/mL, 分别接种于 24孔板, 每孔终体积为2 mL, 每组3个平行样品。37℃、5%CO2恒温培养箱条件下温育3 h,然后用3 mL左右的冷PBS吹洗,反复3次。最后用1 mL冷PBS液制成悬液于流式细胞管内,吹散细胞,立即用流式细胞仪检测10 000个细胞内ADR的平均荧光强度(MFI)。结果以MFI代表细胞内ADR浓度。ADR选用激发波长488 nm, 发射波长575 nm。
1.5.3流式细胞术测定细胞膜P-糖蛋白的功能采用Rho123蓄积和泵出实验检测亲本与耐药细胞膜上P-糖蛋白(P-gp)活性的差别[8,9]。测定 Rho123在细胞内的蓄积时,收集亲本S180细胞和各阶段所诱导的S180细胞,用含2.0 μg/mL Rho123的 RPMI 1640 完全培养基调整细胞至细胞数 1×106/mL, 分别接种于 24 孔板, 每孔终体积为1.0 mL, 每组3个平行样品。在37 ℃、5%CO2恒温培养箱条件下温育3 h, 然后用3.0 mL左右的冷PBS吹洗, 反复3次。最后用1.0 mL冷PBS液制成悬液于流式细胞管内, 吹散细胞, 立即用流式细胞仪检测10 000个细胞内Rho123的MFI。结果以MFI代表细胞内Rho123浓度。
测定 Rho123 在细胞内的泵出时, 收集亲本S180细胞和各阶段所诱导的S180细胞,用含2.0 μg/mL Rho123的 RPMI 1640 完全培养基调整细胞至细胞数 1×106/mL,分别接种于 24 孔板,每孔终体积为1.0 mL,每组3个平行样品。在37℃、5%CO2恒温培养箱条件下温育2 h,然后用3.0 mL左右的冷PBS反复吹洗2次,重悬于不含Rho123的RPMI 1640完全培养基中继续培养1 h后,用冷PBS吹洗2次后, 最后用1.0 mL冷PBS液制成悬液于流式细胞管内, 吹散细胞, 立刻用流式细胞仪检测10 000个细胞内 Rho123的MFI。结果以MFI代表细胞内Rho123浓度。Rho 123选用的激发波长为488 nm,发射波长为530 nm。
1.5.4RT-qPCR测定MDR-1 mRNA与MRP-1 mRNA的表达量采用RT-qPCR法检测细胞内MDR-1 mRNA和MRP-1 mRNA的表达量。目的基因MDR-1的上游引物: 5c -ATGACACCCCTGAAATCCA-3c, 下游引物: 5c-CGCTCCTGTGGTGTTTTTA-3c, 扩增产物为215 bp; 目的基因MRP-1的上游引物: 5c-CCTACTACCCCAGCATTGT-3c, 下游引物: 5c-TATTCCTTCAGTCTCTCCAC-3c, 产物扩增片段238 bp;内参GAPDH的上游引物:5c-CTTAGCACCCCTGGCCAAG-3c, 下游引物:5c-GATGTTCTGGAGAGCCCCG-3c,扩增产物为450 bp。取亲本细胞和各阶段诱导的S180细胞,采用TRizo1法分别提取细胞中 RNA,测定终溶液中D260/D280与RNA浓度。按两步法 RT-qPCR 试剂盒操作说明反转录得到cDNA, 并进行SYBR Green法荧光定量PCR分析各基因的表达。反转录反应条件为(1) 37℃ 15 min;(2)85 ℃ 5 s, 然后冷却至4 ℃; PCR反应条件为(1) 95℃预变性30 s; (2) 95 ℃,5 s; (3)60 ℃, 34 s; 共40个循环。PCR反应结束后,进行熔解曲线实验,条件为95℃, 15 s; 60℃, 1 min; 95℃, 15 s。最终结果用2-△△Ct法进行各基因表达的相对定量分析。1.6S180MDR模型的稳定性观察
将各阶段细胞末次传代后, 停止给予化疗药物,正常饲养、传代, 分别在停药1、2或3周时,取各阶段所诱导细胞,按1.5.1、1.5.2、1.5.3项下方法,测定细胞对各化疗药物的耐药倍数、细胞内ADR含量及细胞膜P-gp功能活性。
1.7统计学处理
实验数据应用SPSS 16.0分析软件进行统计分析,统计数据用±s表示,两样本之间采用t检验,多样本之间采用单因素方差分析进行数据分析,P<0.05为差异具有统计学意义。
2 结果
2.1细胞的耐药倍数
随着诱导时间延长和剂量增大,各阶段所诱导的S180细胞对各化疗药物的耐药倍数逐渐增大(表1),提示本实验体内建立耐药细胞株的方法可以使敏感型细胞获得耐药性。根据Sonw[10]等标准(耐药倍数<5为低度耐药,5~15为中度耐药,>15为高度耐药),第一阶段诱导的细胞为低度耐药,而第二、三阶段的可达到中度耐药; 表1结果还显示,所诱导的S180细胞对ADR也具有一定的耐药性,提示其对结构不同的其他化疗药物也产生了耐药性,具有MDR的特点。表2结果显示,第一阶段所诱导的S180细胞停药1周时对各化疗药物的逆转倍数皆>1.0,但停药2周时除了FU, 对其它化疗药物的耐药倍数皆<1.0, 提示其耐药稳定期只能维持1周; 第二阶段、第三阶段所诱导的S180细胞停药后其耐药稳定期则分别为2周和3周; 表2结果还显示,同期比较,停药2周时,第二、三阶段细胞各耐药倍;数均明显高于第一阶段的,停药3周时,第三阶段的耐药倍数均略高于第二阶段的,显示其诱导时间、诱导剂量与所诱导的S180细胞在停药后对各化疗药物的耐药强度和稳定性具有一定的正相关关系。
2.2细胞内ADR的积累量
药物在细胞内的积累量是其发挥作用的基础。与亲本细胞相比,药物在耐药细胞内的积累量会有所减少。图1结果显示, 各阶段所诱导的S180细胞内ADR的积累量随着诱导时间延长、剂量增大而逐渐减少, 与相应亲本细胞的比较均具有显著性差异。图2结果显示, 第一阶段在停药1周和2周时与相应的亲本细胞比较,所诱导细胞内ADR的积累量也均有所减少(P<0.001和P<0.05), 但停药1周的减少更明显; 各阶段在停药2周时除了所诱导细胞内ADR的积累量显著减少, 还显示其减少程度与诱导剂量和时间具有一定的正相关关系; 第二、三阶段停药3周时细胞内ADR积累量也皆有所减少,但第二阶段的与亲本细胞比较没有统计学差异。
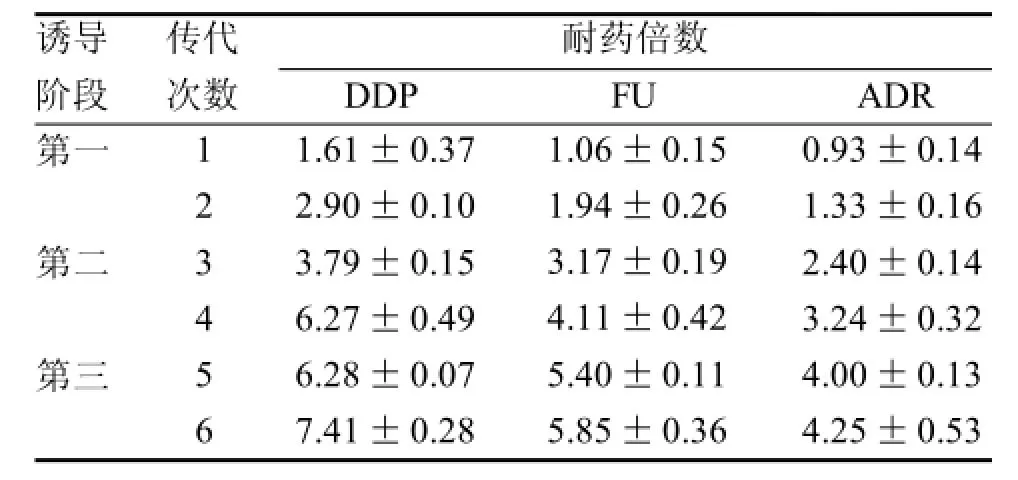
表 1 各阶段细胞对各化疗药物的耐药倍数(n=6)
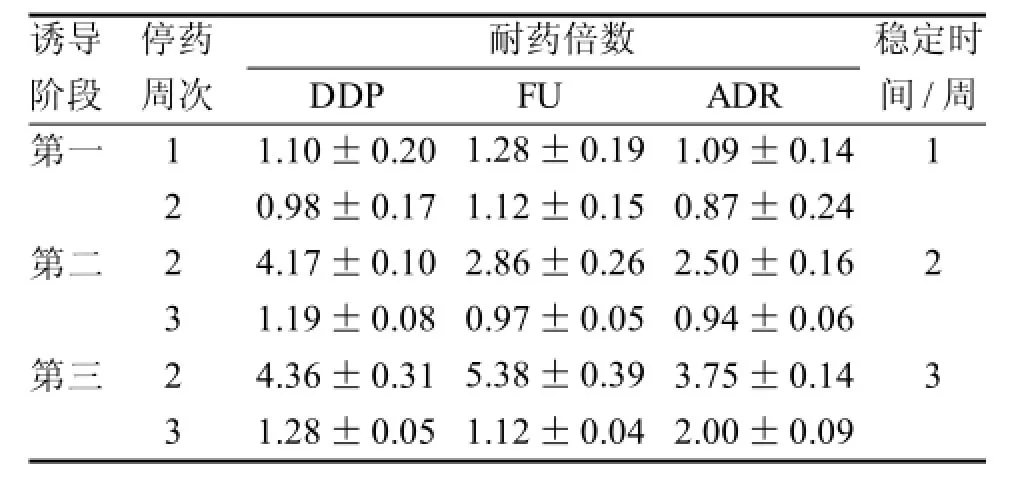
表 2 各阶段诱导细胞停药后耐药倍数测定(n=6)
2.3P-gp的功能活性
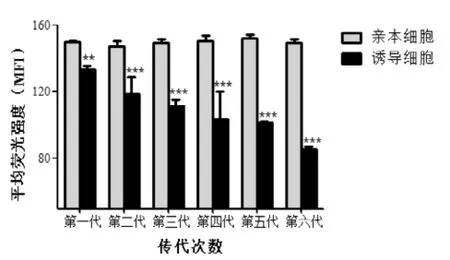
图1 各阶段细胞内ADR的积累量
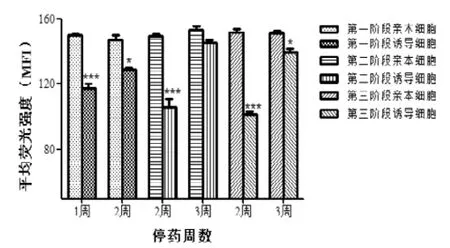
图2 各阶段停药后细胞内ADR的积累量
Rho123是特异性较强的P-gp底物,通过检测细胞对Rho123的蓄积和泵出反映其P-gp功能活性强弱。图3结果显示,各阶段所诱导的S180细胞对Rho123的蓄积量随着诱导时间延长、给药剂量增大而逐渐减少(图3A),而对Rho123的泵出量则逐渐增多(图3B),分别与相应的亲本细胞对照组比较均具有显著性差异,表明经过各阶段体内诱导的S180细胞P-gp功能活性逐渐增强,即产生了不同程度的MDR。图4结果显示, 各阶段停药后的不同时间, 所诱导细胞内Rho123的蓄积量仍然均低于亲本细胞对照组(图4A),而泵出量则反之(图4B),除了第一阶段停药后第二周和第二阶段停药后第三周的, 皆具有统计学意义。提示所诱导的细胞在停药后的一段时间仍然具有不同程度的耐药稳定性,该稳定性与诱导剂量和时间具有一定的正相关。
2.4细胞MDR-1 mRNA和MRP-1 mRNA表达量用核酸蛋白测定仪测定提取的RNA溶液D260/ D280值, 结果为1.6~1.8, 然后调节浓度后采用RT-qPCR法分别检测亲本S180细胞与不同阶段所诱导的S180
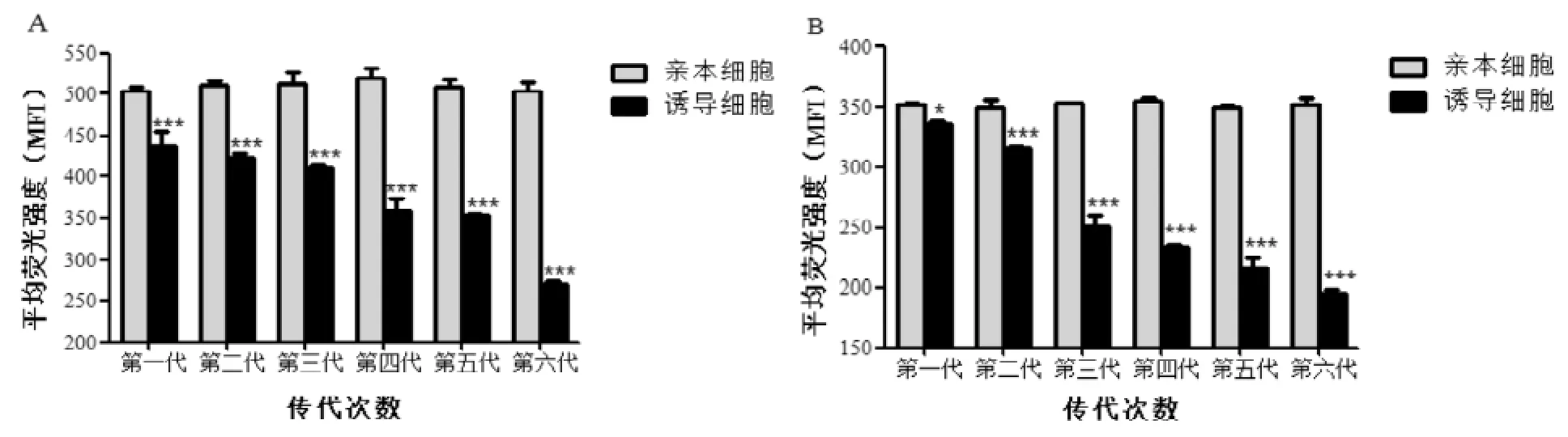
图3 各阶段细胞内Rho123蓄积量(A)和泵出后细胞内剩余量(B)

图4 各阶段停药后细胞内Rho123的蓄积量(A)和泵出后细胞剩余量(B)

图5 2-△△Ct法进行各基因表达的相对定量分析过程

表 3 各阶段细胞中MDR-1mRNA和MRP-1mRNA的表达量(n=3)
3 讨论

图6 各阶段细胞MDR-1 mRNA和GAPDH扩增产物的熔解曲线
模拟PFC联合化疗给药方案, 通过小鼠体内诱导MDR细胞株的研究已有一些报道[11], 但由于所用化疗药物大多剂量偏低,因而所建立的耐药细胞株其耐药强度不高,耐药稳定持续时间较短, 仅1周左右[12], 而大多中药逆转剂起效较慢, 故现有MDR实验模型不太适合中药或植物提取物类逆转剂的研细胞中MDR-1 mRNA和MRP-1 mRNA的表达量, 各基因表达的相对定量结果用2-△△Ct法进行分析(图5)。表3结果显示, 三个阶段所诱导细胞中MDR-1 mRNA、MRP-1 mRNA的表达量均高于亲本细胞, 除了第一阶段的MDR-1, 皆具有统计学差异; 结果还显示各阶段所诱导细胞的基因表达量与诱导药物的给药时间和剂量呈正相关关系。图6、图7的熔解曲线分析显示两种细胞MDR-1 mRNA、MRP-1 mRNA及GAPDH的PCR产物均为单一峰, 没有其他杂质峰出现, 可知采用SYBR Green 法荧光定量PCR 分析各基因的表达时, 荧光信号全部为PCR扩增产物, 无引物二聚体及干扰非特异性产物的干扰。究。此外, 有些实验模型[13]未报道耐药稳定性考察结果, 或是考察时间较短, 因而影响模型复制的成功率。本实验模型在已有PFC方案基础上进行了改进, 体内给药,采用分阶段剂量递增法诱导肿瘤细胞耐药, 其中DDP为3/4/5 mg/kg, FU和CPA均为3/6/12 mg/kg, 并动态检测各阶段诱导细胞的相关耐药指标, 观察随着剂量递增其耐药强度的变化趋势。结果显示, 随着PFC化疗药物剂量递增, 所诱导的S180细胞耐药强度逐渐增强, 并能耐受所用化疗药物的临床最高给药剂量, 提示被诱导细胞具有较高强度的耐药性。各稳定性实验结果相互验证, 均显示第一阶段诱导细胞的耐药稳定时间维持在1周左右,而第二、三阶段则分别在2周和3周左右, 提示该实验模型耐药强度高, 稳定性好, 且耐药强度与稳定性与诱导时间和给药剂量呈正相关, 中药及其提取物的逆转剂建议使用第二、三阶段所诱导的细胞。
图7 各阶段细胞MRP-1 mRNA和GAPDH扩增产物的熔解曲线
研究表明MDR产生的机制与P-gp、MRP-1等多药耐药蛋白密切相关[14,15]。其中P-gp[16]为由mdr-1编码的ATP依赖性药物排出泵,MRP[17]是一种谷光甘肽-S的共轭转运泵, 它们皆可利用ATP提供的能量将胞内抗肿瘤药物转运至胞外使抗肿瘤作用减弱, 其相关变化反应细胞耐药性的产生及其强度。本研究对所建模型动态测定不同阶段所诱导的S180细胞对化疗药物的耐药倍数、细胞ADR的蓄积量及P-gp功能活性, 并同步测定细胞MDR-1 mRNA、MRP-1 mRNA的表达量,以通过多指标相互验证各阶段细胞的耐药性。其中耐药倍数以药效的形式验证所诱导细胞对各化疗药物的敏感性, ADR的蓄积量反映化疗药物进入肿瘤细胞内的多少, P-gp功能活性从蛋白层面验证所诱导细胞外排药物的能力, 而MDR-1 mRNA、MRP-1mRNA表达量则从基因层面验证所诱导细胞的耐药特性。结果显示, 所建模型细胞不仅对DDP、FU产生了较强的耐药性, 且对未接触过的、结构和作用机制不同的ADR也具有一定程度的交叉耐药性, 因而具有MDR特点。从具体结果来看, 随着剂量增大, 各阶段细胞对DDP、FU、ADM的耐药倍数由最初的1.61、1.06、0.93增大到7.41、5.85、4.25;细胞内ADR的积累量逐渐减少, 而细胞P-gp功能活性则逐渐增强; MDR-1 mRNA、MRP-1 mRNA的表达量也与诱导时间和给药剂量正相关。
综上所述, 本实验模型动态、同步检测的各项指标结果相互得到了验证, 一致提示了该MDR模型耐药强度高、稳定时间长, 具有较强的可行性和实用性,为相关逆转剂的研究提供了较理想的动物体内MDR模型建立方法,具有重要实践应用价值。
[1]Huang F, Wu XN, Chen J, et al. Resveratrol reverses multidrug resistance in human breast cancer doxorubicin-resistant cells [J]. Exp Ther Med, 2014.7:1611-1616.
[2]Zhang QY, Wang JZ, He HB, et al. Trametenolic acid B reverses multidrug resistance in breast cancer cells through regulating the expression level of P-Glycoprotein[J]. Phytother Res, 2014, 28:1037-1044.
[3]刘晓冬, 常青, 赵秀芳, 等. 多西他赛诱导肺腺癌A549/ DTX细胞株的建立及耐药机制分析[J]. 肿瘤防治研究, 2014, 41(6):519-522.
[4]Tian QE, Li HD, Yan M, et al. Effects of astragalus polysaccharides on P-glycoprotein efflux pump function and protein expression in H22 hepatoma cells in vitro[J]. BMC Complement Altern Med, 2012, 12:94.
[5]Zhou Y, Ling XL, Li SW, et al. Establishment of a humanhepatoma multidrug resistant cell line in vitro [J]. World J Gastroenterol, 2010, 16(18):2291-2297.
[6]Li GY, Liu JZ, Zhang B, et al. Tegillarca granosa extract Haishengsu (HSS) suppresses expression of mdr1, BCR/ ABL and sorcin in drug-resistant K562/ADR tumors in mice [J]. Adv Med Sci, 2013, 58(1):112-117.
[7]黄永明, 苏海涛, 黄启明, 等. 人骨肉瘤耐药性KH-OS/ ADR细胞SCID小鼠移植模型的建立及其生物学特征的研究[J]. 中国中医骨伤科杂志, 2013, 21(7):1-3.
[8]Zrieki A, Farinotti R, Buyse M. Cyclooxygenase-2 inhibitors prevent trinitrobenzene sulfonic acid-induced P-glycoprotein up-regulation in vitro and in vivo[J]. Eur J Pharmacol, 2010, 636(1-3):189-197.
[9]Loetchutinat C, Saengkhae C, Marbeuf-Gueye C, et al. New insights into the P-glycoprotein-mediated effluxes of rhodamines[J]. Eur J Biochem, 2003, 270(3):476-485.
[10] Snow K, Judd W. Characteristion of adriamycin and amsacrine-resistant human leukaemic T cell lines[J]. Br J Cancer, 1991,63(1):17-28.
[11] 徐龙进, 王祖海, 孙付军, 等. 联合化疗诱导小鼠在体肿瘤多药耐药模型的建立[J]. 实验动物与比较医学, 2005, 25(4):215-217.
[12] 陈强, 李贵海, 孙付军, 等. 适合中药研究的小鼠S180肿瘤获得性多药耐药模型的建立及稳定性研究[J].中草药, 2006, 37(11):1691-1694.
[13] 尹格平, 顾清, 陈铭, 等. 腹水型S180细胞系获得性MDR表达鼠模型的建立[J]. 上海免疫学杂志, 2001, 21(5):282-285.
[14] Juranka PF, Zastawny RL, Ling V. P-glycoprotein: multidrugresistance and a superfamily of membrane-associated transport proteins[J]. FASEB J, 1989, 3(14):2583-2592.
[15] Molinas A, Sicard G, Jakob I. Functional evidence of multidrug resistance transporters (MDR) in rodent olfactory epithelium [J]. PLoS One, 2012, 7(5):1-13.
[16] Hennessy M, Spiers JP. A primer on the mechanics of P-glycoprotein the multidrug transporter[J]. Pharmacol Res, 2007, 55(1):1-15.
[17] Villar VH, V gler O, Barceló F, et al. Oleanolic and maslinic acid sensitize soft tissue sarcoma cells to doxorubicin by inhibiting the multidrug resistance protein MRP-1, but not P-glycoprotein[J]. J Nutr Biochem, 2014, 25:429-438.
Establishment of S180 Tumor Multidrug Resistance Mouse Model by Increasing PFC and Observation on Stability
GU Yun-hao, CAO Chen-jie, HU Bi-yuan, WANG Jun, HAN Dong-dong, XU Ai-hua
(Medical College, Yangzhou University, Yangzhou 225001, China)
ObjectiveTo establish aquired S180 multidrug resistance (MDR) mouse model and study on its stability. MethodsTo mimic the clinical PFC (cis-Dichlorodiamineplatinum+5-Fluorouracil+cyclophosphamide) scheme, gradually increase the dose in three phases to induce S180 ascites tumor mice and establish the aquired S180 MDR mouse model. The induced cells resistance factor to the chemotherapeutics drugs in different stages, the accumulation of adriamycin (ADR) and the functional activity of P-glycoprotein (P-gp) were detected by MTT assay and flow cytometry. And then through detecting the above indicators to monitor the resistance drug stability of induced cells in different stages. The mRNA expression of MDR-1 and multidrug resistance-associated protein 1 (MRP-1) of induced cells in different stages were detected by real time quantitative PCR (RT-qPCR). ResultsCompared with the parent cells, with induction time extending and dose increasing, the resistance factors in each stage of induced S180 cells tochemotherapeutics drugs were gradually increased, the accumulation of ADR was gradually reduced, and the functional activity of P-gp was strengthened.The mRNA expression of MDR-1 and MRP-1 of induced cells in different stages had a positive correlation to the induction time and dose. The stable resistance time of induced cells in the first, second and third phase are respectively for about 1 week, 2 weeks and 3 weeks. ConclusionTo mimic the clinical PFC scheme, using the dose gradually increasing by phased can establish a high resistant strength, long stable time aquired S180MDR experimental model.
cis-Dichlorodiamineplatinum+5-Fluorouracil+cyclophosphamide (PFC); Multidrug resistance;S180 cell line; in vivo; P-gp; multidrug resistance-1(MDR-1mRNA);multidrug resistance-associated protein-1(MRP-1 mRNA)
Q95-33
A
1674-5817(2015)05-0367-07
10.3969/j.issn.1674-5817.2015.05.005
2015-03-03
扬州大学大学生科技创新基金项目(2014); 江苏省医药高技术研究项目(BG2007609)
顾云浩(1994-), 男, 扬州大学医学院2012级在读本科生。E-mail: 907745184@qq.com
许爱华(1957-), 女, 教授, 主要从事肿瘤药理学研究。 E-mail: ahxu@yzu.edu.cn
