二袖套法大鼠原位肝移植手术技巧探讨
2015-10-14戴璟瑜阎玉矿彭海峰
张 杰, 都 敏, 鲍 兴, 戴璟瑜, 阎玉矿, 彭海峰
(1. 深圳市第九人民医院, 深圳 518116; 2. 深圳市龙岗区人民医院, 深圳 518172)
·经验交流·
二袖套法大鼠原位肝移植手术技巧探讨
张杰1, 都敏1, 鲍兴1, 戴璟瑜1, 阎玉矿1, 彭海峰2
(1. 深圳市第九人民医院, 深圳518116;2. 深圳市龙岗区人民医院, 深圳518172)
目的探讨二袖套法建立大鼠原位肝移植模型的外科技巧。方法在Kamada二袖套法基础上, 对供体静脉处理, 受体门静脉、肝上下腔的处理等手术方法作了改进。结果共建立50例大鼠原位肝移植模型,手术成功率92%, 7d存活率达88%。结论在娴熟细致的外科操作基础上,精简术式,改进细节,可成功的建立起大鼠肝移植模型。
原位肝移植; 二袖套法; 动物模型; 大鼠
建立大鼠肝移植模型是缺血-再灌注损伤、排斥反应以及免疫耐受研究的有效手段。自1979 年Kamada等[1]报道二袖套法后, 许多研究者[2-4]进行了各种改良, 并结合自己的体会建立了稳定的大鼠肝移植模型。本实验采用Kamada “二袖套法”[5], 结合国内外相关报道进行相应的改进(表1), 成功地建立了稳定的大鼠肝移植模型, 结合自己的实践体会,阐述如下:
1 材料与方法
1.1材料
清洁级雄性SD大鼠100只, 体质量180~250 g,购于广州中医药大学实验动物中心[SCXK(粤)2013-0034]。受体体质量略重于供体。下腔静脉和门静脉套管均选用静脉留置针14 G内径2.2 mm, 长2.5 mm均留有尾翼, 胆管支架采用静脉留置针24 G, 长3~4 mm, 两端削成锐角。自制拉钩2个,一大块橡皮泥, 上海手术器械厂显微外科手术器械包,丝线,灌注液: 0~4 ℃肝素等渗盐水(100 U/mL), 保存液: 含肝素25 U/mL的4 ℃乳酸钠林格氏液, 乙醚麻醉筒。
1.2方法
1.2.1术前准备选择健康活泼的大鼠, 受体、供体大鼠禁食8~12 h,自由饮水。
1.2.2 供体手术 术前30 min皮下注射的阿托品0.4 mL/kg。体积分数10%水合氯醛0.3 mL/kg, 腹腔注射,腹正中切口进腹, 经阴茎背静脉注射肝素生理盐水2 mL(含肝素100 U/mL), 供肝的游离时很难避免按压它从而造成肝脏的缺血再灌注损伤[6], 故用湿棉签或湿纱布向下牵引肝脏, 解剖第二肝门: 游离肝脏周韧带, 缝扎左膈肌静脉。解剖肝下下腔静脉(subhepatic inferior vena cava, IVC), 结扎切断右肾上腺静脉。游离右肾静脉水平以上的肝下下腔静脉, 游离右肾静脉结扎切断。解剖第一肝门: 游离胆总管, 自胆总管中、下1/3 处向上V 形剪开前壁,向肝侧插入胆管支架管, 5-0丝线固定后, 远端离断胆管。分离结扎切断肝固有动脉, 游离肝门静脉至脾静处结扎并剪断, 留线尾待以后套扎用,适当压力注入灌注液15 mL 经肝门静脉(portal vein, PV)灌洗肝脏。灌注速度控制在3~4 mL/min, 均匀低压, 以肝脏不肿胀为宜[7], 灌注压力过高可引起肝细胞损伤,导致肝细胞水肿进而影响供肝质量[8]。于左肾静脉以下剪断下腔静脉, 以便灌洗液顺利流出, 使供肝迅速进入冷缺血状态。灌注同时稍向左侧牵拉胃底,暴露肝食管韧带内的血管交通支,结扎切断。待肝脏变成土黄色后,剪断肝下下腔静脉和门静脉, 残端尽量留长。轻轻下牵肝, 用眼科剪剪下肝上下腔静脉, 不带膈肌组织。取出肝, 置于0~4℃保存液里。
1.2.3 受体手术 术前30 min按0.4 mL/kg皮下注射阿托品,乙醚吸入麻醉成功后,卧位固定,背部垫高约1 cm,切口同供体,游离肝周韧带,靠近膈肌结扎切断左膈肌静脉。第一肝门分离出胆总管,在左右肝管分叉处结扎切断胆总管,分离肝固有动脉并结扎切断, 分离门静脉至左右支分叉处(图1)。分离肝下下腔静脉,连同软组织结扎肾上腺静脉不剪短结扎线,留作套管时牵引用。将肝脏翻向左侧,离断肝后韧带至膈下。血管夹阻断肝下下腔静脉。血管夹阻断门静脉并用体积分数1%的温碳酸氢钠2.0 mL经门静脉左右分支处注入驱赶肝内血液,即所谓“自体输血”[9]并在分叉处剪一小口,留做供体袖套置入。以Satinsky钳贴膈肌夹闭肝上下腔静脉,紧贴受体肝脏剪断肝上下腔静脉及在肝门处剪断门静脉左右分支,连同部分肝组织剪断肝下下腔静脉,取出肝脏。
1.2.4 原位肝移植 取出供肝置于原位, 适当调整位置,将肝脏向头侧翻起, 将门静脉左右分支的预置线做牵引。7-0预置缝线连续缝合肝上下腔静脉。缝完最后一针与第一针尾线打结前,用2 mL等渗盐水排净吻合口中空气,再打结。快速将供体门静脉袖套插入门静脉,用5-0丝线固定,开放门静脉,待部分血液从肝下下腔流出时开放肝上下腔静脉,结束无肝期。结束无肝期前将各叶轻拨复位,防止出现肝叶充盈不均或淤血,达到真正的“原位肝移植”[10]。此时快速将肝下下腔静脉袖套插入肝下下腔静脉,用5-0丝线固定。熟练和完善的手术步骤是缩短无肝期时间的基础。最后, 将供肝胆总管支撑管插入胆总管中, 结扎固定。擦净腹腔内少许积血, 左侧腰静脉推注等渗盐水2.5 mL,喂以质量分数5%葡萄糖水,1 d后进流食。
2 结果
自2013年6月~2014年3月,共施行大鼠原位肝移植50对。统计数据如下: 供体手术约39 ± 2 min, 受体手术时间54±4 min, 受体无肝期16± 2 min, 供肝修整时间13±2 min, 移植物冷缺血时间约55 min。手术成功率(手术成功判定标准: 以大鼠关腹去除固定后能自行翻身、精神好、主动进水、对刺激反应正常、存活24 h以上)为92%(46/50), 其中1例死于肝上下腔静脉漏血, 1例死于门静脉扭曲,1例死于胆漏, 1例死于肝下下腔开放时血栓栓塞。7 d后存活率88% (44/50), 2例为胆管阻塞。

表 1 本实验操作在Kamada实验基础上主要改进之处
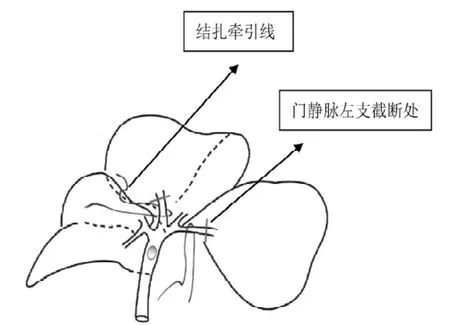
图1 手术操作示意图
3 讨论
成功建立大鼠原位肝移植模型无论是在临床实验, 还是在基础研究中都具有重要意义, 然而此手术操作程序的复杂, 无肝期操作时间的有限, 在很大程度上限制了大鼠肝脏移植模型快速成功建立和广泛推广[11]。作者经过接近1年实践,在供体静脉处理,受体门静脉、肝上下腔静脉吻合等方面做了改进,可单人直视下操作,操作简单, 成功率高。
3.1供体静脉处理
注意事项包括: ①结扎右肾上腺静脉: 连同血管周围组织一同结扎,这样避免了反复翻动尾叶,肝脏质地很脆,避免出血。②左膈静脉处理: 左膈静脉与下腔静脉距离很近,将肝脏向下牵引时,在吸气时,用显微镊子将二者分开,带线结扎。初学者很容易损伤肝上下腔静脉,破裂出血,手术失败。③肝上下腔静脉的处理: 在处理肝上下腔静脉时,分离肝后韧带至膈下, 有时下腔静脉与食管关系紧密, 下腔静脉管壁薄, 应在食管上方用顿弯钳以一定的角度垂直下腔静脉分离, 否则容易分破下腔静脉出血, 膈肌破裂造成气胸。肝上下腔静脉的修整时要与左膈肌静脉为标志,还要保证要有足够的边缘以便于血管的吻合[12]。④门静脉: 分离至脾静脉, 留结扎线, 这样即可保留足够门静脉长度,又可以在作套管时作牵引线和辨别门静脉前后壁,避免门静脉扭转。⑤手术顺序合理化: 利用灌注期间的时间处理肝食管之间的交通血管、使游离与灌注两手术阶段重叠进行, 明显缩短了手术时间。
3.2 受体静脉处理
注意事项包括: ①门静脉的处理: 受体肝摘除时,通过在门静脉左右分支分别用5-0丝线结扎,在分支近肝侧剪断左右支,带线以做牵引,并在分叉处纵形切开前壁约2 mm,容易将供体门静脉袖套置入,Hans等[13]处理门静脉平均时间4 min,本实验平均时间4±0.3 min,成功率98%。②肝上下腔的处理: 肝上下腔静脉的吻合占无肝期的大部分,要求吻合速度快,吻合口不漏血,不狭窄。因此,一定要准确区分受体肝上下腔静脉前后壁层次。左侧角吻合时,准确辨认侧角(以左膈肌静脉结扎线为标志)。进针点应偏向后壁, 在肝脏重力牵来作用下,很容易暴露后壁,再开始缝合后壁。进针准确, 切忌反复操作, 易引起出血和撕裂血管。
总之,建立一个稳定的大鼠原位肝植模型并非易事,除了术者应掌握娴孰的显微外科技术外,还要有坚强的意志品质,不断的实践,总结经验教训。本实验手术方法具有相对简单无肝期短、手术成功率高、是大鼠原位肝移植的理想术式。
[1]Kamada N, Calne RY. Orthotopic liver transplantation in the
rat. Technique using cuff for portal vein anastomosis and biliary drainage [J]. Transplantation, 1979, 28(1):47-50.
[2]Ariyakhagorn V, Schmitz V, Olschewski P, et al. Improvement of microsurgical techniques in orthotopic rat liver transplantation [J]. J Surg Res, 2009, 153(2):332-339.
[3]Hori T, Uemoto S, Zhao X, et al. Surgical guide including innovative techniques for orthotopic liver transplantation in the rat: Key techniques and pitfalls in whole and split liver grafts [J]. Ann Gastroenterol, 2010, 23(3):270-295.
[4]樊斌, 李德卫, 冯渊, 等. 大鼠肝移植急性排斥反应模型的建立 [J]. 中国组织工程研究与临床康复, 2011, 15(5):774 -777.
[5]Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat [J]. Surgery, 1983, 93(Pt1):64-69.
[6]Tian Y, Jochum W, Georgiev P, et al. Kupffer cell-dependent TNF-alpha signaling mediates injury in the arterialized smallfor-size liver transplantation in the mouse [J]. Proc Natl Acad Sci USA, 2006,103(12):4598-4603.
[7]Kashfi A, Mehrabi A, Pahlavan PS, et al. A review of various techniques of orthotopic liver transplantation in the rat [J]. Transplant Proc, 2005, 37(1):185-195.
[8]Schlegel A, Graf R, Clavien PA, et al. Hypothermic oxygenated perfusion (HOPE) protects from biliary injury in a rodent model of DCD liver transplantation [J]. J Hepatol, 2013, 59 (5):984-991.
[9]Lee S, Charter C, Chandler J, et al. A technique for orthotopic liver transplantation in the rat [J]. Transplantation, 1973, 16:664-669.
[10] 王宇, 阚和平, 蒋晓青. 双袖套法大鼠异体原位肝移植模型改进与体会 [J]. 中国临床解剖学杂志, 2010, 28(4):463-466.
[11] 蔡明, 潘桃, 李红洲, 等. 大鼠原位肝移植手术技巧探讨 [J].医学研究生学报, 2009, 22(1):57-60.
[12] 时军, 吴勤荣, 罗文峰, 等. 大鼠肝移植模型的建立[J]. 中国组织工程研究, 2012, 16(5):761-765.
[13] Spiegel HU, Palmes D. Surgical techniques of orthotopic rat liver transplantation [J]. J Invest Surg, 1998, 11:83-96.
Probe on Orthotopic Liver Transplantation in Rats by Double- Cuff Technique
ZHANGJie1, DOUMin1, BAOXing1, DAI Jin-yu1, YAN Yu-kuang1, PENGHai-feng2
(1. Department of General Surgery, the Ninth People's Hospital of Shenzhen, Shenzhen 518116, China;2. Longgang District People's Hospital,Shenzhen 518172, China)
ObjectiveTo investigate the surgical techniques for establishing the rat model of orthotopic liver transplantation. MethodsOn the basis of the double-cuff technique of Kamada, Some of the skills of the techniques for the veins of donors and the portal vein and the suprahepaticinferior vena cava of recipients were modified. ResultsOf the 50 rats that underwent orthotopic liver transplantation, 92% survived longer than 24 hours and 88% over 7 days. ConclusionThe operator can successfully establish the rat model of orthotopic liver transplantation by streamline operations and improving the details on the basis of skillful surgical techniques.
Orthotopic liver transplantation; Double-cuff technique; Animal model; Rat
Q95-33
A
1674-5817(2015)05-0406-03
10.3969/j.issn.1674-5817.2015.05.013
2015-02-14
深圳市创新计划(JCYJ20140411150159437)
张杰(1974-), 男, 硕士, 副主任医师, 从事肝胆外科专业。E-mail: 15811831077@163.com
