酶工程方法在有机反应中的应用进展
2015-10-15夏亚穆李晨晨张怀征
夏亚穆,李晨晨,张怀征
(青岛科技大学化工学院,山东 青岛266042)
酶作为新兴的生物催化剂,能够催化特殊化学键的形成和断裂,合成复杂化合物,还可以在温和的条件下制备手性化合物,较其它催化剂表现出较大优势。
在工业合成中,水解酶和酮还原酶是最常用的生物催化剂。近几年,由于酯酶、脂酶和酰基转移酶等水解酶的可用和易用性,得到了很多药物和农药合成的重要中间体,如光学纯氨基酸、氨基醇、胺、醇、环氧化合物等[1]。同时,脂肪酶通过缩聚和环状单体的开环聚合得到多种聚合物[2]。
酶催化剂可单一使用,也可协同使用。尽管已经发现很多可催化有机合成的酶,但是仍然需要开发新酶来催化更多复杂的化学反应。目前,开发新型酶催化剂的技术主要有:(1)筛选新菌株,构建新工程酶;(2)设计开发具有特定活性功能的酶;(3)生物信息学和计算机建模联合来设计实验。酶工程为筛选新的酶催化剂提供了新方法[3]。
近些年,酶的研究主要集中在酶制剂的制备、酶的固定化、修饰与改造及酶反应器等方面。与传统的化学过程相比,酶催化具有过程清洁、收率高、能耗低等优点,工业化生产将具有重要意义。作者综述了酶催化C=C还原加氢、手性胺和氨基酸的合成、手性环氧化合物的合成的研究进展,总结了酶工程方法在酶串反应中的应用以及未来的发展趋势。
1 酶催化的有机合成反应
1.1 C=C还原加氢
烯烃的不对称加氢是有机合成路线中的关键步骤,常用的催化剂是过渡金属,研究发现Old Yellow Enzyme(OYE)族也能催化此类化学反应[4]。OYE族广泛存在于微生物和植物中,可催化多种底物还原,如不饱和酮、醛、硝基烯、羧酸、酯和硝酸酯类等[5]。Gargiulo等[6]通过耦合 NAD(P)+-脱氢酶(ADH)催化环己醇的氧化和NAD(P)H-烯还原酶催化的α,β-不饱和酮的还原,得到饱和环己酮,总收率达66%。Stückler等[7]以肉桂醛衍生物为原料,使用Saccharomyces sp.OYE2催化,S构型的芳香醛类 Helional产物ee值高于97%,转化率达99%。烯丙基醇的氧化还原异构化反应如图1。
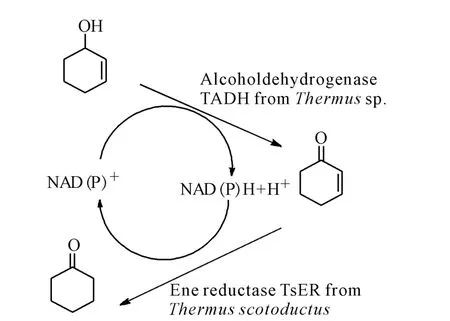
图1 烯丙基醇的氧化还原异构化Fig.1 The redox isomerization of allylic alcohols
“Roche esters”是一种手性化合物,是合成维生素、抗生素、香料和天然产物的重要中间体,用化学方法合成比较困难。Stückler等[8]用OYEs催化保护基保护的2-羟甲基丙烯酸甲酯得到罗氏酯。Saccharo-myces sp.的黄素蛋白 OYE1-OYE3和Bacillus subtilis的YqjM均可催化2-羟甲基丙烯酸甲酯得到相应R构型的罗氏酯(99%ee)。当NADH为辅因子时,底物为未保护的2-羟甲基丙烯酸甲酯时,OYE1催化转化率最高,可达37%;当用烯丙基和二苄醚保护羟基时,Pseudomonas putida的OYE3和XenA催化转化率可达90%以上,并且对映体过量率高(ee>99%),如图2。

图2 不对称酶催化还原制备Roche estersFig.2 Asymmetric enzyme catalytic reduction for the production of Roche esters
此外,一些烯还原酶还可以催化酮类的脱氢、歧化和异构化反应等,如2-环己烯酮类化合物在烯还原酶作用下发生歧化反应得到环己酮和苯酚。Durchschein等[9]研究发现烯还原酶可催化α,β-不饱和γ-丁内酯的双键异构化,如图3。
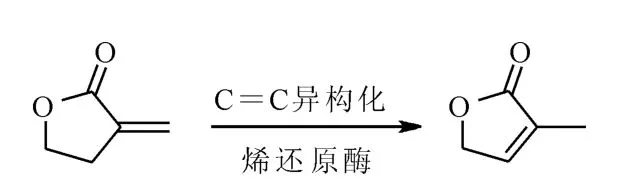
图3 生物催化α,β-不饱和γ-丁内酯的双键异构化Fig.3 Biocatalytic C=C bond isomerization ofα,βunsaturatedγ-butyrolactone
1.2 手性胺和氨基酸的合成
手性胺和氨基酸是大多数医药、农药和其它特种化学品的核心组成部分,该类分子的合成引起工业生物催化研究人员极大兴趣[10]。研究证明,转氨酶、氨基酸裂解酶、变位酶均可实现手性胺和氨基酸的生物合成。
1.2.1 转氨酶
转氨酶(EC 2.6.1.x),是一种吡哆醛-5′-磷酸盐依赖酶(PLP),可直接利用NH3分子作为供体催化酮的胺化[11]。至今,已经发现20多种w-转氨酶具有相似的底物特异性。转氨酶制备手性胺和氨基酸有3种方法:(1)外消旋体胺的动态动力学拆分,收率低于50%;(2)消旋体去消旋得到单一对映体,收率可达100%,但是过程比较复杂;(3)在相应的转氨酶作用下,由前手性酮合成单一手性胺,收率可达100%。这三种方法相比,酮的不对称合成由于操作简单、收率高,受到研究人员的青睐[12]。Wang 等[13]使用 3-胺基-1,5-二烯环己羧酸作为胺供体,w-转氨酶催化得到手性胺,收率为99%,对映体过量率ee>99%,如图4。
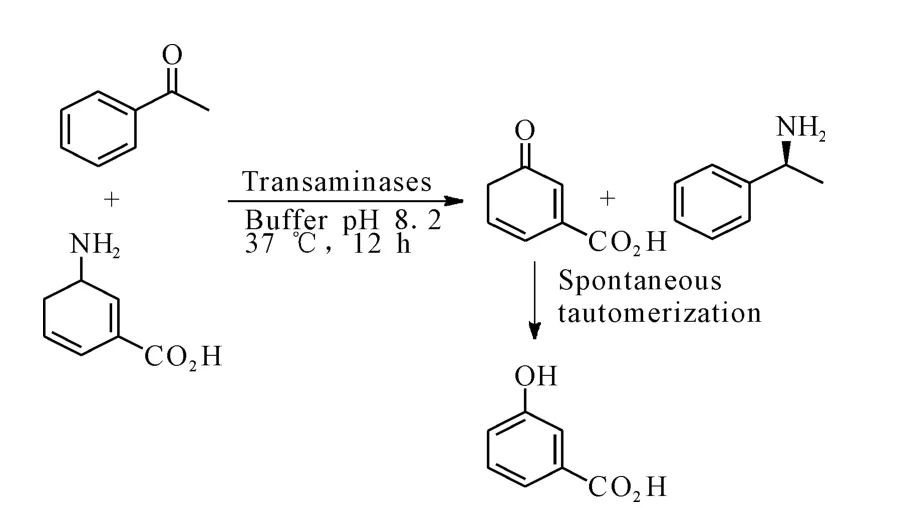
图4 胺基供体存在下手性胺的不对称合成Fig.4 Asymmetric synthesis of a chiral amine with an artificial amine donor
1.2.2 氨基酸裂解酶和变位酶
氨基酸裂解酶通过断裂底物氨基酸的氨基,可以催化α,β-不饱和键的生成以及C=N键的断裂。与转氨酶相比,该酶不需要金属或常见的辅助因子辅助[14]。Lange等[15]联合使用化学催化和酶催化方法得到合成心血管紧张素转化酶(ACE)抑制剂的重要中间体S-2-二氢吲哚碳酸。该反应使用Rhodotorula glutinis DSMPAL01的苯丙氨酸裂解酶(PAL)催化剂,分子NH3作为胺基供体,如图5。
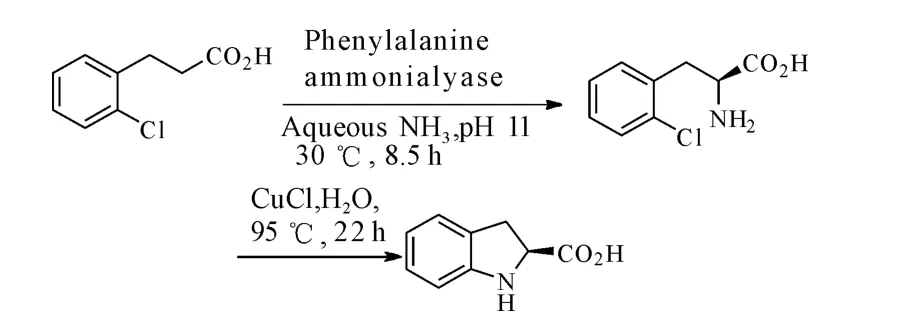
图5 化学-酶催化S-2-二氢吲哚碳酸的不对称合成Fig.5 Chemoenzymatic asymmetric synthesis of(S)-2-2 H-indolinecarboxylic acid
在多种天然产物和药用化合物中,都有β-氨基酸的结构,而变位酶可以催化生成这一结构[16]。Wu等[17]以β-苯丙氨酸消旋体为原料,经过串联Taxus chinensis的PAM 和Rhodosporidium toruloides的PAL这两种酶,催化得到β-苯丙氨酸相应的异构体(反应条件:pH 值8.8,3%甘油,37℃,48h),如图6。
1.3 手性环氧化合物的合成
环氧化物酶广泛存在于自然界的生物体中,能够催化化学合成法较难实现的反应,引起了广泛关注[18]。环氧化物酶在催化有机合成反应中不需要辅因子辅助,因此操作较方便,对映选择性高,反应时间短,收率高。Monfort等[19]运用环氧化物酶得到三唑类抗真菌药关键中间体S-D0870。在H2O/DMSO两相体系中,A.niger环氧化物酶动力学拆分消旋体二取代环氧化物。5h后,R构型环氧化物被分解成R-二醇,收率为43.5%(94.5%ee)。未反应的S-D0870被得到,收率为41.5%(99.9%ee)。然后第一步生成的R-二醇再在NaH和三苯基磷的作用下发生环化反应得到目标产物S-D0870,如图7。
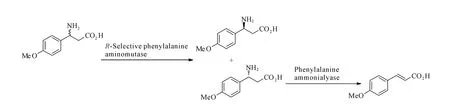
图6 生物催化β-苯丙氨酸的不对称合成Fig.6 Biocatalytic asymmetric synthesis ofβ-phenylalanine
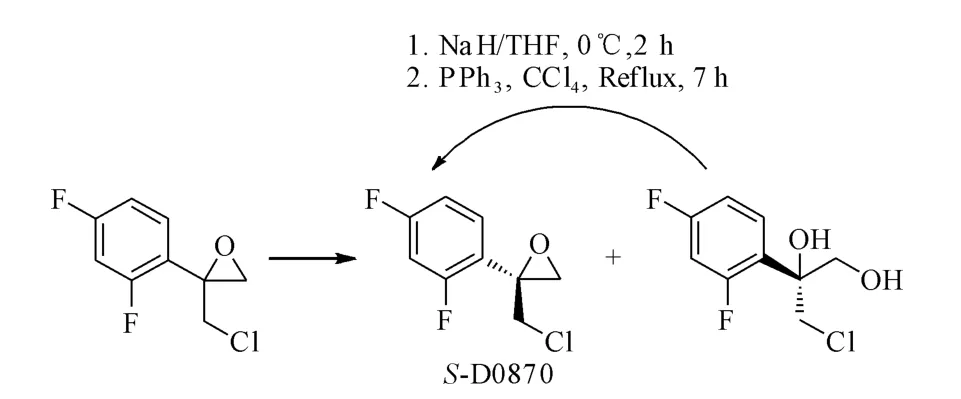
图7 环氧化物水解酶催化D0870的动力学拆分Fig.7 Kinetic resolution of D0870using an epoxide hydrolase
此外,研究发现微生物体中的单加氧酶和卤醇脱卤酶也可催化手性环氧化物的生成,并且操作较简单,产物的收率和对映体过量率也较高。Hofstetter等[20]发现苯乙烯单加氧酶(StyAB)可以催化实现芳烃乙烯基的不对称环氧化,得到环氧化合物相应的对映异构体,转化收率可达87%,对映体过量率(ee)≥98%,如图8。
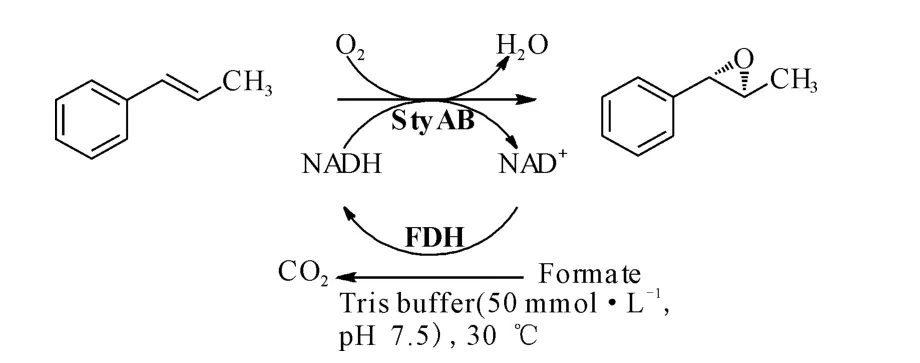
图8 芳烃乙烯基的不对称环氧化Fig.8 Asymmetric epoxidation of aromatic vinyl
苯乙烯单加氧酶(SMO)也可以催化烯丙醇的动力学拆分得到环氧异丙醇衍生物的对映异构体。卤醇脱卤酶也可用于动力学拆分合成环氧化物。Haak等[21]首次运用化学-酶催化动态动力学拆分β-卤代醇,得到相应的手性环氧化物。在特定的条件下,卤醇脱卤酶也可催化环氧化物的开环反应[22]。
2 酶工程在酶串反应中的应用
酶串反应可以通过休眠细胞或冻干细胞在体内或体外进行反应,根据催化剂的不同可以分为生物-化学串级反应与生物-生物串级反应[23],这些反应通常使用两种或更多的酶来催化。Simon等[24]使用非对称的1,5-二酮为原料,首先在ω-转氨酶的催化下得到环状亚胺,用来自于Chromobacterium violaceum 的天然酶生成得到 (2S)-亚胺,用ArRmut11工程酶得到(2S)-亚胺,再分别被LiAlH4和Pd/C还原,得到2,6-二哌啶的4个立体异构体,并且反应收率和立体选择性都很高。生物-生物串级反应主要研究酶的选择性和活性,应用也比较广泛。Sehl等以苯甲醛和丙酮酸为原料,经过两种酶催化,成功得到去甲麻黄碱和去甲伪麻黄碱。反应的第一步,以苯甲醛和丙酮酸为原料,用对映互补E.coli的聚醛酶进行催化,生产苯基乙酰基甲醇的非对映异构体。反应的第二步,用两种来自于C.violaceum 和Aspergillu sterreus的ω-转氨酶合成4个非对映异构体[25]。
酶串反应在底物和产物方面的应用范围广,设计方法随意。但是,至今所报道的大部分酶串反应仍局限于理论研究,工业应用还较少。酶串反应的研究为目标化合物提供了新的合成方法,如ω-羟基脂肪酸、二元酸等单体。今后酶串反应的研究重点主要是克服酶的抑制性以及与传统化学更好地结合,加速实现工业化。
3 结语
在过去十年,越来越多的关注集中在酶催化有机合成反应上,推动了生物催化领域的发展。但是仍然面临一些挑战,首先需要筛选适合新工艺条件的新酶,另一方面要在已定的工艺条件下优化现有酶,提高稳定性和催化速率。虽然在酶及其变体用于特定合成步骤的研究方面取得了一些成果,但是在逆合成分析方面仍需要探索。未来,酶串联级及一锅煮实现化学催化的方法有望被开发,这样既能实现多种键同时被催化又可减少不必要的下游处理步骤。
可以预见,未来几年更多的酶将用于化学反应,如环化酶、亚胺还原酶等。酶工程的发展、酶催化机制的完善、蛋白质设计以及新酶的探索及开发在未来几年将进一步扩大生物催化的使用范围,并且将在实现新的化学反应、化学催化以及生物催化方面发挥重要作用。
[1]BUSTO E,GOTOR-FERNANDEZ V,GOTOR V.Hydrolases in the stereoselective synthesis of N-heterocyclic amines and amino acid derivatives[J].Chemical Reviews,2011,111(7):3998-4035.
[2]VELD M A J,PALMANS A R A.Hydrolases part I:Enzyme mechanism,selectivity and control in the synthesis of well-defined polymers[J].Enzymatic Polymerisation,2010,237:55-78.
[3]LIU D,TRODLER P,EIBEN S,et al.Rational design of Pseudozyma antarcticalipase B yielding ageneral esterification catalyst[J].Chembiochem,2010,11(6):789-795.
[4]WINKLER C K,TASNADI G,CLAY D,et al.Asymmetric bioreduction of activated alkenes to industrially relevant optically active compounds[J].Journal of Biotechnology,2012,162(4):381-389.
[5]TOOGOOD H S,GARDINER J M,SCRUTTON N S.Biocatalytic reductions and chemical versatility of the old yellow enzyme family of flavoprotein oxidoreductases[J].ChemCatChem,2010,2(8):892-914.
[6]GARGIULO S,OPPERMAN D J,HANEFELD U,et al.A biocatalytic redox isomerisation[J].Chemical Communications,2012,48(53):6630-6632.
[7]ST CKLER C,MUELLER N J,WINKLER C K,et al.Bioreduction of alpha-methylcinnamaldehyde derivatives:Chemo-enzymatic asymmetric synthesis of lilial and helional[J].Dalton Transactions,2010,39(36):8472-8476.
[8]ST CKLER C,REITER T C,BAUDENDISTEL N,et al.Nicotinamide-independent asymmetric bioreduction of C=C-bonds via disproportionation of enones catalyzed by enoate reductases[J].Tetrahedron,2010,66(3):663-667.
[9]DURCHSCHEIN K,WALLNER S,MACHEROUX P,et al.Unusual C=C bond isomerization of anα,β-unsaturatedγ-butyrolactone catalysed by flavoproteins from the old yellow enzyme family[J].ChemBioChem,2012,13(16):2346-2351.
[10]PATEL R N.Biocatalysis in the Pharmaceutical and Biotechnology Industries[M].CRC Press,2007:743-755.
[11]ZHU D,HUA L.Biocatalytic asymmetric amination of carbonyl functional groups—A synthetic biology approach to organic chemistry[J].Biotechnology Journal,2009,4(10):1420-1431.
[12]TURNER J T,TRUPPO M D.Biocatalytic routes to nonracemic chiral amines[J].Chiral Amine Synthesis,2010,150(14):431-459.
[13] WANG B,LAND H,BERGLUND P.An efficient single-enzymatic cascade for asymmetric synthesis of chiral amines catalyzed byω-transaminase[J].Chemical Communications,2013,49(2):161-163.
[14]ASANO Y,KATO Y,LEVY C,et al.Structure and function of amino acid ammonia lyases[J].Biocatalysis & Biotransformation,2004,22(2):133-140.
[15]de LANGE B,HYETT D J,MAAS P J,et al.Asymmetric synthesis of(S)-2-indolinecarboxylic acid by combining biocatalysis and homogeneous catalysis[J].ChemCatChem,2011,3(2):289-292.
[16]WU B,SZYMANSKI W,WIETZES P,et al.Enzymatic synthesis of enantiopure alpha-and beta-amino acids by phenylalanine aminomutase-catalysed amination of cinnamic acid derivatives[J].ChemBioChem,2009,10(2):338-344.
[17]WU B,SZYMANSKI W,de WILDEMAN S,et al.Efficient tandem biocatalytic process for the kinetic resolution of aromatic beta-amino acids[J].Advanced Synthesis & Catalysis,2010,352(9):1409-1412.
[18]van LOO B,KINGMA J,ARAND M,et al.Diversity and biocatalytic potential of epoxide hydrolases identified by genome analysis[J].Applied and Environmental Microbiology,2006,72(4):2905-2917.
[19]MONFORT N,ARCHELAS A,FURSTOSS R.Epoxide hydrolase-catalysed resolution of key synthons for azole antifungal agents[J].Tetrahedron Asymmetry,2002,13(22):2399-2401.
[20]HOFSTETTER K,LUTZ J,LANG I,et al.Coupling of biocatalytic asymmetric epoxidation with NADH regeneration in organic-aqueous emulsions[J].Angewandte Chemie(International ed.in English),2004,43(16):2163-2166.
[21]HAAK R M,BERTHIOL F,JERPHAGNON T,et al.Dynamic kinetic resolution of racemic beta-haloalcohols:Direct access to enantioenriched epoxides[J].Journal of the American Chemical Society,2008,130(41):13508-13509.
[22]MA S K,GRUBER J,DAVIS C,et al.A green-by-design biocatalytic process for atorvastatin intermediate[J].Green Chemistry,2010,12(1):81-86.
[23]WALLACE S,BALSKUS E P.Opportunities for merging chemical and biological synthesis[J].Current Opinion in Biotechnology,2014,30:1-8.
[24]SIMON R C,ZEPECK F,KROUTIL W.Chemoenzymatic synthesis of all four diastereomers of 2,6-disubstituted piperidines through stereoselective monoamination of 1,5-diketones[J].Chemistry,2013,19(8):2859-2865.
[25]GHISLIERI D,GREEN A P,PONTINI M,et al.Engineering an enantioselective amine oxidase for the synthesis of pharmaceutical building blocks and alkaloid natural products[J].Journal of the American Chemical Society,2013,135(29):10863-10869.
