高效离子色谱法分离、检测低聚果糖
2015-10-14魏远安郑惠玲吴少辉王光勇刘学术
魏远安,郑惠玲,吴少辉,王光勇,刘学术
(量子高科(中国)生物股份有限公司技术中心,广东 江门 529081)
高效离子色谱法分离、检测低聚果糖
魏远安,郑惠玲*,吴少辉,王光勇,刘学术
(量子高科(中国)生物股份有限公司技术中心,广东 江门 529081)
采用CarboPac PA20柱和脉冲安培检测器的高效阴离子交换色谱建立一种低聚果糖的分析方法,该法可有效分离蔗果型和果果型低聚糖组分,并由此推测出低聚果糖的来源。结果表明,在优化条件下,蔗果低聚糖中蔗果三糖、新蔗果三塘、蔗果四糖和蔗果五糖的回收率分别为98.27%~99.72%、97.32%~102.56%、99.33%~101.81%和97.38%~102.12%。该法的相对标准偏差在0.55%~2.15%。蔗果三糖、新蔗果三塘、蔗果四糖和蔗果五糖的方法检出限分别为0.13、0.19、0.20 μg/g和0.41 μg/g。蔗果三糖在0.3~18 ☒g/mL、新蔗果三糖和蔗果四糖在0.5~20 ☒g/mL、蔗果五糖在0.8~23 ☒g/mL的范围内,其质量浓度与峰面积线性关系良好,相关系数在0.999 6~0.999 9之间。本方法简单、易于掌握,测定结果准确,适合低聚果糖产品及蛋白粉和奶粉等功能性食品中低聚果糖成分的检测分析。
低聚果糖;高效阴离子色谱;定性定量检测
低聚果糖作为优质益生元的代表,是对人体保健功能研究实验最为深入详尽的低聚糖之一,健康生理功效显著,如:调节体内菌群平衡、降低血脂、促进矿物质的吸收和肠内有毒废物的排除、低热量、防龋齿等[1-4],特别在调节体内菌群方面对促进人体内有益菌——双歧杆菌的增殖更具有明显的功效,2000年已通过美国食品药品监督管理局审核作为公认安全级的功能性低聚糖,普遍地被用作保健食品配料[5]。早期的低聚果糖概念泛指以菊粉水解和蔗糖生物酶转化两类工艺制得的低聚糖。研究表明,不同来源的低聚果糖不仅存在组分果糖链链长的不同,而且化学结构上也有蔗果型低聚糖和果果型低聚糖之间的差别。目前国际上对低聚果糖的分类逐渐细化,单独将以蔗糖为原料经过酶转化工艺生产的这类产品称为短链低聚果糖,这类产品的所有组分都是蔗果型低聚糖,且一般情况下果糖链较短,主要是三、四和五糖,六糖及六糖以上的低聚糖含量较低[6-7]。笔者建议将国际上的“short-chain FOS”中文译为蔗果低聚糖,以区别于果果型低聚糖。蔗果低聚糖和果果型低聚糖的分子结构不同。具体的说,果果型低聚果糖的化学结构为2~10 个果糖基经β(2→1)糖苷键相互连接而成的聚合物,主要来源为菊粉经内切型菊粉酶作用,从菊粉分子内部随机切断糖苷键,得到不同聚合度果果型低聚果糖及少量蔗果型低聚果糖[8]。有关低聚果糖异构体细分化学结构及其命名将另文讨论。值得指出的是,随着现代分离分析技术的进一步发展,从方法学上分离分析不同的低聚果糖成分及其异构体已成为可能,也是目前低聚果糖在功能食品、健康食品中迅速发展应用过程中亟待解决的问题。
过去报道的低聚果糖检测方法有薄层色谱法[9-10]、高效液相色谱(high performance liquid chromatography,HPLC)法[11-14]、高效离子色谱法[15-18]等。在食品工业中最常用的为HPLC法和高效离子色谱法,分别参照相应标准[19-21]方法执行。常规的氨基柱HPLC方法检测低聚果糖,一般使用示差折光检测器或蒸发光散射检测器。示差检测器灵敏度较低且不适合梯度洗脱,而蒸发光散射检测器灵敏度有所提高且可进行梯度洗脱分析低聚果糖,但用这些常规的HPLC法很难完全分离分析蔗果低聚糖的异构体和果果型低聚糖(图3)。特别是菊粉来源的低聚果糖为果果型和蔗果型低聚果糖的混合物,现有方法就难以进行全组分的有效分离和直接、有效的定量分析。为此,本实验建立了一种基于离子色谱技术的新的低聚果糖分离与检测方法。不同于以往报道的高效离子色谱分析方法,本方法除了可分离并鉴定出不同聚合度的低聚果糖组分之外,还能分离鉴定果果型和蔗果型低聚果糖组分,以及分离蔗果低聚糖异构体。采用量子高科公司新近开发制备的6 种国家认定的低聚果糖标准品,本方法可实现不同聚合度低聚果糖及其同分异构体的定性和定量分析,可快速、准确、全面地分析低聚果糖组分,且其检测灵敏度比常规HPLC方法大大提高,不仅满足低聚果糖原料生产的分析要求,也能适用于含有低聚果糖的奶粉和蛋白粉等功能食品的分析。
1 材料与方法
1.1材料与试剂
蔗果三糖(GSB 11-3244-2014)、6-蔗果三糖(GSB 11-3242-2014)、新蔗果三糖(GSB 11-3241-2014)、蔗果四糖(GSB 11-3245-2014)、蔗果五糖(GSB 11-3246-2014)、蔗果六糖(GSB 11-3243-2014)标准品,低聚果糖样品(纯度95%) 量子高科(中国)生物股份有限公司;低聚果糖产品(5 个蔗糖来源,1 个菊苣来源) 市购;多种植物蛋白粉(纽崔莱) 安利公司;贝拉米有机奶粉(0~12 月) 澳洲贝拉米公司;国产全脂甜奶粉;氢氧化钠、OnGuard Ⅱ RP柱(2.5 mL) 美国Dionex公司;醋酸钠 美国Sigma公司;乙腈 美国Tedia公司;99.9%氮气 金珠江气体有限公司。所用试剂均为色谱纯。
1.2仪器与设备
ICS-5000离子色谱仪(配有四元梯度泵、脉冲安培检测器、脱气装置、GM-3淋洗液混合器、柱温箱、AS-DV自动进样器、Chromeleon 6.8色谱工作站) 美国Dionex公司;高效液相色谱仪(配有2414示差折光检测器) 美国Waters公司;Inertsil氨基柱(4.6 mm×250 mm,5 ☒m) 日本岛津公司;Casada BIO超纯水机 美国Pall公司;KQ-100DE型数控超声波清洗器 昆山市超声仪器有限公司;TG1650-WS型离心机 湖南赛特湘仪离心机仪器有限公司。
1.3方法
1.3.1标准溶液配制
分别称取10 mg(精确至0.01 mg)蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖于10 mL容量瓶中,用超纯水定容,配制成质量浓度为1 000 μg/mL的单一标准储备液,4 ℃条件下可储存1 个月。使用前根据需要,用超纯水稀释配制成不同质量浓度的混合标样。
1.3.2样品前处理
1.3.2.1糖浆、糖粉原料样品
称取含低聚果糖约0.1~0.15 g(精确至0.01 mg)试样,用10 mL 50 ℃超纯水溶液溶解,定容至100 mL,配制成含低聚果糖1.0~1.5 mg/mL的测试样液,根据测试样液中各糖组分的含量差异(一般情况下蔗果三糖和蔗果四糖含量最高,新蔗果三糖和蔗果五糖含量较低)需稀释2 个不同的倍数,过0.22 μm滤膜后测定。
1.3.2.2含蛋白质、脂肪等物质的样品
称取含低聚果糖约0.1~0.15 g(精确至0.01 mg)试样,用10~20 mL 50 ℃水溶解并超声混匀,然后加入5~10mL乙腈静置10 min,定容至100 mL,配制成含低聚果糖1.0~1.5 mg/mL的测试样液,取适量于离心管中,10 000 r/min离心10 min,取清液稀释后过0.22 μm滤膜和OnGuard Ⅱ RP柱(2.5 mL)后测定。
1.3.3色谱条件[22-23]

表1 洗脱梯度程序Table1 Eluent gradient program
色谱柱:CarboPac PA20保护柱(3 mm×30 mm),CarboPac PA20分离柱(3 mm×150 mm,6.5 μm);流速0.5 mL/min;柱温30 ℃;进样量25 ☒L;检测方式:Au电极,AgCl参比模式,脉冲安培检测,糖标准四电位波形;流动相梯度洗脱:流动相A为250 mmol/L NaOH溶液,B为250 mmol/L NaOH+500 mol/L NaAc溶液,C为水,程序如表1所示。
1.3.4方法检出限的测定
称取29.9 mg蔗果三糖、24.8 mg新蔗果三糖、25.0 mg蔗果四糖、23.0 mg蔗果五糖加超纯水至100 g,混合均匀,分别称取7份10 g混合液,按1.3.2.1糖浆、糖粉原料样品处理方法处理后稀释5 倍,进离子色谱仪测定。能够被检出且在被分析物浓度大于零时能以99%置信度报告的最低浓度定为本方法的检出限[24]。方法检出限(method detection limit,MDL)按式(1)计算:

式中:ν1、ν2为自由度;t(ν1+ν2,1-α)为自由度是ν1+ ν2时的t检验(可查表得到),1-α为置信水平;S为合成标准偏差。
1.3.5回收率实验
根据《中华人民共和国药典》[25]附录中关于中药质量标准分析方法验证指导原则,选取低聚果糖粉添加1.3.1节配制好的蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖储备液配成的混标,及3 种不同的基质按每100 g加入约0.5、1.0、2.0、5.0、15.0 g的低聚果糖(纯度为95%)。采用1.3.2节的样品处理方法处理后,进行离子色谱仪测定。按式(2)计算回收率:

式中:A为供试品中被测成分的基质量/mg;B为加标量/mg;C为测定值/mg。
1.3.6低聚果糖含量计算
蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖的质量分数(以干基计算),按式(3)计算:

式中:Xi为样品(蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖)质量分数/%;Ai为样品的质量浓度/(μg/mL);Di为样液Ai的稀释倍数;m为样品质量(液体为称取样品中可溶性固形物的质量,固体为称取样品质量减去水分质量)/g。
样品中总低聚果糖的质量分数w(以干基计算)为各低聚果糖质量分数的加和,参见公式(4)计算:

2 结果与分析
2.1色谱条件的选择
参考相关文献报道及色谱柱的优缺点对比,选择容量较低、灵敏度高、淋洗液消耗量较少且可兼容有机溶剂的CarboPac PA20柱进行测定。
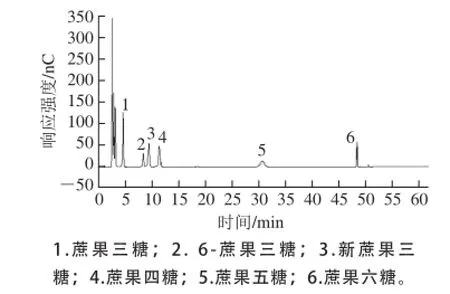
图1 蔗果低聚糖标准品(混标)离子色谱图Fig.1 HPAE chromatogram of mixed standards of scFOS
使用本方法检测混合标准品,结果见图1。混合标准品所含的蔗果三糖、6-蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖、蔗果六糖均能检测出峰,且具有良好的分离效果及峰形。结果表明,该方法可很好地对含上述低聚糖的样品进行定量以及定性检测。
分别使用本方法和氨基柱-HPLC法检测菊粉低聚果糖和蔗果低聚糖。从图2和图3可看出,本方法对菊粉来源低聚果糖中蔗果三糖、蔗果四糖、蔗果五糖、蔗果六糖和蔗果低聚糖中新蔗果三糖、蔗果三糖、蔗果四糖、蔗果五糖、蔗果六糖均能单峰出峰,分离效果良好。而HPLC法检测菊粉低聚糖中蔗果四糖、蔗果五糖、蔗果六糖不是单峰,存在峰黏连现象,而蔗果型低聚糖中的新蔗果三糖和蔗果三糖不能完全分离。结果表明,本方法比HPLC法对低聚果糖的分离检测效果更优越。

图2 蔗果低聚果糖和菊粉低聚果糖离子色谱图Fig.2 HPAE chromatograms of FOS derived from sucrose and inulin
从图2可看出,菊粉来源的低聚果糖成分要比蔗果低聚糖的复杂。几个主要多出来的峰,如峰2、5、7、9经过初步纯化分离得到少量样品,再经水解分析和质谱分析初步确定为果果二糖、果果三糖、果果四糖、果果五糖,这些组分在分析的所有蔗果低聚糖样品中都未检出。

图3 蔗果低聚果糖和菊粉低聚果糖氨基柱HPLC色谱图Fig.3 FOS derived from sucrose and inulin analyzed by HPLC with amino column
2.2方法检出限和线性范围
查置信度表得置信水平为99%,自由度为6时的t值为3.143,得出蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖的方法检出限分别为0.13、0.19、0.20、0.41 ☒g/g(表2)。

表2 重复测定结果Table2 Results of repeated measurements
配制不同质量浓度(0.1~30 ☒g/mL)的混合工作标准液进行测试,得出蔗果三糖质量浓度在0.3~18 ☒g/mL、新蔗果三糖和蔗果四糖质量浓度在0.5~20 ☒g/mL、蔗果五糖质量浓度在0.8~23 ☒g/mL的范围内与其峰面积具有良好的线性关系,4 种糖的相关系数保持在0.999 6~0.999 9之间。
2.3精密度
取同一批低聚果糖粉重复测定6次(表3),4 种糖的相对标准偏差在1.01%~5.43%之间,其中新蔗果三糖大于5%,原因可能为样品中该组分的含量较低,但低聚果糖总含量的相对标准偏差只有0.66%。说明该方法的精密度是比较高的。

表3 低聚果糖粉组分含量重复测定结果( n=6)Table3 Repeatability analysis of FOS components ( n= 6)
2.4回收率实验
以蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖混标加标进行实验,相同添加量做5 个平行,4种标准品的回收率分别为98.27%~99.72%、97.32%~102.56%、99.33%~101.81%、97.38%~102.12%,相对标准偏差为0.55%~2.15%(表4),表明此法对原料低聚果糖的含量检测准确度高。

表4 低聚果糖粉添加混标回收率测定结果Table4 Recovery rates of mixed standards spiked into FOS
2.5含低聚果糖商品检测
收集市场上不同厂家的低聚果糖粉P95S产品共7个样品,使用本法测定蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖及低聚果糖的含量(表5)。1~6号样品是蔗糖来源的低聚果糖,主要成分为蔗果三糖和蔗果四糖,占了低聚果糖含量的90%以上,低聚果糖含量94.56%~96.62%与产品标示低聚果糖≥95%接近;而7号样品是菊粉来源的低聚果糖,检测出的蔗果低聚糖含量为10.57%,而产品标示为低聚果糖含量≥93.2%,从图2可看出该样的成分比蔗果低聚糖的复杂,蔗果型低聚糖组分含量低,果果型低聚糖组分含量高。
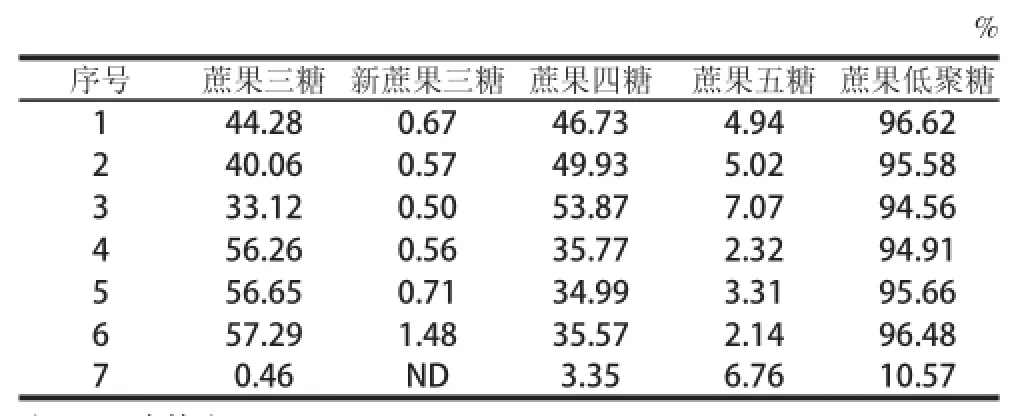
表5 7个低聚果糖样品的组分检测结果Table5 Composition analysis for 7 commercial FOS samples
低聚果糖分析方法的应用过程中一个重大挑战是准确测定功能食品(例如蛋白粉、奶粉)中添加的低聚果糖含量,由于这些产品中复杂基质的影响,导致常用分析方法常出现较大误差。为此,选取了市面上的几种代表产品:多种植物蛋白粉、贝拉米有机奶粉和国产全脂甜奶粉,以新方法进行对比分析。3 种基质不同添加量(多种植物蛋白粉6 个、贝拉米有机奶粉2 个、国产全脂甜奶粉2 个),每个添加量做2 个平行实验,数据见表6,回收率为93.12%~107.44%。从图4可知,多种植物蛋白粉、贝拉米奶粉和国产全脂甜奶粉这3 种基质对低聚果糖组分基本没有干扰,相对标准偏差分别为2.96%、6.56%和3.65%,表明此法对该3 种基质中的低聚果糖含量检测的准确度也较高。

表6 3种基质添加不同量的低聚果糖回收率测定结果Table6 Recovery rates of FOS in three different functional food products

图4 3种不同基质功能食品中添加55%低聚果糖的样品对比分析离子色谱图Fig.4 HPAE chromatograms of three different functional food products added with 5% FOS
3 结 论
本研究选择分离度较好的CarboPac PA20色谱柱建立的高效离子色谱法分离分析低聚果糖,不同产品中不同聚合度的蔗果型和果果型低聚糖及其同分异构体实现有效分离。结合使用量子高科(中国)生物股份有限公司研制标准品可对蔗果三糖、6-蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖、蔗果六糖组分进行定性及定量分析。方法简单、易于掌握,选择性和检测灵敏度比现有方法大幅提高,测定结果准确,适合低聚果糖产品及市场上蛋白粉和奶粉等功能性食品中低聚果糖的检测分析,对基质干扰较大的样品还可进一步通过调整洗脱梯度程序排除干扰组分的影响。由于目前商品低聚果糖中含有的6-蔗果三糖和蔗果六糖含量很少,因此本研究未对这两个组分进行定量分析。另外市场上果果型低聚果糖标准品的缺乏也应引起重视和解决。随着各种低聚果糖标准品的制备方法和商品化的逐步改善将促进低聚果糖的分析方法改进及降低检测成本,从而进一步扩大低聚果糖在各类功能食品、健康食品中的应用。
[1] YEN C H, KUO Y W, TSENG Y H, et al. Beneficial effects of fructooligosaccharides supplementation on fecal bifidobacteria and index of peroxidation status in constipated nursing-home residents-A placebocontrolled, diet-controlled trial[J]. Nutrition, 2011, 27(3): 322-328.
[2] KLEESSEN B, HARTMANN L, BLAUT M. Fructans in the diet cause alterations of intestinal mucosal architecture, released mucins and mucosa-associated bifidobacteria in gnotobiotic rats[J]. British Journal of Nutrition, 2003, 89(5): 597-606.
[3] CAMUESCO D, PERAN L, COMALADA M, et al. Preventative effects of lactulose in the trinitrobenzenesulphonic acid model of rat colitis[J]. Inflammatory Bowel Diseases, 2005, 11(3): 265-271.
[4] 张帆, 汪会玲, 孟晶. 低聚果糖对人体肠道菌群的影响[J]. 现代预防医学, 2006, 33(2): 158-159.
[5] ROBERFROID M. Prebiotics: the concept revisited[J]. Journal of Utrition, 2007, 137(Suppl 2): 830-837.
[6] C☒LINE H, ANNE W, FR☒D☒RIQUE R. ScFOS a prebiotic for synbiotic associations: recent studies in humans[J]. 2010, 9(1): 23-27.
[7] MIGUEL A D A, MIGUEL A B, FRANCISCO J P, et al. Screening β-fructofuranosidases mutant libraries to enhance the transglycosylation rates of β-(2→6) fructooligosaccharides[J]. Combinatorial Chemistry and High Throughput Screening, 2011,14(8): 730-738.
[8] 王静, 金征宇, 江波, 等. Aspergillus fi cuum菊粉酶的分离纯化及其酶解菊粉制备低聚果糖[J]. 食品与生物技术学报, 2006, 25(1): 5-9.
[9] 陈金玲, 黄雪松. 薄层色谱法快速检测大蒜聚果糖[J]. 广东农业科学, 2012, 39(9): 103-105.
[10] 吴三林, 刘芳, 付秦超. 雪莲果低聚果糖的薄层分鉴定[J]. 乐山师范学院学报, 2010, 25(12): 24-25.
[11] 傅博强, 王晶, 王远兴, 等. 食品中低聚果糖高效液相色谱检测方法研究[J]. 食品工业科技, 2010, 31(9): 370-373.
[12] 龚芳红, 贺松, 张德纯, 等. 双歧杆菌发酵果蔬汁中低聚果糖的高效液相色谱法分析[J]. 中国微生态学杂志, 2010, 22(6): 489-491.
[13] LI Jing, LIU Xiaomei, ZHOU Bin, et al. Determination of fructooligosaccharides in burdock using HPLC and microwaveassisted extraction[J]. Journal of Agricultural and Food Chemistry,2013, 61(24): 5888-5892.
[14] 丁洪流, 李灿, 金萍, 等. 高效液相色谱-蒸发光散射法测定食品中的单糖、双糖、低聚果糖和糖醇[J]. 色谱, 2013, 31(8): 804-808.
[15] 刘玉峰, 李东, 唐华澄, 等. 高效离子色谱法测定乳及乳制品中低聚果糖含量[J]. 乳业科学与技术, 2012, 25(1): 40-42.
[16] 张绩觅, 刘玉峰, 唐华澄, 等. 高效离子色谱法测定食品中低聚果糖的含量[J]. 食品研究与开发, 2012, 33(1): 135-137.
[17] ST☒BER P, B☒NET S, HISCHENHUBER C. Simplified enzymatic high-performance anion exchange chromatographic determination of total fructans in food and pet food-limitations and measurement uncertainty[J]. Journal of Agricultural and Food Chemistry, 2004,52(8): 2137-2146.
[18] BIESIEKIERSKI J R, ROSELLA O, ROSE R, et al. Quantification of fructans, galacto-oligosacharides and other short-chain carbohydrates in processed grains and cereals[J]. Journal of Human Nutrition and Dietetics, 2011, 24(2): 154-176.
[19] The United States Pharmacopieial Convention. Food chemicals codex 9 fructooligosaccharides, short chain[S]. USA, The united States pharmacopieial convention, 501-502.
[20] 国家标准化管理委员会. GB/T 23528—2009 低聚果糖[S]. 北京: 中国标准出版社, 2009.
[21] Association of Offi cial Analytical Chemists. AOAC Offi cial Method 997.08 Fructans in Food Products-Ion Exchange Chromatographic Method[S]. USA, Association of Official Analytical Chemists, 1999.
[22] 牟世芬, 留克纳, 丁晓静. 离子色谱方法及应用[M]. 2版. 北京: 化学工业出版社, 2005: 53-88.
[23] 孙长华, 邢宇, 刘晓玲. 离子色谱-脉冲安培检测器分析奶粉中低聚果糖[J]. 中国甜菜糖业, 2011, 49(4): 13-16.
[24] US Environmental Protection Agency. Definition and procedure for the determination of the method detection limit revision[EB/OL]. [2015-05-10]. https://www.law.cornell.edu/cfr/text/40/part-136/appendix-B
[25] 国家药典委员会. 中华人民共和国药典(2010年): 第一增补本[M].北京: 中国医药科技出版社, 2012: 附录130.
Separation and Analysis of Fructooligosaccharides by High-Performance Anion Exchange Chromatography
WEI Yuan'an, ZHENG Huiling*, WU Shaohui, WANG Guangyong, LIU Xueshu
(Technology Center, Quantum Hi-Tech (China) Biological Co. Ltd., Jiangmen 529081, China)
A high-performance anion exchange chromatographic (HPAEC) method for the analysis of fructooligosaccharide(FOS) has been developed, using a CarboPac PA20 column and a PAD detector. This method clearly separated all the GFn and FFn components, which can indicate the origin of FOS. Under the optimal conditions, the 1-kestose (GF2), neokestose(neoGF2), nystose (GF3), 1-fructosylnystose (GF4) components of scFOS were analyzed in commercial FOS samples with recoveries of 98.27%-99.72%, 97.32%-102.56%, 99.33%-101.81% and 97.38%-102.12%, respectively. The relative standard deviation of the method was in the range of 0.55%-2.15%. The limits of detection (LOD) for GF2, neoGF2, GF3 and GF4 were 0.13, 0.19, 0.20 and 0.41 ☒g/g, respectively. In the concentration range of 0.3-18 μg/mL for GF2; 0.5-20 μg/mL for neoGF2 and GF4; and 0.8-23 μg/mL for GF4, there was a good linear relationship between concentration and chromatographic peak area, with correlation coefficients between 0.999 6 and 0.999 9.The new method has been successfully applied to analyze added FOS in commercial functional foods, such as protein powder and milk powder.
fructooligosaccharides; high-performance anion exchange chromatography; qualitative and quantitative analysis
TS207.3
A
1002-6630(2015)14-0151-05
10.7506/spkx1002-6630-201514029
2015-04-27
魏远安(1963—),男,教授,研究方向为碳水化合物化学、糖酶生物化学及其应用。E-mail:yawei@qht.cc
郑惠玲(1986—),女,助理工程师,研究方向为低聚糖分析及生产技术。E-mail:zhenghl@qht.cc
