桦褐孔菌子实体与菌丝体营养成分比较分析
2015-10-14董爱荣刘雪峰宋福强
董爱荣,刘雪峰,宋福强
(1.东北林业大学林学院,黑龙江 哈尔 滨 150040;2.黑龙江大学生命科学学院,微生物重点实验室,黑龙江 哈尔滨 150080)
桦褐孔菌子实体与菌丝体营养成分比较分析
董爱荣1,刘雪峰1,宋福强2,*
(1.东北林业大学林学院,黑龙江 哈尔 滨 150040;2.黑龙江大学生命科学学院,微生物重点实验室,黑龙江 哈尔滨 150080)
将液体培养的菌丝体与野生子实体烘干磨粉处理,对其营养成分测定分析,结果表明:菌丝体粗多糖含量(7.43 g/100 g)显著高于子实体粗多糖含量(2.31 g/100 g),二者均由果糖、木糖、鼠李糖、阿拉伯糖、葡萄糖、甘露糖和半乳糖7 种组成;凯氏定氮法测得子实体粗蛋白含量为6.69 g/100 g,菌丝体粗蛋白含量为21.08 g/100 g;全自动氨基酸分析仪测得子实体含14 种氨基酸,菌丝体含16 种氨基酸;原子吸收分光光度计测得桦褐孔菌中含有大量K、Fe、Ca、Zn、Mg元素,少量Na、Mn、Se。研究结果表明桦褐孔菌的菌丝体营养成分比较丰富,可以代替子实体应用于食品及药品行业中,缓解子实体这种珍稀野生资源的不足。
桦褐孔菌;营养成分;单糖组成;氨基酸;矿物元素
桦褐孔菌(Inonotus obliquus)俗称桦癌褐孔菌,主要寄生于白桦树(Betula platyphylla)等阔叶树活立木的树皮下或倒木枯干上。其菌核可以在砍伐后的枯干上生存6 a之久,菌丝体耐受低温能力极强,主要分布于北纬45°~50°地区的苦寒地带,如俄罗斯、中国黑龙江大小兴安岭、吉林省长白山等地区[1]。
随着对真菌活性物质研究的深入,桦褐孔菌的药用价值、营养价值和经济价值已经引起人民的广泛关注,成为各个行业的热门开发领域[2]。桦褐孔菌多糖、三萜、多酚类天然抗癌药物物质可以作为保健药品、健康食品、保健饮料、微胶囊的主要原料,其天然色素可在食品添加剂、茶叶的深加工、化妆品行业中应用[3-10]。蔡建秀等[11]以桦褐孔菌人工培养菌丝体为材料,对桦褐孔菌蛋白质、脂肪、多糖、氨基酸、矿质元素等营养成分进行了分析及评价。高娃等[12]对桦褐孔菌子实体多糖进行了提取研究。玄光善等[13]对桦褐孔菌多糖进行纯化,并对其中的单糖组成进行了研究。桦褐孔菌(Inonotus obliquus)生长环境特殊,自然资源十分有限,子实体人工栽培困难,而菌丝体液体培养技术成熟。对同一来源的桦褐孔菌子实体及营养体的营养成分进行比较分析,可以促进菌丝体代替子实体应用于食品及药品行业中,缓解子实体野生资源的不足。
1 材料与方法
1.1材料与试剂
褐孔菌子实体采自黑龙江呼中国家级自然保护区白桦林的野生桦(采集人:董爱荣、刘雪峰),采用伞菌分离法,分离获得纯菌种,根据子实体、菌丝体生长特征,由东北林业大学刘雪峰教授鉴定其为桦褐孔菌。菌种用打孔器转接至PDA液体培养基里28℃、120 r/min摇床培养7 d,摇培结束后将培养液离心取菌丝体,菌丝体经去离子水水洗,再离心,这样重复操作几次,收集菌丝体,研磨过筛待测。
苯酚、氯仿、无水甲醇、无水乙醇、正丁醇、异戊醇、硫酸、盐酸、硼酸、硝酸、蒽酮、硫酸钾、氢氧化钠、碘化钾、单质碘、硼砂、碳酸钡、果糖、木糖、鼠李糖、阿拉伯糖、核糖、葡萄糖、甘露糖、半乳糖、半乳糖醛酸等均为国产分析纯。
1.2仪器与设备
SW-CJ-1450超净工作台 苏州金信净化设备工程有限公司;MLS-3750压力蒸汽灭菌锅 上海博迅实业有限公司;HNY-1102C恒温培养振荡器、EMS-9A恒温磁力搅拌器 天津市欧诺仪器有限公司;DHP-9052恒温培养箱、HWS24电热恒温水浴锅 上海一恒科技有限公司;H1650-W离心机 湖南湘仪实验室仪器开发有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;KQ-100DE超声波清洗器 昆山超声仪器有限公司;R-200旋转蒸发仪 瑞士Büchi仪器公司;KJELTEC-8100全自动凯氏定氮仪 美国Foss公司;L-8800全自动氨基酸分析仪 天美科技有限公司。
1.3方法
1.3.1粗多糖的提取及其含量测定
1.3.1.1超声波酶法提取粗多糖
干燥至质量恒定的桦褐孔菌子实体、菌丝体,粉碎成粉末过60目筛,取100 g样品用95%乙醇溶液回流提取3 h,滤液倒掉,重复提取3 次,除去样品中的生物碱、色素、多酚类和低聚糖,弃滤液,烘干滤渣。处理后的滤渣按料液比1∶40(g/mL)加水,待水浴锅温度升至45℃时,加入400 U/g纤维素酶和600 U/g中性蛋白酶,在功率125 W、温度55 ℃超声提取器中作用2 h,升温至80 ℃灭酶,并在此温度条件下恒温浸提3 h后,合并滤液,旋转蒸发仪减压回收,加95%乙醇溶液沉至乙醇终体积分数80%,离心收集沉淀,用无水乙醇、乙醚、丙酮交替洗涤2 次,干燥得粗多糖[14]。
1.3.1.2标准曲线的制作
称取干燥至质量恒定的葡萄糖100.000 0 mg,加蒸馏水溶解并定容至1 000 mL,即得质量浓度为0.10 mg/mL标准葡萄糖溶液。精密量取上述溶液0、0.4、0.8、1.2、1.6、1.8、2.0 mL分别置10 mL具塞试管中,加蒸馏水补充至2.0 mL分别加5%苯酚试剂1.0 mL摇匀,迅速滴加5.0 mL浓硫酸摇匀,放置10 min后置沸水浴加热20 min,取出冷却至室温,于490 nm波长处测定吸光度。同一处理重复3 次,以标准葡萄糖溶液质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程。
1.3.1.3粗多糖含量的测定
称取干燥至质量恒定的桦褐孔菌粗多糖100.000 0 mg,溶解于蒸馏水中,定容至1 000 mL,取粗多糖样品溶液2 mL于具塞试管中,按1.3.1.2节方法操作测定吸光度,同一处理重复3次,按照回归方程计算,得到粗多糖含量。
1.3.2粗多糖中单糖组分的测定
1.3.2.1粗多糖样品水解
取粗多糖样品20.00 mg,加3 mL 1 mol/L的H2SO4溶液到10 mL安瓿管封管105 ℃恒温水解8 h,取出冷却至室温用碳酸钡完全中和,放置过夜,8 000 r/min离心10 min,取上清液,待衍生[15]。
1.3.2.2衍生化处理
分别精密称取果糖18.0 mg、木糖15.0 mg、鼠李糖18.2 mg、阿拉伯糖15.0 mg、核糖13.4 mg、葡萄糖15.0 mg、甘露糖18.0 mg、半乳糖14.6 mg、半乳糖醛酸19.4 mg,分别溶解于100 μL的去离子水中混匀,各取出10 μL,稀释定容至10 mL,混匀,得1 mmol/L的单糖标准溶液。取上述9 种单糖标准品溶液和多糖水解样品溶液各100 ☒L加100 ☒L 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(1-pheny-3-methyl-5-pyrazolone,PMP)无水甲醇液、100 μL 0.3 mol/L氢氧化钠溶液,涡旋混合30 s,70 ℃水浴反应1 h,取出冷却至室温,加0.3 mol/L盐酸中和。加1 mL氯仿振荡混合3 min,静置20 min,取上清重复萃取3 次,得衍生化样品,同时做平行样与空白样对照[16]。
1.3.2.3单糖组分的测定
衍生化样品、75 mmol/L运行硼砂缓冲液(pH 9.8)、去离子水、0.1 mol/L氢氧化钠均过0.45 μm的滤膜过滤,超声脱气后,高效毛细管电泳上样,记录图谱。多糖样品图谱与标准单糖 图谱对照,根据出峰时间和峰面积进行组成成分分析。二极管阵列检测器;石英毛细管柱(58.5 cm×75 μm,有效长度48.5cm);柱温25 ℃;电压15 kV;压力进样0.5 Pa×20 s;检测波长200 nm;32 KaratTMSoftware 8.0数据处理软件[17-18]。
1.3.3粗蛋白含量的测定
通过凯氏定氮仪进行蛋白质检测,选取样品0.20~2.00 mg,加入7g硫酸钾、0.40 g无水硫酸铜、20 mL浓硫酸于消化管中进行消化反应,至液体蓝绿色并澄清后,继续加热1 h。消化好的样品冷却至室温,定容到100 mL容量瓶中。混匀备用,吸取消煮液10.00 mL注入蒸馏器的内室,另取内加硼酸溶液(20 g/L)及2 滴指示剂的150 mL三角瓶,开启自动凯式定氮仪,将消化产生的NH4正转变成NH3,蒸馏10 min后待指示剂变色,流出的三角瓶内液体积约达50~60 mL时,停止蒸馏,标准硫酸滴定馏出液指示剂颜色变为淡粉色(空白测定的滴定终点颜色),根据酸的消耗量计算总氮量。同时进行平行样和空白对照[19]。
1.3.4总氨基酸种类及其含量的测定
称量样品20.00 mg于安瓿瓶中,加6 mol/L盐酸溶解,N2排净空气,酒精喷灯封口,放恒温干燥箱中105 ℃水解24 h。完全水解的样品倒入干燥皿中,65 ℃水浴挥发掉盐酸后,加10 mL去离子水洗涤,重复3次,干燥。取干燥完全的样品粉末用0.02 mol/L的盐酸溶液溶解定容至10 mL,4 ℃冰箱冷藏;获得处理液通过孔径为0.22 μm的滤膜过滤。吸取1 mL处理液置于全自动氨基酸分析仪样品瓶中进行总氨基酸含量检测[20]。
1.3.5矿物元素含量的测定
所有容器耗材用硝酸浸泡24 h,样品粉碎磨细过筛,精密称取干燥至质量恒定的样品5 mg,10%的硝酸(优级纯)消解样品,定容到50 mL,过孔径为0.22 μm的滤膜过滤,进行K、Fe、Ca、Zn、Mg、Na、Mn、Se 8 种矿物元素测定,同一处理重复3 次,同时进行空白对照[21]。
2 结果与分析
2.1粗多糖含量对比
参照NY/T 1676—2008《食用菌中粗多糖含量的测定》绘制标准曲线,可以获得其方程为y=0.146 6x+ 0.000 1,其中R2=0.999 1,表明方程的拟合度较好。桦褐孔菌子实体和菌丝体中多糖含量如图1所示。

图1 桦褐孔菌子实体和菌丝体中粗多糖含量Fig.1 Crude sugar contents in fruiting body and mycelium of I. obliquus
真菌多糖是能够提高人体免疫能力和抗性的物质。测定得到的桦褐孔菌子实体粗多糖含量2.31 g/100 g、菌丝体粗多糖含量7.43 g/100 g,菌丝体多糖含量明显高于子实体。菌丝体营养菌丝发达,生命活动活跃,需要大量碳水化合物。
2.2粗多糖中单糖组分对比
2.2.1标准单糖谱图
将9 种单糖标准品混合后进行电泳分析,图2为混合单糖毛细管区电泳图谱。

图2 混合单糖毛细管区带电泳图谱Fig.2 Capillary electrophoretogram of mixed monosaccharides
混合单糖样品区带电泳图谱上出现了9 个明显的峰,这些单糖得到了有效分离。对照各个单糖与混合单糖样品谱图中的出峰时间,得出下列标准单糖的电泳迁移时间如表1所示。
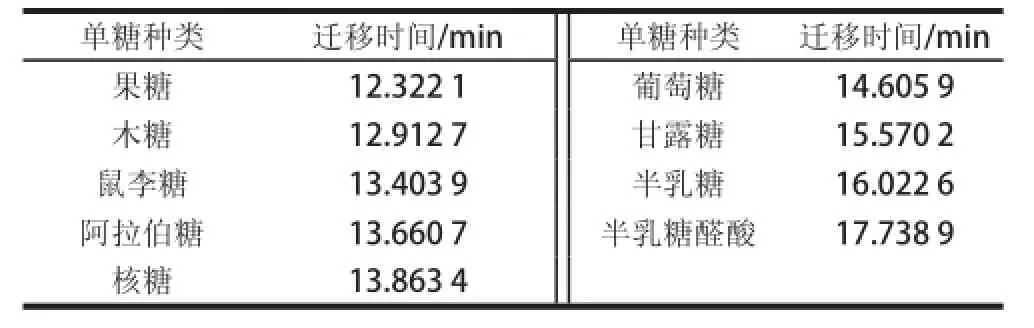
表1 混合单糖的迁移时间Table1 Migration times of mixed monosaccharides
从表1可以看出,单糖出峰顺序依次为果糖、木糖、鼠李糖、阿拉伯糖、核糖、葡萄糖、甘露糖、半乳糖和半乳糖醛酸。
2.2.2粗多糖样品的单糖组分分析
桦褐孔菌子实体(图3A)与菌丝体多糖(图3B)经过水解,PMP甲醇溶液衍生化后进行高效毛细管电泳。
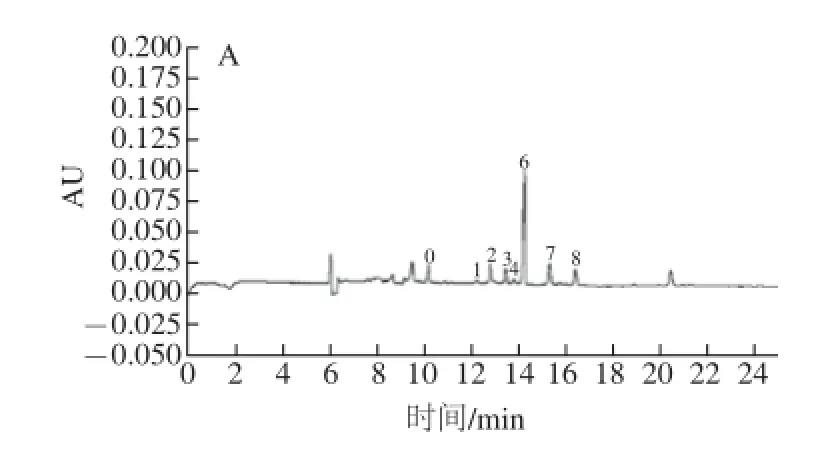

图3 子实体(A)和菌丝体(B)多糖毛细管区带电泳图谱Fig.3 Capillary electrop horetograms of polysaccharides from fruit body and mycelium
根据混合糖和样品糖出峰时间的对应关系,可知桦褐孔菌子实体、菌丝体多糖主要由木糖、鼠李糖、葡萄糖、甘露糖和半乳糖组成,含有微量的果糖和阿拉伯糖。子实体和菌丝体多糖单糖组分的迁移时间、峰面积百分比见表2。
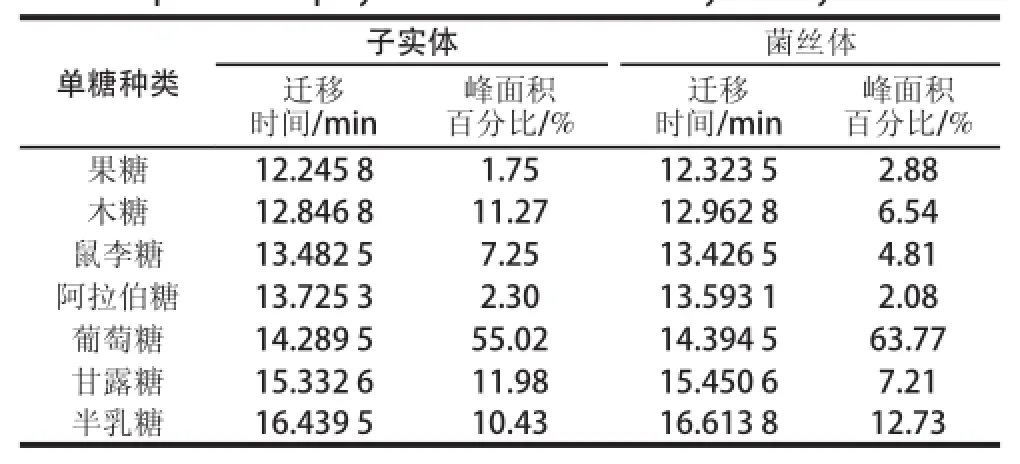
表2 子实体与菌丝体多糖样品中单糖组分的迁移时间、峰面积百分比Table2 Migration times and peak area percentages of monosaccharide components of polysaccharides in fruit body and mycelium
对照多糖样品与标准单糖图谱,根据出峰时间和峰面积进行计算,桦褐孔菌子实体多糖中单糖组分物质的量比为果糖∶木糖∶鼠李糖∶阿拉伯糖∶葡萄糖∶甘露糖∶半乳糖=0.9∶5.6∶3.6∶1.2∶27.5∶6.0∶5.2;菌丝体中单糖组分物质的量比为果糖∶木糖∶鼠李糖∶阿拉伯糖∶葡萄糖∶甘露糖∶半乳糖=1.4∶3.2∶2.5∶1.0∶32.0∶3.6∶6.4。其中葡萄糖组分在子实体和菌丝体多糖中含量都是最大的;果糖组分在子实体含量最少,阿拉伯糖组分在菌丝体中含量最少。桦褐孔菌子实体多糖的单糖组分和菌丝体基本一致,野生真菌由于面对各种胁迫,虫害等,会产生更多抗性成分、其中包括活性多糖。本实验发现子实体多糖中木糖、鼠李糖和甘露糖含量较高,这些单糖都是非供能多糖,在体内参与多种生理功能;而菌丝体则含有较多能量多糖如半乳糖,主要用于菌丝生长生殖。因此从多糖生理活性考虑,菌丝发酵在一定程度上不利于活性多糖,但是由于菌丝生长迅速,繁殖快,可以获得更多多糖。出于多糖质量考虑,还需要在桦褐孔菌菌丝发酵的过程中,施加一定的胁迫因子,以便生产较多高质量活性多糖。
2.3粗蛋白含量对比

图4 子实体和菌丝体中粗蛋白含量Fig.4 Protein contents in fruit body and mycelium of I. obliquus
可为机体提供能量的蛋白质含量高低是衡量食品营养价值的重要标准之一,如图4所示,经过测定计算出子实体粗蛋白含量为6.69 g/100 g,菌丝体粗蛋白含量为21.08 g/100 g,菌丝体中的蛋白含量明显高 于子实体。可能由于菌丝体生命活动代谢旺盛,蛋白表达频繁。
2.4氨基酸种类及含量对比

图5 子实体(A)和菌丝体(B)中氨基酸图谱Fig.5 Amino acid profiles of I. obliquus fruit body and mycelium
经过全自动氨基酸分析仪检测,检测出的子实体含氨基酸14 种(图5A),分别为Asp、Ser、Glu、Gly、Ala、Cys、Arg、His、Ile*、Leu*、Phe*、Lys*、Thr*、Val*(*标注代表必需氨基酸,下同),其中包括6 种必需氨基酸Ile*、Leu*、Phe*、Lys*、Thr*、Val*和2 种半必需氨基酸Arg、His。菌丝体中检测出16 种氨基酸(图5B),分别为Asp、Ser、Glu、Gly、Ala、Cys、Arg、His、Tyr、Ile*、Leu、Phe*、Lys*、Met*、Thr*、Met*、Val*,其中包括7种必需氨基酸和Arg、His 2 种半必需氨基酸。
桦褐孔菌子实体和菌丝体中氨基酸种类和相应的含量如表3所示。桦褐孔菌子实体氨基酸总量为5.011%,6种必需氨基酸Ile*、Leu*、Phe*、Lys*、Thr*、Val*含量占总氨基酸含量的33.62%,其中Asp、Ala含量较高,His、Lys*含量较低。而菌丝体氨基酸总量为19.948%,7 种必需氨基酸Ile*、Leu*、Phe*、Lys*、Met*、Thr*、Val*含量占总氨基酸含量的38.04%,其中Asp、Ala含量较高,His、Tyr、Met*、Val*含量较低,Cys含量最低。

表3 桦褐孔菌子实体、菌丝体中氨基酸种类和含量Table3 Amino acid composition of fruit body and mycelium

图6 子实体和菌丝体中氨基酸含量Fig.6 Amino acid contents of mycelium and fruit body
将子实体和菌丝体中氨基酸组分及相关含量做成柱状图,对比分析结果如图6所示。桦褐孔菌菌丝体中所测氨基酸含量(Cys除外)均高于子实体,与菌丝体的蛋白含量显著高于子实体相一致。其中Asp、Ala、Leu*和Arg等在菌丝体中显著高于子实体。桦褐孔菌子实体中Cys含量高于菌丝体,而Cys是组成蛋白质的20多种氨基酸中惟一还原性氨基酸,从一个侧面反映子实体生长的环境,有助于抵抗野外的氧化胁迫。
2.5矿物元素含量对比
子实体和菌丝体中均含有K、Fe、Ca、Zn、Mg、Na、Mn、Se等矿物元素。如图7所示,子实体中有益矿物元素从高到低为K、Fe、Ca、Zn、Na、Mg、Mn、Se,含量依次为2 099、1 089、687、499、189、185、175、82 mg/100 g。菌丝体中有益矿物元素从高到低为K、Fe、Zn、Ca、Mg、Se、Na、Mn,含量依次为2 394、1 136、973、578、520、284、234、133 mg/100 g。对比可知,Ca和Mn在子实体中含量略高于菌丝体,Zn、Mg和Se在菌丝体中含量显著高于子实体,而对于其他矿物元素,菌丝体中的含量均高于子实体,但并不显著。子实体中Ca和Mn两种元素较高可能源自野外环境的各种不利刺激,在野外条件下,各种生物、非生物胁迫需要有机体较强的抵抗能力。Mn能作为超氧化物歧化酶的一部分积极参与真菌抵抗胁迫,助其生长繁殖。
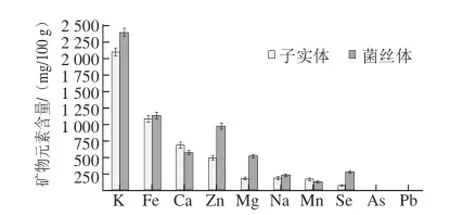
图7 子实体和菌丝体中矿物元素含量Fig.7 Mineral elements contents in fruit body and mycelium of I. obliquus
3 结 论
营养成分含量对比,菌丝体明显高于子实体,子实体粗多糖含量2.31 g/100 g、菌丝体粗多糖含量7.43 g/100 g;子实体粗蛋白含量6.69 g/100 g、菌丝体粗蛋白含量21.08 g/100 g;桦褐孔菌子实体含氨基酸14 种,菌丝体中检测出16 种氨基酸;并且矿物元素含量丰富,含有大量K、Fe、Ca、Zn、Mg,少量Na、Mn、Se。
桦褐孔菌多糖中单糖组分由果糖、木糖、鼠李糖、阿拉伯糖、葡萄糖、甘露糖和半乳糖组成,子实体物质的量比为0.9∶5.6∶3.6∶1.2∶27.5∶6.0∶5.2;菌丝体物质的量比为1.4∶3.2∶2.5∶1.0∶32.0∶3.6∶6.4。
子实体和菌丝体中均含有K、Fe、Ca、Zn、Mg、Na、Mn、Se等矿物元素,矿物元素对比可知,Ca和Mn在子实体中含量略高于菌丝体,Zn、Mg和Se在菌丝体中含量显著高于子实体,其他矿物元素,菌丝体中的含量均高于子实体,但并不显著。
桦褐孔菌的菌丝体营养成分比较丰富,可以代替子实体应用于食品及药品行业中,缓解子实体这种珍稀野生资源的不足。
[1] 黄年来. 俄罗斯神秘的民间药用真菌-桦褐孔菌[J]. 中国食用菌,2002(4): 7-8.
[2] 梁清乐, 王秋颖, 樊锦燕, 等. 桦褐孔菌的研究概况[J]. 中草药,2005(4): 623-625.
[3] 陈义勇, 顾小红, 汤坚. 桦褐孔菌多糖的抗肿瘤活性研究[J]. 食品与生物技术学报, 2011, 30(1): 65-69.
[4] CHOI Y S, HUR S J, AN C S, et al. Anti-inflammatory effects of Inonotus obliquus in colitis induced by dextran sodium sulfate[J]. Journal of Biomedicine and Biotechnology, 2010: 1-6.
[5] HANDA N, YAMADA T, TANAKA R. Four lanostane-type triterpenoids from Inonotus obliquus[J]. Phytochemistry Letters, 2012,5: 480-485.
[6] KIM Y O, HAN S B, LEE H W, et al. Immuno-stimulating effect of the endo-polysaccharide produced by submerged culture of Inonotus obliquus[J]. Life Sciences, 2005, 77: 2438-2456.
[7] KIM Y O, PARK H W, KIM J H, et al. Anti-cancer effect and structural characterization of endopoly saccharide from cultivatedmy celia of Inonotus obliquus[J]. Life Sciences, 2006, 79(1): 72.
[8] MA Lishuai, CHEN Haixia, DONG Peng, et al. Anti-inflammatory and anticancer activities of extracts and compounds from the mushroom Inonotus obliquus[J]. Food Chemistry, 2013, 139: 503-508.
[9] MU Haibo, ZHANG Amin, ZHANG Wuxia, et al. Antioxidative properties of crude polysaccharides from Inonotus obliquus[J]. International Journal of Molecular Sciences, 2012, 13(7): 9194-9206.
[10] XU Xiangqun, LI Juan, HU Yan. Polysaccharides from Inonotus obliquus sclerotia and cultured mycelia stimulate cytokine production of human peripheral blood mononuclear cells in vitro and their chemical characterization[J]. International Immunopharmacology,2014, 21: 269-278.
[11] 蔡建秀, 徐丽芳, 黄卿瑜. 桦褐孔菌人工培养菌丝营养成分分析[J].食品工业, 2012, 33(10): 151-153.
[12] 高娃, 于德水, 刘佳宁, 等. 桦褐孔菌子实体多糖提取研究[J]. 生物技术, 2012, 22(2): 70-73.
[13] 玄光善, 郑晓, 孙钦勇, 等. 桦褐孔菌多糖的纯化及其单糖组成分析[J].中南药学, 2014, 12(10): 981-984.
[14] 胡涛, 解洛香, 徐乐, 等. 超声波辅助提取桦褐孔菌子实体中多糖和三萜[J]. 食品科技, 2012, 37(2): 213-217.
[15] 韩耀玲, 徐腾飞, 贾中祥, 等. 桦褐孔菌粗多糖的精制方法探讨[J].河南大学学报: 医学版, 2012, 31(3): 229-232.
[16] 凌云, 王玉峰, 王莹, 等. 虫草多糖中单糖组成的柱前衍生化HPLC分析[J]. 中国医药工业杂志, 2008, 39(12): 924-926.
[17] 张丽芝. 单糖组成分析方法的研究进展[J]. 微生物学免疫学进展,2013, 41(1): 77-81.
[18] SONG Yana, JING Hui, WEI Kou, et al. Identification of Inonotus obliquus and analysis of antioxidation and antitumor activities of polysaccharides[J]. Current Microbiology, 2008, 57(5): 454-462.
[19] 陈中爱, 曾海英, 董宏伟. 酶法提取糖渣蛋白的工艺研究[J]. 食品科技, 2013, 38(6): 236-241.
[20] LI Jianming, ZHANG Gang, YUAN Xiuzhi, et al. Analysis of amino acid in radix isatidis extract of Qingkailing injection production[J]. Chinese Journal of Modern Drug Application, 2010, 22: 8-9.
[21] ZHANG L X, FAN C, LIU S C, et al. Chemical composition and antitumor activity of polysaccharide from Inonotus obliquus[J]. Journal of Medicinal Plants Research, 2011, 5: 1251-1260.
Comparative Analysis of Nutrients in Fruit Bodies and Mycelia of Inonotus obliquus
DONG Airong1, LIU Xuefeng1, SONG Fuqiang2,*
(1. School of Forestry, Northeast Forestry University, Harbin 150040, China;2. Key Laboratory of Microbiology, School of Life Science, Heilongjiang University, Harbin 150080, China)
Drying and milling were conducted on the liquid-cultured mycelia and fruiting body of Inonotus obliquus. Crude polysaccharides were significantly more abundant in mycelium than in fruiting body (7.43 g/100 g vs. 2.31 g/100 g), both of which consisted of fructose, xylose, rhamnose, arabinose, glucose, mannose and galactose. Meanwhile, crude protein contents in mycelium and fruiting body were determined using the Kjeldahl method to be 6.69 g/100 g and 21.08 g/100 g,respectively. Amino acid profiles measured by amino acid analyzer suggested that the fruiting bodies contained 14 kinds of amino acids, and the mycelium contained 16 kinds of amino acids. Furthermore, as analyzed by atomic absorption spectrometry, both mycelium and fruiting body were rich in K, Fe, Ca, Zn and Mg along with small amounts of Na, Mn and Se. These results show that the mycelia of I. obliquus are rich in nutrients, and can be used as an alternative to the fruiting body as a rare wild mushroom in the food and medicinal industries.
Inonotus obliquus; nutrient component; monosaccharide composition; amino acid; mineral elements
TS201.3
A
1002-6630(2015)14-0096-06
10.7506/spkx1002-6630-201514019
2014-12-19
国家林业局公益性项目(201004079)
董爱荣(1971—),男,副教授,博士,研究方向为森林病理学、微生物学。E-mail:darlmy@tom.com
宋福强(1969—),男,教授,博士,研究方向为森林微生物。E-mail:0431sfq@163.com
