CO-NOx-SO2体系化学平衡分析
2015-10-14张丽秦毅红陈白珍
张丽,秦毅红,陈白珍
CO-NO-SO2体系化学平衡分析
张丽,秦毅红,陈白珍
(中南大学 冶金与环境学院,湖南 长沙,410083)
对CO-NO-SO2体系进行化学平衡分析。研究结果表明:CO,NO和SO2之间可以很好地相互作用从而使得3种污染物同时脱除;烟气中NO比SO2易于被CO还原,增加CO的体积分数(CO)或降低温度有利于SO2的还原,燃煤烟气自身的CO足以在1 000 K以下还原其中的SO2和NO;脱硝产物仅为N2,脱硫产物主要为单质硫和COS,提高反应温度可以抑制副产物COS的生成;随着烟气中NO或SO2体积分数增大,脱硝率维持在100%,脱硫率有所降低,但脱硫产物均主要为单质硫。
CO还原;脱硫脱硝;气相组成;脱硫脱硝效率
发电厂、冶炼厂、焦化厂、炼油厂等排放的烟气中往往同时存在SO2,NO和CO,严重污染大气质量和人类健康,如何行之有效地除去这些污染物成为目前研究的热点。CO是一种优良的还原剂,若能有效利用烟气中CO与SO2和NO的相互作用,将烟气中的SO2还原成元素硫回收利用,将NO还原成无害的氮气直接排放,不仅可以实现CO,SO2和NO这3种污染气同时脱除,而且从脱硫脱硝产物来看,是目前最理想的方法。国内外关于CO还原NO或SO2的研究较多[1−4],普遍认为CO直接还原NO和SO2反应温度高,反应的选择性差,需要使用催化剂。近年来,研究者们开始关注CO催化还原同时脱硫脱硝,并且大多数工作都集中于催化剂的开发及性能研究。例如,Zhang等[5−6]采用CoS2-TiO2和SnO2-TiO2固溶体,Hu等[7]采用CeO2-La2O3/-Al2O3,Lau等[8]采用La2O2S,Pantazis等[9]采用Cu/Ce复合氧化物为催化剂重点考察了催化剂的催化活性及选择性,但均未对SO2-NO-CO体系本身进行分析。因此,本文作者以CO同时还原NO和SO2过程为研究对象,通过CO-NO-SO2体系热力学分析,系统阐明CO同时还原NO和SO2所构成体系的特征,以便为CO还原同时脱硫脱硝技术的研究与发展提供参考。
1 化学平衡计算
1.1 化学平衡理论及计算模型
在封闭体系中,当温度、压力及各元素的物质的量给定时,体系的平衡状态即可确定。设体系中所含元素个数为a,化合物组分个数为c,当无化学计量限制条件时,则独立化学反应个数为b=c−a,此b个反应可产生b个非独立组分,并可用如下矩阵形式表示[10]:

式中:G和 G分别表示独立组分和非独立组分的生成吉布斯自由能。平衡时,独立组分和非独立组分的关系如下[10]:
式中:X和r分别为独立组分的摩尔数和活度系数;Y和分别表示非独立组分的物质的量和活度系数;M和N分别表示组分和组分所属的相数;和分别表示含有组分和组分的相的物质的量。在封闭体系中,各元素总的物质的量Q可表示如下[10]:
式中:Q为元素的总物质的量。通过求解方程组(3)和(4),可计算出平衡时各组分的物质的量。
1.2 相关热力学数据
CO-NO-SO2体系涉及的物种较多,可能存在SO2,NO,NO2,CO,S①,COS,CS2,SO,SO3,N2O,N2O3,N2O4,N2O5,N2,CO2和O2(上标“①”表示随着温度变化,S的状态发生变化,当<388 K时,为S(s);当388<<718 K时,为S(l);当>718 K时,为S(g)[11])。S(g)中取值为2~8或更高,S的形成取决于反应温度及反应器内压力,在反应条件下一般可达到S2−S6−S8的动态平衡[12]。为了简化计算,本文均只取S2(g)),因此,a=4,c=16,p=2。在不同温度下各组分的的生成吉布斯自由能见表1[13]。
表1 不同温度下相关物质的生成吉布斯自由能
Table 1 Gibbs free energy of related substances at different temperatures J/mol
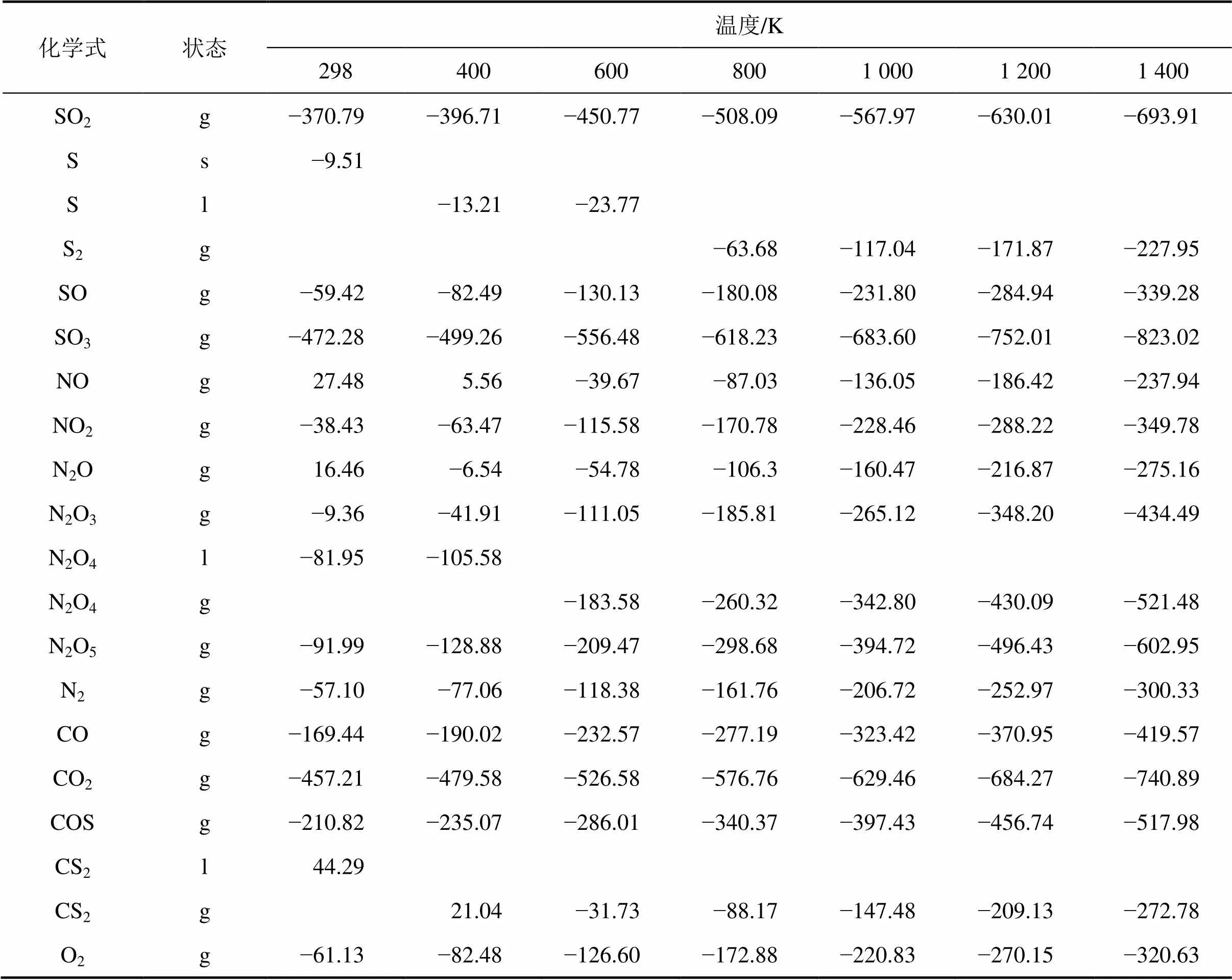
化学式状态温度/K 2984006008001 0001 2001 400 SO2g−370.79−396.71−450.77−508.09−567.97−630.01−693.91 Ss−9.51 Sl−13.21−23.77 S2g−63.68−117.04−171.87−227.95 SOg−59.42−82.49−130.13−180.08−231.80−284.94−339.28 SO3g−472.28−499.26−556.48−618.23−683.60−752.01−823.02 NOg27.485.56−39.67−87.03−136.05−186.42−237.94 NO2g−38.43−63.47−115.58−170.78−228.46−288.22−349.78 N2Og16.46−6.54−54.78−106.3−160.47−216.87−275.16 N2O3g−9.36−41.91−111.05−185.81−265.12−348.20−434.49 N2O4l−81.95−105.58 N2O4g−183.58−260.32−342.80−430.09−521.48 N2O5g−91.99−128.88−209.47−298.68−394.72−496.43−602.95 N2g−57.10−77.06−118.38−161.76−206.72−252.97−300.33 COg−169.44−190.02−232.57−277.19−323.42−370.95−419.57 CO2g−457.21−479.58−526.58−576.76−629.46−684.27−740.89 COSg−210.82−235.07−286.01−340.37−397.43−456.74−517.98 CS2l44.29 CS2g21.04−31.73−88.17−147.48−209.13−272.78 O2g−61.13−82.48−126.60−172.88−220.83−270.15−320.63
若初始混合气体为1 mol,在给定混合气体中SO2,NO和CO体积分数的条件下,根据式(3)和(4)可以建立该体系中C,N,O和S元素守恒方程,联立方程组采用maple软件可计算出平衡时各气体的物质的量。假定体系压强维持在标准大气压Θ(101 325 Pa)下,进一步可求出平衡气相总体积。
1.3 相关计算公式
CO-NO-SO2体系较复杂,对体系不同性质的表征手段不同,因此,需要对原始计算结果进行相关处理,具体计算公式如下。
1) 气体的平衡分压:
式中:p为气体的平衡分压,Pa;n为气体的物质的量,mol;为气体摩尔常数,取8.314;为平衡热力学温度,K;为气相总体积,L。
2) 气体脱除效率:
3) 气体体积分数的换算:
4) SO2还原产物中各含硫物种的摩尔数分数:
式中:y为含硫物种的摩尔数分数。
2 结果讨论
2.1 气相组成随温度和(CO)的变化
通常燃煤烟气中SO2较NO含量高((SO2)为0.3%~1.0%,(NO)为0.04%~0.10%),但为了便于比较SO2和NO同时被CO还原的情况,取反应前SO2和NO(其中NO占95%,NO2占5%)体积分数相等,均为0.5%,平衡气为N2,通过maple软件计算可得不同温度以及不同(CO)(烟气中CO的体积分数)下各气体的平衡压强,见图1和图2。
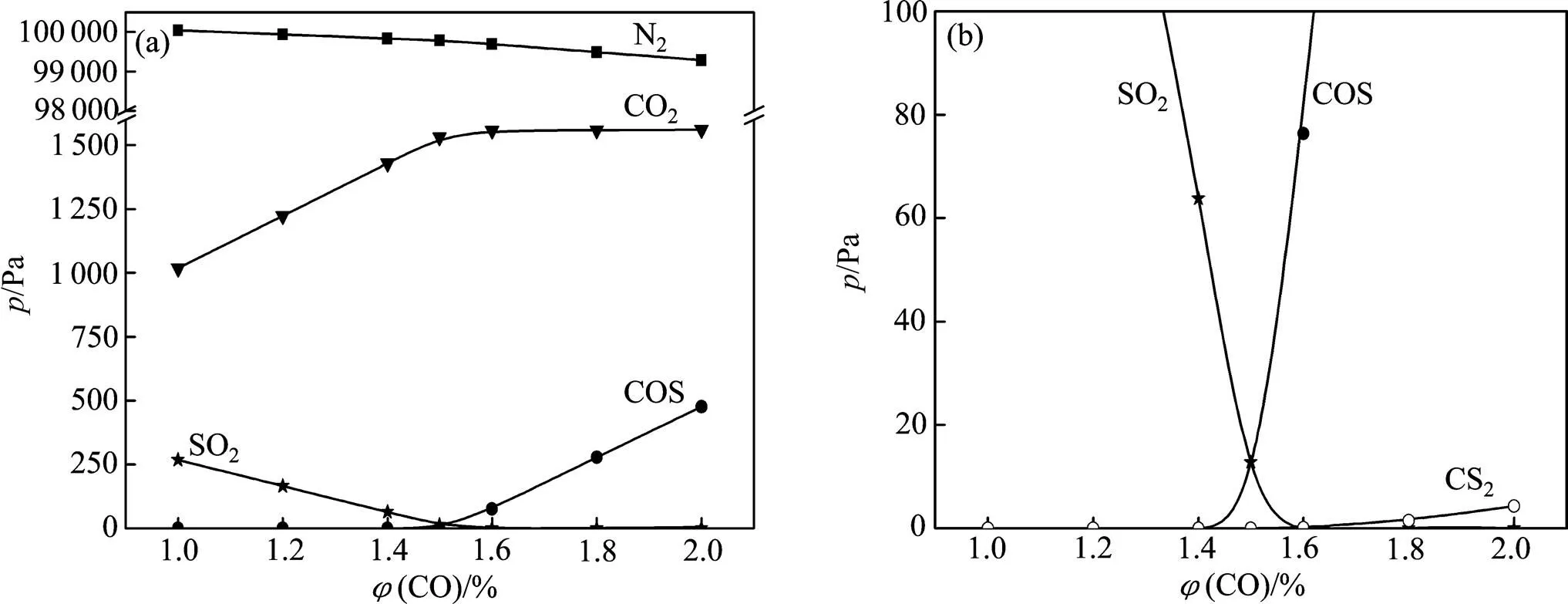
(a) 整体图;(b) 局部放大图
图1=298 K时气相中各气体的平衡分压随(CO)的变化曲线
Fig. 1 Relationship between each gas’ equilibrium partial pressurein gas phase and(CO) when=298 K
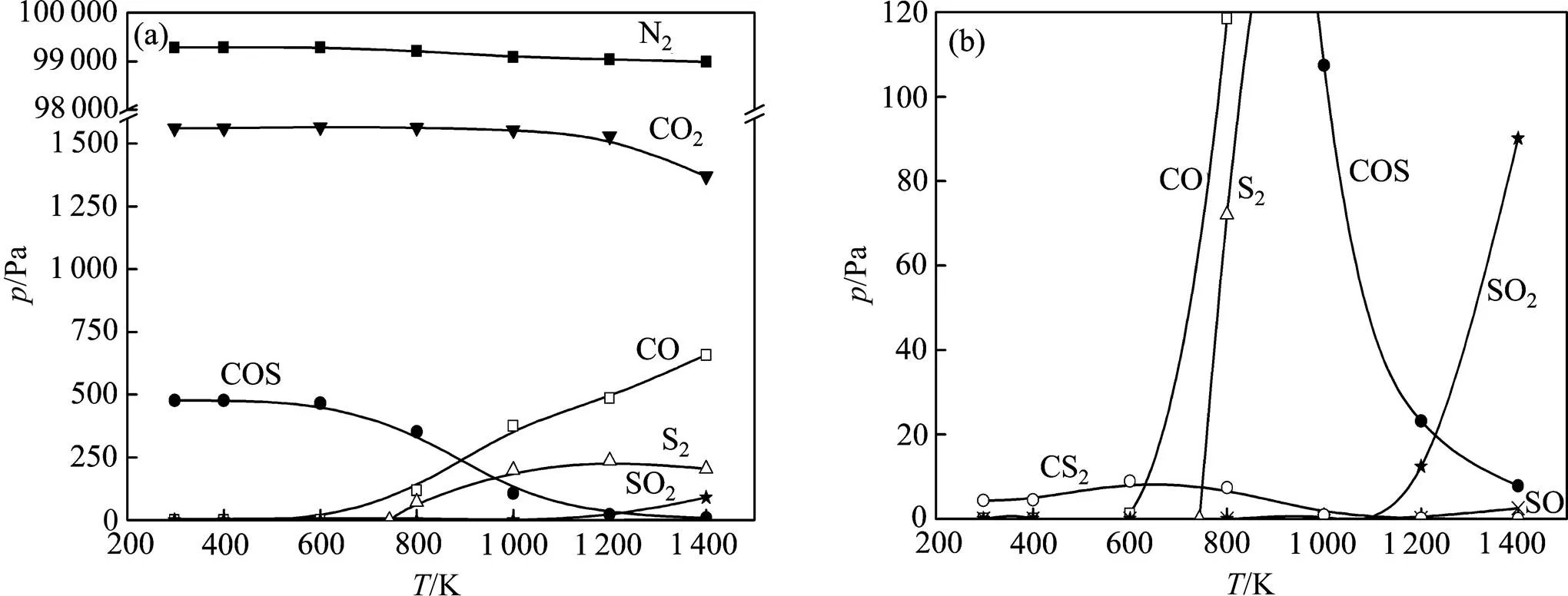
(a) 整体图;(b)局部放大图
图2(CO)=2.0%时气相中各气体的平衡分压随温度的变化曲线
Fig. 2 Relationship between each gas’ equilibrium partial pressurein gas phase and temperature when(CO)=2.0%
从图1和图2可以看出:改变温度和(CO),该体系平衡时气相主要为N2和CO2;当(CO)较低时,气相中存在未反应的SO2;当(CO)较高时,低温区存在少量COS以及极少量CS2,高温区存在少量未反应的SO2,CO以及极少量SO。在整个温度及(CO)变化范围内,含氮物种仅为N2,不存在其他脱硝副产物。因此,对于CO同时还原SO2和NOx过程,需要重点考察体系中含硫物种物质的量的变化。
2.2 脱硫脱硝效率随温度和(CO)的变化
脱硫脱硝效率不仅取决于化学平衡的限度,还取决于达到化学平衡所需的时间(即反应速率),本文主要从热力学的角度对其进行讨论。假设反应前(SO2)=0.5%,(NO)=0.5%(其中NO占95%,NO2占5%),平衡气为N2,且气相总压强为Θ,通过计算得出(CO)和对脱硫脱硝效率的影响规律,见图3。
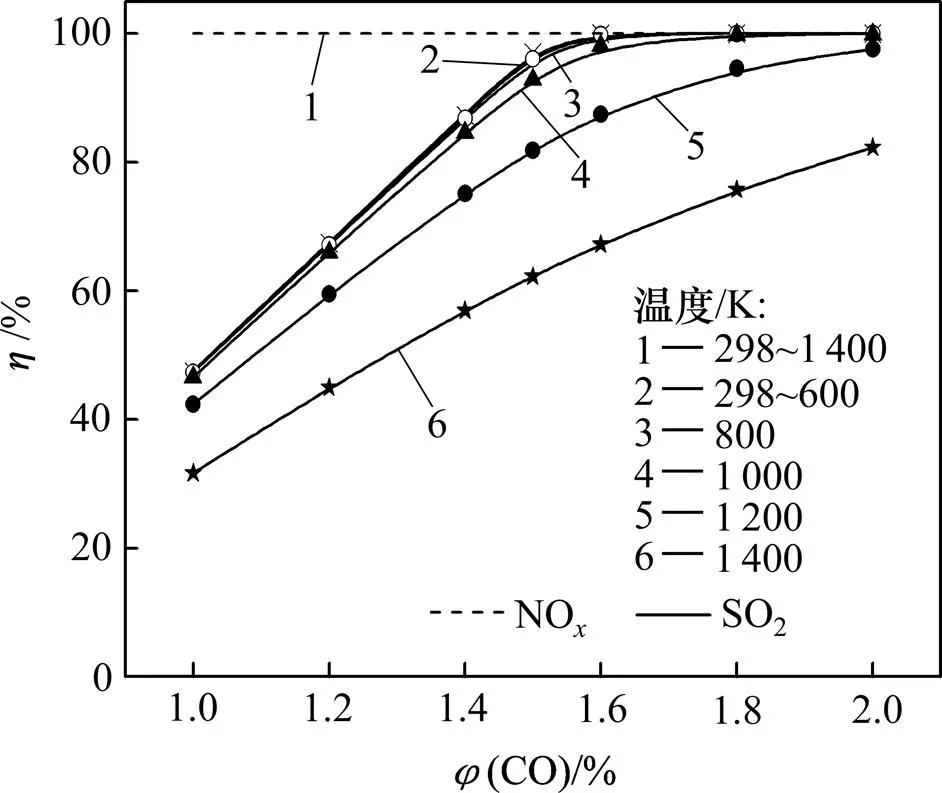
图3 不同温度下脱硫脱硝效率η随φ(CO)的变化曲线
从图3可见:当(CO)从1.0%增大到2.0%,温度从298 K升到1 400 K时,NO的脱除率都为100%;只有在(CO)较大、温度较低时SO2的脱除率才能达到100%,说明NO比SO2易于被CO还原。
不同温度下的(SO2)−(CO)曲线均呈现相同规律:随着(CO)的增加,SO2的脱除率不断提高;当(CO)增加到1.6%时,SO2的脱除率便可达到100%(≤800 K时)。但(CO)相同时,升高温度会使SO2的脱除效率有所降低,特别是温度高于800 K后,脱硫率明显降低。这主要是因为SO2的还原反应为放热反应,升高温度不利于SO2的还原。因此,为了保持较好的SO2还原效果,体系的反应温度不宜太高。若要在高温下获得较高脱硫率,则需增加烟气中的(CO)。
进一步考察烟气中NO和SO2达标排放条件,考虑到NO总是优先SO2被还原,且还原很充分,需重点考察SO2的排放问题。根据最新《火电厂大气污染物排放标准》[14],燃煤锅炉SO2排放质量浓度限值为100 mg/m3,重点地区要求达到50 mg/m3,本文计算取其值为50 mg/m3。假设气相总压强=101 325 Pa,根据式(7)进行相关体积分数及分压换算,结果见表3。
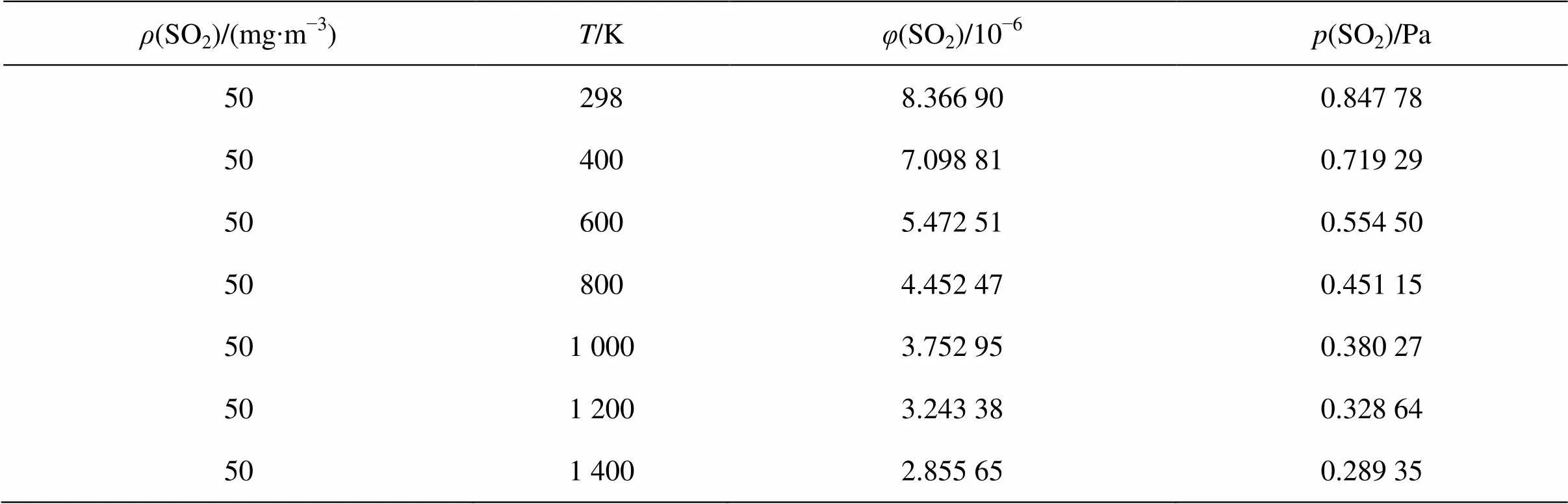
表3 不同温度下的SO2体积分数及分压换算结果
取燃煤烟气中一般SO2和NO体积分数范围内的极大值(即1.0% SO2+0.1% NO)为研究对象,以平衡时气相中SO2平衡分压满足表3中的排放标准为原则,计算不同温度下SO2充分还原时的(CO),见图4。
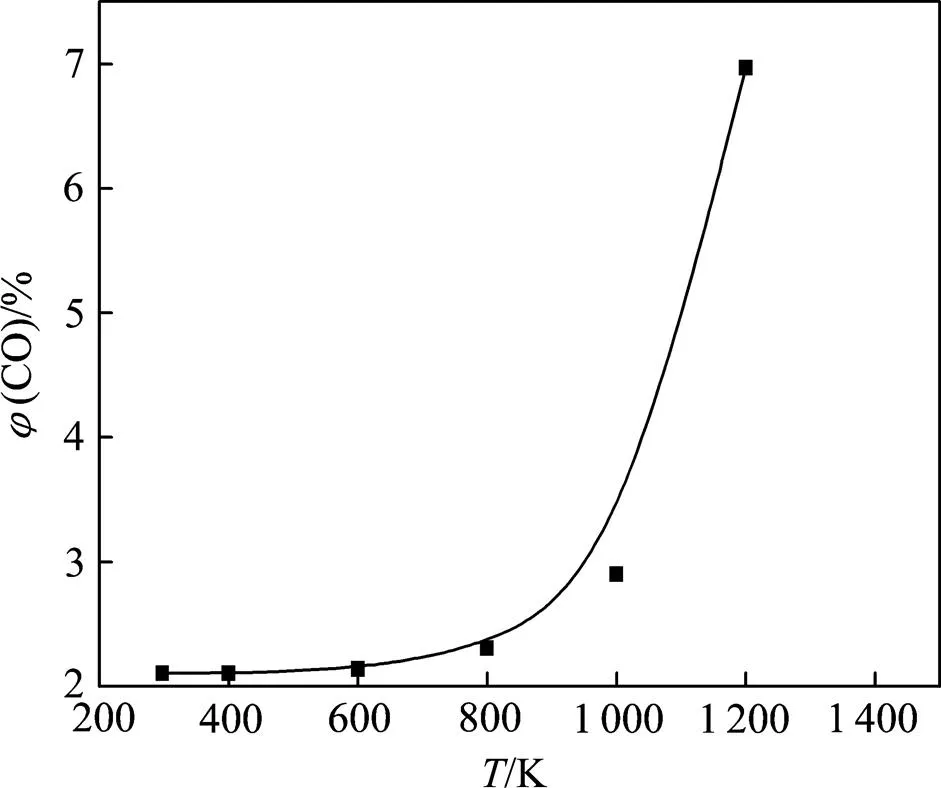
图4 充分还原1.0% SO2+0.1% NOx时φ(CO)与温度的关系
从图4可知:充分还原1.0% SO2+0.1% NO时(CO)在298~800 K温度范围内缓慢增加,基本维持在2.1%~2.3%;当温度高于800 K后(CO)迅速增大,且增加速度越来越快,在1 200 K时达约7%。考虑到能耗问题,一般干法脱硫脱硝温度不超过1 000 K,因此,只要烟气中(CO)达到3%就可完全还原1.0% SO2+0.1% NO。在实际燃煤烟气中,一般(CO)为1%~3%,(SO2)为0.3%~1.0%,(NO)为0.04%~ 0.1%,它们可以充分地发生氧化还原反应使SO2和NO达标排放,不需要额外补充还原剂。
2.3 脱硫产物分配情况随温度和(CO)的变化
在CO-SO2-NO体系中,SO2还原后的含硫物种可能有S(或S2),COS,CS2,SO和SO3,并且在不同条件下SO2还原产物的分配情况不同。在前述相同条件下,通过计算得SO2还原产物中各含硫物种摩尔数分数随温度的变化规律如图5所示。
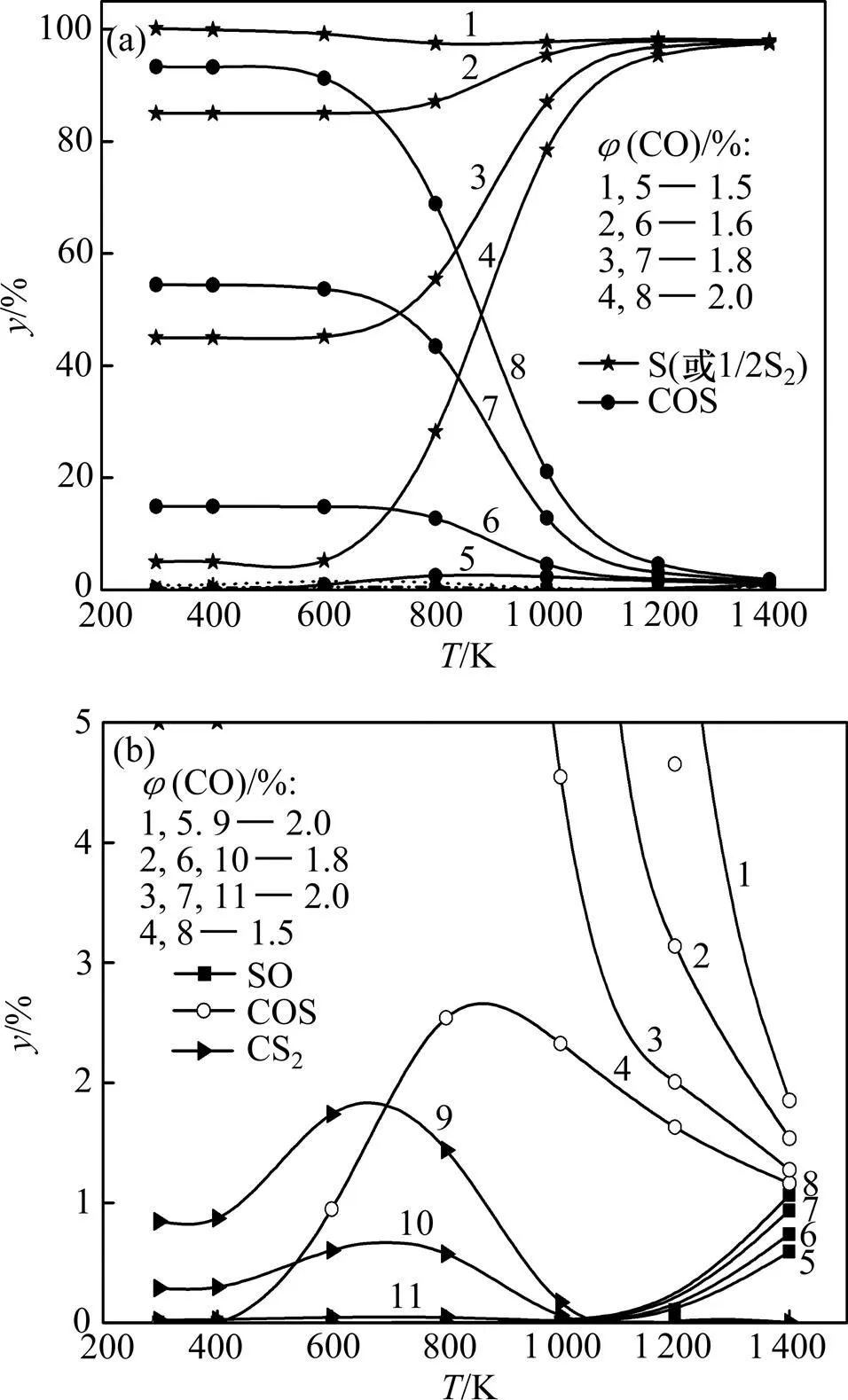
(a) 整体图;(b) 局部放大图
图5 不同(CO)下脱硫产物摩尔数分数随温度的变化关系
Fig. 5 Relationship between desulfurization products’ mole fractionand temperature at different(CO)
从图5可见:脱硫产物主要为单质硫和COS,其他脱硫副产物(CS2和SO)摩尔数分数低于2%;主要副产物COS和极少量副产物CS2均存在于低温区,随着温度升高,其摩尔数分数降低;而极少量副产物SO存在于高温区,随着温度升高,其摩尔数分数有所增加,但仍保持在较低值。总体而言,升高温度有利于减少副产物所占摩尔数分数。
改变体系中的(CO),脱硫产物的分配情况也发生明显变化。当(CO)=1.5%时,脱硫产物中几乎全部为单质硫;随着(CO)的增大,单质硫的摩尔数分数降低,特别是低温区降幅十分显著,而副产物COS的摩尔数分数升高;CS2的摩尔数分数随着(CO)的增大而增大,SO的摩尔数分数随着(CO)的增大而减小,这说明烟气中的CO优先与SO2反应生成S;当CO较充足时,CO进一步与产物S作用生成COS,CO过量越多,消耗的单质硫越多,生成的COS也越多。COS又可进一步分解成CS2,从而使得CS2的摩尔数分数也有所增加。而随着体系中(CO)的增加,SO2的还原越充分,剩余的SO2越少,其分解产生的SO摩尔数分数也随之降低。此外,由于CS2和SO的摩尔数分数始终维持在较低值,使得COS摩尔数分数的增幅与单质硫摩尔数分数的降幅具有很好的对应关系。
2.4 NO体积分数对体系的影响
为了进一步了解SO2和NO相互作用的影响,固定(CO)为1.0%,(SO2)为0.5%,并在燃煤烟气中NO的一般体积分数范围(0.04%~0.10%)内取值,考察NO体积分数对脱硫效率及脱硫产物分配情况的影响,计算结果分别见图6和图7。
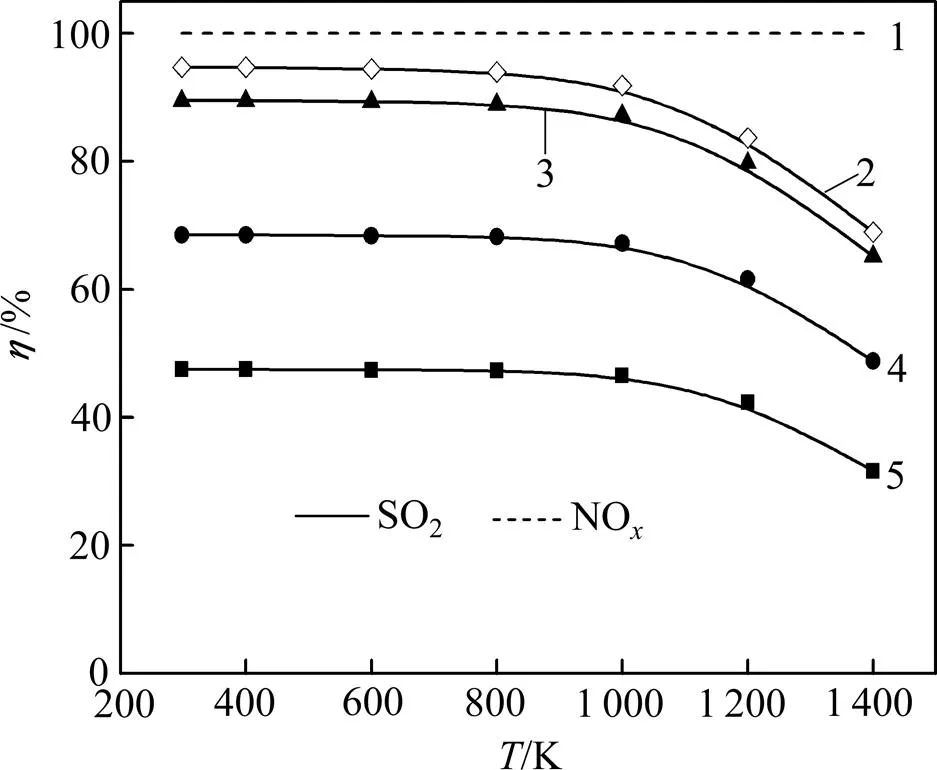
(NO)/%: 1—0.1~0.5; 2—0.05; 3—0.10; 4—0.3; 5—0.5
图6 不同(NO)下脱硫脱硝效率随温度的变化曲线
Fig. 6 Relationship between desulfurization and denitrification efficiencyas temperature at different(NO)
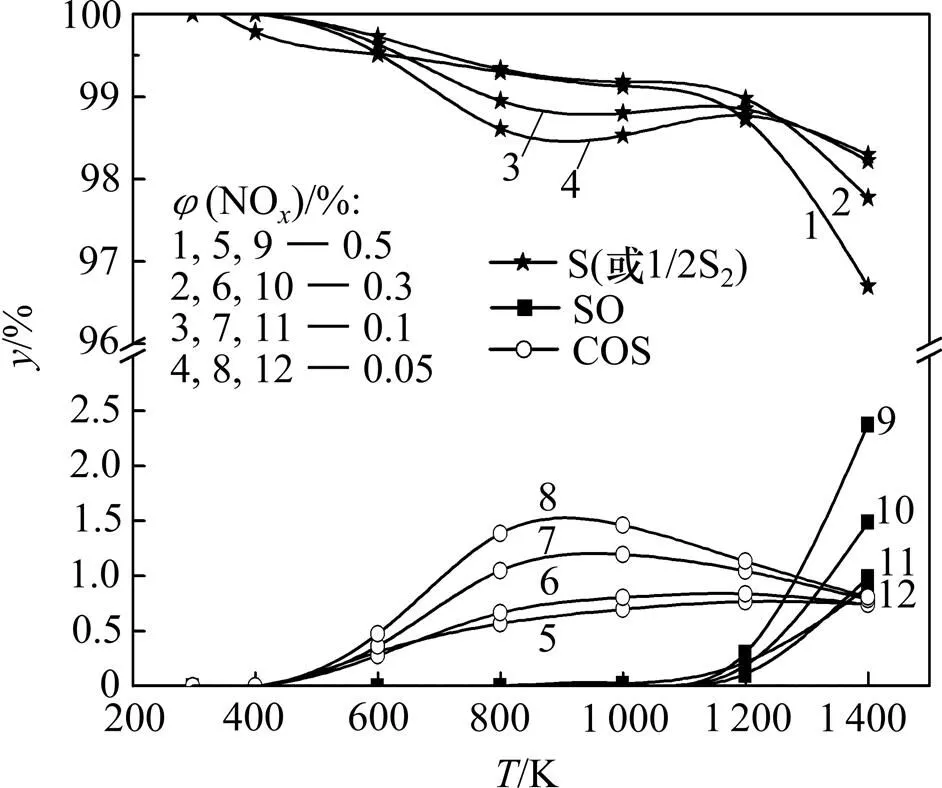
图7 不同φ(NOx)下脱硫产物摩尔数分数y随温度的变化关系
从图6可见:SO2的脱除率随着烟气中(NO)的降低而升高,主要是烟气中CO不是很充足的情况下,(NO)越低,与SO2的竞争还原作用越弱,SO2还原效果越好,脱硫率越高。而NO总是优先SO2被还原,随着(NO)变化,脱硝率始终保持在100%。
从图7可见:改变(NO)对脱硫产物的影响较小,脱硫产物绝大部分为单质硫,副产物COS和SO的摩尔数分数均低于3%;随着(NO)降低,单质硫的摩尔数分数先稍微降低后略有增加,COS的摩尔数分数略增加,SO的摩尔数分数略降低。
2.5 SO2体积分数对体系的影响
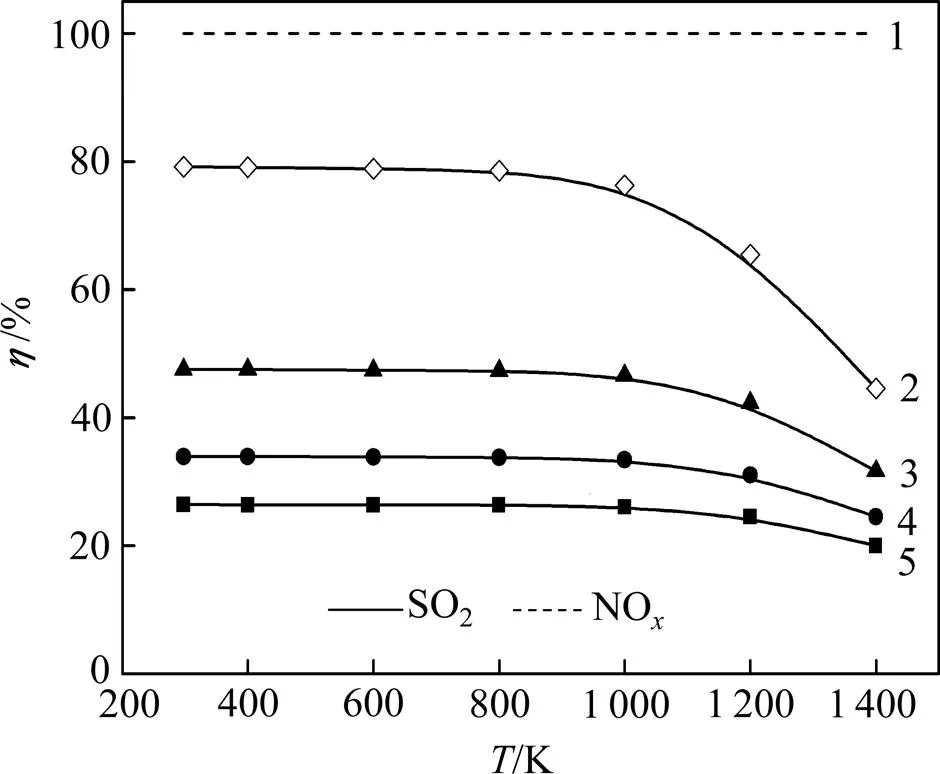
同样保持(CO)为1.0%不变,确定(NO)为0.5%,在燃煤烟气中SO2一般体积分数范围(0.3%~ 1.0%)内取值,考察(SO2)对脱硫过程的影响。
当烟气中(CO)一定且不是很充足时,随着(SO2)的增加,脱硫效率有一定程度降低,且降低幅度有所递减,见图8。这主要是增加(SO2)即增加反应物的浓度会促使反应(8)正向进行,从而使得脱硫率降幅减小。同样,由于NO总是优先于SO2被还原,脱硝率始终保持在100%,见图9。从图9可见:(SO2)的变化对脱硫产物的影响也较小,主要产物仍为单质硫;随着(SO2)的降低,单质硫的摩尔数分数先增后减,SO的摩尔数分数也先增后减,COS的摩尔数分数先减小后增大,但它们的变化幅度均很小。
(SO2)/%: 1—0.3~0.9; 2—0.3; 3—0.5; 4—0.7; 5—0.9
图8 不同(SO2)下脱硫脱硝效率随温度的变化曲线
Fig. 8 Relationship between desulfurization and denitrification efficiencyand temperature at different(SO2)
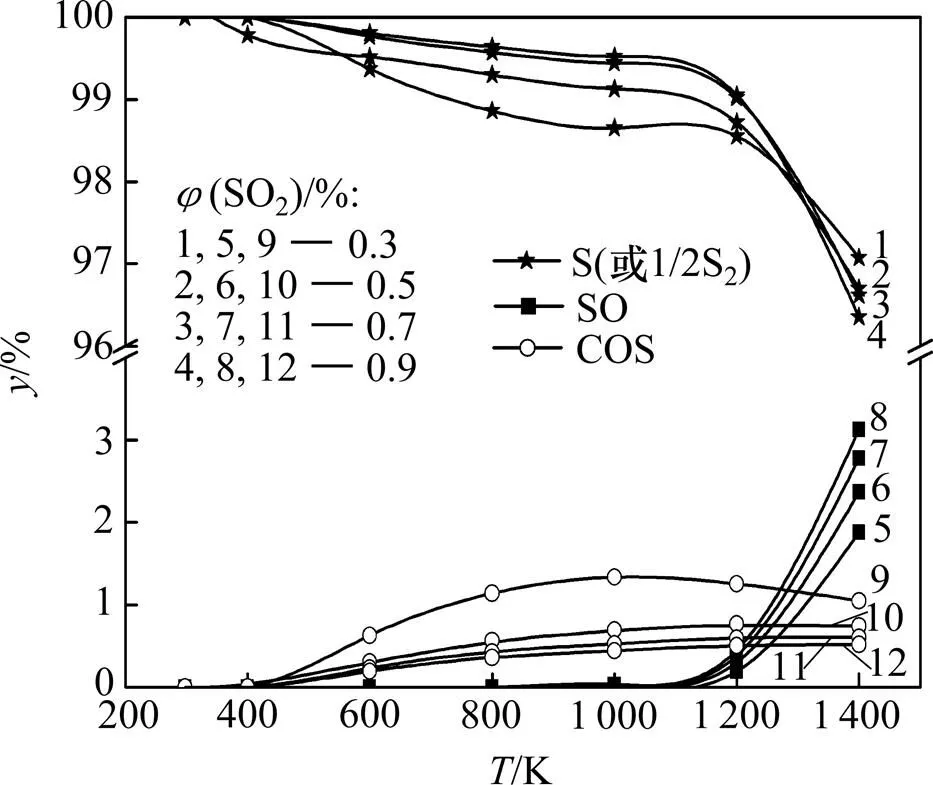
图9 不同φ(SO2)下脱硫产物摩尔数分数y随温度的变化关系
Fig. 9 Relationship between desulfurization products’ mole fractionand temperature at different(SO2)
3 结论
1)CO,NO和SO2之间可以很好地相互作用从而使得3种污染物同时脱除。改变温度和(CO),该体系的平衡气相为N2和CO2,少量的SO2,CO和COS以及极少量的CS2和SO。
2) 烟气中NO比SO2易于被CO还原,增加(CO)或降低温度有利于SO2的还原,并且随着温度的升高,完全还原SO2所需的(CO)增大。燃煤烟气中自身1%~3%的CO已足以在1 000 K以下还原其中的SO2(0.3%~1.0%)和NO(0.04%~0.1%),不需要额外补充还原剂。
3) 脱硝产物仅为N2,脱硫产物主要为单质硫和COS,随着温度升高和(CO)减小,副产物COS的摩尔数分数降低,并且其摩尔数分数与单质硫的摩尔数分数具有此消彼长的对应关系。
4) 随着烟气中NO或SO2的体积分数增大,脱硝率维持在100%,脱硫率会有所降低,但脱硫产物的分配情况变化不大,主要产物均为单质硫。
[1] Patel A, Rufford T E, Rudolph V, et al. Selective catalytic reduction of NO by CO over CuO supported on SBA-15: Effect of CuO loading on the activity of catalysts[J]. Catalysis Today, 2011, 166(1): 188−193.
[2] SUN Chuanzhi, ZHU Jie, LÜ Yuanyuan, et al. Dispersion, reduction and catalytic performance of CuO supported on ZrO2-doped TiO2for NO removal by CO[J]. Applied Catalysis B, 2011, 103(1/2): 206−220.
[3] GAO Guoping, WEI Shiaho, DUAN Xiangmei. Catalytic reduction of SO2by CO over PtAu(CO): A first-principles investigation[J]. Journal of Physical Chemistry, 2012, 116(47): 24930−24934.
[4] HU Hui, ZHANG Jinli, WANG Wenchao, et al. Experimetal and mechanism studies on the catalytic reduction of SO2by CO over Fe2O3/-Al2O3in the presence of H2O[J]. Reaction Kinetics, Mechanisms and Catalysis, 2013, 110(2): 359−371.
[5] ZHANG Zhaoliang, MA Jun, YANG Xiyao. Separate/ simultaneous catalytic reduction of sulfur dioxide and/or nitric oxide by carbon monoxide over TiO2-promoted cobalt sulfides[J]. Molecular Catalysis A: Chemical, 2003, 195(1/2): 189−200.
[6] ZHANG Zhaoliang, MA Jun, YANG Xiyao. Separate/ simultaneous catalytic reduction of sulfur dioxide and/or nitric oxide by carbon monoxide over titanium-tin solid solution catalysts[J]. Chemical Engineering Journal, 2003, 95(1/2/3): 15−24.
[7] HU Hui, WANG Shuxia, ZHANG Xiaoling, et al. Study on simultaneous catalytic reduction of sulfur dioxide and nitric oxide on rare earth mixed compounds[J]. Journal of Rare Earths, 2006, 24(6): 695−698.
[8] Lau N T, Fang Ming, Chan C K. The role of SO2in the reduction of NO by CO on La2O2S[J]. Journal of Catalysis, 2007, 245(2): 301−307.
[9] Pantazis C C, Petrakis D E, Pomonis P J. Simultaneous and/or separate SO2/NO reduction by CO over high surface area Cu/Ce containing mesoporous silica[J]. Applied Catalysis B: Environmental, 2007, 77(1/2): 66−72.
[10] 朱吉庆. 冶金热力学[M]. 长沙: 中南工业大学出版社, 1995: 275−291.
ZHU Jiqing. Metallurgical thermodynamics[M]. Changsha: Central South University Press, 1995: 275−291.
[11] 叶大伦, 胡建华. 实用无机物热力学数据手册[M]. 2版. 北京: 冶金工业出版社, 2002: 868−868.
YE Dalun, HU Jianhua. Inorganic thermodynamic data sheet[M]. 2nd ed. Beijing: Metallurgical Industry Press, 2002: 868−868.
[12] Maria F S, Tianli Z, Yue L. Ceria-based catalysts for the recovery of elemental sulfur from SO2-laden gas streams[J]. Catalysis Today, 2000, 62(2/3): 145−158.
[13] 梁英教, 车荫昌. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社, 1993: 88−281.
LIANG Yingjiao, CHE Yinchang. Inorganic thermodynamic data manual[M]. Shenyang: Northeastern University Press, 1993: 88−281.
[14] GB 13223—2011, 火电厂大气污染物排放标准[S].
GB 13223—2011, Fossil-fuel power plant atmospheric pollutant emission standard[S].
Chemical equilibrium analysis of CO-NO-SO2system
ZHANG Li, QIN Yihong, CHEN Baizhen
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Chemical equilibrium analysis of CO-NO-SO2system was carried out. The results show that there exists good interaction among CO, SO2and NO, which removes the three pollutants at the same time. NO can be more easily reduced by CO than SO2, and it is favorable for the reduction of SO2to increase the volume fraction of CO ((CO)) or lower temperature. CO in the flue gas itself is sufficient to reduce SO2and NOat the temperature lower than 1 000 K. Denitration product is only N2, and desulfurization products include S and COS. Increasing the reaction temperature can greatly inhibit the formation of the possible by-product COS. With the increase of the volume fraction of NOor SO2in flue gas, denitration efficiency remains at 100%, desulfurization efficiency decreases, and desulfurization product is mainly sulfur.
reduced by carbon monoxide; desulfurization and denitration; gas phase composition; desulfurization and denitration efficiency
X131.1
A
1672−7207(2015)01−0027−07
2014−01−19;
2014−03−22
湖南省博士生科研创新项目(CX2011B106) (Project(CX2011B106) supported by Doctoral Research Innovation in Hunan Province)
秦毅红,硕士,教授,从事烟气治理研究;E-mail: qinyihong@163.com
10.11817/j.issn.1672−7207.2015.01.005
(编辑 陈灿华)
