双氧水-氢溴酸光化学氧化合成1,3-二氯丙酮的研究
2015-10-12王小玲
王小玲,孙 娟
(常州寅盛药业有限公司,江苏 常州 213033)
双氧水-氢溴酸光化学氧化合成1,3-二氯丙酮的研究
王小玲,孙 娟
(常州寅盛药业有限公司,江苏 常州 213033)
目的优化1,3-二氯丙酮的合成工艺。方法和结果通过优化反应条件,调整并确定了原料比1,3-二氯丙醇:氢溴酸(HBr):双氧水=2:1:1.1。结论与文献方法相比,原料价廉易得且安全性提高,有较高的经济效益,且避免了铬污染的问题。
1,3-二氯-2-丙醇;1,3-二氯丙酮;氧化;环保
1,3-二氯丙酮是有机化工的基础原料,也是法莫替丁、尼扎替丁和氟康唑等医药产品的重要中间体,虽然制备方法[1-2]有多种,但用仲醇氧化法制备是最简洁的方法,其经典方法是用铬盐+硫酸,把1,3-二氯丙醇氧化成1,3-二氯丙酮[3],但含铬废水污染环境是个难题。
为了消除铬盐的污染,仿照欧洲专利——双氧水-氢溴酸光化学氧化法,并对合成工艺进行了优化:(1)双氧水浓度由70%改为50%,原料价廉易得,操作也更安全;(2) 反应溶剂用1,2-二氯乙烷代替氯仿,大幅降低了成本;(3)用40%的氢溴酸代替专利中以溴化铵-硫酸发生溴化氢,简化了设备和操作。
本法的优点是彻底免除了铬盐的污染。50%的双氧水价廉易得,反应后,双氧水变成了对环境无害的水,具有较高的工业生产价值和社会效益。
1 实验部分
1.1实验原理
一般地,热化学反应可以通过提高反应温度来加速反应,光化学反应不同于常见的热化学反应,反应原料是靠吸收光源发射的光子获得反应的活化能而与另一原料发生化学反应的,常常与温度关系不大,因为此光化学反应大多在室温或低温下就能发生,关键是要有一个波长和强度适当的光源提供光子。
本工艺通过下列三步反应循环进行,同时加入溶剂溶解原料1,3-二氯丙醇,与氢溴酸水溶液构成互不相溶的两相系统,双氧水把溴化氢氧化成难溶于水并易溶于有机溶剂的溴素而与其中的1,3-二氯丙醇充分接触,让氧化反应在有机溶剂中充分展开。而溴化氢易溶于水而难溶于有机溶剂,这样就减少了与有机溶剂中的1,3-二氯丙醇的接触,有效地阻止了溴化氢与醇羟基的卤化反应(副反应),提高了反应的选择性。

三段反应的先后顺序如下:
(1) 双氧水将水相中无色的溴化氢氧化成血红色的溴素。

溴素易溶于反应溶剂而使本为无色的反应液呈血红色。
(2) 溴素接受光源的光子的能量均裂成溴的活性游离基。
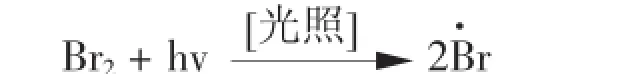
反应液呈红色过渡状态(不稳定)。
(3)活性高的溴游离基达到一定浓度便把1,3-二氯丙醇脱氢氧化成1,3-二氯丙酮,同时生成副产物溴化氢。

生成的溴化氢进入水相形成氢溴酸,被双氧水再次氧化成溴素,重复(1)、(2)、(3)的反应过程进行下一轮的循环氧化反应。
在循环反应过程中,溴化氢并不消耗,仅当二传手作用,但随着套用次数的增加,每次反应生成的水和原料双氧水中的水都会将氢溴酸逐渐稀释。由此可见,本工艺的关键是如何简易地把反应系统中多余的水除去以增加套用次数,从而降低消耗。
1.2实验药品与仪器
实验药品:1,3-二氯-2-丙醇、1,2-二氯乙烷、氢溴酸(40%)、双氧水(50%)、纯化水。1,3-二氯-2-丙醇为车间自制(GC 99%),其余试剂均为分析纯
实验仪器:电动搅拌器、三口烧瓶、节能灯、分液漏斗、蒸馏装置。
1.3实验方法
装有温度计、分液漏斗、冷凝器的250ml三口烧瓶,电磁搅拌,瓶外离壁瓶约1cm安装一支40w节能灯反应全过程照射,水浴冷却。
向三口烧瓶中,加入25.8g(0.2mol)1,3-二氯-2-丙醇,125.7g(100ml)1,2-二氯乙烷和21g氢溴酸溶液(相当于含溴化氢8.1g(0.1mol)),开动搅拌,并用节能灯照射反应液,开始反应液呈微浊微黄色,调节水温使烧瓶瓶内温到20℃~25℃左右,即可慢慢滴加50%的双氧水15g(0.22mol),反应液渐呈血红色,并迅速升温,通过双氧水滴加速度以及调节水浴温度(必要时可放入小冰块)使反应在25℃~30℃之间进行。滴加时间1.5~2h完成。反应期间,要注意观察反应液血红色褪色情况,褪色快说明氧化反应较快。滴加完毕,保温3~4h,血红色变成红色即达到反应终点。
反应毕,冷却,倒入分液漏斗中静置分层,上层母液可留作下批套用(1-3次),分出下层有机层,用纯化水洗去其中残留的双氧水,有机层水浴蒸馏回收的1,2-二氯乙烷,直接用于下批多次套用或提取用。蒸馏后期可减压将溶剂蒸尽,趁热将残留物倒入小烧杯中,即析出白色针状结晶。将烧杯密封放冷,过滤,即得1,3-二氯丙酮结晶湿品,在浓硫酸干燥器中干燥过夜,称重18.3g,收率72%(以1,3-二氯-2-丙醇为基础),mp39~43℃,含量GC 98%以上。
2 结果与讨论
2.1最佳反应温度与时间的选择
通过实验证明,反应温度在20℃以下时,反应缓慢,温度过高,则反应不完全。因此,控制反应温度在25℃~30℃之间,滴加时间维持在1.5~2h,保温3~4h为最佳。
2.2最佳投料配比的选择
一般来讲,过氧化物的危险性主要是自身能受热分解爆炸,所以要控制双氧水的量,但双氧水能被水以任何比例稀释而降低危险性。另外,其放置自身即能分解逐渐放出氧,所以容器务必开小口放气。通过优化反应条件,确定了原料摩尔比为1,3-二氯丙醇:氢溴酸(溴化氢):双氧水=2:1:1.1。
2.3光源的选择
从反应原理可知,反应热主要是由双氧水氧化溴化氢成溴素而发生的,其反应速度是很快的。但整个反应的关键在于溴素经光照成溴游离基的好坏,此反应不需热,仅需有一个合适的灯光源,一般用于光化学的光源有高压汞灯、金属卤化物、浸入式汞灯和节能灯等。
2.4母液处理
反应过程的含溴废气废水都要尽量回收利用,常用的有蒸馏成低浓度氢溴酸溶液或中和蒸发回收含溴盐。
本工艺与现有方法相比,显著的优点是原料价廉易得且安全性提高,有较高的经济效益,且避免了铬污染的问题,是一种可以提供的生产型工艺。
[1]H.盖尔曼,A.勃拉特.有机合成(第1集)[M].北京:科学出版社,1957.
[2]丁光月,傅建彪.1,3-二氯-2-丙酮氧化反应的研究[J].太原理工大学学报,1998,29(1):80-82.
[3]罗劲深.以重铬酸钠—硫酸作氧化剂合成1,3-二氯丙酮[J].合成化学,1993,(1):1.
(责任编辑刘红)
Photochemical Oxidation of 1,3-Dichloroacetone Using Hydrogen Peroxide/Hydrobromic Acid
WANG Xiao-ling,SUN Juan
(Changzhou Yinsheng Pharmaceutical Co.,Ltd.,Changzhou Jiangsu 213033,China)
1,3-Dichloroacetone was synthesized from 1,3-Dichloro-2-propanol by the method of Photochem
1,3-Dichloro-2-propanol;1,3-Dichloroacetone;oxidation;green initiative
O624.1
A
1671-0142(2015)02-0049-03
王小玲(1973-),女,江苏常州人,工程师.
ical oxidation using Hydrogen peroxide/hydrobromic acid.Through optimizing the reactive conditions,the mole ratio of 1,3-Dichloro-2-propanol to hydrobromic acid to Hydrogen peroxide was determined as 2∶1∶1.1.Compared with other method in the literature,the new process has advantage of decreasing material cost,improving security,simplifying operation and it is also an effective method to eliminate pollution.
