不同质地土壤烟株根际微生物菌群变化分析
2015-10-09王淑玉李小龙李红丽
王淑玉,李小龙,李红丽,曾 强,王 岩,林 卿,田 甜,孙 妍
(1. 郑州大学化工与能源学院,河南 郑州450000;2. 福建省烟草公司南平市公司邵武分公司,福建 邵武354000)
良好的土壤生态环境是农业健康、可持续发展的基础[1]。土壤微生物是土壤生态系统的重要参与者,具有以下功能:促进植物营养元素的转化和土壤肥力形成[2];分解土壤有机质,形成腐殖质[3-4];与植物共生,促进植物的生长,防治作物土传病害的发生[5-6];降解农药残留等有机污染物[7]。因此,许多研究把土壤中的真菌、细菌和放线菌3 大类微生物的数量作为评价土壤肥力高低的重要生物学指标[8]。
由于土壤类型和气候条件不同,各种植区土壤微生物的区系和丰度各异。研究表明,作物病害的发生,尤其是土传病害的发生,与根际微生物的数量和区系组成以及群落结构等均关系密切[9-12]。因此,以福建省邵武市不同植烟区的土壤为研究对象,在分析土壤基本性质和土壤微生物数量变化的基础上,通过16 S rDNA 建立克隆文库进行土壤细菌多样性分析,旨在探讨土壤性质与烟叶青枯病发生之间的关系,为制定有效防控烟叶青枯病措施提供理论与技术依据。
1 材料与方法
1.1 试验地概况及供试品种
试验于2014年在邵武市沿山镇徐溪村、城郊镇高南村和水北镇故县村3个地方进行,选择往年青枯病发病严重的地块作为试验田,供试烤烟品种为K326。
1.2 试验方法
1.2.1 试验设计 每个试验地点为1个处理,分别为:T1,沿山镇徐溪村;T2,城郊镇高南村;T3,水北镇故县村。每个处理选择3个性质相似的田块作重复,共占地667 m2。植烟密度为1 100 株/667m2,株行距为50 cm×120 cm,纯氮用量为9.09 kg/667m2,N︰P︰K 比例为1.0︰0.8︰2.7。
1.2.2 测定项目及方法 (1)土样采集。分别于烟苗移栽前、旺长期、采摘期(健康烟株和发病烟株)和采摘后期采集土壤样品,具体方法为:各小区随机选取3株烤烟,将整棵烟株连根拔出,取粘接在细根上的土壤混匀,即为根际土壤,将3 株烤烟的根际土壤混合成1个样品,采用四分法保留1 kg,于4℃冰箱内存放待测。(2)土壤机械组成测定。土壤机械组成依照《农业行业标准》(NY/T 1121-2006)中的测定方法进行。(3)土壤基本性质测定。取部分根际土壤风干,用木槌研磨后过60 目筛,用电位法测定土壤pH 值;土壤有机质、速效钾、速效磷、碱解氮分别采用重铬酸钾容量法、火焰分光光度计法、碳酸氢钠法、碱解扩散法测定[13]。(4)土壤微生物数量测定。采用稀释平板计数法测定土壤微生物数量[14],细菌培养采用牛肉膏蛋白胨琼脂培养基,放线菌培养采用高氏合成1 号琼脂培养基,真菌培养采用马丁孟加拉红链霉素琼脂培养基。(5)宏基因组16S rDNA 测序。按OMEGA 试剂盒的步骤提取土壤DNA,对提取到的基因组DNA 进行琼脂糖电泳检测,查看基因组DNA 的完整性与浓度。利用Qubit2.0 DNA 检测试剂盒对基因组DNA 精确定量,以确定PCR 反应应加入的DNA 量,按照配置好的PCR 体系进行扩增,采用琼脂糖回收试剂盒(cat:SK8131)对PCR 产物进行回收。回收产物用Qubit2.0定量,根据测得的DNA 浓度,将所有样品按照1︰1的比例进行混合;混合后充分震荡均匀。该混合样品用于后续的样品建库(加测序标签)与测序。去除序列中非扩增区域序列,然后用mothur 中的pre.cluster 软件进行测序错误校正,最后采用uchime 去除序列中的嵌合体。采用RDP classifier 软件对处理后序列进行物种分类,采用Na觙ve Bayesian assignment 算法对每条序列在genus 水平上计算其分配到的概率值。(6)烟株发病率调查。在烟株发病期,对每个小区中发病植株进行计数,发病率用发病个体占群体总数的百分数来表示。发病率(%)=(发病株数/调查总株数)×100。
2 结果与分析
2.1 土壤机械组成与基本性质
如表1 所示,沿山镇徐溪村(T1)和城郊镇高南村(T2)的试验田土壤均属棕色轻壤土,而水北镇故县村(T3)的试验田土壤属灰色砂壤土;其中,城郊镇高南村和水北镇故县村的土壤pH 值相近,均在5.1 左右,而沿山镇徐溪村的土壤偏酸性,pH 值为4.60;沿山镇徐溪村的土壤有机质含量最高,其次为水北镇故县村,城郊镇高南村的土壤有机质含量最少,且前者与后两者之间的差异显著;不同试验地的氮磷钾养分差异也较大。
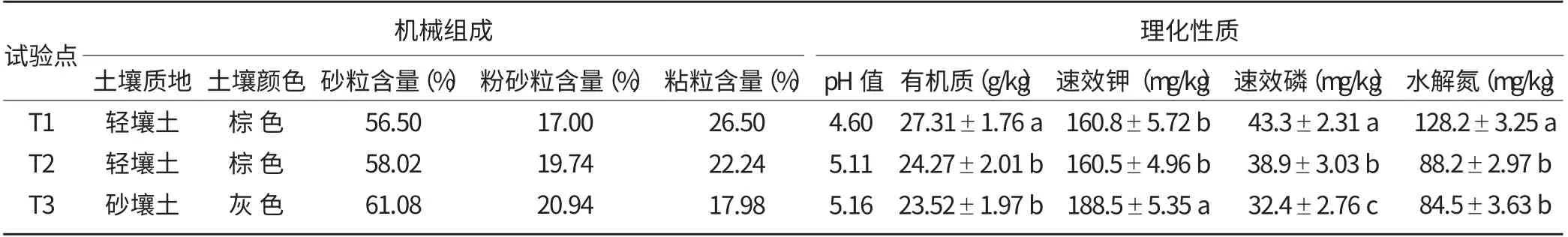
表1 各试验点土壤的机械组成和理化性质
2.2 烟草根际土壤微生物数量的变化
通常情况下,农业土壤中微生物的种类、数量与当地自然生态如土壤种类、气候条件等密切相关。当这些生态条件发生改变时,土壤微生物的种类和数量也会随之发生较大变化[15]。也正是由于微生物种类和数量的这些变化,反映出生态条件的改变以及对农业生产产生的效应。例如土壤有机质的矿化与合成、肥料养分的矿化与生物固持、土壤中病原菌数量比例的消减或增长等[16]。
由于3个试验点的土壤类型及理化性状有较大差异,所以土壤微生物的种类和数量也明显不同。从表2 中可以看出,T1~T3 试验点烟株根际土微生物总量分别为84.98×105、49.89×105、36.20×105cfu/g,处理间差异显著;其中,除T3 试验点外,其他两个试验点各类微生物数量由多到少排列依次为细菌>真菌>放线菌。就不同性质土壤来看,轻壤土中烟草根际微生物的总量以及细菌、真菌和放线菌各类型微生物的数量均多于砂壤土中的。
从表2 中还可看出,在移栽前土壤中微生物数量较低,移栽烟苗后土壤中微生物含量均增高,这是因为作物种植施加肥料后,微生物有了充足的营养物质,含量迅速增加。在烟株生育期间,根际土微生物总量和细菌数量变化趋势较为一致,表现出先增后减的趋势,其峰值出现在烟草生长发育较快的旺长期或采摘初期。进入采摘期之后,根系分泌物逐渐减少,根际微生物数量又有一定幅度地减少。
2.3 不同生育期烟株根际土壤中细菌类群的变化
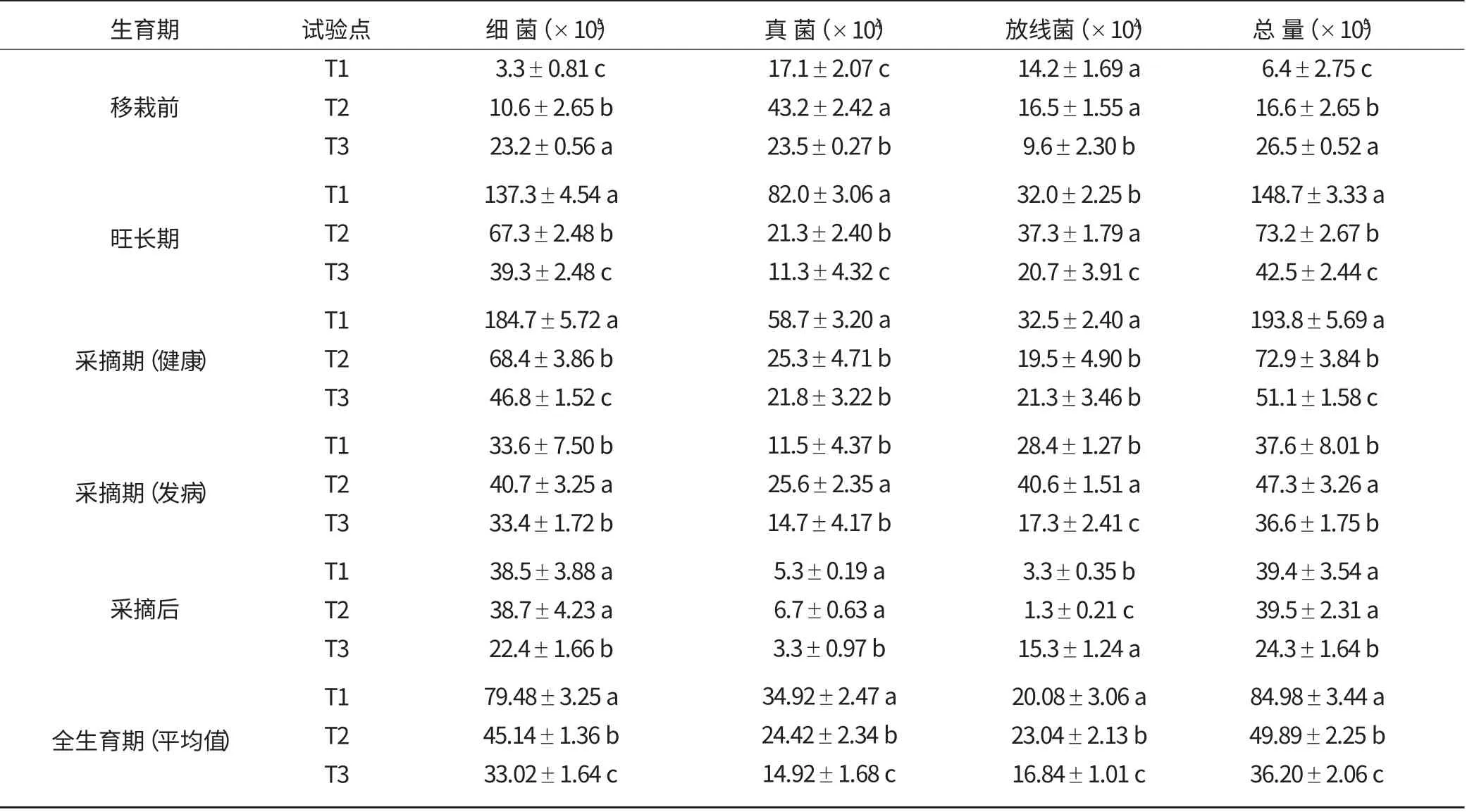
表2 各试验点在烤烟不同生育期土壤微生物的数量 (cfu/g)
从表3 中可以看出,不同试验田土壤中的优势菌群不同,同一试验田在不同时期土壤中优势菌群也有差别。其中,移栽前各处理根际土壤中的优势菌群为Massilia、Gp1 和Gp3(T1),Clostridium、Massilia 和Gp1(T2),Gp1、Sphingomonas 和Massilia(T3);旺长期各处理根际土壤中的微生物数量明显增多,优势菌群也随之发生改变,T1 土壤中优势菌群为Sphingomonas、Gp1 和Ferruginibacter,T2 土 壤 中 的 优 势 菌 群 为Sphingomonas、TM 7 和Massilia,T3 土壤中的优势菌群为Gp1、Sphingomonas 和Gp3;采摘期健康烟株各处理根际土壤中的优势菌群为Sphingomonas、Gp1 和Gp3(T1),Sphingomonas、Gp1 和Gp3(T2),Gp1、Gp3 和Subdivision3(T3);采摘期发病烟株各处理根际土壤中优势菌群为Gp1、Gp3 和Sphingomonas(T1),Gp1、Gp3 和Subdivision3(T2),Gp1、Gp3 和Spartobacteria(T3)。
从表4 中可以看出,在烤烟生育期内各试验点土壤中细菌文库的覆盖率达到70%以上,说明所建文库能真实反应出该环境细菌多样性特征;香农指数是衡量群落的异质性,而细菌文库的香浓指数均达到7.00以上,表明根际的细菌群落多样性已达较高水平。
ACE 指数和Chao1 指数是预测环境中细菌总数的指标,值越高则物种越多。由表4 可知,采摘期,3个试验点的根际土壤中ACE 指数与Chao1 指数均表现为T2>T1>T3,即轻壤土中细菌总量较砂壤土多。从表4 中还可以看出,在烟叶采摘期,健康植株的根际土壤中的这两个指标均显著高于发病植株的根际土壤的。这说明在健康状态下,烟株根际土壤细菌多样性程度较高,并且健康植株根际土壤中的细菌多样性和丰度远高于发病植株根际土壤中的。有研究表明,病原物在侵入寄主的过程中以及侵入后,会在一定程度上干扰植物的正常代谢,引起根系分泌物的改变。由此推测,发病植株根际中烤烟青枯病菌可能诱导根际环境发生了相应变化。
在T1 和T2 土壤中,健康植株根际的Sphingomonas数量高于发病植株根际的数量。Sphingomonas,即鞘氨醇单胞菌,属变形细菌的4 亚类,该类菌株均为革兰氏阴性菌,无孢子,以单侧生极性鞭毛运动,多呈黄色,专性需氧且能产生过氧化氢酶;除此之外,鞘氨醇单胞菌还可将戊糖、己糖及二糖转变成酸。由于鞘氨醇单胞菌对芳香化合物有极为广泛的代谢能力,并且该菌属某些菌种能够合成有价值的胞外生物高聚物,从而形成疏水表面,有利于这些细菌在生态环境中存活并方便其摄取芳香化物,具有一定的生防作用。
2.4 试验点烟株青枯病发生情况
从表5 中可以看出,第一次调查时(6月24日)烟株青枯病发病率以T3 最高,T1 的发病率最低;到后两次调查时,T3 的发病率仍居高不下,发病率由高到低均表现为T3>T2>T1。采摘结束时T3 发病率分别比T1、T2 高出20.79、9.02个百分点,病情指数分别比T1、T2 高19.52、12.29。由此可见,不同土壤类型对烟株青枯病的发生有一定影响。T1 和T2 土壤中微生物总量最高且种类丰富,且土壤中优势菌群较为分散,微生物结构相对稳定,病原微生物较难打破原有菌群结构,故发病较轻;而T3 土壤中菌落数量相对较少,且微生物种类不如T1、T2 丰富,因此其土壤菌群结构易受外界因素影响而发生改变。另外,T3 试验点土质偏砂质化,在烟叶青枯病发病高峰期恰逢邵武市雨季,青枯病病原菌随雨水扩散,蔓延迅速,从而造成青枯病大面积爆发。
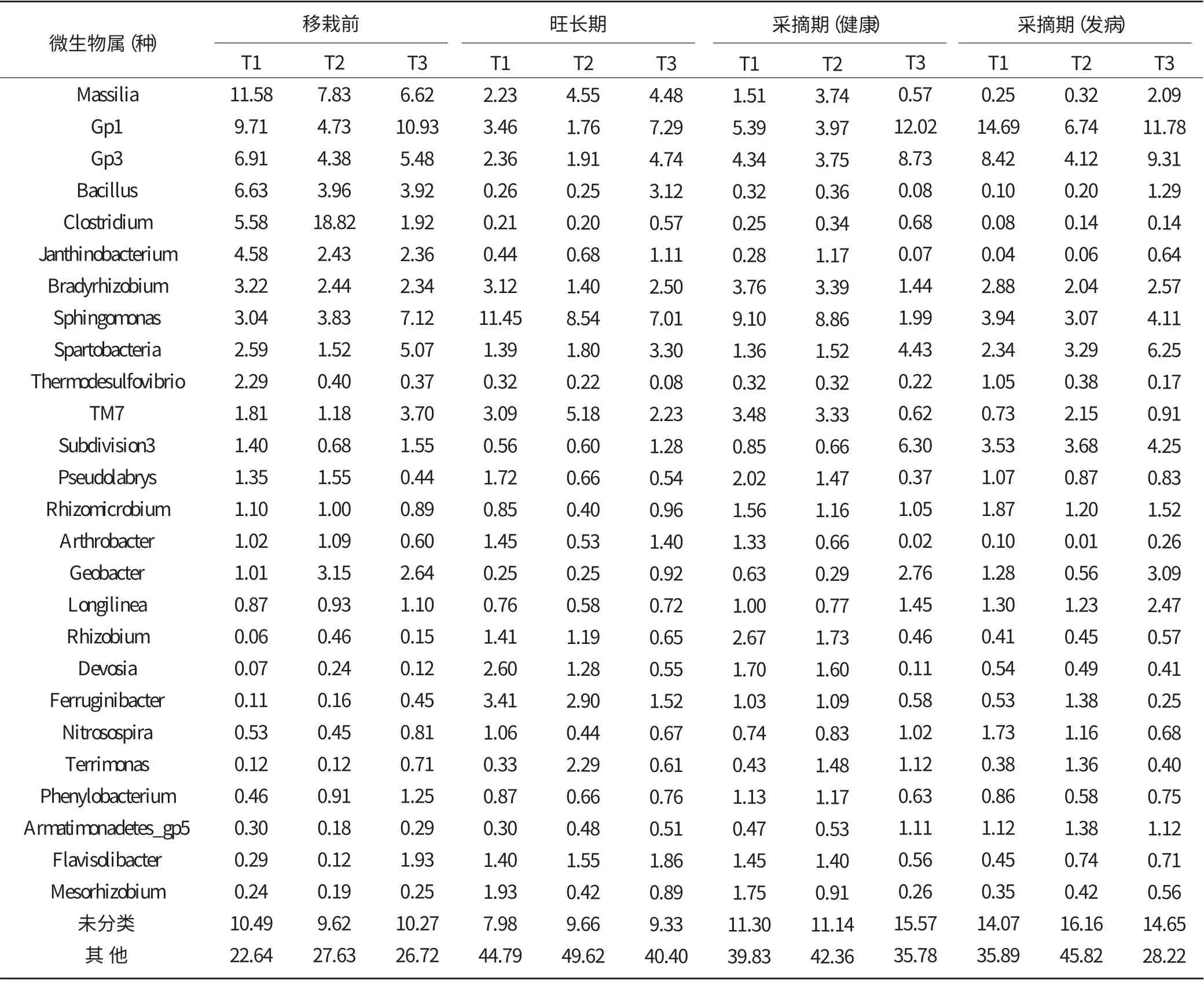
表3 各试验点在烤烟不同生育期土壤微生物组成及占比 (%)
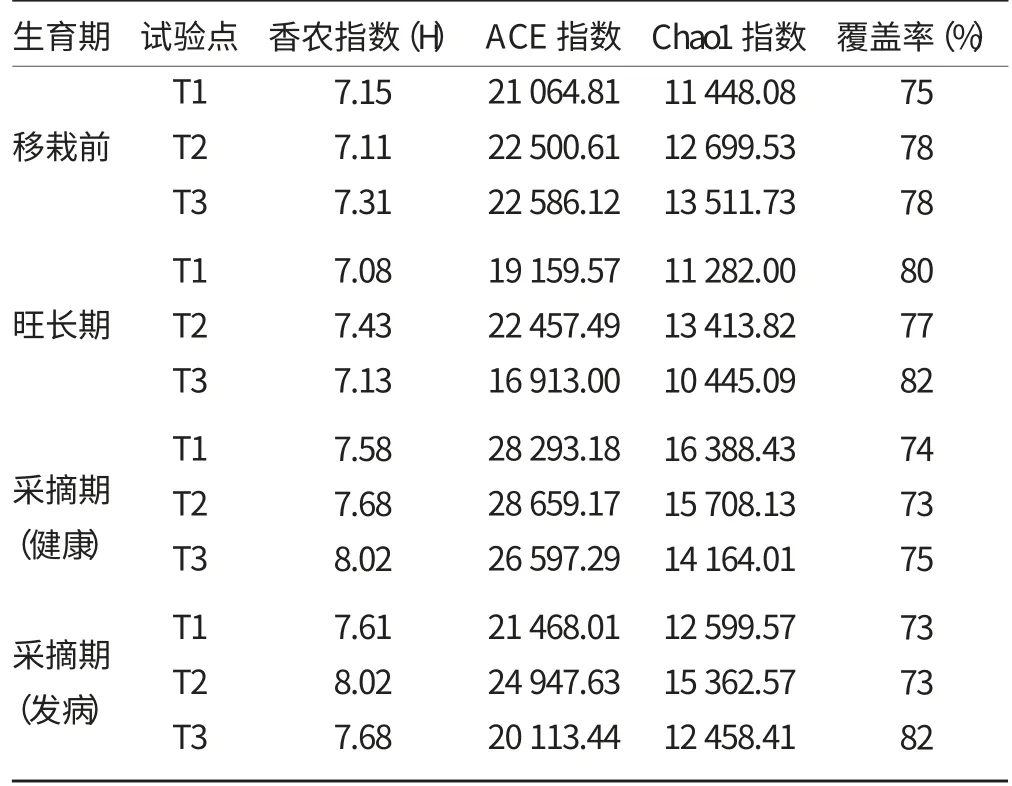
表4 试验点土壤根际细菌群落多样性指数
3 结论与讨论
随着人们对微生物在农业生产中重要作用的认识不断加深,用土壤微生物学特性来评价土壤的健康程度和质量日渐被认可[17]。微生物学特性包括土壤微生物数量、活性、种群多样性等,其中土壤微生物数量可以作为指示土壤肥力和监控土壤生态环境的一个重要指标。一般来说,土壤微生物尤其是土壤细菌数量越多,则土壤肥力越高,对作物越有利。而真菌型或放线菌型土壤则不利于作物生长,是土壤肥力下降的标志[18]。试验的3个点,土壤微生物中细菌数量均占绝对多数,达90%以上,均为细菌型土壤。
群落多样性、均匀度和优势种群集中度是从不同角度衡量生物群落结构和稳定性的重要指标。群落多样性参数值与均匀度越大,优势集中度越小,则群落的结构越复杂,其反馈系统也就越强大,对于环境的变化或来自群落内部种群波动的缓冲作用越强,群落也就越稳定[19]。试验结果表明,轻壤土中的微生物总量大于砂壤土,且轻壤土中的细菌数量及其在土壤微生物中的占比也大于砂壤土,其丰度均较砂壤土高,因此轻壤土中烟草青枯病发病率显著低于砂壤土。
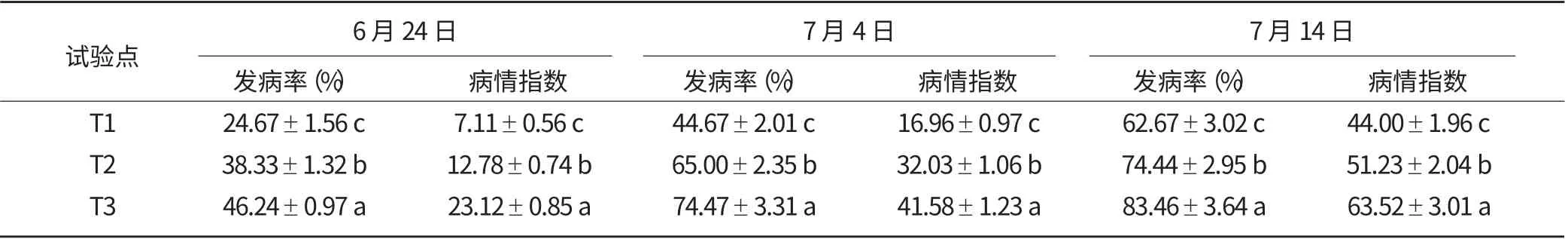
表5 2014年各试验点烟株青枯病发生情况
植物根系、土壤与微生物共同构成根际生态系统。在健康的根际生态系统中,微生物丰度较高,物种间物质交换和转化途径呈现出多样化,协调性增强,土壤中有机质和养分的转化速度加快,有利于保持土壤生态平衡。宏基因测序结果表明,土壤微生物结构和数量随烟株的移栽以及肥料的施加发生改变。在烟叶采摘期,同一试验点健康烟株根际土壤细菌多样性程度较高,且健康根际土壤中细菌丰度远高于发病根际土壤。而且这一时期轻壤土中细菌菌群结构较砂壤土稳定。如此,烤烟植株可通过细菌与细菌之间、细菌与真菌之间的相互作用,抑制病原微生物的生长,维持生态平衡,提高烟株的抗病性。综上所述,在以后的病害防治过程中,可大力研发土壤菌群调节剂或微生物制剂,加强微生物菌群的构建,充分发挥拮抗菌的作用,提高土壤养分转化的协调性。
[1]Ghorbani R,Wilcockson S,Koocheki A,et al.Soil management for sustainable crop disease control:a review[J].Environmental Chemistry Letters,2008,6(3):149-162.
[2]Jenkinson DS.Microbialbiomass in soil,measurementand turnover[J].Soilbiochemistry,1981,(5):415-471.
[3]李阜棣.土壤微生物学[M].北京:中国农业出版社,1996.140-179.
[4]Mooney J H,Cushman E,Medina O H,et al.Functional role of biodiversity[M].New York:JohnWiley&Sons Ltd,1996.
[5]Li Q K.Development and prospect of soil science in China[J].Acta Pedologica Sinica,1989,26(3):207-216.
[6]龚福明,贺江舟,孙晓棠,等.土壤微生物与土壤抑病性形成关系研究进展[J].新疆农业科学,2007,44(6):814-819.
[7]Boopathy R.Factors limitingbioremediation technologies[J].Bioresource Technology,2000,74(1):63-67.
[8]Ebhin Masto R,Chhonkar P,Singh D,et al.Changes in soil biological and biochemical characteristics in a long-term field trial on a sub-tropical inceptisol[J].Soil Biology and Biochemistry,2006,38(7):1577-1582.
[9]Peshakov G,Ampova G,Toskov N,etal.Effectof certain herbi cides on microorganisms,isolated from the rhizosphere of different crops(wheat,maize,tobacco,tomatoes,apples)[J].Soil Science and Agrochemistry,1976,11(5):93-99.
[10]Anilkumar TB,ChakravartiBP.Changes in the rhizospheremicroflora ofmaize seedlings by pretreatmentof rootswith hormones and urea[J].Plantand Soil,1970,33(1-3):679-684.
[11]Ampova G,Milianchev I.Changes in the rhizosphere microflora of tobaccoaffected by vetch and pea predecessors[J].Pochvozn Agrokhim,1972,7(2):99-103.
[12]张晓海,杨春江,王绍坤,等.烤烟施用菜籽饼后根际微生物数量变化研究[J].云南农业大学学报,2003,18(1):14-19.
[13]鲍士旦.土壤农业化学[M].北京:中国农业出版社,2000.22-110.
[14]李阜棣,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996.
[15]王 岩,沈其荣,史瑞和.土壤微生物量及其生态效应[J].南京农业大学学报,1996,19(4):45-51.
[16]殷全玉,王 岩,赵铭钦,等.我国植烟土壤微生物研究进展[J].中国烟草科学,2009,30(1):73-77.
[17]李秀英,赵秉强,李絮花,等.不同施肥制度对土壤微生物的影响及其与土壤肥力的关系[J].中国农业科学,2005,38(8):1591-1599.
[18]马云华,魏 珉,王秀峰.日光温室连作黄瓜根区微生物区系及酶活性的变化[J].应用生态学报,2004,15(6):1005-1008.
[19]王 超,吴 凡,刘训理,等.不同肥力条件下烟草根际微生物的初步研究[J].中国烟草科学,2005,26(2):12-14.
