NRRB在水稻应答高盐和干旱胁迫中的功能解析
2015-10-06张玉霞吴敏亮杨钰莹厦门大学生命科学学院厦门市植物遗传重点实验室福建厦门361102
张玉霞,周 丹,吴敏亮,李 燕,杨钰莹,陈 亮(厦门大学 生命科学学院,厦门市植物遗传重点实验室,福建 厦门 361102)
NRRB在水稻应答高盐和干旱胁迫中的功能解析
张玉霞,周丹,吴敏亮,李燕,杨钰莹,陈亮
(厦门大学 生命科学学院,厦门市植物遗传重点实验室,福建 厦门 361102)
为研究NRRB在水稻抗逆反应中的作用,通过重叠延伸PCR扩增NRRB基因编码区,构建超量表达载体,并转化水稻愈伤组织获得超量表达转基因水稻植株。鉴定结果表明,该基因已被整合到水稻基因组中,并实现超量表达;同时构建了抑制表达载体,获得转基因株系,PCR检测结果证实NRRB基因在转基因水稻中受到明显抑制。对T1代转基因植株进行抗旱性、耐盐性分析,结果显示,超量表达NRRB基因增强了转基因水稻对干旱的抗性,抑制表达NRRB基因的转基因水稻对干旱的敏感性增强,表明NRRB正调控水稻对干旱的抗性;耐盐性分析表明,NRRB基因的抑制表达降低了植株对盐的敏感性。
NRRB;超量表达载体;RNAi表达载体;转基因水稻
水稻Oryza sativa是重要的粮食作物,但由于各种非生物胁迫,水稻产量受到严重制约[1—2]。在非生物胁迫中,盐碱和干旱是制约植物生长的两个主要胁迫因素[3]。据统计,目前世界上约 22%耕种土地是盐碱地,接近 50%灌溉土地受到盐胁迫的危害[4—5]。而且,干旱和盐渍化面积扩张迅速,至 2050年,预计将有50%以上的可耕地面积严重盐碱化[6]。
植物在遇到非生物胁迫时,其形态和生理生化代谢将发生变化,以适应或忍耐环境胁迫[7]。植物与胁迫相关的基因、蛋白质及代谢物构成一个复杂的调控网络,其中胁迫相关基因的转录控制发挥着重要作用[8]。研究表明,多数植物类受体激酶(Receptor-like kinase,RLK)基因参与盐、高温、冷害、干旱和重金属等非生物胁迫应答,如OsSIK1(stress induced protein kinase 1,SIK1)是水稻的一种RLK,在水稻抵抗盐害和干旱胁迫中发挥重要作用[9]。与野生型植株相比,突变体sik1-1和sik1-2对盐胁迫和干旱胁迫的耐受性降低;相反,过量表达 OsSIK1基因可提高转基因植株超氧化物歧化酶含量,H2O2等活性氧含量降低,植株表现出更好的逆境耐受力。
NRRB基因位于水稻10号染色体,编码一个胞质RLK,含1个蛋白激酶结构域和1个U-box结构域。经过生物芯片分析,该基因对非生物胁迫具有响应能力。本文从生物信息学、超表达、RNAi及转基因植株耐旱性、耐盐性等方面分析评估转基因植株对逆境的抗性,进一步探讨转基因植株抗逆性增强的分子机理,以加深对水稻逆境胁迫应答信号网络组分的认识,为筛选具有开发利用价值的功能基因提供参考。
1 材料与方法
1.1材料
植物材料为粳稻 Oryza sativ a subsp. japonica品种‘台北 309’(TP309);克隆菌株为大肠杆菌Escherichia coli DH5α;用于Gateway技术的中间载体pENTRTM/D-TOPO购自Invitrogen公司;表达载体为 pCAMBIA-1301 Vector;干扰表达载体 pH7GWIWG2(II);根癌农杆菌菌株为 Agrobacterium tumefaciens EHA105;限制性内切酶BglII、BstEII购于TaKaRa公司。
1.2方法
1.2.1水稻基因组总RNA提取及cDNA合成采用Trizol试剂(Invitrogen,上海) 提取水稻不同组织总RNA,利用M-MLV反转录酶(TaKaRa,大连)合成cDNA第一链。
1.2.2NRRB超量表达载体构建以携带NRRB基因全长cDNA的质粒DNA为模板,用引物1301-f 和1301-r(表1)以及高保真pfu DNA 聚合酶扩增NRRB基因cDNA全长,扩增片段为2700 bp。PCR反应体系:10×PCR buffer 2 μL,dNTP 2 μL,上、下游引物(10 μmol·L-1)各 1 μL,DNA模板1 μL,pfu DNA聚合酶0.2 μL,ddH2O 12.8 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,退火57 ℃ 30 s,30个循环;72 ℃3 min。PCR产物胶回收后,连接pMD18-T Vector后测序,发现在第1600 bp处缺失两个碱基AG,于是根据重叠延伸PCR原理[10],重新设计引物,引物由Invitrogen公司合成。
两对引物YWx1-f、YWx1-r与YWx2-f、YWx2-r(表1)分别用来扩增前1600 bp和后1100 bp,最后再用引物1301-f、1301-r做重叠延伸PCR,扩增全长2700 bp的CDS区。PCR产物经胶回收后,经BglII 与BstEII酶切后,再进行凝胶回收,然后连接到经过BglII和BstEII酶切的pCAMBIA1301双元载体上,最终获得包含CaMV35S启动子和NRRB基因的超量表达载体pCAMBIA1301-NRRB。将超量表达载体采用冻融法导入EHA105中,挑选菌落PCR鉴定为阳性的单克隆,摇菌后保存备用。

表1 载体构建及鉴定所用引物Table 1 Primers used for the construction of the expression vectors and identification assays
1.2.3NRRB抑制表达载体构建以超表达重组载体pCAMBIA1301-NRRB的质粒DNA为模板,利用高保真pfu DNA聚合酶及上下游引物OsNRRBi-f和OsNRRBi-r(表1),扩增位于CDS区第1550~1895 bp处的NRRB干扰片段。PCR反应体系为:10×PCR buffer 2 μL,dNTP 2 μL,上、下游引物(10 μmol·L-1)各1 μL,DNA模板1 μL,pfu DNA聚合酶0.2 μL,ddH2O 12.8 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,退火57 ℃ 30 s,30个循环;72 ℃ 30 s。PCR得到大小为346 bp的干扰片段,将此片段回收纯化后,通过TOPO反应定向克隆到入门载体pENTRTM/D-TOPO上,再通过invitrogen的Gateway LR重组反应将目的片段插入表达载体pH7GWIWG2(II)。将干扰表达载体采用冻融法导入EHA105中,挑选菌落PCR鉴定为阳性的单克隆,摇菌后保存备用。
1.2.4转基因水稻检测根据潮霉素磷酸转移酶基因 Hyg和启动子 P35S序列设计特异引物 Hyg-S、Hyg-A和P35S-S、P35S-A(表1),对转基因植株进行PCR检测,野生型植株为对照。扩增1421 bp Hyg基因片断和942 bp启动子P35S片段。PCR反应体系:2×PCR Taq Mix 5 μL,引物(10 μmol·L-1)各0.5 μL,DNA模板1 μL,ddH2O 3 μL。反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸7 min。
1.2.5基因表达分析以三叶期水稻叶片提取转基因植株和野生植株总RNA,经反转录后获得cDNA,以此为模版,以NRRB-real-f1、NRRB-real-r1和Actin-rq-F、Actin-rq-R为引物(表1),PCR扩增基因actin和NRRB,其中actin为内参基因。
荧光定量PCR(qRT-PCR)的反应体系为:2×SYBR®Premix ExTaqTMⅡ 5 μL,上下游引物各0.4 μL,各取1 μL cDNA模板,ROX Reference Dye 0.2 μL,用双蒸水补足至10 μL。反应程序:95 ℃ 30 s,95 ℃5 s,60 ℃ 30 s,40个循环,在每个循环72 ℃延伸最后5 s进行荧光采集。定量数据采用2-ΔΔCT方法对qRT-PCR实验数据进行目的基因相对表达量分析[11]。每样品3个重复,每实验重复3次。
1.2.6转基因植株抗逆性分析水稻TP309种子催芽后,置于固定在组培瓶的纱布上培养(组培瓶中盛满新鲜营养液,并以浸湿纱布为准),萌发2 d后,挑选萌发一致的转基因水稻和野生型水稻萌发种子,分别转移至含20% PEG或150 mmol·L-1甘露醇(Mannitol)的1/2MS培养基上进行抗旱性分析。生长12 d后观察表型,并统计生长指标变化。另取一部分萌发一致的种子分别转移至含150 mmol·L-1NaCl的1/2MS培养基上进行耐盐性分析。生长10 d后观察表型,并统计生长指标变化。
2 结果与分析
2.1NRRB基因及其编码蛋白质生物信息学分析
通过搜索RGAP数据库(http://rice.plantbiology.msu.edu),获得NRRB基因及其编码蛋白的信息,基因位于水稻10号染色体上,基因序列全长5160 bp,有两个不同的剪接变体,本实验中研究的是变体一,即LOC_Os1040100.1。NRRB基因变体一包含9个外显子8个内含子(图1),该基因编码的蛋白属于PKc-like superfamily,是一个含900个氨基酸的丝氨酸/苏氨酸蛋白激酶,预测蛋白分子量为99.4 KD,等电点为6.42。
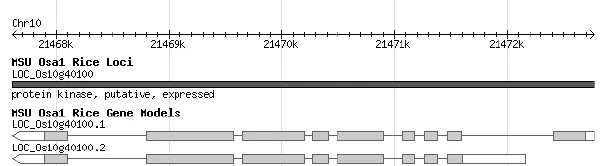
图1 NRRB基因组DNA结构和预测的蛋白结构Fig. 1 The structure of NRRB and its putative protein
2.2转基因水稻的获得及检测
2.2.1超量表达转基因水稻的获得及检测以携带NRRB基因全长cDNA的质粒DNA为模板,扩增基因并连接到pMD18-T载体,测序后发现在第1600 bp处有碱基缺失。根据重叠延伸PCR原理重新设计引物,构建好NRRB基因的超量表达载体(图2:A),分别扩增缺失位点前后两片段即片段一、片段二(图2:B),重叠延伸PCR获得全长序列(图2:C),最终用NcoI酶切对重组载体pCAMBIA1301-NRRB进行酶切鉴定,得到1686bp的目的条带(图2:D),结果表明该基因已被成功插入表达载体。通过农杆菌介导的转化方法将构建好的NRRB超量表达重组载体导入水稻TP309中,经组织培养后,共转化获得23株超表达转基因植株。分别取转基因水稻植株和野生型水稻叶片,提取基因组 DNA,并用启动子P35S特异引物P35S-S/P35S-A和潮霉素磷酸转移酶基因特异引物Hyg-S/Hyg-A进行PCR检测。大多数转基因水稻能扩增出与预期片段大小一致的目的片段,而野生型不能扩增出目的片段(图2:E、F),说明目的基因已成功整合进水稻基因组中,得到了成功转化的转基因水稻植株。
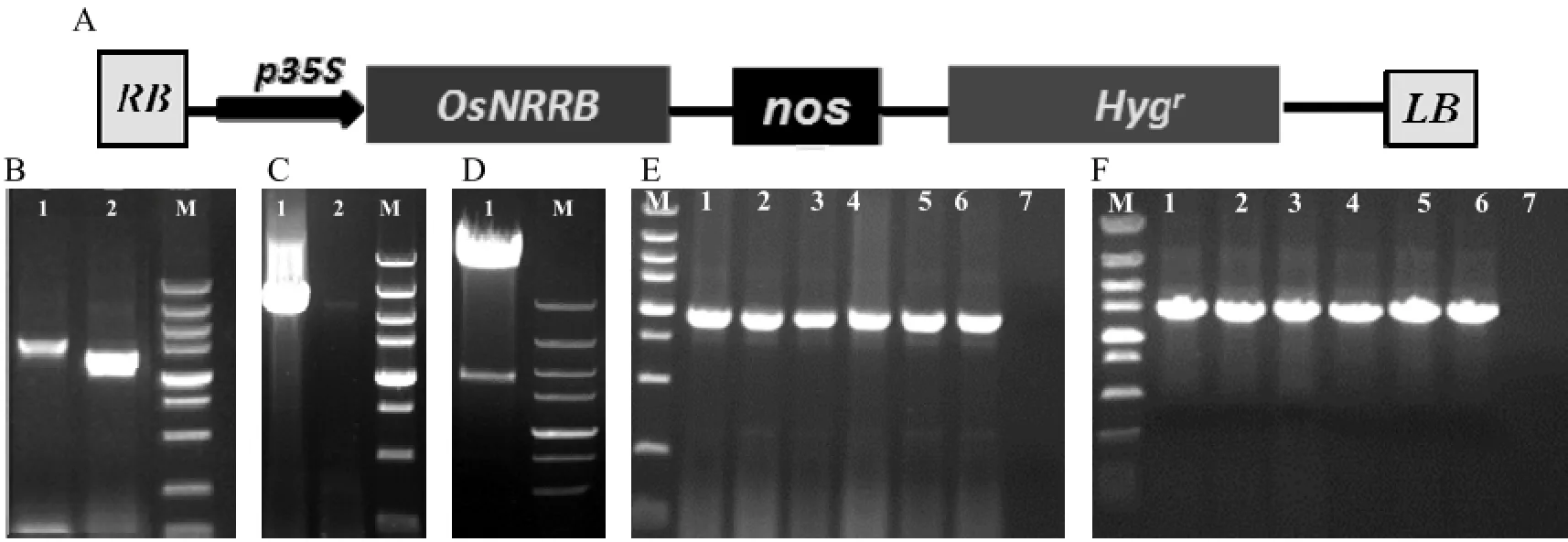
图2 PCR检测转基因植株Fig. 2 Identification of the transgenic plants by PCR
2.2.2抑制表达转基因水稻检测以pCAMBIA1301-NRRB质粒为模板,用基因特异性引物OsNRRBi-f 和OsNRRBi-r进行PCR扩增,得到大小为346 bp的干扰片段(图3:A)。将此片段回收纯化后,通过TOPO反应定向克隆到入门载体pENTRTM/D-TOPO上,并转化大肠杆菌DH5α感受态细胞。挑取单克隆并进行PCR鉴定(图3:B),将阳性克隆测序。经比对正确后,以上述阳性克隆的质粒为模板,通过重组反应将目的片段插入到表达载体pH7GWIWG2(II)中(图3:C)。转化大肠杆菌DH5α感受态细胞后,提取阳性克隆的质粒,经测序、比对,测序结果与目的序列一致,说明干扰片段已被成功构建到表达载体中。采用特异引物Hyg-S/A和P35S-S/A对抑制表达转基因植株进行PCR检测,以转基因水稻植株基因组DNA为模板的PCR大多能分别扩增到1421 bp和942 bp的DNA 片段(图3:D、E),而野生型植株则不能扩增到这样的条带,说明大多数转基因水稻植株的基因组已成功整合了目的片段。
2.3转基因植株中NRRB基因的表达水平
取12棵PCR检测为阳性的超量表达T0代转基因植株(分别命名为OE1~12)进行荧光定量PCR分析,结果显示,除了OE7外,其他超量表达转基因植株的NRRB表达量均比野生型高,说明这些转基因水稻植株实现NRRB的超量表达。其中,OE8、OE9、OE10的NRRB基因表达量比野生型水稻高出20倍以上(图4:A),可用于后续基因功能分析实验。同样选取11棵 PCR检测为阳性的抑制表达T0代转基因植株(分别命名为 RNAi1~11),检测目的基因NRRB的表达水平,结果显示,相对于野生型植株,NRRB基因在所选植株中的表达量均有不同程度的下降(图4:B),选取株系RNAi7、RNAi9作为后续实验材料。
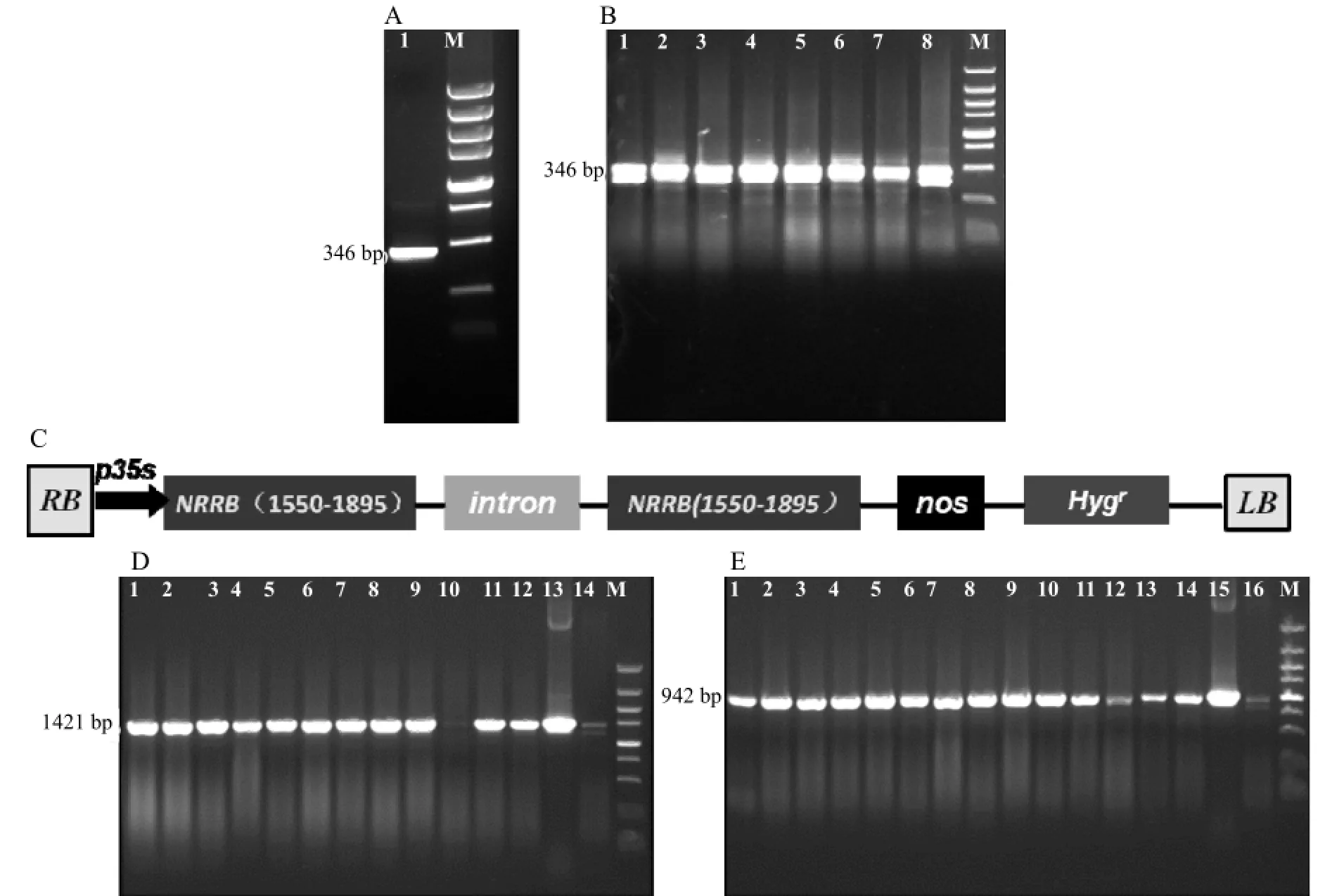
图3 PCR检测抑制表达转基因植株Fig. 3 Identification of the inhibition transgenic plants by PCR

图4 T0代转基因植株中NRRB基因的表达Fig. 4 Relative expression levels of NRRB in the T0 transgenic plants
2.4T1代NRRB基因超量表达和抑制表达转基因植株耐盐性分析
为了解NRRB在逆境胁迫应答中的功能,首先对转基因植株在高渗、高盐处理下的表型进行分析。耐盐性结果表明,在1/2MS培养基上,转基因植株和野生型植株之间没有明显的表型差异(图5:A);在含150 mmol·L-1NaCl的1/2MS培养基上,超量表达植株株高低于野生型(23%),且存在显著性差异;而抑制表达植株则比野生型高(15%)(图5:B)。因此,NRRB基因的抑制表达降低了植株对盐的敏感性。
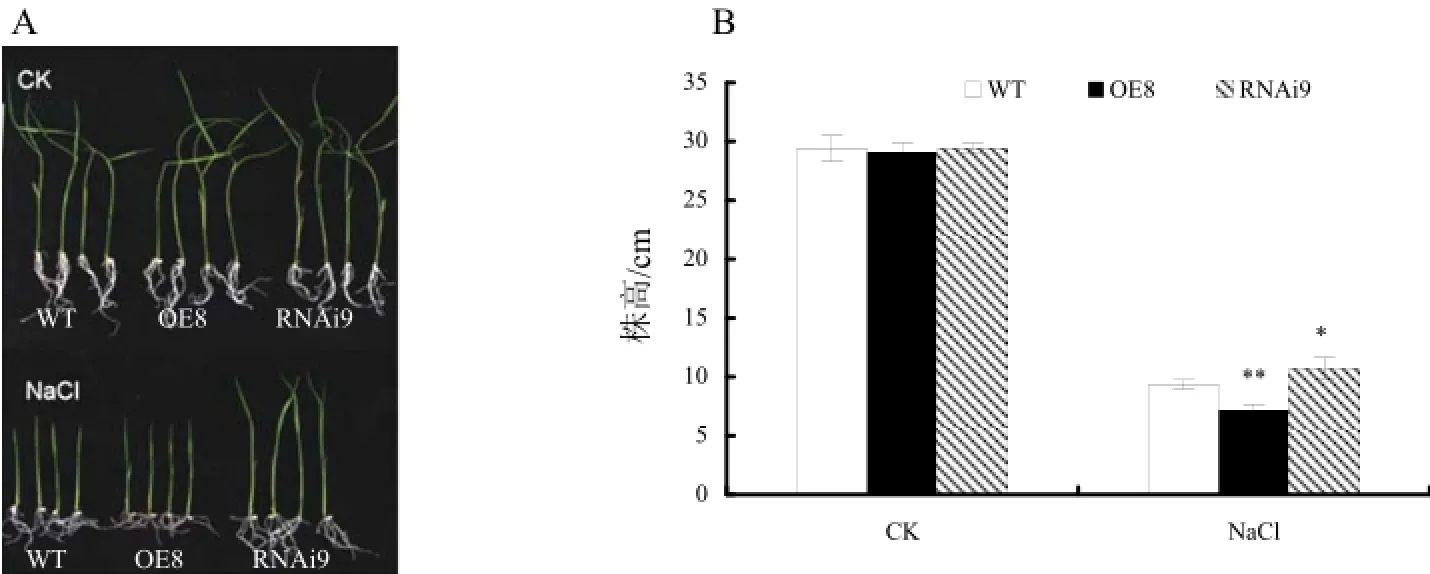
图5 T1代NRRB转基因植株的耐盐性分析Fig. 5 Analysis of salinity tolerance of the T1 NRRB transgenic plants
A. 正常情况和高盐胁迫下生长10 d的野生型和NRRB转基因植株的表型;B. 对应的株高。“*”和“**”分别表示转基因和野生型植株之间差异显著(P<0.05)和极显著(P<0.01),图6同。
2.5T1代NRRB基因超量表达和抑制表达转基因植株耐旱性分析
耐旱性实验表明,在PEG胁迫条件下,过量表达转基因水稻幼苗的长势明显高于野生型幼苗(图6:A、B),超量表达转基因幼苗的鲜重显著高于野生型幼苗(图6:C),株高要比对照高出16.8%,差异显著;鲜重差异极显著,高出29.8%。抑制表达转基因植株幼苗长势明显比野生型弱(图6:A),株高较对照低12.1%,鲜重也相应下降26.1%(图6:B、C)。然而,在正常生长条件下,转基因水稻幼苗的表型没有明显变化,相应的生长指标与对照没有显著差异。由此说明,NRRB超量表达转基因植株对模拟干旱胁迫的抗性增强,NRRB抑制表达转基因植株对模拟干旱胁迫的抗性减弱。甘露醇模拟干旱处理结果与PEG 处理表现出一致的变化趋势,过量表达转基因水稻幼苗株高要比对照高出21.1%,鲜重也高出1.4%;而抑制表达转基因植株长势明显比野生型弱,株高较对照低18.4%,鲜重变化不大(图6:D、E、F),进一步证实超量表达NRRB基因可提高水稻抗旱性。
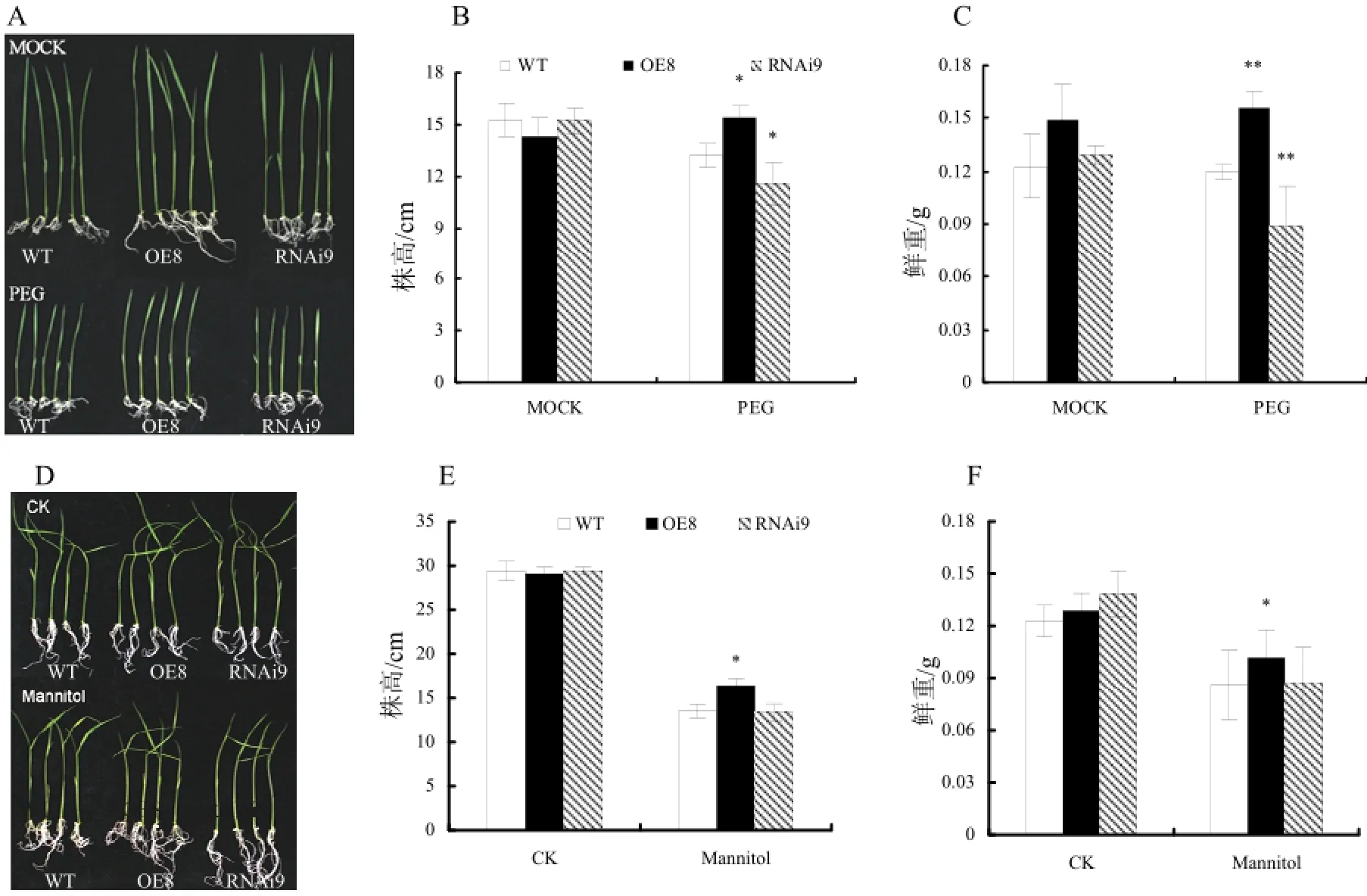
图6 T1代NRRB转基因植株耐旱性分析Fig. 6 Analysis of drought tolerance of the T1 NRRB transgenic plangts
3 讨论
蛋白激酶普遍存在于各种生物体内,植物类受体激酶是植物体内信号分子的重要受体,几乎参与所有的细胞代谢过程,包括生长发育、表达调控和逆境反应等[12—13]。NRRB基因编码一个含900个氨基酸的丝氨酸/苏氨酸蛋白激酶,本研究中通过重叠延伸PCR方法克隆了基因编码区序列,并进一步构建了超量和抑制表达载体,通过农杆菌介导的方法获得了稳定遗传的转基因植株,为后续研究奠定良好基础。
高盐和干旱都会导致植物细胞缺水,打乱细胞的水平衡,还可引起蛋白质等大分子变性,破坏植物细胞内的膜结构等[14—15],是制约植物生长的两个主要胁迫因素,也是全球粮食减产的主要因素[16—17]。在逆境下生长的植物,对非生物胁迫的应答反应涉及到胁迫相关基因的转录表达以及体内代谢的变化,胁迫相关基因、蛋白质及代谢物构成一个复杂的调控网络。本文在对T1代NRRB转基因植株进行逆境胁迫处理时发现,过量表达NRRB的转基因株系表现出耐旱性及盐敏感性。这种对逆境的不同抗性,预示NRRB作为一个蛋白激酶,其功能具有多样性,可以通过不同的调控网络参与到逆境胁迫途径中,但具体通过何种途径调控还需进一步验证。
[1] Hirayama T, Shinozaki K. Research on plant abiotic stress responses in the post-genome era: past, present and future[J]. The Plant Journal, 2010,61: 1041—1052.
[2] Zhu J K. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 2002, 53(1): 247—273.
[3] Vickers C E, Gershenzon J, Lerdau M T, Loreto F. A unified mechanism of action for volatile isoprenoids in plant abiotic stress[J]. Nature Chemical Biology, 2009,5: 283—291.
[4] Vinocur B, Altman A. Recent advances in engineering plant tolerance to abiotic stress: achievements and limitations[J]. Current Opinion in Biotechnology, 2005,16: 123—132.
[5] Zhu J K. Plant salt tolerance[J]. Trends in Plant Science, 2001,6(2): 66—70.
[6] Cattivelli L, Baldi P, Crosatti C, Fonzo N D, Faccioli P, Grossi M, Mastrangelo A M, Pecchioni N, Stanca A M. Chromosome regions and stress-related sequences involved in resistance to abiotic stress in Triticeae[J]. Plant Molecular Biology, 2002,48: 649—665.
[7] Hong Z L, Zhang Z M, Desh P S. Removal of feedback inhibition of Δ1-pyrroline-5-carboxylate synthetase results in increased proline accumulation and protection of plants from osmotic stress[J]. Plant Physiology, 2000,122:1129—1136.
[8] Caplan, Jeffrey, Padmanabhan, Meenu, Dinesh K, Savithramma P. Plant NB-LRR immune receptors: From recognition to transcriptional reprogramming[J]. Cell Host & Microbe, 2008,3(3): 126—135.
[9] Ouyang S Q, Liu Y F, Liu P, Lei G, He S J, Ma B, Zhang W K, Zhang J S, Chen S Y. Receptor-like kinase OsSIK1 improves drought and salt stress tolerance in rice (Oryza sativa) plants[J]. The Plant Journal, 2010,62(2): 316—329.
[10] Horton R M, Cai Z L, Ho S N, Pease L R. Gene splicing by overlap extension: tailor-made genes using the polymerase chain[J]. Biotechniques, 1990,8: 528—535.
[11] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001,25: 402—408.
[12] Morris E R, Walker J C. Receptor- like protein kinases: the keys to response[J]. Current Opinion in Plant Biology, 2003,6: 339—342.
[13] Vij S, Giri J, Dansana P K, Kapoor S, Tyagi A K. The receptor-like cytoplasmic kinase(OsRLCK) gene family in rice: organization, phylogenetic relationship, and expression during development and stress[J]. Molecular Plant, 2008,1: 732—750.
[14] 杨少辉,季静,王罡,宋英今. 盐胁迫对植物影响的研究进展[J]. 分子植物育种, 2006,4(S1): 139—142.
[15] Skirycz A, Inze D. More from less: plant growth under limited water[J]. Current Opinion in Biotechnology, 2010,21(2): 197—203.
[16] 赵雅静,翁伯琦,王义祥,徐国忠. 植物对干旱胁迫的生理生态响应及其研究进展[J]. 福建稻麦科技, 2009,27(2): 45—50.
[17] Osakabe Y, Osakabe K, Shinozaki K, Tran S L. Response of plants to water stress [J]. Frontiers in Plant Science, 2014,5: 86.
Functional Analysis of NRRB in Rice Response to Salt and Drought Stresses
ZHANG Yu-xia, ZHOU Dan, WU Min-liang, LI Yan, YANG Yu-ying, CHEN Liang
(Xiamen Key Laboratory for Plant Genetics, School of Life Sciences, Xiamen University, Xiamen 361102, Fujian China)
To explore the role of NRRB protein in rice resistance to abiotic stress, we amplified gene coding region by overlap extension PCR, constructed over-expression vector, and transformed into rice callus then obtained transgenic lines. The identification results showed that NRRB gene had been integrated into the rice genome, and was overexpressed in positive transgenic plants. Meanwhile,interference expression vector was constructed and transgenic lines were obtained, PCR result confirmed that the expression of NRRB was notably downregulated. The research on drought resistance in the T1 generation of transgenic plants indicated that overexpressing NRRB improved resistance of the transgenic plants to drought, and suppressing its expression enhanced susceptibility of the transgenic plants to drought, indicating that NRRB positively regulates resistance of rice to drought. The results of salt tolerance showed that suppressing NRRB reduced the susceptibility of the transgenic plants to salt.
NRRB; over-expression vector; RNAi-expression vector; transgenic rice
10.3969/j.issn.1009-7791.2015.04.001
Q943.2
A
1009-7791(2015)04-0267-07
2015-10-23
国家重点基础研究发展计划(973)前期研究专项(No. 2011ZX08001-001)
张玉霞,博士研究生,从事植物基因工程研究。E-mail: zyxia2010@126.com
注:陈亮为通讯作者。E-mail: chenlg@xmu.edu.cn
