纳米木质素磺酸钠的制备及其对Zn2+吸附性能研究*
2015-09-28俞家楠刘照斌吕建洲
俞家楠 刘照斌 兰 盾 王 卓 吕建洲
(1.辽宁师范大学生命科学学院,辽宁 大连 116081;2.辽宁师范大学 实验中心,辽宁 大连 116029)
0 引言
金属锌的污染主要来自锌矿开采、冶炼加工、机械制造以及镀锌、仪器仪表、有机物合成和造纸等工业废水排放。锌污染和其他重金属污染相似,会在人体和动植物体内沉积富集,严重影响人体的健康和动植物的生长,从而造成不可估量的危害。因此,现今含锌废水的处理已受到人们的强烈关注[1]。常用水体中重金属的治理方法有化学沉淀法、电解法、吸附法、膜分离法、离子交换法和生物法等[1-2]。
木质素是一种来源丰富的天然高分子材料,是世界上第二位最丰富的有机物。20世纪80年代后期以来,随着木质素化学研究的深入,越来越多的研究表明,各种工业木质素及其改性产物表现出良好的吸附性能,不仅可用于吸附金属阳离子(如Cd2+、Pb2+、Cu2+、Zn2+、Cr3+等),也可用于吸附水中的阴离子、有机物(如酚类、醇类、碳氢化合物、卤化物)和其他物质(如染料、杀虫剂、蛋白质、酶)等[3]。木质素分子中含有甲氧基、羟基和羰基,这些功能基可作为金属离子的吸附位点,经蒸煮后产生更多的酚羟基或磺酸基,这些基团中氧原子上的未共用电子对能与金属离子的外层空电子轨道形成配位键[4],生成螯合物,从而达到吸附金属离子,净化废水的效果。但至今木质素还没有得到很好的开发和利用,尤其木质素的多分散性和无定形结构,使其很难作为材料应用[5]。木质素磺酸盐是一种来源广泛、价格较低且可再生的无毒资源,常作为工业加工过程的表面活性剂和分散剂使用[6]。本研究将木质素磺酸钠制备成纳米试剂,并对其结构进行表征,测定纳米木质素磺酸钠对Zn2+的吸附性能,探究对Zn2+的最佳吸附条件,以期为木质素纳米制剂的深度研究与开发应用作初步探索。
1 材料与方法
1.1 试剂与仪器
木质素磺酸钠:湖北兴银河化工有限公司;氧化锌、丙稀酰胺、三聚磷酸钠(STTP)、氢氧化钠、盐酸等均为分析纯。
电子天平(FA2104B,上海平轩科学仪器有限公司),磁力搅拌器(81-1型,江苏省金坛市环宇科学仪器有限公司),超声波清洗机(FRQ-1030XH,杭州法兰特超声波科技有限公司),场发射扫描电镜(SU8010,Hitachi),紫外分光光度计(常州菲普实验仪器厂),ICP电感耦合等离子体发射光谱仪(SPECTRO BLUE,德国斯派克)。
1.2 纳米制剂的制备
以木质素磺酸钠为原料,对其进行磁力搅拌和超声波处理,并加入一定量丙烯酰胺(AM)、三聚磷酸钠(STPP),制成纳米木质素磺酸钠制剂。分别向3个烧瓶中加入4 g木质素磺酸钠,充分溶解于500 mL去离子水。向第二、三组分别加入一定量,浓度都为1 mg/mL的丙烯酰胺和三聚磷酸钠作为分散剂,在25℃恒温磁力搅拌器上搅拌3~5 min,调节最适酸碱度。再将3组溶液分别放入超声波清洗机中超声震荡一段时间,制得所需纳米制剂。
1.3 纳米木质素磺酸钠制剂的结构表征
1.3.1 初步观察
将制备得到的纳米木质素磺酸钠制剂静置一定时间后,肉眼观察是否有乳光色出现,再用激光笔照射,观察是否出现丁达尔现象。
1.3.2 场发射扫描电子显微镜(SEM)观察
将制备得到的纳米制剂滴加到铝片上,在室温下待干燥后,进行喷金处理。通过扫描电镜观察其形态结构。
1.4 纳米木质素磺酸钠对Zn2+的吸附性测定
1.4.1 静态吸附实验
各取100 mL浓度为4 mg/mL纳米木质素磺酸钠、木质素磺酸钠原剂于锥形瓶中,然后加入40 mL初始浓度为1 mg/mL的硫酸锌标准溶液,经恒温摇床振荡后吸取上清液,利用电感耦合等离子体质谱(ICP)测定上清液中锌离子浓度,计算出木质素磺酸钠原剂及其纳米制剂对Zn2+的吸附量Q以及吸附率R%,计算公式如下:

式中:C0——溶液的初始浓度(mg/mL);
Ce——残余浓度(mg/mL);
V——溶液的体积(mL);
M——所加吸附剂的体积(mL)。
1.4.2 等温吸附实验
取5份100 mL不同浓度的Zn2+溶液,分别加入50 mL的纳米木质磺酸钠,20℃下吸附2 h后,测定溶液中剩余Zn2+的浓度,计算出吸附平衡浓度和吸附量。再根据上述步骤操作,在达到具有最佳吸附活性的温度时,对硫酸锌进行等温吸附实验。本试验主要采用 Langmuir等温式[7]和 Freundlich等温式[8]两种单组分体系模型。
2 结果与分析
2.1 纳米木质素磺酸钠的表征
直接观察到木质素磺酸钠纳米制剂样品有乳白色光亮,且能产生丁达尔效应。在45 k倍场发射电子扫描显微镜下表征纳米木质素磺酸钠制剂,如图1。图1显示木质素磺酸钠与三聚磷酸钠发生交联,呈现明显的球状,粒径均在20~60 nm范围内,且分布均匀。
2.2 纳米木质素磺酸钠对Zn2+的吸附性能
2.2.1 吸附剂的吸附性比较

图1 45k倍电子扫描显微镜下纳米木质素磺酸钠图像
采用木质素磺酸钠原剂、纳米木质素磺酸钠对重金属离子的吸附量的对比实验,结果见表1。由表1可知,纳米木质素磺酸钠的吸附性比原剂要高,纳米制剂对 Zn2+的吸附量为83.05 mg/g,吸附率83.05%;而原剂对 Zn2+的吸附量为 76.35 mg/g,吸附率76.35%。现在普遍认为,纳米粒子的吸附作用主要是由于纳米粒子的表面羟基作用。纳米粒子表面存在的羟基能够和某些阳离子键合,从而达到表观上对金属离子或有机物产生吸附作用;另外,纳米离子具有大的比表面积,也是纳米粒子吸附作用的重要原因[9]。
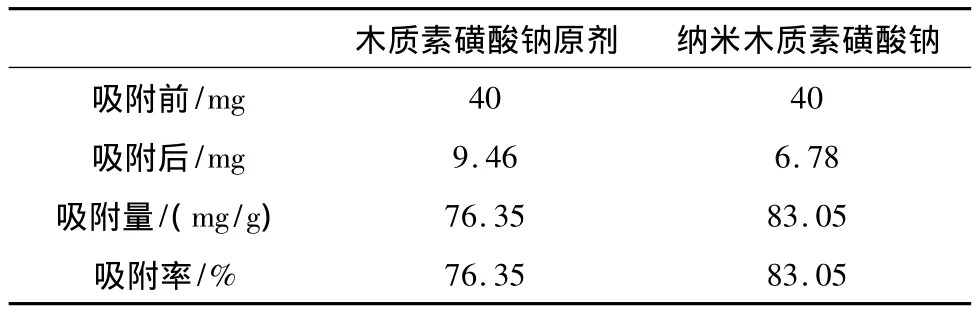
表1 木质素磺酸钠原剂、纳米制剂对Zn2+的吸附量
2.2.2 木质素磺酸钠纳米制剂用量对吸附反应的影响
在室温20℃,中性条件下,向6个烧杯中加入20 mL浓度均为50 mg/mL的Zn2+溶液,用不同体积4 mg/mL的纳米木质素磺酸钠制剂吸附,用电感耦合等离子体质谱(ICP)测定溶液中剩余Zn2+的含量。结果见表2。
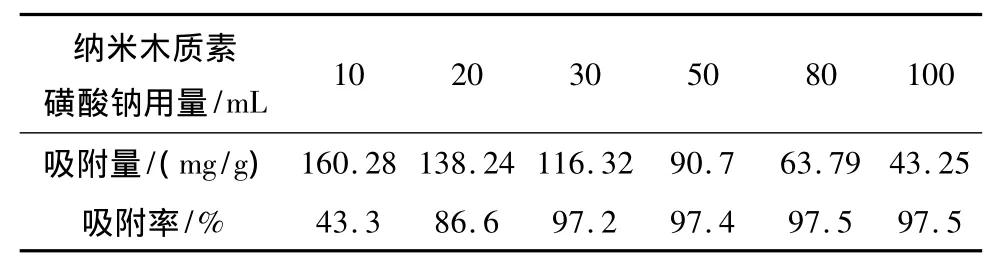
表2 不同木质素磺酸钠纳米制剂用量对Zn2+吸附的影响
由表2可知,在相同反应条件下,吸附剂用量与单位吸附量成反比,但随着吸附剂的增加,吸附能力逐渐增强。当吸附剂投入量为30 mL时,对Zn2+的单位吸附量为116.32 mg/g,去除率为97.2%,此时效果最佳。
2.2.3 不同pH值对木质素磺酸钠纳米制剂吸附性的影响
在相同环境下,测定酸性条件下的吸附情况,结果如表3。由表3看出,纳米木质素磺酸钠吸附量随着pH升高而逐渐增加,在pH=6时达到最大值。pH较小时,由于H+较多,发生电荷排斥,从而抑制其对Zn2+的吸附;随着pH值升高H+减少,此时主要发生离子交换反应,Zn2+与吸附剂上的吸附基团发生络合,生成络合物。因此在pH=6时吸附效果最佳。

表3 不同pH值对纳米木质素磺酸钠吸附容量的影响
2.2.4 不同温度对木质素磺酸钠纳米制剂吸附性的影响
在pH=6条件下,不同温度下测定30 mL,4 mg/mL的纳米木质素磺酸钠溶液吸附Zn2+的吸附量见图2。

图2 不同温度对Zn2+吸附性的影响
由图2可知,在50℃前吸附量随着温度上升而增加,当温度达到50℃时吸附剂有最大吸附活性,随后温度升高,吸附量逐渐下降,活性降低。因此,在50℃,即最大值132.5 mg/g,吸附性能最优。
2.2.5 反应时间对Zn2+吸附性能的影响
在pH=6、50℃条件下,不同吸附时间对纳米木质素磺酸钠溶液吸附Zn2+的影响如图3所示。
根据图3可以看出,吸附时间的增加,吸附越完全。吸附率初始阶段增长快速,在3 h后增加速率开始逐渐减慢,在5 h时达到99.2%,之后吸附率趋于稳定。综合考虑,Zn2+吸附时间5 h较为合理。
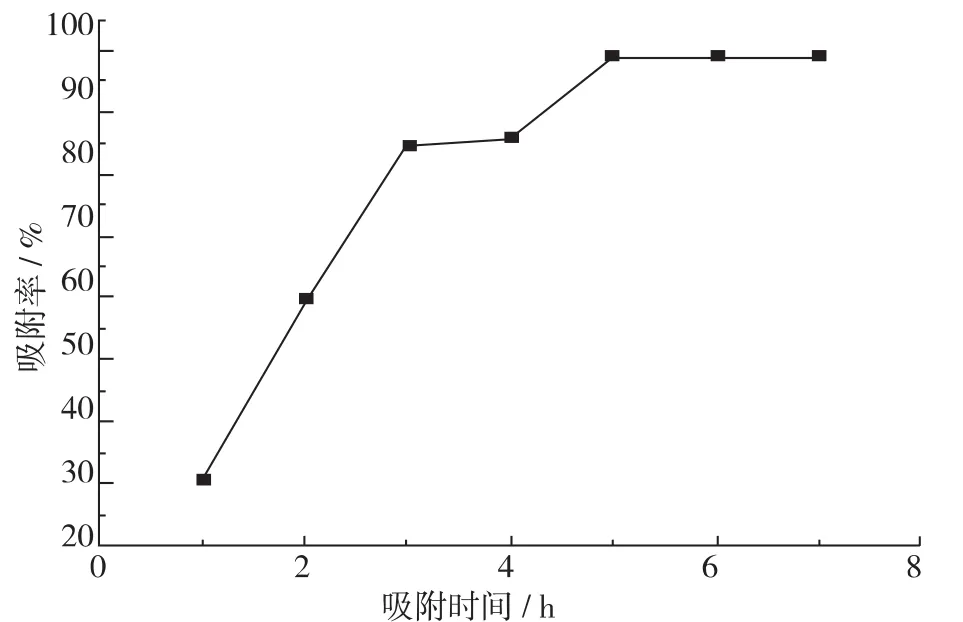
图3 反应时间对木质素磺酸钠纳米制剂吸附Zn2+的影响
2.2.6 吸附等温线
吸附是一个动态平衡过程,在固定的温度条件下,当吸附达到平衡时,颗粒物表面上的吸附量(G)与溶液中溶质的平衡浓度(c)之间的关系,可用吸附等温线来表达[10]。为研究纳米木质素磺酸钠对金属离子吸附的作用机制,对5份不同浓度的Zn2+溶液吸附剂的吸附量和平衡吸附过程进行分析,结果如图4。
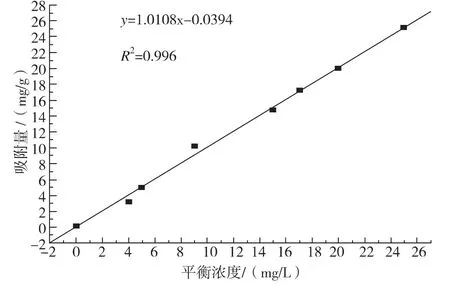
图4 Zn2+的吸附等温线
吸附平衡研究中,Zn2+在纳米木质素磺酸钠上的吸附平衡数据对Langmuir方程的拟合的线性方程:y=1.0351 x+0.0029,R2=0.9954;Freundlich方程的拟合的线性方程:y=1.0263 x+0.0086,R2=0.9973。在此实验条件下,吸附平衡数据均符合Langmuir和 Freundlich方程,且对 Freundlich等温吸附线拟合程度较高,相关性更好,说明木质素磺酸钠的吸附作用更可能是多层吸附。并由此计算出纳米木质素磺酸钠对Zn2+的最大吸附量为129.5 mg/g,理论值与实验测得的真实值132.5 mg/g接近。
3 结论
制备纳米木质素磺酸钠制剂最佳制备条件:分散剂为三聚磷酸钠(STPP),pH值中性。通过电镜表征,制得的纳米微粒呈现均匀分布的规则球状,粒径大小在20~60 nm范围内。
相同条件下,纳米木质素磺酸钠的吸附性比木质素磺酸钠原剂高。纳米制剂、原剂对Zn2+的吸附量分别为 89.45 mg/g、79.35 mg/g,吸附率分别为89.45%、79.35%。
比较木质素磺酸钠纳米制剂在相同条件下对锌离子的吸附性能,确定最佳反应条件为:pH=6,温度50℃,吸附时间5 h时,30 mL浓度为4 mg/mL的木质素磺酸钠纳米制剂对Zn2+的吸附率最大。纳米制剂对Zn2+的Langmuir等温吸附线和Freundlich等温吸附线的拟合程度均良好,且Freundlich等温吸附线拟合程度更高,说明木质素磺酸钠吸附反应是多层吸附可能性更大。在实际吸附体系中,往往存在多种吸附质,在研究中,通过应用单组分吸附模型,得到多组分体系的吸附模型[11]。因此仍有待进一步研究。
由此可见,纳米木质素磺酸钠作为一种吸附剂能够有效吸附环境中的锌离子,对纳米材料的发展和环境重金属污染治理应用有广阔的研究前景。
[1]SHETA A S,FALATAH A M.Sorption characteristics of zinc and iron by natural zeoliteand bentonite[J].Micmpomus and Mesopomus Materials,2003,61(1 -3):127 -136.
[2]崔志新,任庆凯,艾胜书.重金属废水处理及回收的研究进展[J].环境科学与技术,2010,33(12F):375 -377.
[3]范娟,詹怀宇,刘明华.木质素基吸附材料的研究进展[J].中国造纸学报,2004,19(2):181 -187.
[4]何新建,谢建军,李晟,等.木质素及其衍生物对重金属离子吸附性能研究进展[J].广东化工,2009,36(10):81 -83.
[5]王春海,艾青,赵银风,等.木质素磺酸钠一壳聚糖电解质对铜离子的吸附性能[J].林产化学与工业,2012,32(1):29-34.
[6]王哲,李忠正,高鸿海.改性木质素磺酸钠的混凝土减水性能及其结构特征[J].中华纸业,2007,28(11):14 -17.
[7]Langmuir I.The constitution and fundamental properties of so lids and liquids[J].J Am Chem Soc,1916,38(11):2267.
[8]Bellot J C,Condoret J S.Modelling of liquid chromatography equilibria[J].Process Biochem,1993,28(2):365 -376.
[9]喻德忠,蔡汝秀,潘祖亭.纳米技术在处理环境中无机污染物的研究现状[J].分析科学学报,2003,19(4):389 -394.
[10]戴桂树.环境化学[M].北京:高等教育出版社,2006:170-214.
[11]相波,李义久.吸附等温式在重金属吸附性能研究中的应用[J].有色金属,2007(01):77-80.
