不同配比冻存液对兔脂肪干细胞液氮冻存效果的研究
2015-09-26姚永明张泽敏吴彩凤牛常英杨彪炳潍坊医学院山东潍坊6053费县人民医院山东临沂73400
姚永明,张 帆,张泽敏,阎 贺,吴彩凤,胡 飞,牛常英,杨彪炳(.潍坊医学院山东潍坊6053;.费县人民医院山东临沂73400)
·基础研究·
不同配比冻存液对兔脂肪干细胞液氮冻存效果的研究
姚永明1,张帆2,张泽敏1,阎贺1,吴彩凤1,胡飞1,牛常英1,杨彪炳1
(1.潍坊医学院山东潍坊261053;2.费县人民医院山东临沂273400)
目的:探究不同浓度配比冻存液对脂肪干细胞(Adipose-derived Stem Cells,ADSCs)冻存复苏后存活率及增殖活性的影响。方法:无菌条件下取新西兰大白兔的脂肪组织,体外分离、培养ADSCs并传代至第3代,行免疫细胞化学染色对其表面标志物进行鉴定,同时对其行成软骨及成表皮细胞诱导以证实其多项分化能力。将第3代ADSCs置于液氮(-196℃)中冻存,根据冻存液中培养基(DMEM)、胎牛血清(Fetal bovine serum,FBS)及二甲基亚砜(Dimethyl sulfoxide,DMSO)的配比不同分为8组:①含不同浓度FBS配比分组:A组(70%DMEM+20%FBS+10%DMSO)、B组(60%DMEM+30%FBS+10%DMSO)、C组(50%DMEM+40%FBS+10%DMSO)、D组(含有40%DMEM+50%FBS+10%DMSO);②含不同浓度DMSO配比分组:E组(55%DMEM+40%FBS+5%DMSO)、F组(50%DMEM+40%FBS+10%DMSO)、G组(45%DMEM+40%FBS+15%DMSO)、H组(40%DMEM+40%FBS+20%DMSO)。细胞冻存三个月后,对其进行复苏并观察细胞形态学变化;通过细胞计数计算细胞存活率;采用MTT法绘制复苏后细胞生长曲线,以测定其生长增殖情况。结果:细胞复苏后,通过细胞计数计算结果显示C、D组存活率明显高于A、B组(P<0.05),E、F、G、H四组之间有统计学意义(P<0.01);MTT法结果显示C、D、F组的增殖曲线与未冻存组无明显差异(P>0.05)。结论:从兔脂肪组织中成功分离出了ADSCs,并且能在体外培养过程中稳定生长,快速增殖;ADSCs冻存液比例选择以DMEM:FBS:DMSO=5:4∶1的冻存效果最好。
脂肪来源干细胞;冻存液;液氮
ADSCs是从脂肪组织中提取的干细胞,具有取材方便,来源丰富,体外增殖能力强等优点,在组织个过程中得到广泛应用。然而在体外培养过程中,随着传代次数的增加,细胞的生物学特性会发生变化,从而在一定程度上影响了ADSCs的生物活性。对于采用液氮(-196℃)进行细胞冻存,理论上是没有时间限制的,但实际上细胞冻存的时间越长,复苏后存活率会越低。因此,我们需要找到一种有效减少细胞冻存凋亡的方法,使其活性最大程度的接近正常水平。本实验以DMEM作为基础培养液,加入保护剂DMSO以及FBS作为冻存液,调整冻存液中三者配比比例,对不同配比冻存液复苏后ADSCs的生物学特性进行观察,进而筛选出适合ADSCs的最佳配比冻存液,对今后ADSCs不管在科研领域还是在临床应用方面起到一定的指导性作用。
1 材料和方法
1.1材料
2~3个月龄新西兰大白兔(购自潍坊医学院动物中心),体重2.5~3.0kg,DMEM培养基(美国HyClone有限公司),胎牛血清(杭州四季青生物工程材料有限公司),DMSO液(上海生工生物工程公司),MTT液(北京Solarbio公司),台盼蓝染料(北京Solarbio科技有限公司)
1.2方法
1.2.1 ADSCs的分离、培养及鉴定:无菌条件下取新西兰大白兔的新鲜脂肪,在盛有PBS缓冲液的无菌盘中反复冲洗,用眼科剪剪碎至糊状,1 200r/min离心5min,加入Ⅰ型胶原酶后置于1 900r/min,37℃摇床消化50min,经200目筛网过滤后,加入DMEM培养液终止消化、离心,弃上清,留贴壁细胞;用DMEM培养液重悬并接种培养瓶中,在37℃、5%CO2的培养箱中培养,观察细胞生长形态特征。用免疫荧光法检测ADSCs表面特异性标记物CD34、CD44、CD29及CDl06的表达情况。通过软骨诱导液诱导其向软骨方向分化,利用甲苯胺蓝染色法检测结果,对其行表皮细胞诱导实验,行免疫荧光检测其CK19的表达。
1.2.2 ADSCs的分组与冻存方法:①含不同浓度FBS配比分组:A组(70%DMEM+20%FBS+10%DMSO)、B组(60%DMEM+30%FBS+10%DMSO)、C组(50%DMEM+40% FBS+10%DMSO)、D组(含有40%DMEM培养基+50%FBS+ 10%DMSO);②含不同浓度DMSO配比分组:E组(55% DMEM+40%FBS+5%DMSO)、F组(50%DMEM+40%FBS+10% DMSO)、G组(45%DMEM+40%FBS+15%DMSO)、H组(40% DMEM+40%FBS+20%DMSO)。取第3代的ADSCs,用0.25%胰酶对其进行消化,离心后,收集细胞,向其中加入不同比例组成的冻存液,细胞密度约为5× 106/ml,吹打混匀后分装入冻存管内,每管1ml。先在4℃冰箱中放置30min;然后放入-20℃的冰箱中冷冻60min;接着在-80℃超低温冰箱中过夜冷冻;之后转入液氮中保存。
1.2.3 ADSCs的复苏:冻存3个月后,从液氮中取出冻存的细胞,迅速放入37℃水浴箱内,轻轻振荡,使冻存管中的固体快速融化。在超净工作台中用滴管将细胞移到离心管中,1 200r/min离心10min,去除冻存液,加入L-DMEM完全培养液(DMEM中加入10%胎牛血清,1ml谷氨酰胺,0.05g/L L-抗坏血酸,1%青链霉素混合液),放置于培养箱中培养。
1.2.4复苏后ADSCs的测定
1.2.4.1形态学观察:倒置显微镜下观察细胞的生长、增殖情况及细胞形态学的特征并且进行拍照记录。
1.2.4.2细胞计数和细胞存活率的统计:ADSCs悬液与0.4%的台盼蓝染液按4:1的比例混匀,室温条件下静置约3 min,采用计数板统计细胞的密度和细胞的存活率,其中被染成蓝色的为死细胞,而活细胞不被染色。
磨河水库工程水土保持防治工程实施的投资为242.86万元,较水土保持方案减少42.07万元,其中工程措施投资减少35.93万元,植物措施投资减少757万元,临时工程投资减少1.57万元。
细胞的密度(细胞个数/ml)=(四个大格的细胞的总的数目/4)×104×细胞被稀释的倍数
细胞的存活率(%)=[(细胞总的数目-死亡的细胞的数目)/细胞的总的数目]×100%
1.2.4.3 MTT生长曲线的测定:取复苏后的细胞加入L-DMEM中培养,将处于对数生长期的细胞消化成细胞悬液,调整细胞密度为1×104个/ml后分别接种在96孔培养板中,每孔细胞悬液量为100μl,总共接种7个培养板。每块培养板分十组:1组~8组分别为不同比例冻存液冻存的实验组;第9组为未冻存过的对照组;第10组为单纯加培养液不加细胞的空白组。另外每组增设3个复孔,边缘孔用无菌的PBS缓冲液填充。放入培养箱中静置并且培养。从次日起每天同一时间取出一块培养板测OD值。具体方法为:向每个含有细胞的孔内加入20μl的浓度为5mg/ml的MTT,置于培养箱之中孵育4h后,吸出孔内液体,终止培养。然后每孔加入150μl的DMSO之后,将其置摇床上振荡10min,使结晶物充分的溶解之后放置到酶联免疫检测仪之上,选在OD值为490nm处测量各个孔的吸光值。1.2.4.4统计学分析:实验数据以均数±标准差(±s)的形式表示,采用SPSS17.0软件对ADSCs的存活率的数据进行单因素方差分析(One-Way-ANOVA),P<0.05为差异有统计学意义。

图1 倒置显微镜下观察ADSCs形态
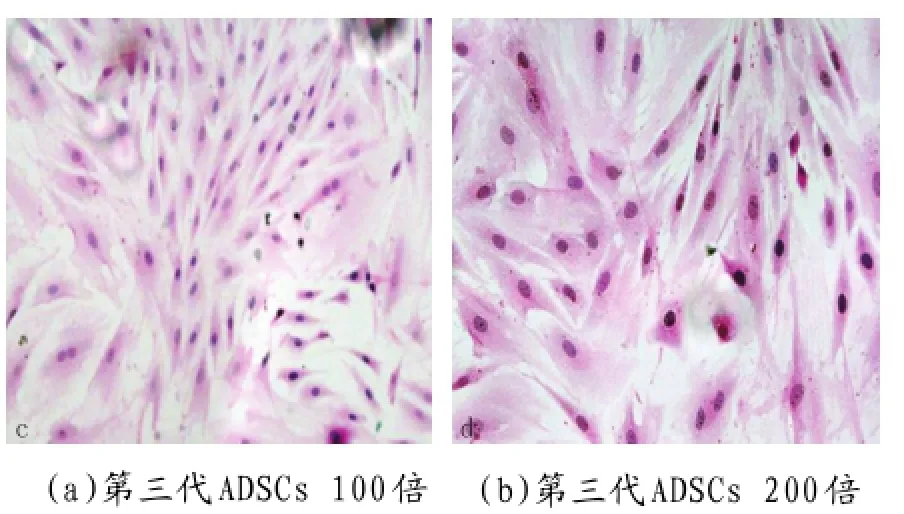
图2 显微镜下观察第3代ADSCs

图3 细胞免疫荧光染色观察(400×)
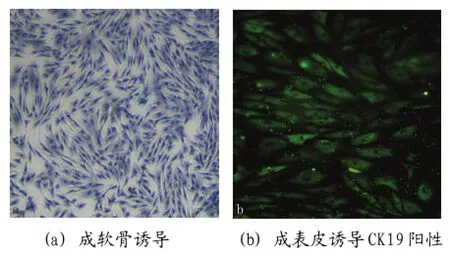
图4 第3代ADSCs分化能力鉴定
2 结果
2.1脂肪干细胞的鉴定
2.1.1倒置显微镜下观察细胞的形态:刚消化分离的的原代ADSCs细胞呈透亮圆形,与少量残留的红细胞、结缔组织碎片等共同漂浮于培养液中。4h后逐渐沉降贴壁,细胞体积逐渐增大,呈短梭形或小多角形,24h后存活的细胞基本贴壁,3~4d细胞开始充分的伸展,形成鱼群样聚集。7d左右细胞铺满瓶底(见图1)。传至第3代,HE染色显示细胞形态均匀,呈长梭形(见图2)。
2.1.2细胞免疫荧光表面抗原及多向分化能力鉴定:用免疫荧光法检测的结果是,ADSCs细胞表面的抗原CD29以及CD44呈现阳性表达,而CD34以及CD106呈现阴性表达(见图3);ADSCs经EGF向表皮细胞诱导,检测有CK19呈阳性表达;经软骨诱导液诱导ADSCs,显示胞内基质均匀蓝染(见图4)。
2.2冻存后复苏ADSCs的检测
2.2.1复苏后ADSCs细胞形态学及生长状况:显微镜下观察:冻存细胞复苏后呈圆形悬浮于培养液中,接种2h后开始有少量细胞贴壁,24h后大部分细胞均已贴壁。细胞形态由圆形逐渐向梭形、多角形转化。未冻存细胞在接种10min开始贴壁,2h后逐渐伸展呈梭形,多角形。
表1 不同比例冻存液下复苏后的兔ADSCs复苏率的比较(±s,%)

表1 不同比例冻存液下复苏后的兔ADSCs复苏率的比较(±s,%)
组别不同比例冻存液复苏率A组70%DMEM+20%FBS+10%DMSO35.00±0.02 B组60%DMEM+30%FBS+10%DMSO40.39±0.02 C组50%DMEM+40%FBS+10%DMSO73.34±0.07 D组40%DMEM+50%FBS+10%DMSO71.82±0.15 E组55%DMEM+40%FBS+5%DMSO18.35±0.06 F组50%DMEM+40%FBS+10%DMSO75.03±0.11 G组45%DMEM+40%FBS+15%DMSO56.68±0.06 H组40%DMEM+40%FBS+20%DMSO38.35±0.08
2.2.3生长曲线测定:复苏后,脂肪干细胞生长曲线图大致呈S形,在第1~2天细胞均处于停滞期,但均比未冻存组的开始值低,从第3天开始细胞进入迅速生长期,第5天可达到增殖顶峰。实验结果均与以往研究相一致[1]。其中冻存组C、D、F组的增殖曲线与未冻存组无明显差异,F组更加接近未冻存组,而G组的增殖曲线与未冻存组相比稍低。而其他的组别的增殖曲线与未冻存组相比较低(见图5)。
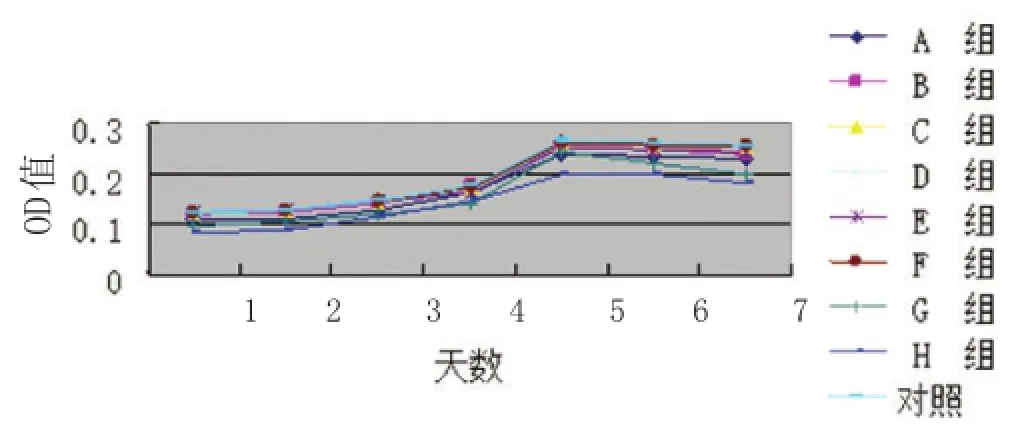
图5 复苏后ADSCs生长曲线
3 讨论
ADSCs来源于胚胎期的中胚层,具有向中胚层的组织和神经外胚层的组织等分化的潜力。可以在特定条件下分化为脂肪、骨、软骨、肌肉、血管内皮、神经前体细胞及表皮细胞等多种组织细胞[2-3]。由于体外需要ADSCs的量较大,所以我们需要进行体外分离纯化并进行大量的增殖。但是ADSCs在体外长期培养的过程中生物学特性容易发生改变,从而失去其多分化的潜能。因此及时进行ADSCs的冻存不仅可以减少这种情况还可以节省时间和减少材料的消耗。细胞的冻存复苏后的效果、成活率以及生长状态直接影响后续各项生物学实验的结果。而细胞的来源、冻存前细胞的活力、冻存时细胞的代数、冻存的密度、保护剂的选择和浓度、冻存液中FBS的浓度、降温以及复温的程序都会直接影响到冻存效果[4]。所以冻存成功的关键是选择合适的冻存保护剂、方法、合适的冻存温度以及冻存时细胞的浓度等[5-6]。
经研究表明冻存液对各类细胞都存在破坏作用。细胞在冻存的过程中要经历液相固化以及水分子通过细胞膜的渗透,在这个过程中,会产生融合热以及溶液的冰晶,这些东西会直接导致细胞的大量死亡[7]。而冻存时细胞的生长、防冻剂的细胞的毒性损害和高渗透压性也将会对细胞造成到伤害[8]。鉴于降温速度太快,细胞内外同时形成冰晶,将导致细胞损伤,甚至是死亡;而复温速率太慢,细胞内容易形成冰晶,导致细胞的损伤,甚至是死亡,我们选择慢冻快溶作为冻存复苏的方式,这一做法明显地降低了冻存剂对细胞的损害作用。
冷冻保护剂是一类可以通过稀释溶液中溶质的浓度,减少冷冻和解冻过程中对细胞造成损伤的化合物[9],发挥作用的机制为在降温过程中,保护剂透过胞膜进入细胞,进而降低细胞皱缩的程度[10]。DMSO是一种分子质量小,溶解度大,具有强穿透细胞膜能力的非电解质,并能降低冰点,从而减少其对细胞的毒性作用。研究表明DMSO本身是一种有毒化学试剂,高浓度时对细胞具有一定的毒性[11]。但提前将DMSO4℃冰箱中预冷,可降低其对细胞的毒性[12]。所以在本实验采用低温条件下加入DMSO作为保护剂的方法。
从本研究中可以分析得出,当DMSO浓度较低(5%)时,不能有效阻止细胞内形成冰晶,从而在冻存过程中对细胞产生了极大的损伤。当DMSO浓度增到20%甚至以上时,不利于细胞复苏后的成活以及细胞活性的恢复。所以应该严格控制DMSO的冻存浓度。本研究结果表明浓度为10%DMSO冻存液对ADSCs的保护效果较好。FBS本身对细胞就具有保护作用,可以用来中和DMSO对细胞的毒性,所以适当提高其浓度对冻存细胞有保护作用。研究表明:冻存剂中FBS浓度是40%、50%时,ADSCs的冻存复苏效率最高,均显著高于FBS含量较低的实验组,表现为:当FBS含量低于40%时,FBS浓度越高,细胞复苏率也越高。当FBS浓度高于40%时,FBS浓度的变化对ADSCs复苏效果的无明显影响。因此,使用含有40%FBS的冻存液即可满足对ADSCs冻存复苏的要求。而选择40%FBS的另外一个原因是考虑到虽然降温冻存过程使细胞处于低代谢状态,但仍不能完全避免在降温和复苏开始阶段时,会有部分干细胞因血清等成分的存在而自主分化,从而失去多能性[13]。所以ADSCs的冻存选择含40%FBS的冻存液较好。
本实验从经济、合理性考虑,建立了一种较为适合ADSCs短期冻存方法,为解决ADSCs的储备、材料和时间的节省提供了有效的方法。而对于更长时间的冻存复苏率以及对于细胞活力的影响还需要进一步研究证实。
[1]安荣泽,赵俊延,王兆杰.脂肪干细胞与骨髓间充质干细胞成软骨能力的比较[J].中国组织工程研究,2013,17(32): 5793-5798.
[2]StremBM,HicokKC,ZhuM,etal.Multipotential differentiation of adipose tissue-derived stem cells[J].Keio J Med,2005,54(3):132-41.
[3]Zuk PA,Zhu M,Mizuno H,et al.Hedrick MH:Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7:211-228.
[4]Koebe HG,Muhling B,Deglmann CJ,et al.Cryopreserved porcine hepatocyte cultures[J].Chem Biol Interact,1999,121: 99-115.
[5]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,1992:79-82.
[6]Lengheden A.Influence of pH and calcium on growth and attachment of human fibroblasts in vitro[J].Scand J Dent Res,1994,102(2):130-136.
[7]Odriozola J,Ramos P,Villalon L,et al.An amplified scope of concentrationsandDimethylSulphoxide(DMSO)percentages for the cryopreservation of Peripheral Blood stem cells(PBSC)[J].BoneMarrow Transp lantation,2000,25(1):S253-261.
[8]华泽钊,任禾盛.低温生物学技术[M].北京:科学出版社,1994:149-50.
[9]郭娟.牛卵母细胞玻璃化冷冻保存的研究[D].新疆乌鲁木齐:新疆农业大学,2009.
[10]Woods EJ,Zieger MA,Gao D Y,et al.Equations for obtaining melting points for the ternary system ethylene glycol/sodiumchloride/waterandtheirapplicationto cryperservation[J].Cryobiology,1999,38(4):403-407.
[11]Newton I,Charbord P,Schaal JP,et al.Toward cord blood banking:density-separation and cryopreservation of cord blood progenitors[J].Exp Hematol,1993,21:671-674.
[12]王亮,刘婷婷,彭涛,等.荷斯坦奶牛耳组织成纤维细胞分离培养及冷冻保存方法研究[J].黑龙江畜牧兽医,2006,5: 9-12.
[13]Zhao J,Hao HN,Thomas RL,et al.An efficient method for the cryopreservation of fetal human liver hematopoeitor progenitor cells[J].Stem Cells,2001,19:212-218.
编辑/张惠娟
Effects of different combinations cryopreservation of rabbit adipose stem cells were frozen in liquid nitrogen effects
YAO Yong-ming1,ZHANG Fan2,ZAHNG Ze-min1,YAN He1,WU Cai-feng1,HU Fei1,NIU Chang-ying1,YANG Biao-bing1
(1.WeiFang Medical Uniwersity,Weifang 261053,Shandong,China 2.Feixian People's Hospital,Linyi 273400,Shandong,China)
Objective To investigate the ability to maintain the proliferation of Adipose-derived Stem Cells(ADSCs)in different concentration ratio of frozen liquid.MethodsFat isolated from healthy rabbits was isolated,cultured and then generated in vitro for 3 passage into the ADSCs,P3 ADSCs were identified by detecting of adipose stem cell surface markers expression.The third passage cells were preserved in liquid nitrogen for 3 months,ADSCs were divided into eight group in order to cryopreservation:groupA:70%DMEM+20%FBS+10%DMSO,groupB:60%DMEM+30%FBS+10%DMSO,groupC:50%DMEM+40%FBS+10%DMSO,groupD:40%DMEM+50%FBS+10%DMSO,groupE:55% DMEM+40%FBS+5%DMSO,groupF:50%DMEM+40%FBS+10%DMSO,groupG:45%DMEM+40%FBS+ 15%DMSO,groupH:40%DMEM+40%FBS+20%DMSO.After cryopreservation three months,observed the cells after recovering,and compared with the group not frozen.The growth curves of the cryopreserved cells were analyzed by MTT assay.Results The results of immunocytochemistryshowed ADSCs were negative for CD34,CD106 and positive for CD29,CD44.Trypan blue staining and microscopic counting of results showed that Group C and Group D had higher cell survival rate than Group A and Group B with significant difference(P<0.05).There was significant difference between group E,F,G,H(P<0.01).The growth curve showed that there was no significant difference in growth rate of ADSCs between Group C,D,F and control group(P>0.05).ConclusionAn experiment successfully separated from the fat rabbit adipose tissue stem cells cultured in vitro with a stable growth process.Adipose stem cells cryopreserved in vitro,frozen liquid ratio selected to DMEM:FBS: DMSO=5:4:1 freezing with the best results.
adipose-derived stem cells;Cryoprotectants;liquid nitrogen
Q813.1
A
1008-6455(2015)09-0029-05
潍坊医学院科技创新研究基金资助项目(K11TSl006)
杨彪炳,潍坊医学院整形研究所副所长,教授,主任医师,硕士研究生导师,美国加州大学交流学者,中华医学会潍坊整形美容学会副主任
2015-03-21
2015-05-13
