内蒙古中东部地区草乌乌头碱类含量分析△
2015-09-25锡林通嘎拉嘎那生桑
锡林通嘎拉嘎,那生桑
(1.内蒙古自治区人民医院 药学处,呼和浩特 010017;2.内蒙古医科大学,呼和浩特 010110)
·基础研究·
内蒙古中东部地区草乌乌头碱类含量分析△
锡林通嘎拉嘎1,那生桑2*
(1.内蒙古自治区人民医院 药学处,呼和浩特 010017;2.内蒙古医科大学,呼和浩特 010110)
目的:对内蒙古中东部地区生长的草乌药材有效成分乌头碱类的含量进行分析比较。方法:采用高效液相色谱法,Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相A:乙腈-四氢呋喃(25∶15),B:0.1 mol·L-1乙酸铵溶液(每1000 mL加0.5mL冰乙酸);流速:1.0 mL·min-1;检测波长:235 nm;进样量:10 μL;梯度洗脱VA:1~48 min=15~26,48~60 min=26~35,测定草乌有效成分乌头碱类的含量进行比较。结果:内蒙古中东部地区草乌总酯型乌头碱质量分数分别为10.899、7.841、12.729、8.399、8.625、8.461、7.515、15.283 mg·g-1,总乌头原碱质量分数分别为0.521、0.390、0.514、0.545、0.114、0.112、0.115、0.823 mg·g-1。结论:内蒙古中东部地区草乌有效成分含量差异较大,建立蒙药草乌统一标准需要进一步研究分析。
草乌;有效成分;乌头碱;内蒙古中东部地区
草乌是我国广泛使用的毒性药材,也是最常用的传统蒙药,用途较广。从国内外文献可以了解其基源、化学成分、炮制、药理临床的研究概况,但尚缺乏系统的研究,而且药材质量不稳定,品种混杂,这些都制约了蒙药产业化水平和发展。产地较多、药材质量不一致,给用药带来了安全隐患,且各地采集加工和炮制工艺变异很大,缺乏专属性强的质量控制标准。本文对内蒙古中东部地区草乌有效成分乌头碱类的含量进行检测,为今后蒙医临床用药及进一步研究草乌药材资源提供参考。
1 仪器与试药
1.1 仪器
KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);ALH-6000-U艾科浦超纯水机(重庆颐洋企业发展有限公司);岛津LC-20A 高效液相色谱仪:P-20A高压输液泵、SPD-20A紫外检测器、CLASS-VP工作站;AB135-S电子天平(瑞士)。
1.2 试药
苯甲酰新乌头原碱、苯甲酰次乌头原碱、苯甲酰乌头原碱、新乌头碱、乌头碱、次乌头碱(中国食品药品鉴定研究院,批号分别为111795-200901,111796-201002,111794-200901,110799-200404,110720-201111,110798-200404);甲醇、乙腈、冰乙酸、四氢呋喃、乙酸铵(天津市精细化工研究所,批号分别为MH-2311,20111214,20110527,20120312,20120312);纯净水;其余试剂均为分析纯。
草乌药材采集于内蒙古中东部地区(草乌的产地及采集时间见表1)。由内蒙古医科大学蒙医药研究院那生桑教授鉴定为蒙药草乌。
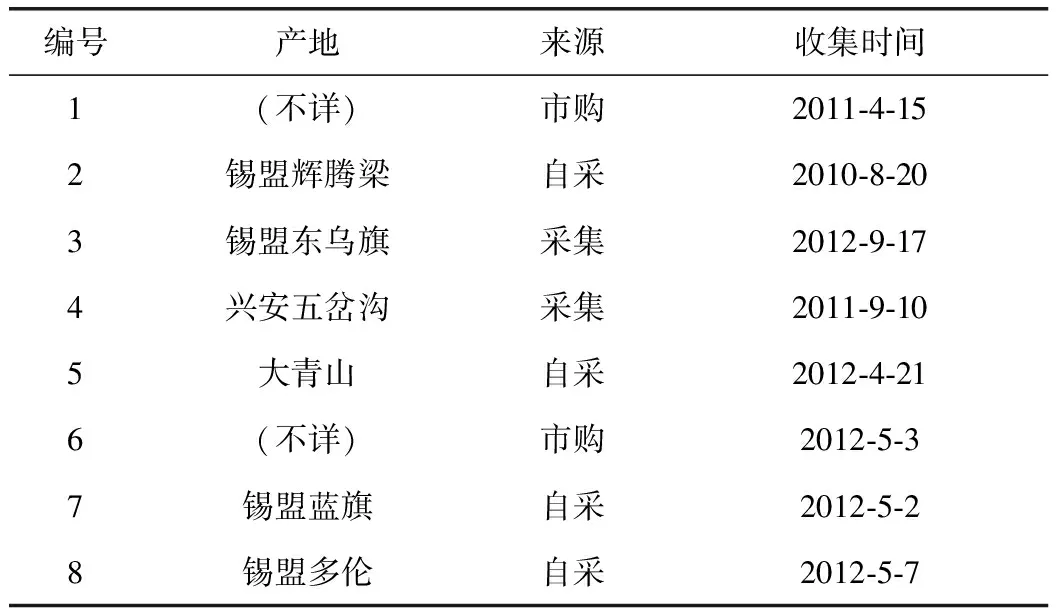
表1 草乌来源
2 方法与结果
2.1 混合对照品溶液的制备
苯甲酰新乌头原碱、苯甲酰乌头原碱、新乌头碱、乌头碱、次乌头碱依次称取1.32、0.58、6.98、3.78、3.69 mg,置同一个25 mL容量瓶,10%盐酸水溶液溶解,并定容至刻度,待用。
2.2 供试品溶液的制备
取样品(批号:20110910)粉末(过三号筛)约2 g,精密称定,置具塞锥形瓶中。加氨试液3 mL,精密加入异丙醇-乙酸乙酯(1∶1)混合液50 mL,称定重量,超声处理30 min,放冷,再称定重量,用异丙醇-乙酸乙酯(1∶1)混合液补足减失的重量,摇匀,滤过。精密量取续滤液25 mL,40 ℃以下减压回收溶剂至干,残渣精密加入10%盐酸水3 mL,溶解,摇匀,滤过,取续滤液,即得。
2.3 阴性供试品溶液制备
具塞锥形瓶中,加氨试液3 mL,精密加入异丙醇-乙酸乙酯(1∶1)混合液50 mL,称定重量,超声处理30 min,放冷,再称定重量,用异丙醇-乙酸乙酯(1∶1)混合液补足减失的重量,摇匀,滤过。精密量取续滤液25 mL,40 ℃以下减压回收溶剂至干,残渣精密加入10%盐酸水3 mL溶解,摇匀,滤过,取续滤液,即得。
2.4 色谱条件
色谱柱:Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相A:乙腈-四氢呋喃(25∶15),B:0.1 mol·L-1乙酸铵溶液(每1000 mL加0.5 mL冰乙酸);流速:1.0 mL·min-1;检测波长:235 nm;进样量:10 μL;梯度洗脱:VA:1 min~48 min=15~26,48 min~60 min=26~35。
2.5 系统适用性试验
分别取乌头碱混合对照品溶液、供试品溶液及阴性供试品溶液各10 μL,注入高效液相色谱仪,结果表明阴性对照无干扰。见图1。

1.苯甲酰新乌头原碱; 2.苯甲酰乌头原碱;3.苯甲酰次乌头原碱;4.次乌头碱;5.新乌头碱;6.乌头碱;A.混合对照品溶液;B.供试品溶液;C.阴性对照。图1 专属性高效液相色谱图
2.6 线性关系考察
精密吸取混合对照品溶液2、4、6、8、10、12、16 μL,依次注入液相色谱仪,测得峰面积。以峰面积值为纵坐标,乌头碱、次乌头碱、新乌头碱、苯甲酰新乌头原碱、苯甲酰乌头原碱进样量(mg·μL-1)为横坐标,绘制标准曲线,计算回归方程,乌头碱:Y=1.177×106X+1.527×105,线性范围0.604 8~2.419 2,r=0.999 8;新乌头碱:Y=1.225×106X+3.021×104,线性范围1.116 8~4.467 2,r=0.999 7;次乌头碱:Y=1.279×106X+1.021×104,线性范围0.590 4~2.361 6,r=0.999 7;苯甲酰乌头原碱:Y=1.991×106X-6.425×103,线性范围0.047 2~0.283 2,r=0.999 6;苯甲酰新乌头原碱:Y=1.160×106X-5.71 2×103,线性范围0.105 6~0.633 6,r=0.999 3。由此可见,对照品进样量与峰面积值呈良好的线性关系。
2.7 精密度试验
取供试品溶液10 μL,按2.4色谱条件连续进样6次,测定峰面积,结果5种被测化合物的RSD均在1.6%~2.9%之间,表明精密度良好。
2.8 稳定性试验
取供试品溶液,按2.4色谱条件,分别在0、2、4、6、8、12 h测定,5种被测化合物的RSD均在1.6%~3.3%之间,表明供试品溶液在12 h内稳定。
2.9 重复性试验
取供试品溶液6份,按2.2项下方法制备,按2.4色谱条件测定,5种被测化合物的RSD均在0.75%~2.23%之间,表明该方法重复性良好。
2.10 加样回收率试验
精密称取2.9项下已测知含量的样品粉末1 g,共6份,分别精密加入相应量的各乌头碱类对照品,按2.2项下方法制备供试品溶液,并按2.4项下色谱条件进行测定,计算回收率,结果见表2。
2.11 样品含量测定
按2.2供试品溶液的制备方法及2.4色谱条件,对内蒙古中东部地区草乌有效成分进行含量测定,结果见表3。

表2 加样回收率结果
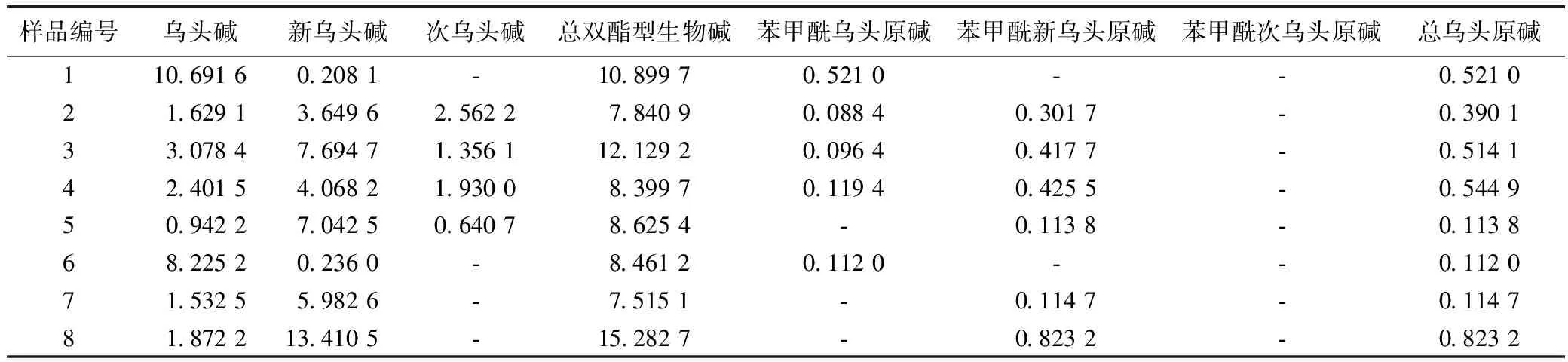
表3 草乌各样品乌头碱类成分含量 /mg·g-1
3 讨论
3.1内蒙古中东部地区生长草乌有效成分种类及含量有一定的差异,所含乌头碱虽均以新乌头碱为主,但以锡林郭勒盟正蓝旗地域为界限,靠北区域的草乌含有一定比例的次乌头碱,偏南区域的草乌几乎不含次乌头碱。市售草乌商品药材所含乌头碱类90%以上为乌头碱,不含次乌头碱。首次发现蒙药草乌市售商品与自采自用药材所含生物碱种类截然不同。这是蒙药草乌药材质量标准研究中急待解决的问题。
3.2市售草乌与内蒙古本地生长草乌所含有效成分生物碱种类差异很大,其毒性和疗效固然不同。蒙药早年主要用本地产草乌,故以市售草乌为蒙药药材,很大程度上制约了蒙药疗效及独特用药特色。
3.3流动相A:乙睛-四氢吠喃(25∶15),B:0.1 mol·L-1乙酸铵(1000 mL加乙酸0.5 mL),该条件的酸碱性适中,适用性强。按照《中华人民共和国药典》梯度进行洗脱,0~45 min(15%→26%A)、48~49 min(26%→35%A)、49~58 min(35%A)、58~65 min(35%→15%A),基线在52 min时突然飘高,对色谱峰造成干扰。为了克服这种现象,本试验对流动相的梯度比例进行调整,梯度洗脱条件:1~48 min(15%→26%A)、48~60 min(26%→35%A),能克服基线飘高现象,且6种被测组分分离度较好,峰展宽适中。为了使起始基线平稳,两次进样之间用初始浓度平衡20 min左右,效果满意。
3.4照《中华人民共和国药典》2010版草乌项下方法,以异丙醇-三氯甲烷(1∶1)混合溶剂溶解被测组分,可获得较稳定的结果,且溶解完全,但峰形不理想,杂质甚多。为了克服以上困难,以10%盐酸水为溶剂,可获得溶解完全、杂质少、峰形满意且较稳定的结果。
3.5检测分析中,苯甲酰次乌头原碱含量过低,相对误差偏大,杂峰干扰严重,故本文忽略。
[1] 中国中医药管理局《中华本草》编委会.《中华本草》蒙药卷[M].上海:上海科学技术出版社,2004:276.
[2] 内蒙古中蒙医研究所.《医宗要旨》[M].呼和浩特:内蒙古人民出版社,1995:491-192.
[3] 蒙古学百科全书编辑委员会,《医学卷》编辑委员会.《蒙古学百科全书》:蒙药卷[M].呼和浩特:内蒙古人民出版社,2002:280.
[4] 毕力夫.蒙药炮制规范化研究[M].呼和浩特:内蒙古人民出版社,2007:78-87.
[5] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:220.
[6] 李正邦,吕光华,陈东林,等.草乌中生物碱的化学成分研究[J].天然产物研究与开发,1997,91(01):9.
[7] 毕力夫.蒙药指纹图谱研究[M].呼和浩特:内蒙古人民出版社,2007:156-177.
[8] 辛杨,王淑敏,刘志强.高效液相色谱法测定草乌叶中新乌头碱、乌头碱和次乌头碱[J].国外医药·植物药分册,2008,23(4):170-172.
[9] 罗霄,彭善贵,文永盛,等.HPLC测定制川乌中的乌头碱、次乌头碱和新乌头碱[J].华西医药杂志,2010,25(4):472-473.
[10] 张聿梅,谢黔锋,鲁静,等.草乌药材标准修订研究[J].药物分析杂志,2010,30(5):940-944.
[11] 胡文波,高敏,何军民,等.草乌总生物碱的提取工艺研究[J].中华中医药学刊,2010,28(9):1993-1994.
[12] 于永军,李俊松,蔡皓,等.草乌炮制前后HPLC指纹图谱比较研究[J].现代中药研究与实践,2009,22(6):47-48.
[13] 随志刚,陈明玉,刘志强,等.草乌中乌头类生物碱提取方法比较研究[J].药理药化,2009,20(3):513-514.
[14] 张智圆,沈志滨,季宇彬.HPLC同时测定制草乌中三种生物碱质量比[J].哈尔滨商业大学学报(自然科学版),2010,26(1):1-3.
[15] 赵英,崔秀明,戴云,等.草乌药材HPLC指纹图谱研究[J].中国中药杂志,2006,31(13):1056-1058.
[16] 凌珊,龚千锋.草乌的研究进展[J].江西中医学院学报,2011,23(3):90-94.
[17] 敖艳青,敖其尔,查森其其格,等.蒙药草乌的基源植物学研究[J].中国民族医药杂志,2011,2(2):37-41.
AnalysisofAconitineContentinAconitiKusnezoffiiRadixofEasternInnerMongolia
XILINTonggalaga1,NAShengsang2*
(1.InnerMongoliaPeople’sHospitalPharmacyDepartment,Hohhot010017,China;2.InnerMongoliaMedicalUniversity,Hohhot010110,China
Objective:To analyse and compare aconitine content of Aconiti kusnezoffiis Radix from eastern of Inner Mongolia.Methods:The content of aconitine was determined by HPLC.Eclipse XDB-C18column (4.6×250 mm,5 μm) was used with mobile phase of A: Acetonitrile-tetrahydrofuran (25∶15) and B: 0.1 mol·L-1ammonium acetate solution,1000 mL ammonium acetate solution with 0.5 mL acetic acid.The flow rate was 1.0 mL·min-1.The detection wavelength was 235 nm.The injection volume was 10 μL.Gradient elution was: VA:1 min~48 min=15~26,48 min~60 min=26~35.Results:The total ester type aconitine content (mg·g-1) were 10.899,7.841,12.729,8.399,8.625,8.461,7.515,15.283,respectively.The total aconitine content (mg·g-1) were 0.521,0.390,0.514,0.545,0.114,0.112,0.115,0.823,respectively.Conclusion:The difference of the content of active components in Aconiti Kusnezoffii Radix differences in eastern of Inner Mongolia area is large,a further study is needed for establishing a unified standard of Aconitum Kusnezoffii Radix in Mongolian medicine.
Aconiti Kusnezoffii Radix;active ingredients;aconitine;eastern of Inner Mongolia
2014-09-02)
内蒙古医科大学博士基金(NY2010BQ006)
*
那生桑,教授,博士生导师,研究方向:蒙药现代化;E-mail:nasang56@sina.com
10.13313/j.issn.1673-4890.2015.5.011
