雪菊总黄酮抗氧化活性研究△
2015-09-25邱佳俊高飞李雅丽刘江云木胡牙提乌拉斯汉郝丽莉杨世林
邱佳俊,高飞,李雅丽,刘江云,木胡牙提·乌拉斯汉,郝丽莉,杨世林
(1.苏州大学医学部 药学院,江苏 苏州 215123;2.新疆医科大学第一附属医院 VIP内科,新疆 乌鲁木齐 830011;3.新疆医科大学第一附属医院 综合心脏内科,新疆 乌鲁木齐 830011)
·基础研究·
雪菊总黄酮抗氧化活性研究△
邱佳俊1,高飞1,李雅丽2*,刘江云1,木胡牙提·乌拉斯汉3,郝丽莉1,杨世林1
(1.苏州大学医学部 药学院,江苏 苏州 215123;2.新疆医科大学第一附属医院 VIP内科,新疆 乌鲁木齐 830011;3.新疆医科大学第一附属医院 综合心脏内科,新疆 乌鲁木齐 830011)
目的:研究雪菊总黄酮及其主要成分的抗氧化活性。方法:对雪菊总黄酮的主成分进行分离鉴定和含量测定,采用1,1-二苯基-2-三硝基苯肼(DPPH)和2,2-联氮-二-(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)法测试其抗氧化活性。结果:分离鉴定了雪菊总黄酮中的黄诺玛苷、马里苷2个主成分,雪菊总黄酮对DPPH、ABTS自由基的半数清除率依次为11.06、139.3 μg·mL-1,与马里苷、黄诺玛苷的半数清除率相近。结论:雪菊精制总黄酮具有优良的抗氧化能力,其中主要含有马里苷、黄诺玛苷等黄酮类活性成分。
两色金鸡菊;抗氧化;马里苷;黄诺玛苷
菊科植物两色金鸡菊CoreopsistinctoriaNutt.原产北美,花色艳丽,作为观赏植物在全球多地均有分布。该植物全草称为蛇目菊,具有清热解毒、化湿止痢的功能。在20世纪80年代,新疆和田等地将其作为一种特色花茶饮用,俗称雪菊、血菊、金鸡菊,维语称为“古里恰依”,具有预防心血管疾病的功能[1]。近年来,有研究表明,雪菊具有较为明确的降血糖[2-4]、降血压[5-6]、降脂[7]、抗氧化[8-9]等作用。随着人们对雪菊功能认识的加深,该药材被誉为与天山雪莲齐名的新疆特产,并已在新疆多地区进行规模化种植和推广。
雪菊中的主要化学成分为黄酮类物质[3,9-12],包括马里苷、奥卡宁、黄诺玛苷等。近年来对雪菊的化学成分及药理活性方面已有较多报道,但未见对其总黄酮及各单体成分的含量分析和相应抗氧化活性的研究。本课题组以雪菊总黄酮及其主要成分为研究对象,采用1,1-二苯基-2-三硝基苯肼(DPPH)法和2,2-联氮-二-(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)法评价雪菊总黄酮及2种主要成分的抗氧化能力,为雪菊药效物质基础的进一步研究提供参考。
1 材料与仪器
1.1 材料
雪菊药材(批号:20130510)购自新疆达坂城,经苏州大学药学院陆叶博士鉴定为菊科两色金鸡菊CoreopsistinctoriaNutt.的花蕾。
黄诺玛苷、马里苷对照品(实验室自制,纯度分别为93.2%、97.1%);芦丁对照品(中国食品药品鉴定研究院,批号:100080-200306,纯度为91.7%);1,6-双(二苯基膦基)己烷(DPPH,批号:D0908)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,批号:A2166)购自日本东京化成工业株式会社;AB-8、LX2000大孔吸附树脂(西安蓝晓科技有限公司);十八烷基硅烷键合硅胶(ODS)填料(75 μm,日本Cosmosil公司);乙腈(色谱纯,美国Fisher公司);色谱用纯净水(杭州娃哈哈公司);乙醇、甲醇等试剂(分析纯,国药集团化学试剂有限公司)。
1.2 仪器
Agilent 1260高效液相色谱系统,包括1260 Infinity VL 型四元泵、1260 DAD VL紫外检测器、1260 TCC柱温箱、LC-Solution色谱工作站(美国Agilent 公司);ODS色谱柱(5C18-AR-II,日本Cosmosil公司);Agilent-6100型LCMS系统;Avance III plus 400 MHz核磁共振仪(德国Bruker Daltonics公司);UV-SPD-M20A紫外分光光度计(日本岛津公司);ME215S型电子天平(德国Starorious公司)。
2 方法
2.1 雪菊总黄酮的制备
称取干燥雪菊药材1.0 kg,加入12倍量75%乙醇回流提取2次,每次60 min,减压浓缩至2.2 L,溶液经AB-8大孔吸附树脂柱(100 cm×10 cm,柱体积2 L)吸附后,依次用水(12 L)、10%乙醇(6 L)、75%乙醇(8 L)、95%乙醇(4 L)洗脱,75%乙醇洗脱部分减压浓缩干燥,即得雪菊总黄酮(CTFE,114.9 g)提取物。
2.2 黄诺玛苷和马里苷的分离与鉴定
称取CTFE1.0 g,经LX2000小孔树脂柱(柱体积50 mL)吸附,依次用水(300 mL)、30%、50%、75%甲醇、纯甲醇各250 mL洗脱。其中30%甲醇流分浓缩,溶液上ODS反相硅胶柱,依次用15%、20%、25%、30%、75%甲醇各300 mL洗脱,20%和25%洗脱流分经HPLC检测合并,浓缩,经Sephadex LH-20柱用甲醇洗脱,浓缩,获得化合物1(16.1 mg,按HPLC相对峰面积计纯度为93.2%);50%和75%甲醇流分合并浓缩,溶液上ODS反相硅胶柱,依次用30%、40%、50% 、90%甲醇各300 mL洗脱,40%及50%洗脱流分经HPLC检测合并、浓缩,经Sephadex LH-20柱用甲醇洗脱,浓缩,获得化合物2(34.6 mg,按HPLC相对峰面积计纯度为97.1%)。
采用HRESIMS[11]、1H-NMR、13C-NMR等波谱技术,参考相关文献,对2个化合物进行结构鉴定,各化合物结构式见图1。
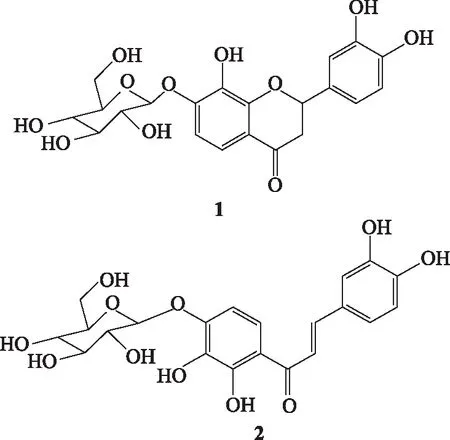
图1 黄诺玛苷(1)和马里苷(2)结构
化合物1:淡黄色粉末,HR-ESI-MS(+)给出准分子离子m/z473.1051([M+Na]+,计算值473.1054),相应分子式为C21H22O11。UV max(HPLC,16%乙腈-0.1%乙酸溶液):280 nm。1H-NMR(400 MHz,DMSO-d6)δ:7.18(1H,d,J=8.4 Hz,H-5),6.92(1H,br s,H-2′),6.86(1H,d,J=8.4 Hz,H-6),6.76(2H,both d,J=7.8 Hz,H-5′,H-6′),5.41(1H,dd,J=12.4,2.8 Hz,H-2),4.92(1H,d,J=7.0 Hz,H-1″),3.10(1H,overlap,H-3b),2.69(1H,dd,J=16.8,2.8 Hz,H-3a);13C-NMR(100 MHz,DMSO-d6)δ:191.13(C-4),150.72 和150.62(C-7;C-9),145.61(C-3′),145.11(C-4′),135.15(C-8),129.86(C-1′),117.95(C-6′),116.67(C-5),115.84(C-10),115.27(C-5′),114.45(C-2′),108.94(C-6),101.41(C-1″),79.17(C-2),77.24(C-3″),75.71(C-5″),73.15(C-2″),69.65(C-4″),60.60(C-6″),43.41(C-3)。以上数据经与文献[11,13]报道数据比较,基本一致,鉴定为异奥卡宁-7-O-β-D-吡喃葡萄糖苷(黄诺玛苷)。
化合物2:橙色粉末,HR-ESI-MS(+)给出准分子离子m/z535.1076([M+Na]+,计算值535.1093),相应分子式为C24H24O14。UV max(HPLC,16%乙腈-0.1%乙酸溶液):265,310(sh),378 nm。1H-NMR(400 MHz,DMSO-d6)δ:13.23(1H,s,OH-2′),7.78(1H,d,J=8.0 Hz,H-6′),7.71(1H,d,J=16.0 Hz,β-H),7.30(1H,d,J=16.0 Hz,α-H),7.24(1H,d,J=8.2 Hz,H-6),6.82(1H,d,J=8.2 Hz,H-5),6.78(1H,d,J=8.0 Hz,H-5′),4.92(1H,d,J=7.2 Hz,H-1″);13C-NMR(100 MHz,DMSO-d6)δ:192.68(3-C=O),152.46(C-2′),150.56(C-4′),149.15(C-4),145.61(β-C),145.32(C-3),134.38(C-3′),126.13(C-1),122.57(C-6),121.49(C-6′),117.46(α-C),115.98(C-2),115.74和115.67(C-5;C-1′),106.53(C-5′),100.95(C-1″),77.34(C-3″),75.85(C-5″),73.20(C-2″),69.74(C-4″),60.65(C-6″)。以上数据经与文献[10-11]报道数据比较,基本一致,鉴定为奥卡宁-4′-O-β-D-吡喃葡萄糖苷(马里苷)。
2.3 液相分析
采用HPLC方法测定黄诺玛苷和马里苷含量。液相分析条件:流动相为乙腈(A)-0.1%乙酸水溶液(B),梯度洗脱(0~20 min,16% A;20~40min,30% A);检测波长为280 nm(黄诺玛苷)和378 nm(马里苷);柱温为30 °C;流速为1 mL·min-1;进样量为20 μL。在优化色谱条件下,各相邻色谱峰之间分离度均大于1.5,理论塔板数均大于3500。
2.4 抗氧化活性测定
2.4.1 DPPH法 参考文献[14]方法进行。取配好的0.04% DPPH乙醇溶液3 mL,加入800 μL各浓度的样品溶液,室温避光反应30 min,用分光光度计测定517 nm处吸光度Ai。按下列公式计算各样品对DPPH·的清除率:
DPPH·清除率(%)=[1-Ai/Ab]×100%
式中Ai为加入样品反应后溶液的吸光度值,Ab为未加样品的DPPH.工作液吸光度值。根据清除率数据曲线计算半数清除率(IC50)。
2.4.2 ABTS法 参考文献[14]方法进行。将配制好的ABTS溶液与过硫酸钾(K2S2O8)均匀混合,在室温下置于暗处过夜。将生成的ABTS·+溶液用乙醇稀释,使其在30 ℃、734 nm波长下的吸光度为0.70,即得到ABTS·+工作液。在试管中加入3.0 mL的ABTS·+工作液,再加入100 μL的样品溶液,混匀,放置于暗处,反应6 min,在734 nm处测吸光度值Ai。按下列公式计算各样品对ABTS·+的清除率:
ABTS·+清除率(%)=[1-Ai/Ab]×100%
式中Ai为加入样品反应后溶液的吸光度值,Ab为未加样品的ABTS·+工作液吸光度值,根据清除率数据曲线计算IC50。
3 结果
3.1 雪菊总黄酮的成分分析
采用乙醇提取和大孔吸附树脂纯化方法,制备获得雪菊总黄酮。经液相分析,并与文献[3,9,12]对比,推测雪菊总黄酮中主要成分为黄诺玛苷和马里苷。经进一步分离纯化,获得该2个主成分对照品,并经高分辨电喷雾电离质谱(HR-ESI-MS)、核磁共振(NMR)测试鉴定了这2个成分的结构。

注:A,1.黄诺苷对照品;B,2马里苷对照品;C1、C2.雪菊总黄酮液相图谱。图2 雪菊总黄酮液相图谱
采用所述液相分析条件(见图2),测定结果显示:马里苷在4.124~82.48 μg呈现良好的线性关系,按峰面积(Y)和对照品含量(X)进行计算,所得回归方程为Y=1.837×106X-1736.9(r=0.999 9,n=6);黄诺马苷在0.401~ 8.016 μg呈现良好线性关系,按峰面积(Y)和对照品含量(X)进行计算,所得回归方程为Y=9.738×105X-201.99(r=0.999 9,n=5)。测得雪菊总黄酮(CTFE)中黄诺玛苷和马里苷的质量分数分别为105.2、130.5 mg·g-1。
3.2 DPPH测试
各样品对DPPH自由基的清除率见表1。根据清除率随样品溶液浓度变化的数据,计算出雪菊总黄酮、黄诺马苷、马里苷及芦丁对该自由基的IC50分别为(11.06±0.37)、(26.23±0.60)、(6.84±0.42)、(7.72±0.98)μg ·mL-1。
3.3 ABTS测试验
各样品对ABTS自由基的清除率见表2。根据清除率随样品溶液浓度变化的数据,计算出雪菊总黄酮、马里苷、黄诺马苷及芦丁对照品对该自由基的IC50分别为(139.3±1.7)、(117.5±0.7)、(92.6±2.0)、(368.6±1.2)μg ·mL-1。
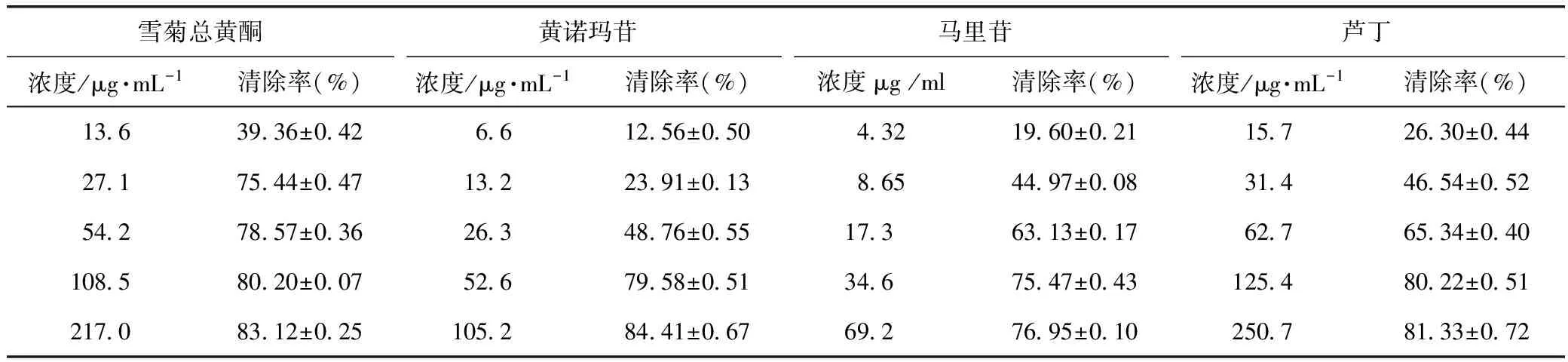
表1 各样品对DPPH自由基的清除率
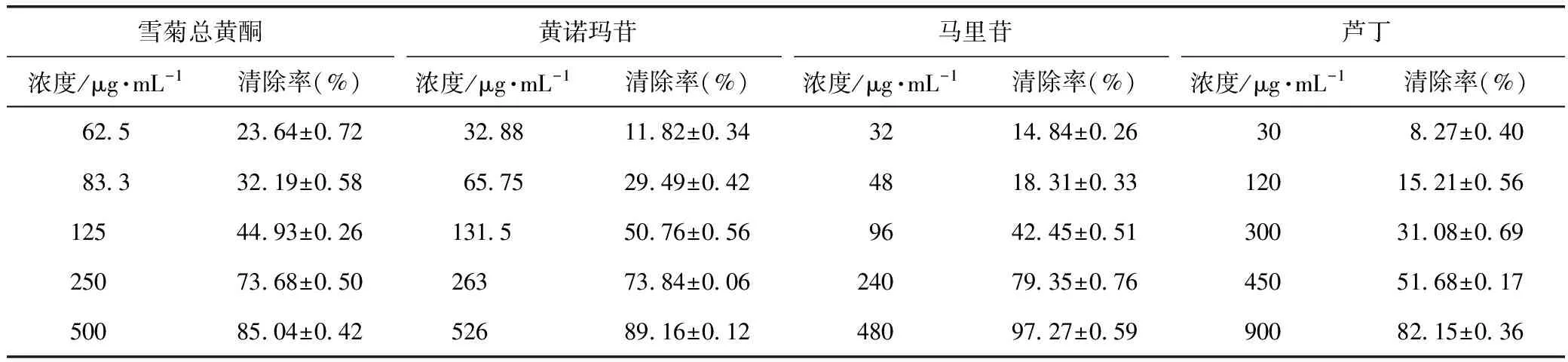
表2 各样品对ABTS自由基的清除率
4 讨论
雪菊中主要成分为黄酮类,对雪菊提取物的抗氧化活性已有文献报道[8-9],但均限于提取物及其中总多酚含量的测定。本文首次对雪菊总黄酮的抗氧化活性进行测试,并进一步对其主要成分进行含量分析和相应抗氧化活性研究。在DPPH体系中的清除能力排序:马里苷>芦丁>雪菊总黄酮>黄诺玛苷;在ABTS体系中的清除能力排序:马里苷>黄诺玛苷>雪菊总黄酮>芦丁。结果表明,雪菊总黄酮具有与对照品芦丁相近的优良抗氧化活性,其主要抗氧化活性成分为马里苷、黄诺玛苷等。
近年来有研究表明,雪菊具有较为明确的降血糖、降血压、降脂等功能[7],这在一定程度上与其抗氧化作用[4-8]有关。本文对雪菊总黄酮及其2个主要成分的体外抗氧化能力进行测试,可为雪菊今后在相关功能食品领域的应用提供参考。
[1] 新疆植物志编辑委员会.新疆植物志[M].乌鲁木齐:新疆科技卫生出版社,1999:93.
[2] 张燕,李琳琳,木合布力·阿布力孜等.新疆昆仑雪菊5种提取物对α-葡萄糖苷酶活性的影响[J].中国实验方剂学杂志,2011,17(7):166-169.
[3] Dias T,Bronze M R,Houghton PJ,et al.The flavonoid rich fraction ofCoreopsistinctoriapromotes glucose tolerance regain and pancreatic function recovery in streptozotocin-induced glucose-intolerant rats [J].J Ethnopharmacol,2010,132(10):483-490.
[4] Dias T,Liu B,Jones P,et al.Cytoprotective effect ofCoreopsistinctoriaextracts and flavonoids on tBH Pand cytokine-induced cell injury in pancreatic MIN6 cells [J].J Ethnopharmacol,2012,139(23):485-492.
[5] 明婷,孙玉华,胡梦颖,等.金鸡菊提取物降压及体内抗氧化作用的研究[J].中国实验方剂学杂志,2012,18(10):249-252.
[6] 梁淑红,哈木拉提,庞市宾,等.金鸡菊提取物降血压化学成分实验研究[J].时珍国医国药,2011,21(7):1619-1621.
[7] 梁淑红,庞市宾,刘晓燕,等.金鸡菊提取物降血脂作用的研究[J].中国实验方剂学杂志,2010,31(8):495-498.
[8] 曹燕,庞市宾,徐磊,等.金鸡菊提取物体外抗氧化活性[J].中国实验方剂学杂志,2011,17(12):144-147.
[9] Zălaru C,Crian C C,Călinescu I,et al.Polyphenols inCoreopsistinctoriaNutt.fruits and the plant extracts antioxidant capacity evaluation [J].Central Eur J Chem,2014,12(8):858-867.
[10] Zhang Y,Shi S P,Zhao M B,et al.A novel chalcone fromCoreopsistinctoriaNutt.[J].Biochem Syst Ecol,2006,34(10):766-769.
[11] 赵军,孙玉华,徐芳,等.昆仑雪菊黄酮类成分研究[J].天然产物研究与开发,2013,25(3):50-52.
[12] 张兰兰,孙玉华,哈木拉提,等.HPLC测定金鸡菊中金鸡菊查尔酮含量[J].中国中医药信息杂志,2012,19(7):48-49.
[13] 李帅,匡海学,冈田嘉仁,等.鬼针草有效成分的研究(Ⅱ)[J].中草药,2004,35(9):972-975.
[14] Sun Y,Yuan H,Hao L,et al.Enrichment and antioxidant properties of flavoneC-glycosides from trollflowers using macroporous resin [J].Food Chem,2013,141(1):533-541.
InvestigationofAntioxidantCapacitiesofTotalFlavonoidExtractofCoreopsistinctoria
QIUJiajun1,GAOFei1,LIYaLi2*,LIUJiangyun1,MUHUYATIWulasihan3,HAOLili1,YANGShilin1
(1.CollegeofPharmaceuticalSciences,SoochowUniversity,Jiangsu,Suzhou,215123,China;2.VIPInternalMedicineDepartment,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China;3.GeneralCardiologyDepartment,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China
Objective:Antioxidant capacities of the total flavonoid extract ofcoreopsistinctoria(CTFE) and its main constituents were investigated in this study.Methods:Key components in CTFE were separated and determined.DPPH and ABTS tests were applied to measure their antioxidant capacities.Results:Marein and flavanomarein were identified as two key components in CTFE.The half inhibition concentrations of CTFE against DPPH and ABTS free radical were 11.06 and 139.3 ·mL-1,respectively,similar to those of marein and flavanomarein.Conclusion:CTFE showed strong antioxidant capacities,with marein,flavanomare and other flavonoids as the bioactive constituents.
Coreopsistinctoria;antioxidant;marein;flavanomarein
2014-08-07)
国家自然基金项目(81460634);新疆医科大学第一附属医院自然基金项目(2013ZRZD07)
*
李雅丽,副教授,研究方向:非酒精性脂肪肝及代谢综合征的基础和临床;Tel:(0991)4363245,E-mail:lylemai@sina.cn
10.13313/j.issn.1673-4890.2015.5.006
